2.1.1 化学键 离子键 课件(共26张PPT) 2023-2024学年高一化学鲁科版(2019)必修第二册
文档属性
| 名称 | 2.1.1 化学键 离子键 课件(共26张PPT) 2023-2024学年高一化学鲁科版(2019)必修第二册 |  | |
| 格式 | pptx | ||
| 文件大小 | 4.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-15 19:45:38 | ||
图片预览






文档简介
(共26张PPT)
第2章 化学键 化学反应规律
第1节 化学键与物质构成 课时1
1.通过水分子的组成认识化学键的概念,并能从化学键的角度认识化学反应的实质。
2.理解离子键的含义,能用电子式表示其形成过程。
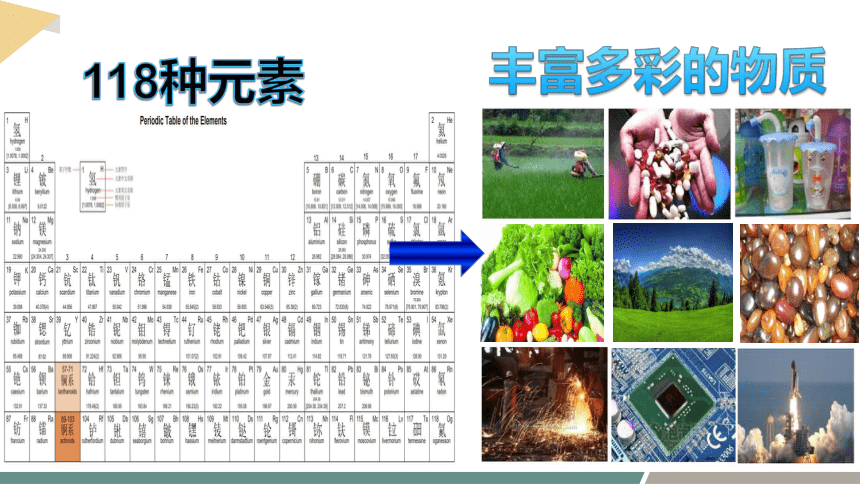
丰富多彩的物质
118种元素
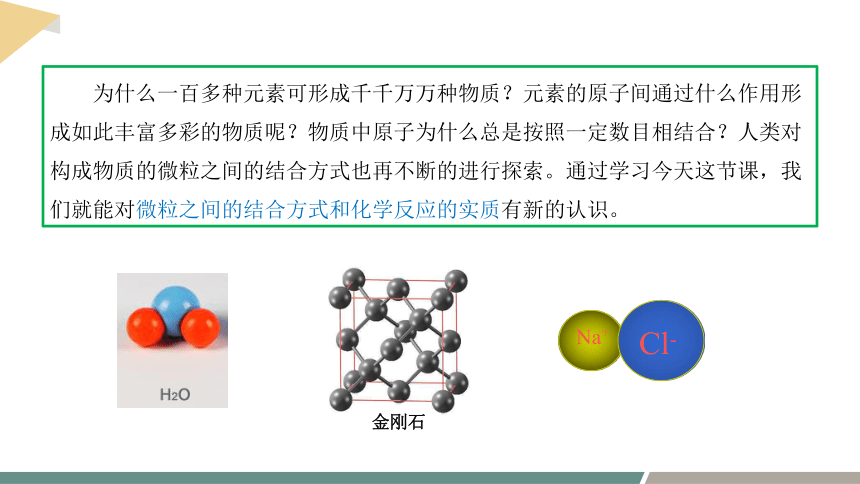
为什么一百多种元素可形成千千万万种物质?元素的原子间通过什么作用形成如此丰富多彩的物质呢?物质中原子为什么总是按照一定数目相结合?人类对构成物质的微粒之间的结合方式也再不断的进行探索。通过学习今天这节课,我们就能对微粒之间的结合方式和化学反应的实质有新的认识。
金刚石
Na+
Cl-
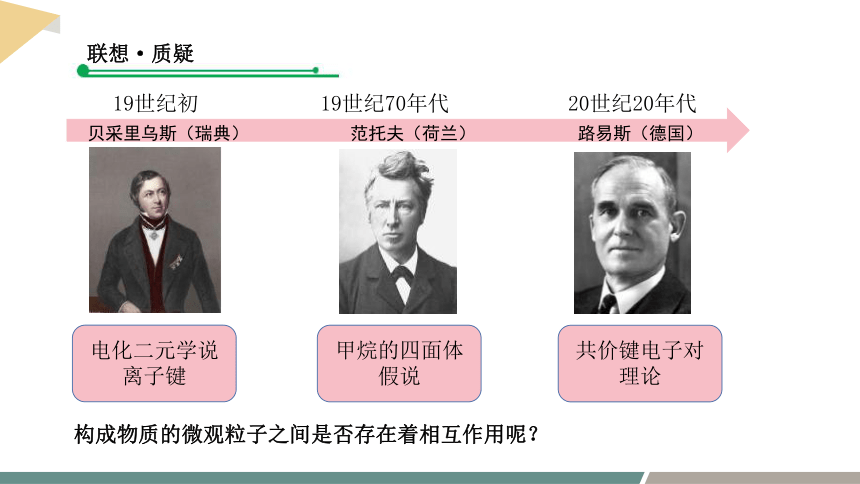
联想·质疑
19世纪初
19世纪70年代
20世纪20年代
贝采里乌斯(瑞典)
范托夫(荷兰)
路易斯(德国)
电化二元学说
离子键
甲烷的四面体假说
共价键电子对理论
构成物质的微观粒子之间是否存在着相互作用呢?
交流·研讨
1.加热至100℃时,水会沸腾变成水蒸气。这一变化过程中,外界提供
的能量作用是什么?
2.加热至2200℃以上或者通电时,水会分解。在这一过程中,外界提供的能量
作用是什么?
3.为什么使水分解需要加热到2200℃以上或者通电,而使水沸腾只需要加热到
100℃?
1.加热至100℃时,水会沸腾变成水蒸气。这一变化过程中,外界提供
的能量作用是什么?
水分子之间存在相互作用,加热提供能量用来破坏水分子之间的作用力。
2.加热至2200℃以上或者通电时,水会分解。在这一过程中,外界提供的能量作用是什么?
水分子内H和O之间也存在相互作用,加热或者通电提供能量用来破坏这种作用力使水分解。
3.为什么使水分解需要加热到2200℃以上或者通电,而使水沸腾只需要加热到100℃?
水分子内氢氧原子之间存在比分子间作用力更强的相互作用——化学键
说明水分子与水分子之间的相互作用比较弱,容易破坏;而把水分子破裂成原子很困难,说明分子内原子之间相互作用很强。
一、化学键
定义:相邻原子间的强相互作用
①是直接相邻的原子
③是强的相互作用
④相互作用既包括吸引力也包括排斥力
②原子指广义原子,包括中性原子、阴阳离子
说明:
HCl
N2
氢氯键
氮氮键
迁移·应用
断裂:氢氧键
形成:氢氢键
形成:氧氧键
2H2O 2H2 + O2
通电
迁移·应用
分析下表列出的各反应中化学键变化的情况,写出各反应中断裂的化学键和形成的化学键。
化学反应 断裂的化学键 形成的化学键
2H2+O2 2H2O
H2+Cl2 2HCl
N2+3H2 2NH3
点燃
高温,高压
催化剂
点燃
氢氢键、氧氧键
氢氢键、氯氯键
氮氮键、氢氢键
氢氧键
氢氯键
氮氢键
思考:根据分析,对你认为化学反应的实质有哪些新的启示?
宏观角度:
反应物
生成物
微观角度:
分子
原子
新分子
裂分
重组
化学键角度:
旧键断裂
新键形成
吸收能量
释放能量
化学反应的过程就是旧化学键断裂和新化学键形成的过程
视频
[练一练]
1.下列关于化学键的说法中正确的是( )
①相邻原子间的相互作用叫做化学键 ②化学键既存在于相邻原子间,又存在于相邻分子间 ③在水中氢、氧原子间均以化学键相结合 ④相邻原子之间强烈的相互吸引作用叫做化学键 ⑤化学键是指相邻原子间的强相互作用
A.②③④ B.③④⑤ C.①②③ D.只有⑤
D
2.下列变化不需要破坏化学键的是( )
A.加热氯化铵 B.干冰升华
C.水通电分解 D.氯化氢溶于水
B
3.根据化学反应的实质是旧键断裂,新键生成这一事实,判断下列变化哪些是化学变化,并说出理由( )
A.石墨在高温下转化为金刚石;
B.碘升华;
C.氯气加压变成液氯;
D.氯化钠的融化
A
思考:NaCl与HCl中所含化学键是否相同?
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
失 e-
得 e-
Na+
Cl-
共用电子对
把这种带相反电荷离子之间的相互作用叫做离子键
带相反电荷的钠离子和氯离子,通过静电作用结合在一起,从而形成与单质钠和氯气性质完全不同的氯化钠。
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
二、离子键
定义:带相反电荷离子之间的相互作用叫做离子键
成键粒子:
【阴离子】①活泼非金属得到电子形成的离子(Cl-、S2-、O2-)
②氢氧根离子(OH-)
③含氧酸根离子()
【阳离子】①活泼金属失去电子形成的离子(Na+、Mg2+、Zn2+)
②铵根离子()
【实质】静电作用(静电引力和静电斥力)
离子键
ionic bond
用原子结构示意图表示化合物的形成过程相对繁琐,有没有更简便的表示方法呢?
Na
Cl
Na+
+11
Cl-
+17
-e-
+e-
Na+
Cl-
电子式
在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子),这样的式子叫做电子式。
(1)原子的电子式:
书写规则:①把原子的最外层电子全部排列在元素符号周围
②排列方式为在元素符号上、下、左、右四个方向,每个方向不能超过两个电子
(2)简单阳离子的电子式:钠离子、镁离子
(3)简单阴离子的电子式:
书写规则:①金属原子在形成金属阳离子时,最外层电子已经失去,所以它的电子式就是离子符号
书写规则:①一般非金属原子在形成阴离子时,最外层已经得到电子,这些电子都要画出
②将符号用“[ ]”括上,右上角标出所带的电荷数,电荷的表示方法同离子符号
Na+、Mg2+
(4)含离子键的化合物的电子式:
书写规则:①先画出阴、阳离子的电子式
②阳、阴离子间隔排列
③相同离子不能合并,对称分布表示
【思考】你能用电子式来表示离子键的形成过程吗?
(5)用电子式来表示离子键的形成过程
以NaCl的形成过程为例:
+
→
规则:①表达式左侧写各原子的电子式,右侧写离子化合物的电子式,各原子之间用“+”连接,中间用 “→” 连接
②用弧线箭头指明电子的转移情况
以K2S的形成过程为例:
+
+
→
[练一练]
1.下列关于离子键的说法正确的是( )。
A.离子键就是阴、阳离子间的静电引力
B.不同非金属元素不能形成离子键
C.原子通过电子的得失先形成阴阳离子后再成键
D.在离子化合物CaCl2中,两个氯离子间也存在离子键
C
2.请用电子式写出下列离子化合物的形成过程。
CaCl2 KI Na2S MgBr2
+
+
→
+
→
+
+
→
+
+
→
CaCl2
KI
Na2S
MgBr2
离子键
概念
要点
带相反电荷离子之间的相互作用
成键微利
成键实质
成键范围
阴离子、阳离子
静电作用
活泼金属和活泼非金属
化学键
相邻原子间的强相互作用
分类
形成过程
第2章 化学键 化学反应规律
第1节 化学键与物质构成 课时1
1.通过水分子的组成认识化学键的概念,并能从化学键的角度认识化学反应的实质。
2.理解离子键的含义,能用电子式表示其形成过程。
丰富多彩的物质
118种元素
为什么一百多种元素可形成千千万万种物质?元素的原子间通过什么作用形成如此丰富多彩的物质呢?物质中原子为什么总是按照一定数目相结合?人类对构成物质的微粒之间的结合方式也再不断的进行探索。通过学习今天这节课,我们就能对微粒之间的结合方式和化学反应的实质有新的认识。
金刚石
Na+
Cl-
联想·质疑
19世纪初
19世纪70年代
20世纪20年代
贝采里乌斯(瑞典)
范托夫(荷兰)
路易斯(德国)
电化二元学说
离子键
甲烷的四面体假说
共价键电子对理论
构成物质的微观粒子之间是否存在着相互作用呢?
交流·研讨
1.加热至100℃时,水会沸腾变成水蒸气。这一变化过程中,外界提供
的能量作用是什么?
2.加热至2200℃以上或者通电时,水会分解。在这一过程中,外界提供的能量
作用是什么?
3.为什么使水分解需要加热到2200℃以上或者通电,而使水沸腾只需要加热到
100℃?
1.加热至100℃时,水会沸腾变成水蒸气。这一变化过程中,外界提供
的能量作用是什么?
水分子之间存在相互作用,加热提供能量用来破坏水分子之间的作用力。
2.加热至2200℃以上或者通电时,水会分解。在这一过程中,外界提供的能量作用是什么?
水分子内H和O之间也存在相互作用,加热或者通电提供能量用来破坏这种作用力使水分解。
3.为什么使水分解需要加热到2200℃以上或者通电,而使水沸腾只需要加热到100℃?
水分子内氢氧原子之间存在比分子间作用力更强的相互作用——化学键
说明水分子与水分子之间的相互作用比较弱,容易破坏;而把水分子破裂成原子很困难,说明分子内原子之间相互作用很强。
一、化学键
定义:相邻原子间的强相互作用
①是直接相邻的原子
③是强的相互作用
④相互作用既包括吸引力也包括排斥力
②原子指广义原子,包括中性原子、阴阳离子
说明:
HCl
N2
氢氯键
氮氮键
迁移·应用
断裂:氢氧键
形成:氢氢键
形成:氧氧键
2H2O 2H2 + O2
通电
迁移·应用
分析下表列出的各反应中化学键变化的情况,写出各反应中断裂的化学键和形成的化学键。
化学反应 断裂的化学键 形成的化学键
2H2+O2 2H2O
H2+Cl2 2HCl
N2+3H2 2NH3
点燃
高温,高压
催化剂
点燃
氢氢键、氧氧键
氢氢键、氯氯键
氮氮键、氢氢键
氢氧键
氢氯键
氮氢键
思考:根据分析,对你认为化学反应的实质有哪些新的启示?
宏观角度:
反应物
生成物
微观角度:
分子
原子
新分子
裂分
重组
化学键角度:
旧键断裂
新键形成
吸收能量
释放能量
化学反应的过程就是旧化学键断裂和新化学键形成的过程
视频
[练一练]
1.下列关于化学键的说法中正确的是( )
①相邻原子间的相互作用叫做化学键 ②化学键既存在于相邻原子间,又存在于相邻分子间 ③在水中氢、氧原子间均以化学键相结合 ④相邻原子之间强烈的相互吸引作用叫做化学键 ⑤化学键是指相邻原子间的强相互作用
A.②③④ B.③④⑤ C.①②③ D.只有⑤
D
2.下列变化不需要破坏化学键的是( )
A.加热氯化铵 B.干冰升华
C.水通电分解 D.氯化氢溶于水
B
3.根据化学反应的实质是旧键断裂,新键生成这一事实,判断下列变化哪些是化学变化,并说出理由( )
A.石墨在高温下转化为金刚石;
B.碘升华;
C.氯气加压变成液氯;
D.氯化钠的融化
A
思考:NaCl与HCl中所含化学键是否相同?
Na
+11
8
1
2
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
失 e-
得 e-
Na+
Cl-
共用电子对
把这种带相反电荷离子之间的相互作用叫做离子键
带相反电荷的钠离子和氯离子,通过静电作用结合在一起,从而形成与单质钠和氯气性质完全不同的氯化钠。
+11
+17
+17
+11
Na+ Cl-
Na
Cl
Cl-
Na+
二、离子键
定义:带相反电荷离子之间的相互作用叫做离子键
成键粒子:
【阴离子】①活泼非金属得到电子形成的离子(Cl-、S2-、O2-)
②氢氧根离子(OH-)
③含氧酸根离子()
【阳离子】①活泼金属失去电子形成的离子(Na+、Mg2+、Zn2+)
②铵根离子()
【实质】静电作用(静电引力和静电斥力)
离子键
ionic bond
用原子结构示意图表示化合物的形成过程相对繁琐,有没有更简便的表示方法呢?
Na
Cl
Na+
+11
Cl-
+17
-e-
+e-
Na+
Cl-
电子式
在元素符号周围用“·”或“×”来表示原子的最外层电子(价电子),这样的式子叫做电子式。
(1)原子的电子式:
书写规则:①把原子的最外层电子全部排列在元素符号周围
②排列方式为在元素符号上、下、左、右四个方向,每个方向不能超过两个电子
(2)简单阳离子的电子式:钠离子、镁离子
(3)简单阴离子的电子式:
书写规则:①金属原子在形成金属阳离子时,最外层电子已经失去,所以它的电子式就是离子符号
书写规则:①一般非金属原子在形成阴离子时,最外层已经得到电子,这些电子都要画出
②将符号用“[ ]”括上,右上角标出所带的电荷数,电荷的表示方法同离子符号
Na+、Mg2+
(4)含离子键的化合物的电子式:
书写规则:①先画出阴、阳离子的电子式
②阳、阴离子间隔排列
③相同离子不能合并,对称分布表示
【思考】你能用电子式来表示离子键的形成过程吗?
(5)用电子式来表示离子键的形成过程
以NaCl的形成过程为例:
+
→
规则:①表达式左侧写各原子的电子式,右侧写离子化合物的电子式,各原子之间用“+”连接,中间用 “→” 连接
②用弧线箭头指明电子的转移情况
以K2S的形成过程为例:
+
+
→
[练一练]
1.下列关于离子键的说法正确的是( )。
A.离子键就是阴、阳离子间的静电引力
B.不同非金属元素不能形成离子键
C.原子通过电子的得失先形成阴阳离子后再成键
D.在离子化合物CaCl2中,两个氯离子间也存在离子键
C
2.请用电子式写出下列离子化合物的形成过程。
CaCl2 KI Na2S MgBr2
+
+
→
+
→
+
+
→
+
+
→
CaCl2
KI
Na2S
MgBr2
离子键
概念
要点
带相反电荷离子之间的相互作用
成键微利
成键实质
成键范围
阴离子、阳离子
静电作用
活泼金属和活泼非金属
化学键
相邻原子间的强相互作用
分类
形成过程
