3.4 沉淀溶解平衡(含解析) 同步测试题2023-2024学年高二上期人教版(2019)选择性必修1
文档属性
| 名称 | 3.4 沉淀溶解平衡(含解析) 同步测试题2023-2024学年高二上期人教版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 340.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-15 19:30:06 | ||
图片预览




文档简介
3.4 沉淀溶解平衡 同步测试题
一、单选题
1.25 ℃时,在含有大量PbI2的饱和溶液中存在着平衡:PbI2(s) Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( )
A. 溶液中Pb2+和I-浓度都增大
B.溶度积常数Ksp增大
C.沉淀溶解平衡向右移动
D.溶液中Pb2+浓度减小
2.化学与生产、生活息息相关.下列做法正确的是( )
A.铵态氮肥和草木灰可以混合施用
B.废水中的、等离子可用处理
C.次氯酸钠溶液呈碱性,可用作胃酸中和剂
D.明矾溶于水形成胶体,可用于杀菌
3.下列叙述错误的是( )
A.BaCO3是难溶于水的强电解质,在医学上用作钡餐
B.中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
C.施肥时,草木灰不能与铵态氮肥混合使用,否则会降低肥效
D.锅炉水垢中含有的CaSO4,可先用饱和碳酸钠溶液处理,而后用盐酸除去
4.在下列溶液中,BaSO4的溶解度最大的是( )
A.1mol/LH2SO4溶液 B.2mol/LNa2SO4溶液
C.0.1mol/ L BaCl2溶液 D.纯水
5.下列实验操作对应的现象与结论均正确的是( )
选项 实验操作 现象 结论
A 常温下将Ba(OH)2·8H2O晶体与NH4Cl晶体在小烧杯中混合 烧杯壁变凉 Ba(OH)2·8H2O晶体与NH4Cl的反应是吸热反应
B 将充有NO2的密闭烧瓶放入热水中 烧瓶内气体颜色变深 NO2生成N2O4的反应中,△H>0
C 将0.1mol·L-1的氨水稀释成0.01mol·L-1,测量稀释前后溶液 pH pH减小 稀释后NH3·H2O电离程度减小
D 常温下向物质的量浓度均为0.1mol·L-1的NaCl和NaI混合溶液中逐滴滴入AgNO3溶液 先出现黄色沉淀 Ksp(AgCl)<Ksp(AgI)
A.A B.B C.C D.D
6.对Ca(OH)2(Ksp=5.5×10﹣6)、Mg(OH)2(Ksp=1.2×10﹣11)、AgCl(Ksp=1.56×10﹣10)三种物质,下列说法正确的是( )
A.Mg(OH)2的溶解度最小
B.Ca(OH)2的溶解度最小
C.AgCl的溶解度最小
D.同一温度下Ksp越大的溶解度也越大
7.硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如下图所示。下列说法错误的是( )
A.图中p和q分别为、温度下CdS达到沉淀溶解平衡
B.图中各点对应的的关系为:
C.向m点的溶液中加入少量固体,溶液中浓度降低
D.温度降低时,q点饱和溶液的组成由q沿qp线向p方向移动
8.下列有关说法中正确的是( )
A.某温度时的混合溶液中c(H+)= mol L﹣1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
B.由水电离出的c(H+)=10﹣12mol L﹣1的溶液中:Na+、Ba2+、HCO3﹣、Cl﹣可以大量共存
C.已知Ksp(AgCl)=1.56×10﹣10,Ksp(Ag2CrO4)=9.0×10﹣12.向含有Cl﹣、CrO42﹣且浓度均为0.010 mol L﹣1溶液中逐滴加入0.010 mol L﹣1的AgNO3溶液时,CrO42﹣先产生沉淀
D.常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO﹣)
9.已知:①298K时K(HF)=3.5×10-4,Ksp(CaF2)=1.8×10-7
②HF(aq) H+(aq)+F-(aq)△H<0
根据以上已知信息判断下列说法正确的是( )
A.298K时,加蒸馏水稀释HF溶液, 保持不变
B.308K时,HF的电离常数Ka>3.5×10-4
C.298K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小
D.2HF(aq)+Ca2+(aq) CaF2(s)+2H+(aq)K≈0.68
10.常温下,有关物质的溶度积如下,下列有关说法错误的是( )
物质 CaCO3 MgCO3 Ca(OH)2 Mg(OH)2 Fe(OH)3
Ksp 4.96×10-9 6.82×10-6 4.68×10-6 5.60×10-12 2.80×10-39
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.0×10-21
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.0×10-2mol/L],若保持温度不变,向其中加入100mL0.012mol/L的NaOH,则该溶液变为不饱和溶液
11.下列说法正确的是( )
A.反应2Mg+CO2 2MgO+C△H<0从熵变角度看,可自发进行
B.在密闭容器发生可逆反应:2NO(g)+2CO(g) N2(g)+2CO2(g)△H=﹣113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,△H变小
C.已知:Ksp(AgCl)=1.8×10﹣10,Ksp(Ag2CrO4)=2.0×10﹣12,将等体积浓度为1.0×10﹣4mol/L的AgNO3溶液滴入到浓度均为1.0×10﹣4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生
D.根据HClO的Ka=3.0×10﹣8,H2CO3的Ka1=4.3×10﹣7,Ka2=5.6×10﹣11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者
12.下列说法错误的是( )
A.用热的纯碱溶液去除油污
B.FeS溶于稀H2SO4,而CuS不溶于稀H2SO4,Ksp(FeS)<KspCuS)
C.用Na2S处理废水中的Cu2+、Hg2+等重金属离子
D.明矾水解时产生具有吸附性的胶体粒子,可作净水剂
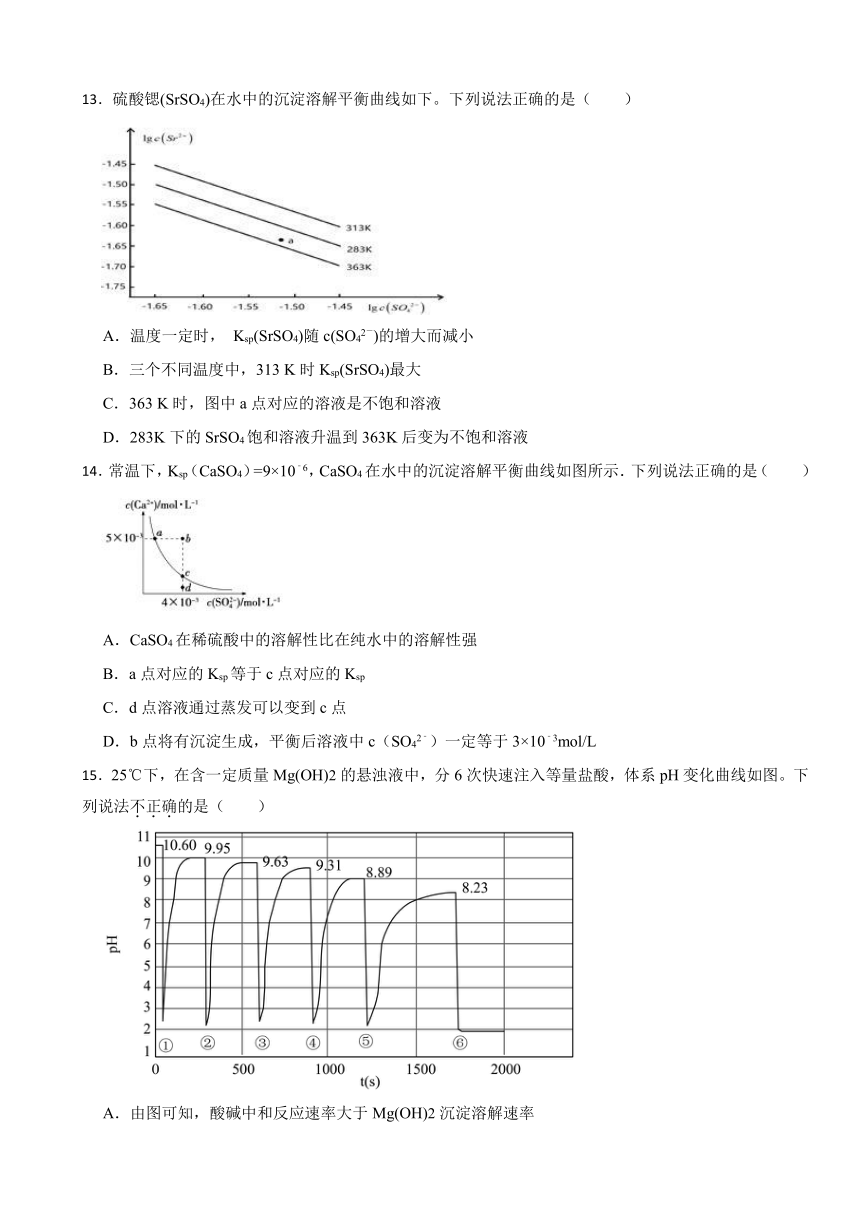
13.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下。下列说法正确的是( )
A.温度一定时, Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313 K时Ksp(SrSO4)最大
C.363 K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
14.常温下,Ksp(CaSO4)=9×10﹣6,CaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
A.CaSO4在稀硫酸中的溶解性比在纯水中的溶解性强
B.a点对应的Ksp等于c点对应的Ksp
C.d点溶液通过蒸发可以变到c点
D.b点将有沉淀生成,平衡后溶液中c(SO42﹣)一定等于3×10﹣3mol/L
15.25℃下,在含一定质量Mg(OH)2的悬浊液中,分6次快速注入等量盐酸,体系pH变化曲线如图。下列说法不正确的是( )
A.由图可知,酸碱中和反应速率大于Mg(OH)2沉淀溶解速率
B.第6次加入盐酸时,Mg(OH)2沉淀消耗完全
C.由图可知Ksp[Mg(OH)2]=5×10-32.8
D.上述过程中Mg(OH)2沉淀溶解平衡常数保持不变
16.室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10﹣9 mol2/L2,下列说法不正确的是( )
A.x数值为2×10﹣5
B.c点时有碳酸钙沉淀生成
C.加入蒸馏水可使溶液由d点变到a点
D.b点与d点对应的溶度积相等
17.下列根据实验操作和现象所得出的结论错误的是( )
选项 实验操作 实验现象 结论
A 向NaHS溶液中滴入酚酞 溶液变红色 HS-水解程度大于电离程度
B 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 出现蓝色沉淀 Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
C 向Na2CO3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 产生白色浑浊 酸性:盐酸>碳酸>硅酸
D 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 前者溶液变蓝色,后者有黄色沉淀 KI3溶液中存在I I2+I 平衡
A.A B.B C.C D.D
18.室温下,分别向体积均为20mL、浓度均为0.1mol·L-1的HX、HY溶液中,滴加相同浓度的Ba(OH)2溶液(Ba2+与X-、Y-均不反应)。随着Ba(OH)2溶液的加入,由水电离产生的c(H+)的变化趋势如图所示。下列说法错误的是( )
A.相同条件下,Ka(HX)>Ka(HY)
B.M点溶液显中性,溶液中c(Y-)C.N点对应Ba(OH)2溶液的体积为10mL
D.T点溶液中阴离子浓度之和大于M点
19.已知:T℃时, Ksp(CaSO4)=4.90×10-5,Ksp(CaCO3) =2.8×10-9,Ksp(PbCO3) =8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )
A.a线代表的是PbCO3
B.T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+):c(Pb2+)=3×10-5
C.T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
D.T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化
20.一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.Ksp(CaCO3)的数量级为10-9
B.a点表示的溶液中,c(Ca2+)>c(CO )
C.向浓度均为0.01mol·L-1的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,最先形成MgCO3沉淀
D.向MgCO3悬浊液中加入少量CaCl2溶液,会生成CaCO3沉淀
21.某温度下,向1.0mL 0.1mol/LCuSO4溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是()
[已知:lg2=0.3,Ksp(ZnS)=3×10-25]
A.Na2S溶液呈碱性,是因为S2-离子发生了水解,用离子方程式可表示为:S2-+2H2O HS-+2OH-
B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C.向100 mLZn2+、Cu2+浓度均为10 5mol/L的混合溶液中逐滴加入10 4mol/L的Na2S溶液,Zn2+先沉淀
D.该温度下Ksp(CuS)=4×10-36
二、综合题
22.某研究小组以银盐为实验对象,研究难溶盐时进行了如下实验:
①0.1mol/LAgNO3溶液和0.1mol/LNaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c:
②向滤液b中滴加0.1mol/LKI溶液。出现浑浊;
③向沉淀c中滴加0.1mol/LKI溶液,沉淀变为黄色;
④向AgI中滴加0.1mol/LNaCl溶液,无明显现象。
已知: 25℃时,AgCl 和AgI 的溶解度分别是1.5×10-4g 和3×10-7g
请回答:
(1)沉淀c是 。
(2)步骤②中的现象说明滤液b中含有的微粒是 。
(3)步骤③中反应的离子方程式是 。
(4)根据实验,可以得出的结论是 。
23.
(1)已知在25℃时,Ksp[Mg(OH)2]=3.2×10-11,假设饱和Mg(OH)2溶液的浓度为1 g/mL,则Mg(OH)2的溶解度为 g。
(2)在25℃时,向0.02 mol L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为 mol L-1。
(3)25℃时,向浓度均为0.02mol L﹣1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成沉淀 (填化学式);当两种沉淀共存时, = 。(已知25℃时,Ksp[Cu(OH)2]=2.2×10-20)(每个小题都写出计算过程)
24.碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)碳酸钠俗称 ,可作为碱使用的原因是 (用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g) Na2CO3(s)+H2O(g) ΔH1= 127.4 kJ·mol 1
②NaOH(s)+CO2(g) NaHCO3(s) ΔH1= 131.5 kJ·mol 1
反应2Na2CO3(s) Na2CO3(s)+ H2O(g) +CO2(g)的ΔH= kJ·mol 1,该反应的平衡常数表达式K= 。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中
= 。已知Ksp(BaCO3)=2.6×10 9,Ksp(BaSO4)=1.1×10 10。
25.工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32﹣(aq) PbCO3(s)+SO42﹣(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(1)上述反应的平衡常数表达式:K= .
(2)室温时,向两份相同的样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在 溶液中PbSO4转化率较大,理由是 .
26.根据题目提供的溶度积数据进行计算并回答下列问题:
(1)T℃时,在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c( )=10-3 mol·L-1,则Ca2+是否沉淀完全? (填“是”或“否”)。
[已知c(Ca2+)≤10-5 mol·L-1时可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(2)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH <8.0 8.0~9.6 >9.6
颜色 黄色 绿色 蓝色
25℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为 。
(3)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)= 。
②完全沉淀后,溶液的pH= 。
③如果向完全沉淀后的溶液中继续加入50 mL
0.001 mol·L-1的盐酸,是否有白色沉淀生成? (填“是”或“否”)。
答案解析部分
1.【答案】D
【解析】【解答】当加入KI溶液时,溶液中I-浓度增大,PbI2(s) Pb2+(aq)+2I-(aq)溶解平衡向左移动,Pb2+浓度减小,A、C项错误、D项正确;温度不变,Ksp不变,B项错误。
故答案为:D
【分析】本题主要考查沉淀的溶解平衡移动。根据沉淀溶解平衡方程式结合浓度对平衡移动的影响进行解答,注意溶度积常数仅受温度的影响。
2.【答案】B
【解析】【解答】A、草木灰的主要成分是K2CO3,其水溶液显碱性,能与NH4+反应生成NH3,使得肥效降低,因此不可混合使用,A不符合题意。
B、加入Na2S后可发生反应:Cu2++S2-=CuS↓、Hg2++S2-=HgS↓,因此可用Na2S除去废水中的Cu2+、Hg2+,B符合题意。
C、NaClO溶液具有碱性和氧化性,具有腐蚀作用,因此不可用作胃酸中和剂,C不符合题意。
D、明矾为KAl(SO4)2·12H2O,溶于水后可形成Al(OH)3胶体,具有吸附性,可用于净水,但不具有杀菌消毒作用,D不符合题意。
故答案为:B
【分析】A、草木灰显碱性,能与氨态氮肥反应生成NH3。
B、CuS、HgS是一种沉淀。
C、NaClO溶液具有强氧化性,有腐蚀作用。
D、明矾能用于净水,不能用于杀菌。
3.【答案】A
【解析】【解答】A.BaCO3难溶于水但易溶于酸,故不能做钡餐,能用于做钡餐的是硫酸钡,故A符合题意;
B.明矾溶液中Al3+水解使溶液呈酸性,铜锈为Cu2(OH)2CO3,溶于酸性溶液,故利用明矾溶液的酸性清除铜镜表面的铜锈,故B不符合题意;
C.草木灰水溶液显碱性,铵态氮肥与碱性物质混合后,放出氨气,降低肥效,故C不符合题意;
D.由平衡CaSO4(s) Ca2+(aq)+SO42-(aq)可知,加入Na2CO3溶液后,CO32-与Ca2+结合生成CaCO3沉淀,Ca2+浓度减少,使CaSO4的沉淀溶解平衡向溶解方向移动,发生反应:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq),然后再加盐酸,盐酸和碳酸钙反应生成氯化钙、二氧化碳和水,从而除去硫酸钙,故D不符合题意。
故答案为:A。
【分析】A、能用于做钡餐的是难溶于水和盐酸的硫酸钡;
B、明矾溶液中Al3+水解使溶液呈酸性,铜锈与酸性物质反应;
C、草木灰水溶液显碱性,铵态氮肥与碱性物质反应;
D、先用Na2CO3溶液处理,发生沉淀的转化生成碳酸钙,碳酸钙溶于盐酸。
4.【答案】D
【解析】【解答】溶液中存在的SO42-、Ba2+都会抑制BaSO4的溶解,因此BaSO4在纯水中的溶解度最大,D符合题意;
故答案为:D
【分析】结合BaSO4在溶液中的沉淀溶解平衡BaSO4(s) Ba2+(aq)+SO42-(aq)进行分析。
5.【答案】A
【解析】【解答】A.烧杯壁变凉,反应吸热,导致温度降低,为吸热反应,现象、结论均合理,故A符合题意;
B. 将充有NO2的密闭烧瓶放入热水中,烧瓶内气体颜色变深,证明NO2生成N2O4的反应向逆反应方向移动,则逆方向是吸热方向,正方向是放热反应,△H<0,结论不符合题意,故B不符合题意;
B.稀释碱溶液,pH减小,但一水合氨为弱电解质,稀释促进电离,电离程度增大,故C不符合题意;
D. Ksp小的先沉淀,由现象可知Ksp(AgCl)>Ksp(AgI),故D不符合题意;
故答案为:A。
【分析】A.杯壁变凉反应为吸热反应;
B.放入热水生成二氧化氮的量增大,反应向逆反应进行,且逆反应为吸热反应;
C.碱液稀释pH值减小是氢氧根浓度降低所致,与电离程度无关;
D.先出现的沉淀Ksp小,氯化银为黑色,碘化银为黄色。
6.【答案】C
【解析】【解答】解:由Ca(OH)2与Mg(OH)2化学式结构组成相似,而且Ca(OH)2的Ksp大于Mg(OH)2的Ksp,所以Mg(OH)2的溶解度较小;
c[Mg(OH)2]=c(Mg2+)= = ×10﹣3mol/L,c(AgCl)=c(Ag+)= = ×10﹣5mol/L,所以AgCl的溶解度比Mg(OH)2的溶解度小,故C正确、AB错误;
化学式结构组成不相似的难溶物,不能直接根据Ksp比较溶解度大小,故D错误;
故选C.
【分析】化学式结构组成相似的难溶物,Ksp越小,溶解度越小;化学式结构组成不相似的,不能直接比较,要根据Ksp求出其浓度,再比较溶解度大小;当Qc>Ksp时,可以实现沉淀的转化,据此进行解答.
7.【答案】B
【解析】【解答】A、溶解度曲线上的点表示该温度下达到沉淀溶解平衡,则图中p和q分别为、温度下CdS达到沉淀溶解平衡,故A正确;
B、升高温度,Ksp增大,则则T2>T1,则图中各点对应的 的关系为: ,故B错误;
C、 m点达到沉淀溶解平衡,Ksp=c(Cd2+)c(S2-),加入少量Na2S固体时溶液中c(S2-)增大,c(Cd2+),溶液组成由m沿mpn线向p方向移动,故C正确;
D、CdS的溶解过程吸热,温度降低,则饱和CdS溶液中Cd2+、S2-离子浓度同比减小,所以温度降低时q点的饱和溶液的组成由q沿qp线向p方向移动, 故D正确;
故答案为:B。
【分析】A、p、q均在沉淀溶解平衡曲线上;
B、Ksp只与温度有关;
C、 Ksp=c(Cd2+)c(S2-)可知,c(S2-)增大,c(Cd2+)减小;
D、降低温度,Ksp减小。
8.【答案】A
【解析】【解答】解:A.某温度时的混合溶液中c(H+)= mol L﹣1,可知c(H+)=c(OH﹣),则溶液为中性,故A正确;
B.由水电离出的c(H+)=10﹣12mol L﹣1的溶液,为酸或碱溶液,酸碱溶液中均不能大量存在HCO3﹣,故B错误;
C.向含有Cl﹣、CrO42﹣且浓度均为0.010 mol L﹣1溶液中逐滴加入0.010 mol L﹣1的AgNO3溶液时,由Ksp可知需要银离子浓度分别为 =1.56×10﹣8mol/L、 =9.0×10﹣8mol/L,则Cl﹣先产生沉淀,故C错误;
D.pH=7,可知c(H+)=c(OH﹣),由c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)可知,c(Na+)=c(CH3COO﹣),故D错误;
故选A.
【分析】A.某温度时的混合溶液中c(H+)= mol L﹣1,可知c(H+)=c(OH﹣);
B.由水电离出的c(H+)=10﹣12mol L﹣1的溶液,为酸或碱溶液;
C.结合Ksp计算需要的银离子,需要银离子浓度小的阴离子先沉淀;
D.pH=7,可知c(H+)=c(OH﹣),结合电荷守恒式c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)分析.
9.【答案】D
【解析】【解答】A.因 = ,298 K时,加蒸馏水稀释HF溶液,氢离子浓度减小,则 增大,故A不符合题意;
B.298K时K(HF)=3.5×10-4,升高温度,平衡逆向移动,则Ka<3.5×10-4,故B不符合题意;C.温度不变,则溶度积不变,故C不符合题意;D.已知①HF(aq) H+(aq)+F-(aq),②CaF2(s) Ca2+(aq)+2F-(aq),将①×2-②可得2HF(aq)+Ca2+(aq) CaF2(s)+2H+(aq),则K= ≈0.68,故D符合题意;
故答案为:D。
【分析】A.加入蒸馏水稀释促进HF的电离;
B.升高温度,HF挥发,平衡左移;
C.溶度积常数只是温度的函数;
D.根据平衡常数和HF的电离常数、氟化钙的溶度积常数计算该反应的平衡常数。
10.【答案】B
【解析】【解答】A.设镁离子的浓度为a,根据表格中的数据可知当产生Mg(OH)2沉淀时c(OHˉ)= mol/L,当产生碳酸镁沉淀时,c(CO )= mol/L, mol/L< mol/L,所以当镁离子浓度相同时,氢氧化镁更容易产生沉淀,则除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好,故A不符合题意;
B.设钙离子离子的浓度为b,根据表格中的数据可知当产生Ca(OH)2沉淀时c(OHˉ)= mol/L,当产生碳酸钙沉淀时,c(CO )= mol/L, mol/L> mol/L,所以当钙离子浓度相同时,碳酸钙更容易沉淀,则除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好,故B符合题意;
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时, , ,所以 ,C项不符合题意;
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和,c(Ca2+)=1.0×10-2mol/L,c(OH-)= mol/L=2.163×10-2mol/L,若保持温度不变,向其中加入100mL 0.012mol/L的NaOH,混合后,c(Ca2+)=0.5×10-2mol/L,c(OH-)= ,此时Ca(OH)2的离子积 <Ksp[Ca(OH)2],则该溶液变为不饱和溶液,D项不符合题意;
故答案为:B。
【分析】A.当镁离子浓度相同时,氢氧化镁更容易产生沉淀;
B.当钙离子浓度相同时,碳酸钙更容易沉淀;
C.利用Ksp进行计算;
D.比较Qc与Ksp的大小,判断溶液是否饱和。
11.【答案】D
【解析】【解答】解:A.反应的△S<0,从熵变角度看不利于反应的进行,反应能否自发进行,应满足△H﹣T △S<0,故A错误;
B.平衡发生移动,反应热不变,故B错误;
C.将等体积浓度为1.0×10﹣4mol/L的AgNO3溶液滴入到浓度为1.0×10﹣4mol/L的K2CrO4的混合溶液,c(Ag+)=5.0×10﹣5mol/L,则c2(Ag+)×c(CrO42﹣)=2.5×10﹣13,则没有生成Ag2CrO4沉淀,如生成沉淀,则Cl﹣先沉淀,故C错误;
D.由电离常数可知,酸越弱,对应的盐的碱性越强,故D正确.
故选D.
【分析】A.反应的△S<0,从熵变角度看不利于反应的进行;
B.平衡发生移动,反应热不变;
C.根据Ksp(AgCl)、Ksp(Ag2CrO4)计算生成AgCl、Ag2CrO4沉淀时银离子的浓度,比较大小后确定谁先沉淀;
D.酸越弱,对应的盐的碱性越强.
12.【答案】B
【解析】【解答】A.油脂在碱性条件下水解产生可溶性物质,纯碱水解使溶液显碱性,温度升高,纯碱溶液碱性增强,因而去除油污能力增强,故可以用热的纯碱溶液去除油污,A不符合题意;
B.FeS溶于稀H2SO4,而CuS不溶于稀H2SO4,说明二者在硫酸中的溶度积常数Ksp(FeS)>KspCuS),B符合题意;
C.Na2S溶解电离产生的S2-与废水中的Cu2+、Hg2+等重金属离子结合形成HgS、CuS沉淀,从而降低水中重金属离子的浓度,故可以用Na2S处理废水中的Cu2+、Hg2+等重金属离子,C不符合题意;
D.明矾水解时产生的Al(OH)3胶体表面积大,具有强的吸附性,吸附水中悬浮的固体小颗粒,使之形成沉淀而从水中析出,因此可作净水剂,D不符合题意;
故答案为:B。
【分析】A.根据影响水解平衡移动的因素分析;
B.依据反应情况判断溶度积常数;
C.依据沉淀生成原理分析;
D.Al(OH)3胶体表面积大,具有强的吸附性,吸附水中悬浮的固体小颗粒。
13.【答案】B
【解析】【解答】A.Ksp只与温度有关而与离子浓度大小无关,A不符合题意;
B.由图象可知:在相同条件下,温度在313 K时,c(SO42 ) c(Sr2+)乘积最大,则在该温度时Ksp(SrSO4)最大,B符合题意;
C.a点在363K的上方,属于该温度下饱和溶液,C不符合题意;
D.283K下的SrSO4饱和溶液升温到363K后会有晶体析出,析出溶液后的溶液属于饱和溶液,D不符合题意;
故答案为:B。
【分析】沉淀溶解平衡中的溶度积常数只与温度有关,与浓度改变无关;溶解度随温度变化而变化,也随离子浓度改变;硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线,纵轴是锶离子浓度的对数,横轴是硫酸根离子浓度的对数,图象分析采取定一议二的方法进行分析。
14.【答案】B
【解析】【解答】解:A.稀硫酸使溶解平衡逆向移动,则CaSO4在稀硫酸中的溶解性比在纯水中的溶解性弱,故A错误;
B.曲线上的点为平衡点,且温度不变,则a点对应的Ksp等于c点对应的Ksp,故B正确;
C.蒸发时离子浓度增大,则d点溶液不能通过蒸发可以变到c点,因d、c点硫酸根离子浓度相同,故C错误;
D.b转化为a或转化为c,均有沉淀生成,则平衡后溶液中c(SO42﹣)可能等于3×10﹣3mol/L、5×10﹣3mol/L、4×10﹣3mol/L,故D错误;
故选B.
【分析】A.稀硫酸使溶解平衡逆向移动;
B.曲线上的点为平衡点;
C.蒸发时离子浓度增大;
D.b转化为a或转化为c,均有沉淀生成.
15.【答案】C
16.【答案】C
【解析】【解答】解:A.在d点c(CO32﹣)=1.4×10﹣4 mol L﹣1,因室温时,CaCO3的溶度积Ksp=2.8×10﹣9,所以c(Ca2+)=2×10﹣5 mol L﹣1,故x的数值为2×10﹣5,故A正确;
B.在c点c(Ca2+)>×10﹣5 mol L﹣1,即相当于增大c(Ca2+),平衡左移,有CaCO3生成,故B正确;
C.d点为饱和溶液,加入蒸馏水后如仍为饱和溶液,则c(Ca2+)、c(CO32﹣)都不变,如为不饱和溶液,则二者浓度都减小,故不可能使溶液由d点变成a点,故C错误;
D.b点与d点在相同的温度下,溶度积相等,故D正确.
故选:C.
【分析】CaCO3在水中的沉淀溶解平衡为CaCO3(s) Ca2+(aq)+CO32﹣(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题.
17.【答案】C
【解析】【解答】A. NaHS溶液中存在平衡:HS-+H2O H2S+OH-,HS- H++S2-,向NaHS溶液中滴入酚酞,溶液变红色,溶液呈碱性,说明HS-水解程度大于电离程度,实验目的和结论一致,A项不符合题意;
B. 溶度积小的先生成沉淀,向浓度为0.1mol L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水先出现蓝色沉淀,说明Ksp[Cu(OH)2]较小,B项不符合题意;
C. 浓盐酸具有挥发生,反应产生的二氧化碳中含有氯化氢气体,干扰二氧化碳与硅酸钠反应生成硅酸,无法证明碳酸酸性强于硅酸,C项符合题意;
D. 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液,前者溶液变蓝色,说明溶液中含有碘,后者有黄色沉淀,说明溶液中含有碘离子,原来的溶液是KI3溶液,由现象可知,KI3溶液中存在I3- I2+I-平衡,D项不符合题意;
故答案为:C。
【分析】A.硫氢化钠可水解可电离,电离显酸性,水解呈碱性,加入酚酞变红,故显碱性
B.铜离子和镁离子和氨水反应都可产生沉淀,出现蓝色沉淀,说明铜离子与氢氧根结合能力强
C.在通入硅酸钠溶液前,需要将氯化氢除去以免造成干扰
D.淀粉变蓝,说明含有碘单质,加入硝酸银,黄色沉淀,说明有碘离子,因此I3-存在这平衡
18.【答案】B
【解析】【解答】A.由图示可知, 水解对水的电离促进程度较大,则HY的酸性较弱,所以相同条件下Ka(HX)>Ka(HY),故A不选;
B.本题为向酸中滴加Ba(OH)2溶液,因此随着Ba(OH)2溶液的加入溶液先进行酸碱中和反应,所以当HY与Ba(OH)2溶液中水电离出的 第一次达到 时为中性点,当继续滴加Ba(OH)2溶液会抑制水的电离(N点之后),即第二次水电离 该点为碱性点,所以M点呈中性,根据电荷守恒 ,所以c(Y-)>(Ba2+),故B;
C.N点完全反应点,0.1mol/LBa(OH)2溶液中 ,故消耗完20mL0.1mol/L的HY需要10mL0.1mol/LBa(OH)2溶液,故C不选;
D.根据电荷守恒可得T点 ;M点 ;T、M点 相同,T点 大于M点,所以 ,故D不选。
故答案为:B
【分析】A.根据起始点的氢离子浓度即可判断HX和HY的电离常数大小
B.根据电荷守恒进行判断
C.恰好完全反应即可计算出氢氧化钡的体积
D.根据电荷守恒结合氢离子浓度的大小即可判断
19.【答案】C
【解析】【解答】A.离子浓度越大,-lgc(离子)的数值越小,因此a曲线对应的是硫酸钙,b曲线对应的是碳酸钙,c曲线对应的是碳酸铅,A不符合题意;
B.CaCO3和PbCO3的饱和溶液中c(Ca2+):c(Pb2+)= ,B不符合题意;
C.硫酸钙饱和溶液中c(Ca2+)=0.007mol/L,向硫酸钙沉淀中加入1mol/L的碳酸钠溶液时,此时浓度熵=c(Ca2+)·c( )=0.007>Ksp(CaCO3),因此一定有碳酸钙沉淀生成,所以硫酸钙会转化为碳酸钙沉淀,C符合题意;
D.当向CaCO3悬浊液中加入NH4Cl固体时,铵根水解显酸性,会消耗溶液中的 ,使溶解平衡向溶解的方向移动,溶液中c(Ca2+)增大,d点向e点转化,D不符合题意;
故答案为:C。
【分析】A.电离常数越大,对应的 pM=-lgc(阴离子)、pN=-lgc(阳离子) 数值越小
B.根据饱和溶液中的溶度积公式计算出 c(Ca2+):c(Pb2+) 即可
C.根据Ksp越小,越难溶解,越易形成沉淀
D.铵根水解呈酸性,导致沉淀平衡的移动
20.【答案】C
【解析】【解答】A.根据起点:-lgc(Ca2+)≈9, -lgc(CO )=0,可得 Ksp(CaCO3)的数量级为10-9,故A不符合题意;
B.因为横纵坐标均为负对数,值越大,离子浓度越小,所以a点表示的溶液中,c(Ca2+)>c(CO ),故B不符合题意;
C.向浓度均为0.01mol·L-1的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,Ksp最小的先达到饱和,生成沉淀,根据图像可知Ksp(MnCO3)D. 根据图像可知Ksp(CaCO3)< Ksp(MgCO3),向MgCO3悬浊液中加入少量CaCl2溶液,会生成CaCO3沉淀,故D不符合题意;
故答案为C。
【分析】A.根据与横纵坐标的交点即可计算出数量级
B.根据横纵坐标的大小即可比较大小
C根据图标帕努但,负对数越大,浓度越小,说明因此碳酸锰的离子浓度最小,其次是碳酸钙中离子浓度,最后是碳酸镁溶液中离子浓度,因此碳酸锰的Ksp最小,最先沉淀
D.Ksp最小的先达到饱和,生成沉淀,而ksp(CaCO3)<ksp(MgCO3)
21.【答案】D
【解析】【解答】
A. Na2S是强碱弱酸盐,S2-水解使溶液呈碱性,离子方程式为:S2-+H2O HS-+OH-、HS-+H2O H2S+OH-,故A错误,A不符合题意;
B. 在Na2S溶液中,根据物料守恒得2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),故B错误,B不符合题意;
C. 向10 mL 0.1 mol/L CuSO4溶液中滴加0.1 mol/L的Na2S溶液,发生反应:Cu2++S2-=CuS↓,根据方程式可知,当加入10mL0.1 mol/L的Na2S溶液时,二者恰好完全反应,则b点时恰好完全反应形成CuS沉淀,CuS存在沉淀溶解平衡:CuS(s) Cu2+(aq)+S2 (aq),已知此时 lgc(Cu2+)=17.7,则平衡时c(Cu2+)=c(S2 )=10 17.7mol/L,Ksp(CuS)=c(Cu2+)×c(S2 )=10 17.7mol/L×10 17.7mol/L=10 35.4,已知lg2=0.3,则Ksp(CuS)=10 35.4 =(100.3)2×10 36 =4×10 36,向100 mLZn2+、Cu2+浓度均为10 5mol/L的混合溶液中逐滴加入10 4mol/L的Na2S溶液,产生ZnS时需要的S2 浓度为c(S2 )=Ksp(ZnS)÷c(Zn2+)=(3×10 25÷10 5)mol/L=3×10 20mol/L,产生CuS时需要的S2 浓度为c(S2 )=Ksp(CuS)÷c(Cu2+)=(4×10 36÷10 5)mol/L=4×10 31mol/L,则产生CuS沉淀所需S2 浓度更小,先产生CuS沉淀,故C错误,C不符合题意;
D. 根据C项分析可知,该温度下Ksp(CuS)=4×10-36,故D正确,D符合题意;
故正确答案为:D。
【分析】A、考查盐类水解离子水解方程式书写,注意弱酸根离子水解分步水解。
B、考查盐类水解的物料守恒,突破口是原子守恒。
C、沉淀生成先后顺序。注意根据KSP来判断溶解度大小,先生成溶解度小的。
D、考查KSP的计算。
22.【答案】(1)AgCl
(2)Ag+
(3)AgCl (s) +I-=AgI (s) +Cl-
(4)难溶盐在水中存在溶解平衡; 通过溶解平衡的移动,溶解度小的难溶盐转化为溶解度更小的难溶盐容易实现
【解析】【解答】本题主要考查沉淀的转化。(1)沉淀c是AgCl。(2)步骤②中的现象说明生成AgI,滤液b中含有的微粒是Ag+。(3)步骤③中反应的离子方程式是AgCl (s) +I-=AgI (s) +Cl-。(4)根据实验,可以得出的结论是难溶盐在水中存在溶解平衡; 通过溶解平衡的移动,溶解度小的难溶盐转化为溶解度更小的难溶盐容易实现。
【分析】要注意被一个步骤出现的物质,根据复分解反应得到的沉淀,以及难溶物的转化,可以得到每一步的结果;
(1)根据复分解反应可以知道产物为氯化银;
(2)要注意氯化银难溶于水,溶液中含有少量的银离子;
(3)根据难溶物的进一步转换可以知道氯化银可以转化为碘化银;
(4)难溶电解质的溶解平衡,满足勒夏特列定律。
23.【答案】(1)1.16×10-3
(2)4.0×10-5
(3)Cu(OH)2;1.45×109
【解析】【解答】(1)设饱和溶液Mg(OH)2的物质的量浓度为c,则c(Mg2+)×c2(OH-)=4c3=3.2×10-11,解得c=2×10-4 mol/L,假设饱和Mg(OH)2溶液的浓度为1 g/mL,则100 mL溶液的质量为100 g,含有溶质的质量m[Mg(OH)2]=2×10-4 mol/L×0.1 L×58 g/mol=1.16×10-3 g,溶剂的质量约为100 g,所以其溶解度S≈1.16×10-3 g;(2)如果溶液中Qc>Ksp[Mg(OH)2]就能产生沉淀,c(OH-)= =4.0×10-5 mol/L;(3)溶度积常数越小的物质先产生沉淀,由于Ksp[Cu(OH)2]<Ksp[Mg(OH)2],所以先生成沉淀的是Cu(OH)2,当两种沉淀共存时, =1.45×109。
【分析】(1)求溶解度,就是要求在某一物温度下,固体在100g溶剂中溶解溶质达到饱和状态的固体的质量,给出的条件是 饱和Mg(OH)2溶液的浓度为1 g/mL ,即是在100mL溶液里面有溶液为100g.根据难溶物质的dialing平衡,额可以求出镁离子的物质的量浓度,可以计算出100mL溶液含有的氢氧化镁的质量即可
(2)根据Ksp=c(Mg2+)×c2(OH-)可以计算出氢氧根离子的浓度即可
(3)根据溶度积进行比较,越小越难溶解,根据Ksp(Mg(OH)2)=c(Mg2+)×c2(OH-),Ksp(Cu(OH)2)=c(Cu2+)×c2(OH-)进行公式换算即可求出答案
24.【答案】(1)纯碱;CO32﹣+H2O HCO3﹣+OH﹣
(2)+135.6;c(H2O) c(CO2)
(3)
【解析】【解答】解:(1)碳酸钠俗称纯碱;Na2CO3为强碱弱酸盐,CO32﹣离子水解方程式为CO32﹣+H2O HCO3﹣+OH﹣,使溶液呈碱性,
故答案为:纯碱;CO32﹣+H2O HCO3﹣+OH﹣;(2)①2NaOH(s)+CO2(g)═Na2CO3(s)+H2O(g)△H1=﹣127.4kJ mol﹣1
②NaOH(s)+CO2(g)═NaHCO3(s)△H1=﹣131.5kJ mol﹣1
,①﹣2×②得,2NaHCO3(s)═Na2CO3(s)+H2O(g)+CO2(g)△H=+135.6kJ mol﹣1;K=c(H2O) c(CO2),
故答案为:+135.6;c(H2O) c(CO2);(3)Ksp(Ba SO4)=c(Ba2+)(SO42﹣)=1.1×10﹣10;Ksp(BaCO3)=c(Ba2+)c(CO32﹣)=2.6×10﹣9,
所以 = = = ,
故答案为: .
【分析】(1)碳酸钠俗称纯碱;Na2CO3为强碱弱酸盐,CO32﹣水解使溶液呈碱性;(2)①2NaOH(s)+CO2(g)═Na2CO3(s)+H2O(g)△H1=﹣127.4kJ mol﹣1
②NaOH(s)+CO2(g)═NaHCO3(s)△H1=﹣131.5kJ mol﹣1
,①﹣2×②得,2NaHCO3(s)═Na2CO3(s)+H2O(g)+CO2(g)据此进行分析;K= ;(3)当碳酸钡、硫酸钡两种沉淀共存时,溶液中钡离子浓度为定值,根据溶度积计算.
25.【答案】(1)
(2)Na2CO3 ;相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32﹣)较大
【解析】【解答】解:(1)反应平衡常数是用各反应物和生成物浓度计算表示,固体和纯液体的浓度是定值不出现在表达式中,平衡常数K= ,故答案为: ;(2)在溶液中Na2CO3能完全电离生成碳酸根离子,而碳酸氢根离子微弱电离生成碳酸根离子,所以相同浓度的Na2CO3和NaHCO3溶液中,碳酸钠溶液中碳酸根离子浓度大,PbSO4转化率较大;
故答案为:Na2CO3 ;相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32﹣)较大.
【分析】(1)PbSO4(s)+CO32﹣(aq) PbCO3(s)+SO42﹣(aq).依据平衡常数概念写出计算式;(2)根据反应达到的平衡分析:PbSO4(s)+CO32﹣(aq) PbCO3(s)+SO42﹣(aq),增大碳酸根离子浓度平衡正向进行,促进硫酸铅转化.
26.【答案】(1)是
(2)蓝色
(3)1.0×10-7mol·L-1;2;否
【解析】【解答】(1) Ksp(CaCO3)=4.96×10-9 ,若c(CO32-)=10-3mol/L,则c(Ca2+)=4.96×10-9÷10-3=4.96×10-6<10-5 mol/L,所以Ca2+沉淀完全了; (2) 25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12,根据反应Mg(OH)2(s) Mg2++2OH-可得:c(Mg2+) c2(OH-)=5.6×10-12,设c(OH-)=2c(Mg2+)=x,则:0.5x×x2=5.6×10-12,解得:x=2.24×10-4mol/L,则根据室温下水的离子积常数Kw= c(H+) c(OH-)=10-14,可得c(H+)= mol/L=4.5×10-11mol/L,溶液的pH=10.4>9.6,所以溶液呈蓝色;(3)①反应前,n(Ag+)=0.018 mol/L×0.05 L=9×10-4 mol,n(Cl-)=0.020 mol/L×0.05L=1×10-3 mol;反应后剩余的Cl-为1×10-4 mol,则混合溶液中,c(Cl-)=1.0×10-3 mol/L,c(Ag+)=Ksp(AgCl)÷c(Cl-)=1.0×10-7 mol/L; ②H+没有参与反应,完全沉淀后,c(H+)=0.020mol/L÷2=0.010 mol/L,所以反应后溶液中pH=2;③再向反应后的溶液中加入50mL0.001mol/L盐酸,由于加入盐酸中c(Cl-)与反应后溶液中的c(Cl-)相同,c(Cl-)不变,但c(Ag+)由于盐酸加入,溶液的体积增大而变小,所以Qc= c(Ag+) c(Cl-)【分析】1、本题考查是溶度积的知识,要注意根据溶度积计算公式,将碳酸根的浓度代入可以求出钙离子的浓度;
2、根据氢氧化镁的溶度积,可以计算出其氢氧根的浓度,根据浓度值观察在指示剂的范围;
3、要注意混合溶液的时候体积会发生变化,所以两种溶液的浓度也会发生相应变化,根据变化后的浓度代入溶度积计算公式。
一、单选题
1.25 ℃时,在含有大量PbI2的饱和溶液中存在着平衡:PbI2(s) Pb2+(aq)+2I-(aq),加入KI溶液,下列说法正确的是( )
A. 溶液中Pb2+和I-浓度都增大
B.溶度积常数Ksp增大
C.沉淀溶解平衡向右移动
D.溶液中Pb2+浓度减小
2.化学与生产、生活息息相关.下列做法正确的是( )
A.铵态氮肥和草木灰可以混合施用
B.废水中的、等离子可用处理
C.次氯酸钠溶液呈碱性,可用作胃酸中和剂
D.明矾溶于水形成胶体,可用于杀菌
3.下列叙述错误的是( )
A.BaCO3是难溶于水的强电解质,在医学上用作钡餐
B.中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
C.施肥时,草木灰不能与铵态氮肥混合使用,否则会降低肥效
D.锅炉水垢中含有的CaSO4,可先用饱和碳酸钠溶液处理,而后用盐酸除去
4.在下列溶液中,BaSO4的溶解度最大的是( )
A.1mol/LH2SO4溶液 B.2mol/LNa2SO4溶液
C.0.1mol/ L BaCl2溶液 D.纯水
5.下列实验操作对应的现象与结论均正确的是( )
选项 实验操作 现象 结论
A 常温下将Ba(OH)2·8H2O晶体与NH4Cl晶体在小烧杯中混合 烧杯壁变凉 Ba(OH)2·8H2O晶体与NH4Cl的反应是吸热反应
B 将充有NO2的密闭烧瓶放入热水中 烧瓶内气体颜色变深 NO2生成N2O4的反应中,△H>0
C 将0.1mol·L-1的氨水稀释成0.01mol·L-1,测量稀释前后溶液 pH pH减小 稀释后NH3·H2O电离程度减小
D 常温下向物质的量浓度均为0.1mol·L-1的NaCl和NaI混合溶液中逐滴滴入AgNO3溶液 先出现黄色沉淀 Ksp(AgCl)<Ksp(AgI)
A.A B.B C.C D.D
6.对Ca(OH)2(Ksp=5.5×10﹣6)、Mg(OH)2(Ksp=1.2×10﹣11)、AgCl(Ksp=1.56×10﹣10)三种物质,下列说法正确的是( )
A.Mg(OH)2的溶解度最小
B.Ca(OH)2的溶解度最小
C.AgCl的溶解度最小
D.同一温度下Ksp越大的溶解度也越大
7.硫化镉(CdS)是一种难溶于水的黄色颜料,其在水中的沉淀溶解平衡曲线如下图所示。下列说法错误的是( )
A.图中p和q分别为、温度下CdS达到沉淀溶解平衡
B.图中各点对应的的关系为:
C.向m点的溶液中加入少量固体,溶液中浓度降低
D.温度降低时,q点饱和溶液的组成由q沿qp线向p方向移动
8.下列有关说法中正确的是( )
A.某温度时的混合溶液中c(H+)= mol L﹣1,说明该溶液呈中性(Kw为该温度时水的离子积常数)
B.由水电离出的c(H+)=10﹣12mol L﹣1的溶液中:Na+、Ba2+、HCO3﹣、Cl﹣可以大量共存
C.已知Ksp(AgCl)=1.56×10﹣10,Ksp(Ag2CrO4)=9.0×10﹣12.向含有Cl﹣、CrO42﹣且浓度均为0.010 mol L﹣1溶液中逐滴加入0.010 mol L﹣1的AgNO3溶液时,CrO42﹣先产生沉淀
D.常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO﹣)
9.已知:①298K时K(HF)=3.5×10-4,Ksp(CaF2)=1.8×10-7
②HF(aq) H+(aq)+F-(aq)△H<0
根据以上已知信息判断下列说法正确的是( )
A.298K时,加蒸馏水稀释HF溶液, 保持不变
B.308K时,HF的电离常数Ka>3.5×10-4
C.298K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小
D.2HF(aq)+Ca2+(aq) CaF2(s)+2H+(aq)K≈0.68
10.常温下,有关物质的溶度积如下,下列有关说法错误的是( )
物质 CaCO3 MgCO3 Ca(OH)2 Mg(OH)2 Fe(OH)3
Ksp 4.96×10-9 6.82×10-6 4.68×10-6 5.60×10-12 2.80×10-39
A.常温下,除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
B.常温下,除去NaCl溶液中的CaCl2杂质,选用NaOH溶液比Na2CO3溶液效果好
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时,c(Mg2+):c(Fe3+)=2.0×10-21
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和[c(Ca2+)=1.0×10-2mol/L],若保持温度不变,向其中加入100mL0.012mol/L的NaOH,则该溶液变为不饱和溶液
11.下列说法正确的是( )
A.反应2Mg+CO2 2MgO+C△H<0从熵变角度看,可自发进行
B.在密闭容器发生可逆反应:2NO(g)+2CO(g) N2(g)+2CO2(g)△H=﹣113.0 kJ/mol,达到平衡后,保持温度不变,缩小容器体积,重新达到平衡后,△H变小
C.已知:Ksp(AgCl)=1.8×10﹣10,Ksp(Ag2CrO4)=2.0×10﹣12,将等体积浓度为1.0×10﹣4mol/L的AgNO3溶液滴入到浓度均为1.0×10﹣4mol/L的KCl和K2CrO4的混合溶液中产生两种不同沉淀,且Ag2CrO4沉淀先产生
D.根据HClO的Ka=3.0×10﹣8,H2CO3的Ka1=4.3×10﹣7,Ka2=5.6×10﹣11,可推测相同状况下,等浓度的NaClO与Na2CO3溶液中,pH前者小于后者
12.下列说法错误的是( )
A.用热的纯碱溶液去除油污
B.FeS溶于稀H2SO4,而CuS不溶于稀H2SO4,Ksp(FeS)<KspCuS)
C.用Na2S处理废水中的Cu2+、Hg2+等重金属离子
D.明矾水解时产生具有吸附性的胶体粒子,可作净水剂
13.硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下。下列说法正确的是( )
A.温度一定时, Ksp(SrSO4)随c(SO42-)的增大而减小
B.三个不同温度中,313 K时Ksp(SrSO4)最大
C.363 K时,图中a点对应的溶液是不饱和溶液
D.283K下的SrSO4饱和溶液升温到363K后变为不饱和溶液
14.常温下,Ksp(CaSO4)=9×10﹣6,CaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( )
A.CaSO4在稀硫酸中的溶解性比在纯水中的溶解性强
B.a点对应的Ksp等于c点对应的Ksp
C.d点溶液通过蒸发可以变到c点
D.b点将有沉淀生成,平衡后溶液中c(SO42﹣)一定等于3×10﹣3mol/L
15.25℃下,在含一定质量Mg(OH)2的悬浊液中,分6次快速注入等量盐酸,体系pH变化曲线如图。下列说法不正确的是( )
A.由图可知,酸碱中和反应速率大于Mg(OH)2沉淀溶解速率
B.第6次加入盐酸时,Mg(OH)2沉淀消耗完全
C.由图可知Ksp[Mg(OH)2]=5×10-32.8
D.上述过程中Mg(OH)2沉淀溶解平衡常数保持不变
16.室温时,CaCO3在水中的溶解平衡曲线如图所示,已知:25℃其溶度积为2.8×10﹣9 mol2/L2,下列说法不正确的是( )
A.x数值为2×10﹣5
B.c点时有碳酸钙沉淀生成
C.加入蒸馏水可使溶液由d点变到a点
D.b点与d点对应的溶度积相等
17.下列根据实验操作和现象所得出的结论错误的是( )
选项 实验操作 实验现象 结论
A 向NaHS溶液中滴入酚酞 溶液变红色 HS-水解程度大于电离程度
B 向浓度均为0.1mol/L的MgCl2、CuCl2混合溶液中逐滴加入氨水 出现蓝色沉淀 Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
C 向Na2CO3溶液中加入浓盐酸,将产生的气体通入硅酸钠溶液中 产生白色浑浊 酸性:盐酸>碳酸>硅酸
D 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液 前者溶液变蓝色,后者有黄色沉淀 KI3溶液中存在I I2+I 平衡
A.A B.B C.C D.D
18.室温下,分别向体积均为20mL、浓度均为0.1mol·L-1的HX、HY溶液中,滴加相同浓度的Ba(OH)2溶液(Ba2+与X-、Y-均不反应)。随着Ba(OH)2溶液的加入,由水电离产生的c(H+)的变化趋势如图所示。下列说法错误的是( )
A.相同条件下,Ka(HX)>Ka(HY)
B.M点溶液显中性,溶液中c(Y-)
D.T点溶液中阴离子浓度之和大于M点
19.已知:T℃时, Ksp(CaSO4)=4.90×10-5,Ksp(CaCO3) =2.8×10-9,Ksp(PbCO3) =8.4×10-14,三种盐的沉淀溶解平衡曲线如图所示,pM=-lgc(阴离子)、pN=-lgc(阳离子).下列说法正确的是( )
A.a线代表的是PbCO3
B.T℃时,向10 mL水中加入CaCO3和PbCO3至二者均饱和,溶液中c(Ca2+):c(Pb2+)=3×10-5
C.T℃时,向CaSO4沉淀中加入1mol·L-1的Na2CO3溶液,CaSO4沉淀会转化为CaCO3沉淀
D.T℃时,向CaCO3悬浊液中加入NH4Cl固体,会使图象中d点向f点转化
20.一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。下列说法错误的是( )
A.Ksp(CaCO3)的数量级为10-9
B.a点表示的溶液中,c(Ca2+)>c(CO )
C.向浓度均为0.01mol·L-1的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,最先形成MgCO3沉淀
D.向MgCO3悬浊液中加入少量CaCl2溶液,会生成CaCO3沉淀
21.某温度下,向1.0mL 0.1mol/LCuSO4溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是()
[已知:lg2=0.3,Ksp(ZnS)=3×10-25]
A.Na2S溶液呈碱性,是因为S2-离子发生了水解,用离子方程式可表示为:S2-+2H2O HS-+2OH-
B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C.向100 mLZn2+、Cu2+浓度均为10 5mol/L的混合溶液中逐滴加入10 4mol/L的Na2S溶液,Zn2+先沉淀
D.该温度下Ksp(CuS)=4×10-36
二、综合题
22.某研究小组以银盐为实验对象,研究难溶盐时进行了如下实验:
①0.1mol/LAgNO3溶液和0.1mol/LNaCl溶液等体积混合得到浊液a,过滤得到滤液b和白色沉淀c:
②向滤液b中滴加0.1mol/LKI溶液。出现浑浊;
③向沉淀c中滴加0.1mol/LKI溶液,沉淀变为黄色;
④向AgI中滴加0.1mol/LNaCl溶液,无明显现象。
已知: 25℃时,AgCl 和AgI 的溶解度分别是1.5×10-4g 和3×10-7g
请回答:
(1)沉淀c是 。
(2)步骤②中的现象说明滤液b中含有的微粒是 。
(3)步骤③中反应的离子方程式是 。
(4)根据实验,可以得出的结论是 。
23.
(1)已知在25℃时,Ksp[Mg(OH)2]=3.2×10-11,假设饱和Mg(OH)2溶液的浓度为1 g/mL,则Mg(OH)2的溶解度为 g。
(2)在25℃时,向0.02 mol L-1的MgCl2溶液中加入NaOH固体,如要生成Mg(OH)2沉淀,应使溶液中的c(OH-)最小为 mol L-1。
(3)25℃时,向浓度均为0.02mol L﹣1的MgCl2和CuCl2混合溶液中逐滴加入NaOH溶液,先生成沉淀 (填化学式);当两种沉淀共存时, = 。(已知25℃时,Ksp[Cu(OH)2]=2.2×10-20)(每个小题都写出计算过程)
24.碳酸钠是一种重要的化工原料,主要采用氨碱法生产。回答下列问题:
(1)碳酸钠俗称 ,可作为碱使用的原因是 (用离子方程式表示)。
(2)已知:①2NaOH(s)+CO2(g) Na2CO3(s)+H2O(g) ΔH1= 127.4 kJ·mol 1
②NaOH(s)+CO2(g) NaHCO3(s) ΔH1= 131.5 kJ·mol 1
反应2Na2CO3(s) Na2CO3(s)+ H2O(g) +CO2(g)的ΔH= kJ·mol 1,该反应的平衡常数表达式K= 。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中
= 。已知Ksp(BaCO3)=2.6×10 9,Ksp(BaSO4)=1.1×10 10。
25.工业上从废铅酸电池的铅膏回收铅的过程中,可用碳酸盐溶液与铅膏(主要成分为PbSO4)发生反应:PbSO4(s)+CO32﹣(aq) PbCO3(s)+SO42﹣(aq).某课题组用PbSO4为原料模拟该过程,探究上述反应的实验条件及固体产物的成分.
(1)上述反应的平衡常数表达式:K= .
(2)室温时,向两份相同的样品中分别加入同体积、同浓度的Na2CO3和NaHCO3溶液均可实现上述转化,在 溶液中PbSO4转化率较大,理由是 .
26.根据题目提供的溶度积数据进行计算并回答下列问题:
(1)T℃时,在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c( )=10-3 mol·L-1,则Ca2+是否沉淀完全? (填“是”或“否”)。
[已知c(Ca2+)≤10-5 mol·L-1时可视为沉淀完全;Ksp(CaCO3)=4.96×10-9]
(2)已知25℃时,Ksp[Mg(OH)2]=5.6×10-12;酸碱指示剂百里酚蓝变色的pH范围如表所示:
pH <8.0 8.0~9.6 >9.6
颜色 黄色 绿色 蓝色
25℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为 。
(3)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液混合后体积的变化,请计算:
①完全沉淀后,溶液中c(Ag+)= 。
②完全沉淀后,溶液的pH= 。
③如果向完全沉淀后的溶液中继续加入50 mL
0.001 mol·L-1的盐酸,是否有白色沉淀生成? (填“是”或“否”)。
答案解析部分
1.【答案】D
【解析】【解答】当加入KI溶液时,溶液中I-浓度增大,PbI2(s) Pb2+(aq)+2I-(aq)溶解平衡向左移动,Pb2+浓度减小,A、C项错误、D项正确;温度不变,Ksp不变,B项错误。
故答案为:D
【分析】本题主要考查沉淀的溶解平衡移动。根据沉淀溶解平衡方程式结合浓度对平衡移动的影响进行解答,注意溶度积常数仅受温度的影响。
2.【答案】B
【解析】【解答】A、草木灰的主要成分是K2CO3,其水溶液显碱性,能与NH4+反应生成NH3,使得肥效降低,因此不可混合使用,A不符合题意。
B、加入Na2S后可发生反应:Cu2++S2-=CuS↓、Hg2++S2-=HgS↓,因此可用Na2S除去废水中的Cu2+、Hg2+,B符合题意。
C、NaClO溶液具有碱性和氧化性,具有腐蚀作用,因此不可用作胃酸中和剂,C不符合题意。
D、明矾为KAl(SO4)2·12H2O,溶于水后可形成Al(OH)3胶体,具有吸附性,可用于净水,但不具有杀菌消毒作用,D不符合题意。
故答案为:B
【分析】A、草木灰显碱性,能与氨态氮肥反应生成NH3。
B、CuS、HgS是一种沉淀。
C、NaClO溶液具有强氧化性,有腐蚀作用。
D、明矾能用于净水,不能用于杀菌。
3.【答案】A
【解析】【解答】A.BaCO3难溶于水但易溶于酸,故不能做钡餐,能用于做钡餐的是硫酸钡,故A符合题意;
B.明矾溶液中Al3+水解使溶液呈酸性,铜锈为Cu2(OH)2CO3,溶于酸性溶液,故利用明矾溶液的酸性清除铜镜表面的铜锈,故B不符合题意;
C.草木灰水溶液显碱性,铵态氮肥与碱性物质混合后,放出氨气,降低肥效,故C不符合题意;
D.由平衡CaSO4(s) Ca2+(aq)+SO42-(aq)可知,加入Na2CO3溶液后,CO32-与Ca2+结合生成CaCO3沉淀,Ca2+浓度减少,使CaSO4的沉淀溶解平衡向溶解方向移动,发生反应:CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq),然后再加盐酸,盐酸和碳酸钙反应生成氯化钙、二氧化碳和水,从而除去硫酸钙,故D不符合题意。
故答案为:A。
【分析】A、能用于做钡餐的是难溶于水和盐酸的硫酸钡;
B、明矾溶液中Al3+水解使溶液呈酸性,铜锈与酸性物质反应;
C、草木灰水溶液显碱性,铵态氮肥与碱性物质反应;
D、先用Na2CO3溶液处理,发生沉淀的转化生成碳酸钙,碳酸钙溶于盐酸。
4.【答案】D
【解析】【解答】溶液中存在的SO42-、Ba2+都会抑制BaSO4的溶解,因此BaSO4在纯水中的溶解度最大,D符合题意;
故答案为:D
【分析】结合BaSO4在溶液中的沉淀溶解平衡BaSO4(s) Ba2+(aq)+SO42-(aq)进行分析。
5.【答案】A
【解析】【解答】A.烧杯壁变凉,反应吸热,导致温度降低,为吸热反应,现象、结论均合理,故A符合题意;
B. 将充有NO2的密闭烧瓶放入热水中,烧瓶内气体颜色变深,证明NO2生成N2O4的反应向逆反应方向移动,则逆方向是吸热方向,正方向是放热反应,△H<0,结论不符合题意,故B不符合题意;
B.稀释碱溶液,pH减小,但一水合氨为弱电解质,稀释促进电离,电离程度增大,故C不符合题意;
D. Ksp小的先沉淀,由现象可知Ksp(AgCl)>Ksp(AgI),故D不符合题意;
故答案为:A。
【分析】A.杯壁变凉反应为吸热反应;
B.放入热水生成二氧化氮的量增大,反应向逆反应进行,且逆反应为吸热反应;
C.碱液稀释pH值减小是氢氧根浓度降低所致,与电离程度无关;
D.先出现的沉淀Ksp小,氯化银为黑色,碘化银为黄色。
6.【答案】C
【解析】【解答】解:由Ca(OH)2与Mg(OH)2化学式结构组成相似,而且Ca(OH)2的Ksp大于Mg(OH)2的Ksp,所以Mg(OH)2的溶解度较小;
c[Mg(OH)2]=c(Mg2+)= = ×10﹣3mol/L,c(AgCl)=c(Ag+)= = ×10﹣5mol/L,所以AgCl的溶解度比Mg(OH)2的溶解度小,故C正确、AB错误;
化学式结构组成不相似的难溶物,不能直接根据Ksp比较溶解度大小,故D错误;
故选C.
【分析】化学式结构组成相似的难溶物,Ksp越小,溶解度越小;化学式结构组成不相似的,不能直接比较,要根据Ksp求出其浓度,再比较溶解度大小;当Qc>Ksp时,可以实现沉淀的转化,据此进行解答.
7.【答案】B
【解析】【解答】A、溶解度曲线上的点表示该温度下达到沉淀溶解平衡,则图中p和q分别为、温度下CdS达到沉淀溶解平衡,故A正确;
B、升高温度,Ksp增大,则则T2>T1,则图中各点对应的 的关系为: ,故B错误;
C、 m点达到沉淀溶解平衡,Ksp=c(Cd2+)c(S2-),加入少量Na2S固体时溶液中c(S2-)增大,c(Cd2+),溶液组成由m沿mpn线向p方向移动,故C正确;
D、CdS的溶解过程吸热,温度降低,则饱和CdS溶液中Cd2+、S2-离子浓度同比减小,所以温度降低时q点的饱和溶液的组成由q沿qp线向p方向移动, 故D正确;
故答案为:B。
【分析】A、p、q均在沉淀溶解平衡曲线上;
B、Ksp只与温度有关;
C、 Ksp=c(Cd2+)c(S2-)可知,c(S2-)增大,c(Cd2+)减小;
D、降低温度,Ksp减小。
8.【答案】A
【解析】【解答】解:A.某温度时的混合溶液中c(H+)= mol L﹣1,可知c(H+)=c(OH﹣),则溶液为中性,故A正确;
B.由水电离出的c(H+)=10﹣12mol L﹣1的溶液,为酸或碱溶液,酸碱溶液中均不能大量存在HCO3﹣,故B错误;
C.向含有Cl﹣、CrO42﹣且浓度均为0.010 mol L﹣1溶液中逐滴加入0.010 mol L﹣1的AgNO3溶液时,由Ksp可知需要银离子浓度分别为 =1.56×10﹣8mol/L、 =9.0×10﹣8mol/L,则Cl﹣先产生沉淀,故C错误;
D.pH=7,可知c(H+)=c(OH﹣),由c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)可知,c(Na+)=c(CH3COO﹣),故D错误;
故选A.
【分析】A.某温度时的混合溶液中c(H+)= mol L﹣1,可知c(H+)=c(OH﹣);
B.由水电离出的c(H+)=10﹣12mol L﹣1的溶液,为酸或碱溶液;
C.结合Ksp计算需要的银离子,需要银离子浓度小的阴离子先沉淀;
D.pH=7,可知c(H+)=c(OH﹣),结合电荷守恒式c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)分析.
9.【答案】D
【解析】【解答】A.因 = ,298 K时,加蒸馏水稀释HF溶液,氢离子浓度减小,则 增大,故A不符合题意;
B.298K时K(HF)=3.5×10-4,升高温度,平衡逆向移动,则Ka<3.5×10-4,故B不符合题意;C.温度不变,则溶度积不变,故C不符合题意;D.已知①HF(aq) H+(aq)+F-(aq),②CaF2(s) Ca2+(aq)+2F-(aq),将①×2-②可得2HF(aq)+Ca2+(aq) CaF2(s)+2H+(aq),则K= ≈0.68,故D符合题意;
故答案为:D。
【分析】A.加入蒸馏水稀释促进HF的电离;
B.升高温度,HF挥发,平衡左移;
C.溶度积常数只是温度的函数;
D.根据平衡常数和HF的电离常数、氟化钙的溶度积常数计算该反应的平衡常数。
10.【答案】B
【解析】【解答】A.设镁离子的浓度为a,根据表格中的数据可知当产生Mg(OH)2沉淀时c(OHˉ)= mol/L,当产生碳酸镁沉淀时,c(CO )= mol/L, mol/L< mol/L,所以当镁离子浓度相同时,氢氧化镁更容易产生沉淀,则除去NaCl溶液中的MgCl2杂质,选用NaOH溶液比Na2CO3溶液效果好,故A不符合题意;
B.设钙离子离子的浓度为b,根据表格中的数据可知当产生Ca(OH)2沉淀时c(OHˉ)= mol/L,当产生碳酸钙沉淀时,c(CO )= mol/L, mol/L> mol/L,所以当钙离子浓度相同时,碳酸钙更容易沉淀,则除去NaCl溶液中的CaCl2杂质,选用Na2CO3溶液比NaOH溶液效果好,故B符合题意;
C.向含有Mg2+、Fe3+的溶液中滴加NaOH溶液,当两种沉淀共存且溶液的pH=8时, , ,所以 ,C项不符合题意;
D.将适量的Ca(OH)2固体溶于100mL水中,刚好达到饱和,c(Ca2+)=1.0×10-2mol/L,c(OH-)= mol/L=2.163×10-2mol/L,若保持温度不变,向其中加入100mL 0.012mol/L的NaOH,混合后,c(Ca2+)=0.5×10-2mol/L,c(OH-)= ,此时Ca(OH)2的离子积 <Ksp[Ca(OH)2],则该溶液变为不饱和溶液,D项不符合题意;
故答案为:B。
【分析】A.当镁离子浓度相同时,氢氧化镁更容易产生沉淀;
B.当钙离子浓度相同时,碳酸钙更容易沉淀;
C.利用Ksp进行计算;
D.比较Qc与Ksp的大小,判断溶液是否饱和。
11.【答案】D
【解析】【解答】解:A.反应的△S<0,从熵变角度看不利于反应的进行,反应能否自发进行,应满足△H﹣T △S<0,故A错误;
B.平衡发生移动,反应热不变,故B错误;
C.将等体积浓度为1.0×10﹣4mol/L的AgNO3溶液滴入到浓度为1.0×10﹣4mol/L的K2CrO4的混合溶液,c(Ag+)=5.0×10﹣5mol/L,则c2(Ag+)×c(CrO42﹣)=2.5×10﹣13,则没有生成Ag2CrO4沉淀,如生成沉淀,则Cl﹣先沉淀,故C错误;
D.由电离常数可知,酸越弱,对应的盐的碱性越强,故D正确.
故选D.
【分析】A.反应的△S<0,从熵变角度看不利于反应的进行;
B.平衡发生移动,反应热不变;
C.根据Ksp(AgCl)、Ksp(Ag2CrO4)计算生成AgCl、Ag2CrO4沉淀时银离子的浓度,比较大小后确定谁先沉淀;
D.酸越弱,对应的盐的碱性越强.
12.【答案】B
【解析】【解答】A.油脂在碱性条件下水解产生可溶性物质,纯碱水解使溶液显碱性,温度升高,纯碱溶液碱性增强,因而去除油污能力增强,故可以用热的纯碱溶液去除油污,A不符合题意;
B.FeS溶于稀H2SO4,而CuS不溶于稀H2SO4,说明二者在硫酸中的溶度积常数Ksp(FeS)>KspCuS),B符合题意;
C.Na2S溶解电离产生的S2-与废水中的Cu2+、Hg2+等重金属离子结合形成HgS、CuS沉淀,从而降低水中重金属离子的浓度,故可以用Na2S处理废水中的Cu2+、Hg2+等重金属离子,C不符合题意;
D.明矾水解时产生的Al(OH)3胶体表面积大,具有强的吸附性,吸附水中悬浮的固体小颗粒,使之形成沉淀而从水中析出,因此可作净水剂,D不符合题意;
故答案为:B。
【分析】A.根据影响水解平衡移动的因素分析;
B.依据反应情况判断溶度积常数;
C.依据沉淀生成原理分析;
D.Al(OH)3胶体表面积大,具有强的吸附性,吸附水中悬浮的固体小颗粒。
13.【答案】B
【解析】【解答】A.Ksp只与温度有关而与离子浓度大小无关,A不符合题意;
B.由图象可知:在相同条件下,温度在313 K时,c(SO42 ) c(Sr2+)乘积最大,则在该温度时Ksp(SrSO4)最大,B符合题意;
C.a点在363K的上方,属于该温度下饱和溶液,C不符合题意;
D.283K下的SrSO4饱和溶液升温到363K后会有晶体析出,析出溶液后的溶液属于饱和溶液,D不符合题意;
故答案为:B。
【分析】沉淀溶解平衡中的溶度积常数只与温度有关,与浓度改变无关;溶解度随温度变化而变化,也随离子浓度改变;硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线,纵轴是锶离子浓度的对数,横轴是硫酸根离子浓度的对数,图象分析采取定一议二的方法进行分析。
14.【答案】B
【解析】【解答】解:A.稀硫酸使溶解平衡逆向移动,则CaSO4在稀硫酸中的溶解性比在纯水中的溶解性弱,故A错误;
B.曲线上的点为平衡点,且温度不变,则a点对应的Ksp等于c点对应的Ksp,故B正确;
C.蒸发时离子浓度增大,则d点溶液不能通过蒸发可以变到c点,因d、c点硫酸根离子浓度相同,故C错误;
D.b转化为a或转化为c,均有沉淀生成,则平衡后溶液中c(SO42﹣)可能等于3×10﹣3mol/L、5×10﹣3mol/L、4×10﹣3mol/L,故D错误;
故选B.
【分析】A.稀硫酸使溶解平衡逆向移动;
B.曲线上的点为平衡点;
C.蒸发时离子浓度增大;
D.b转化为a或转化为c,均有沉淀生成.
15.【答案】C
16.【答案】C
【解析】【解答】解:A.在d点c(CO32﹣)=1.4×10﹣4 mol L﹣1,因室温时,CaCO3的溶度积Ksp=2.8×10﹣9,所以c(Ca2+)=2×10﹣5 mol L﹣1,故x的数值为2×10﹣5,故A正确;
B.在c点c(Ca2+)>×10﹣5 mol L﹣1,即相当于增大c(Ca2+),平衡左移,有CaCO3生成,故B正确;
C.d点为饱和溶液,加入蒸馏水后如仍为饱和溶液,则c(Ca2+)、c(CO32﹣)都不变,如为不饱和溶液,则二者浓度都减小,故不可能使溶液由d点变成a点,故C错误;
D.b点与d点在相同的温度下,溶度积相等,故D正确.
故选:C.
【分析】CaCO3在水中的沉淀溶解平衡为CaCO3(s) Ca2+(aq)+CO32﹣(aq),图象中位于曲线上的b、d点为饱和溶液,处于溶解平衡状态,a点处离子浓度小于饱和溶液浓度为不饱和溶液,c点为过饱和溶液,以此解答该题.
17.【答案】C
【解析】【解答】A. NaHS溶液中存在平衡:HS-+H2O H2S+OH-,HS- H++S2-,向NaHS溶液中滴入酚酞,溶液变红色,溶液呈碱性,说明HS-水解程度大于电离程度,实验目的和结论一致,A项不符合题意;
B. 溶度积小的先生成沉淀,向浓度为0.1mol L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水先出现蓝色沉淀,说明Ksp[Cu(OH)2]较小,B项不符合题意;
C. 浓盐酸具有挥发生,反应产生的二氧化碳中含有氯化氢气体,干扰二氧化碳与硅酸钠反应生成硅酸,无法证明碳酸酸性强于硅酸,C项符合题意;
D. 向盛有KI3溶液的两试管中分别加入淀粉溶液和AgNO3溶液,前者溶液变蓝色,说明溶液中含有碘,后者有黄色沉淀,说明溶液中含有碘离子,原来的溶液是KI3溶液,由现象可知,KI3溶液中存在I3- I2+I-平衡,D项不符合题意;
故答案为:C。
【分析】A.硫氢化钠可水解可电离,电离显酸性,水解呈碱性,加入酚酞变红,故显碱性
B.铜离子和镁离子和氨水反应都可产生沉淀,出现蓝色沉淀,说明铜离子与氢氧根结合能力强
C.在通入硅酸钠溶液前,需要将氯化氢除去以免造成干扰
D.淀粉变蓝,说明含有碘单质,加入硝酸银,黄色沉淀,说明有碘离子,因此I3-存在这平衡
18.【答案】B
【解析】【解答】A.由图示可知, 水解对水的电离促进程度较大,则HY的酸性较弱,所以相同条件下Ka(HX)>Ka(HY),故A不选;
B.本题为向酸中滴加Ba(OH)2溶液,因此随着Ba(OH)2溶液的加入溶液先进行酸碱中和反应,所以当HY与Ba(OH)2溶液中水电离出的 第一次达到 时为中性点,当继续滴加Ba(OH)2溶液会抑制水的电离(N点之后),即第二次水电离 该点为碱性点,所以M点呈中性,根据电荷守恒 ,所以c(Y-)>(Ba2+),故B;
C.N点完全反应点,0.1mol/LBa(OH)2溶液中 ,故消耗完20mL0.1mol/L的HY需要10mL0.1mol/LBa(OH)2溶液,故C不选;
D.根据电荷守恒可得T点 ;M点 ;T、M点 相同,T点 大于M点,所以 ,故D不选。
故答案为:B
【分析】A.根据起始点的氢离子浓度即可判断HX和HY的电离常数大小
B.根据电荷守恒进行判断
C.恰好完全反应即可计算出氢氧化钡的体积
D.根据电荷守恒结合氢离子浓度的大小即可判断
19.【答案】C
【解析】【解答】A.离子浓度越大,-lgc(离子)的数值越小,因此a曲线对应的是硫酸钙,b曲线对应的是碳酸钙,c曲线对应的是碳酸铅,A不符合题意;
B.CaCO3和PbCO3的饱和溶液中c(Ca2+):c(Pb2+)= ,B不符合题意;
C.硫酸钙饱和溶液中c(Ca2+)=0.007mol/L,向硫酸钙沉淀中加入1mol/L的碳酸钠溶液时,此时浓度熵=c(Ca2+)·c( )=0.007>Ksp(CaCO3),因此一定有碳酸钙沉淀生成,所以硫酸钙会转化为碳酸钙沉淀,C符合题意;
D.当向CaCO3悬浊液中加入NH4Cl固体时,铵根水解显酸性,会消耗溶液中的 ,使溶解平衡向溶解的方向移动,溶液中c(Ca2+)增大,d点向e点转化,D不符合题意;
故答案为:C。
【分析】A.电离常数越大,对应的 pM=-lgc(阴离子)、pN=-lgc(阳离子) 数值越小
B.根据饱和溶液中的溶度积公式计算出 c(Ca2+):c(Pb2+) 即可
C.根据Ksp越小,越难溶解,越易形成沉淀
D.铵根水解呈酸性,导致沉淀平衡的移动
20.【答案】C
【解析】【解答】A.根据起点:-lgc(Ca2+)≈9, -lgc(CO )=0,可得 Ksp(CaCO3)的数量级为10-9,故A不符合题意;
B.因为横纵坐标均为负对数,值越大,离子浓度越小,所以a点表示的溶液中,c(Ca2+)>c(CO ),故B不符合题意;
C.向浓度均为0.01mol·L-1的Mg2+、Ca2+、Mn2+混合溶液中逐滴加入Na2CO3溶液,Ksp最小的先达到饱和,生成沉淀,根据图像可知Ksp(MnCO3)
故答案为C。
【分析】A.根据与横纵坐标的交点即可计算出数量级
B.根据横纵坐标的大小即可比较大小
C根据图标帕努但,负对数越大,浓度越小,说明因此碳酸锰的离子浓度最小,其次是碳酸钙中离子浓度,最后是碳酸镁溶液中离子浓度,因此碳酸锰的Ksp最小,最先沉淀
D.Ksp最小的先达到饱和,生成沉淀,而ksp(CaCO3)<ksp(MgCO3)
21.【答案】D
【解析】【解答】
A. Na2S是强碱弱酸盐,S2-水解使溶液呈碱性,离子方程式为:S2-+H2O HS-+OH-、HS-+H2O H2S+OH-,故A错误,A不符合题意;
B. 在Na2S溶液中,根据物料守恒得2c(S2-)+2c(HS-)+2c(H2S)=c(Na+),故B错误,B不符合题意;
C. 向10 mL 0.1 mol/L CuSO4溶液中滴加0.1 mol/L的Na2S溶液,发生反应:Cu2++S2-=CuS↓,根据方程式可知,当加入10mL0.1 mol/L的Na2S溶液时,二者恰好完全反应,则b点时恰好完全反应形成CuS沉淀,CuS存在沉淀溶解平衡:CuS(s) Cu2+(aq)+S2 (aq),已知此时 lgc(Cu2+)=17.7,则平衡时c(Cu2+)=c(S2 )=10 17.7mol/L,Ksp(CuS)=c(Cu2+)×c(S2 )=10 17.7mol/L×10 17.7mol/L=10 35.4,已知lg2=0.3,则Ksp(CuS)=10 35.4 =(100.3)2×10 36 =4×10 36,向100 mLZn2+、Cu2+浓度均为10 5mol/L的混合溶液中逐滴加入10 4mol/L的Na2S溶液,产生ZnS时需要的S2 浓度为c(S2 )=Ksp(ZnS)÷c(Zn2+)=(3×10 25÷10 5)mol/L=3×10 20mol/L,产生CuS时需要的S2 浓度为c(S2 )=Ksp(CuS)÷c(Cu2+)=(4×10 36÷10 5)mol/L=4×10 31mol/L,则产生CuS沉淀所需S2 浓度更小,先产生CuS沉淀,故C错误,C不符合题意;
D. 根据C项分析可知,该温度下Ksp(CuS)=4×10-36,故D正确,D符合题意;
故正确答案为:D。
【分析】A、考查盐类水解离子水解方程式书写,注意弱酸根离子水解分步水解。
B、考查盐类水解的物料守恒,突破口是原子守恒。
C、沉淀生成先后顺序。注意根据KSP来判断溶解度大小,先生成溶解度小的。
D、考查KSP的计算。
22.【答案】(1)AgCl
(2)Ag+
(3)AgCl (s) +I-=AgI (s) +Cl-
(4)难溶盐在水中存在溶解平衡; 通过溶解平衡的移动,溶解度小的难溶盐转化为溶解度更小的难溶盐容易实现
【解析】【解答】本题主要考查沉淀的转化。(1)沉淀c是AgCl。(2)步骤②中的现象说明生成AgI,滤液b中含有的微粒是Ag+。(3)步骤③中反应的离子方程式是AgCl (s) +I-=AgI (s) +Cl-。(4)根据实验,可以得出的结论是难溶盐在水中存在溶解平衡; 通过溶解平衡的移动,溶解度小的难溶盐转化为溶解度更小的难溶盐容易实现。
【分析】要注意被一个步骤出现的物质,根据复分解反应得到的沉淀,以及难溶物的转化,可以得到每一步的结果;
(1)根据复分解反应可以知道产物为氯化银;
(2)要注意氯化银难溶于水,溶液中含有少量的银离子;
(3)根据难溶物的进一步转换可以知道氯化银可以转化为碘化银;
(4)难溶电解质的溶解平衡,满足勒夏特列定律。
23.【答案】(1)1.16×10-3
(2)4.0×10-5
(3)Cu(OH)2;1.45×109
【解析】【解答】(1)设饱和溶液Mg(OH)2的物质的量浓度为c,则c(Mg2+)×c2(OH-)=4c3=3.2×10-11,解得c=2×10-4 mol/L,假设饱和Mg(OH)2溶液的浓度为1 g/mL,则100 mL溶液的质量为100 g,含有溶质的质量m[Mg(OH)2]=2×10-4 mol/L×0.1 L×58 g/mol=1.16×10-3 g,溶剂的质量约为100 g,所以其溶解度S≈1.16×10-3 g;(2)如果溶液中Qc>Ksp[Mg(OH)2]就能产生沉淀,c(OH-)= =4.0×10-5 mol/L;(3)溶度积常数越小的物质先产生沉淀,由于Ksp[Cu(OH)2]<Ksp[Mg(OH)2],所以先生成沉淀的是Cu(OH)2,当两种沉淀共存时, =1.45×109。
【分析】(1)求溶解度,就是要求在某一物温度下,固体在100g溶剂中溶解溶质达到饱和状态的固体的质量,给出的条件是 饱和Mg(OH)2溶液的浓度为1 g/mL ,即是在100mL溶液里面有溶液为100g.根据难溶物质的dialing平衡,额可以求出镁离子的物质的量浓度,可以计算出100mL溶液含有的氢氧化镁的质量即可
(2)根据Ksp=c(Mg2+)×c2(OH-)可以计算出氢氧根离子的浓度即可
(3)根据溶度积进行比较,越小越难溶解,根据Ksp(Mg(OH)2)=c(Mg2+)×c2(OH-),Ksp(Cu(OH)2)=c(Cu2+)×c2(OH-)进行公式换算即可求出答案
24.【答案】(1)纯碱;CO32﹣+H2O HCO3﹣+OH﹣
(2)+135.6;c(H2O) c(CO2)
(3)
【解析】【解答】解:(1)碳酸钠俗称纯碱;Na2CO3为强碱弱酸盐,CO32﹣离子水解方程式为CO32﹣+H2O HCO3﹣+OH﹣,使溶液呈碱性,
故答案为:纯碱;CO32﹣+H2O HCO3﹣+OH﹣;(2)①2NaOH(s)+CO2(g)═Na2CO3(s)+H2O(g)△H1=﹣127.4kJ mol﹣1
②NaOH(s)+CO2(g)═NaHCO3(s)△H1=﹣131.5kJ mol﹣1
,①﹣2×②得,2NaHCO3(s)═Na2CO3(s)+H2O(g)+CO2(g)△H=+135.6kJ mol﹣1;K=c(H2O) c(CO2),
故答案为:+135.6;c(H2O) c(CO2);(3)Ksp(Ba SO4)=c(Ba2+)(SO42﹣)=1.1×10﹣10;Ksp(BaCO3)=c(Ba2+)c(CO32﹣)=2.6×10﹣9,
所以 = = = ,
故答案为: .
【分析】(1)碳酸钠俗称纯碱;Na2CO3为强碱弱酸盐,CO32﹣水解使溶液呈碱性;(2)①2NaOH(s)+CO2(g)═Na2CO3(s)+H2O(g)△H1=﹣127.4kJ mol﹣1
②NaOH(s)+CO2(g)═NaHCO3(s)△H1=﹣131.5kJ mol﹣1
,①﹣2×②得,2NaHCO3(s)═Na2CO3(s)+H2O(g)+CO2(g)据此进行分析;K= ;(3)当碳酸钡、硫酸钡两种沉淀共存时,溶液中钡离子浓度为定值,根据溶度积计算.
25.【答案】(1)
(2)Na2CO3 ;相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32﹣)较大
【解析】【解答】解:(1)反应平衡常数是用各反应物和生成物浓度计算表示,固体和纯液体的浓度是定值不出现在表达式中,平衡常数K= ,故答案为: ;(2)在溶液中Na2CO3能完全电离生成碳酸根离子,而碳酸氢根离子微弱电离生成碳酸根离子,所以相同浓度的Na2CO3和NaHCO3溶液中,碳酸钠溶液中碳酸根离子浓度大,PbSO4转化率较大;
故答案为:Na2CO3 ;相同浓度的Na2CO3和NaHCO3溶液中,前者c(CO32﹣)较大.
【分析】(1)PbSO4(s)+CO32﹣(aq) PbCO3(s)+SO42﹣(aq).依据平衡常数概念写出计算式;(2)根据反应达到的平衡分析:PbSO4(s)+CO32﹣(aq) PbCO3(s)+SO42﹣(aq),增大碳酸根离子浓度平衡正向进行,促进硫酸铅转化.
26.【答案】(1)是
(2)蓝色
(3)1.0×10-7mol·L-1;2;否
【解析】【解答】(1) Ksp(CaCO3)=4.96×10-9 ,若c(CO32-)=10-3mol/L,则c(Ca2+)=4.96×10-9÷10-3=4.96×10-6<10-5 mol/L,所以Ca2+沉淀完全了; (2) 25℃时,Mg(OH)2的溶度积Ksp=5.6×10-12,根据反应Mg(OH)2(s) Mg2++2OH-可得:c(Mg2+) c2(OH-)=5.6×10-12,设c(OH-)=2c(Mg2+)=x,则:0.5x×x2=5.6×10-12,解得:x=2.24×10-4mol/L,则根据室温下水的离子积常数Kw= c(H+) c(OH-)=10-14,可得c(H+)= mol/L=4.5×10-11mol/L,溶液的pH=10.4>9.6,所以溶液呈蓝色;(3)①反应前,n(Ag+)=0.018 mol/L×0.05 L=9×10-4 mol,n(Cl-)=0.020 mol/L×0.05L=1×10-3 mol;反应后剩余的Cl-为1×10-4 mol,则混合溶液中,c(Cl-)=1.0×10-3 mol/L,c(Ag+)=Ksp(AgCl)÷c(Cl-)=1.0×10-7 mol/L; ②H+没有参与反应,完全沉淀后,c(H+)=0.020mol/L÷2=0.010 mol/L,所以反应后溶液中pH=2;③再向反应后的溶液中加入50mL0.001mol/L盐酸,由于加入盐酸中c(Cl-)与反应后溶液中的c(Cl-)相同,c(Cl-)不变,但c(Ag+)由于盐酸加入,溶液的体积增大而变小,所以Qc= c(Ag+) c(Cl-)
2、根据氢氧化镁的溶度积,可以计算出其氢氧根的浓度,根据浓度值观察在指示剂的范围;
3、要注意混合溶液的时候体积会发生变化,所以两种溶液的浓度也会发生相应变化,根据变化后的浓度代入溶度积计算公式。
