第九单元课题3溶液的浓度课时2课件(共22张PPT)-2023-2024学年九年级化学人教版下册
文档属性
| 名称 | 第九单元课题3溶液的浓度课时2课件(共22张PPT)-2023-2024学年九年级化学人教版下册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-16 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
第九单元 溶液 Solution
课题3 溶液的浓度
第2课时 溶质质量分数的综合计算
学习目标
初步学会溶质的质量分数与化学方程式的综合计算。
01
提升有关溶质质量分数计算的能力。
02
课程回顾
溶质质量分数的表达式:
=
溶液质量
溶质质量
溶质的质量分数
%
×100
已知溶解度的饱和溶液怎么计算溶质的质量分数?
=
100g+溶解度
溶解度
饱和溶液溶质的质量分数
%
×100
【注意】溶液是混合物,溶液的质量不能直接代入化学方程式中计算,必须先换算成溶质的质量,然后再利用溶质的质量分数定义来求解。
【例4】100g某硫酸溶液恰好与13g锌完全反应。这种硫酸溶液中溶质的质量分数是多少?
一、有关溶质质量分数与化学方程式的综合计算
小试牛刀
解:设这种硫酸溶液中溶质的质量为x。
Zn + H2SO4=ZnSO4 + H2↑
65 98
13g x
溶质的质量分数为:
答:这种硫酸溶液中溶质的质量分数为19.6%。
x=19.6g
一、有关溶质质量分数与化学方程式的综合计算
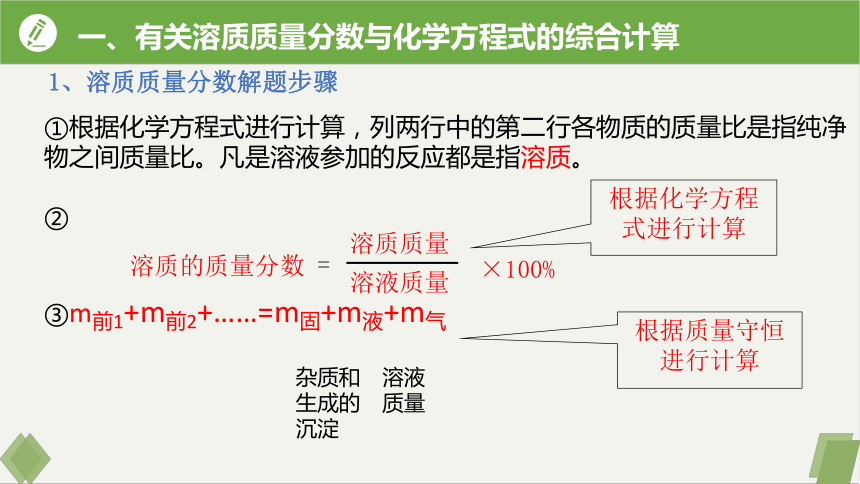
①根据化学方程式进行计算,列两行中的第二行各物质的质量比是指纯净物之间质量比。凡是溶液参加的反应都是指溶质。
②
③m前1+m前2+……=m固+m液+m气
=
溶液质量
溶质质量
溶质的质量分数
×100%
根据化学方程式进行计算
根据质量守恒进行计算
杂质和生成的沉淀
溶液质量
一、有关溶质质量分数与化学方程式的综合计算
1、溶质质量分数解题步骤
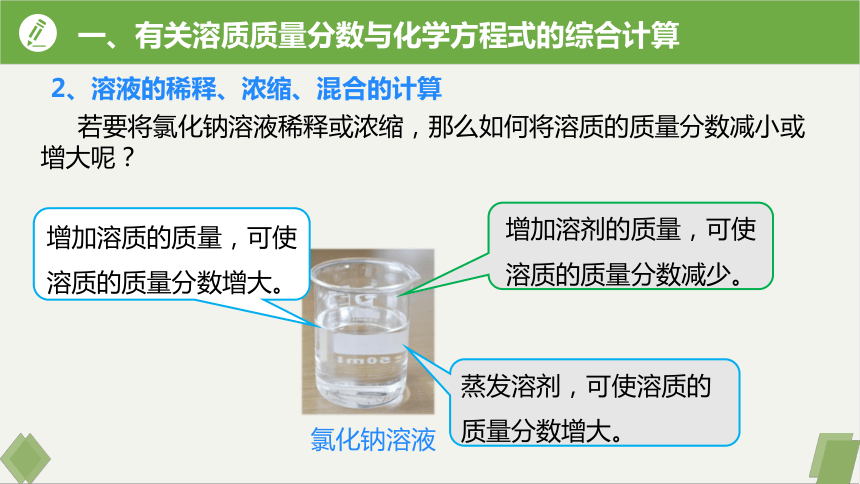
2、溶液的稀释、浓缩、混合的计算
若要将氯化钠溶液稀释或浓缩,那么如何将溶质的质量分数减小或增大呢?
一、有关溶质质量分数与化学方程式的综合计算
氯化钠溶液
增加溶质的质量,可使溶质的质量分数增大。
蒸发溶剂,可使溶质的质量分数增大。
增加溶剂的质量,可使溶质的质量分数减少。
解:设需要加水的质量为x。
依据稀释前后溶质质量不变,则有:
100g×98%=(100g+x )×10%
解得:x=880g
答:需要水的质量为880g。
一、有关溶质质量分数与化学方程式的综合计算
例题1.把100g质量分数为98%的浓硫酸稀释成10%的稀硫酸,需要水的质量是多少?
例题2.100 g某盐酸恰好与13 g锌完全起反应。试计算这种盐酸中溶质的质量分数。
解:设这种盐酸溶液中溶质的质量为x。
Zn + 2HCl=ZnCl2 + H2↑
65 73
13g x
溶质的质量分数为:
答:这种盐酸溶液中溶质的质量分数为14.6%。
65
73
13g
x
=
x=14.6g
14.6g
100g
×100%=14.6%
一、有关溶质质量分数与化学方程式的综合计算
35
33.4
物质总质量/g
反应时间/s
0
1.6
解:设34g过氧化氢溶液中过氧化氢的质量为x。
2H2O2 == =2H2O+O2↑
过氧化氢溶液中溶质的质量分数为: ×100%=10%
答:过氧化氢溶液中溶质的质量分数为10%。
68 32
x 1.6g
68
32
x
1.6g
=
x = 3.4g
MnO2
3.4g
34g
例题3.实验室用34g过氧化氢溶液和1g二氧化锰制取氧气,实验的相关数据如图。
(1)反应生成氧气的质量为______g。
(2)计算反应前过氧化氢溶液中溶质的质量分数。
一、有关溶质质量分数与化学方程式的综合计算
稀硫酸的质量/g 10 10 10 10 10
剩余固体的质量/g 8.7 7.4 6.1 4.8 4.8
不考虑实验过程中的质量损失,请根据实验数据完成下列问题:
(1)如果小红用所得银制作一枚戒指,其质量不超过 g。
(2)计算所用稀硫酸中溶质的质量分数。(计算结果精确至0.1%)
4.8
Zn-65, S-32, O-16, H-1
一、有关溶质质量分数与化学方程式的综合计算
例题4.小红同学在网店花200元买了一个10 g的手镯(银锌合金),她想探究此手镯中银的含量,于是请化学老师和她一起探究,在实验室用足量的稀硫酸分多次与手镯反应,记录数据如下表:
解:由表格中的数据可知,10 g稀硫酸与1.3 g锌反应。
设所用稀硫酸中溶质的质量分数为x。
Zn + H2SO4══ZnSO4+H2↑
65 98
1.3 g 10 g×x
x=19.6%
答:所用稀硫酸中溶质的质量分数为19.6%。
一、有关溶质质量分数与化学方程式的综合计算
例题5.某市石灰石资源丰富,某课外小组同学为了测定石灰石中碳酸钙的质量分数,取石灰石样品10.0 g于烧杯中,将100 g稀盐酸分5次加入烧杯中,充分反应后(杂质不与稀盐酸反应),测得剩余固体的质量记录如表。请计算:
(1)X的值为______。
(2)该石灰石样品中碳酸钙的质量分数。
(3)求所用稀盐酸溶质的质量分数
2.5
Ca-40, Cl-35.5, O-16, H-1, C-12
一、有关溶质质量分数与化学方程式的综合计算
(3)每加入20 g稀盐酸对应2 g碳酸钙,设20 g稀盐酸中HCl的质量为x
CaCO3 + 2HCl==CaCl2 + H2O + CO2↑
100 73
2 g x
= x = 1.46 g
所用稀盐酸溶质的质量分数为 × 100% = 7.3%
答: (3)所用稀盐酸溶质的质量分数为7.3%。
解:(2)碳酸钙的质量为10.0 g - 2.5 g = 7.5 g
该石灰石样品中碳酸钙的质量分数为 × 100% = 75%
一、有关溶质质量分数与化学方程式的综合计算
0.2
Zn-65, S-32, O-16, H-1
一、有关溶质质量分数与化学方程式的综合计算
例题6.合金是重要的金属材料,常用来制造机械零件、仪表和日用品。某化学研究小组利用黄铜(铜、锌合金)进行了如图所示实验。
(1)生成氢气的质量为________g。
(2)计算过滤后所得溶液的溶质质量分数。(写出计算过程)
解:设参加反应锌的质量为x,生成硫酸锌的质量为y。
Zn+H2SO4 == ZnSO4+H2↑
65 161 2
x y 0.2 g
x=6.5 g y=16.1 g
过滤后所得溶液的溶质质量分数为 ×100%
=16.1%。
答:过滤后所得溶液的溶质质量分数为16.1%。
一、有关溶质质量分数与化学方程式的综合计算
知识归纳
在溶液中进行的化学反应,其相关计算应该注意的问题:
1.计算的理论依据是各纯物质的质量比,即不能将混合物直接代入计算。
2.求溶质的质量分数时,应首先明确溶质的成分,进而计算溶质的成分,最后依据公式计算溶质质量分数。
3.稀释前后溶质的质量不变。
课堂总结
一、溶质的质量分数=
二、饱和溶液中溶质的质量分数:
三、溶液的稀释
计算依据:稀释前后溶质的质量不变
稀释公式:m浓×c浓% = m稀×c稀%
=(m浓+m水)×c稀%
习题训练
1.在20℃时,将40 g硝酸钾固体加入100 g水中,充分搅拌后,仍有8.4 g硝酸钾固体未溶解。请填写下列空白:
(1)所得溶液是20℃时硝酸钾的_____溶液(填“饱和”或“不饱和”);
(2)20℃时硝酸钾的溶解度为______;
(3)所得溶液中硝酸钾的质量分数为______。
饱和
31.6g
24%
2.某温度时,蒸干35 g氯化钾溶液,得到7 g氯化钾,求该溶液中溶质的质量分数。
解:
习题训练
3.如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:
(1)t2℃时,A、B、C三种物质的溶解度大小关系是 。
(2)t3℃时,将50gA物质加入到50g水中,充分溶解后,所得溶液的质量是 g。
(3)将t3℃时A、B、C的饱和溶液降温到t1℃后,所得溶液中溶质的质量分数的大小关系是 。
(4)将100g10%的甲溶液稀释到4%需加入 g水。
A=B>C
90
B>A>C
150
习题训练
4.实验室用15%的氯化钠溶液配制5%的氯化钠溶液。下列叙述错误的是( )
A.配制步骤是:计算、称量、溶解、装瓶贴标签
B.溶解时用玻璃棒搅拌是为了加快溶解速率
C.装瓶时,有少量溶液洒出对溶质的质量分数无影响
D.量水的体积时仰视读数,会使配得的溶液溶质质量分数偏小
A
谢谢聆听
第九单元 溶液 Solution
课题3 溶液的浓度
第2课时 溶质质量分数的综合计算
学习目标
初步学会溶质的质量分数与化学方程式的综合计算。
01
提升有关溶质质量分数计算的能力。
02
课程回顾
溶质质量分数的表达式:
=
溶液质量
溶质质量
溶质的质量分数
%
×100
已知溶解度的饱和溶液怎么计算溶质的质量分数?
=
100g+溶解度
溶解度
饱和溶液溶质的质量分数
%
×100
【注意】溶液是混合物,溶液的质量不能直接代入化学方程式中计算,必须先换算成溶质的质量,然后再利用溶质的质量分数定义来求解。
【例4】100g某硫酸溶液恰好与13g锌完全反应。这种硫酸溶液中溶质的质量分数是多少?
一、有关溶质质量分数与化学方程式的综合计算
小试牛刀
解:设这种硫酸溶液中溶质的质量为x。
Zn + H2SO4=ZnSO4 + H2↑
65 98
13g x
溶质的质量分数为:
答:这种硫酸溶液中溶质的质量分数为19.6%。
x=19.6g
一、有关溶质质量分数与化学方程式的综合计算
①根据化学方程式进行计算,列两行中的第二行各物质的质量比是指纯净物之间质量比。凡是溶液参加的反应都是指溶质。
②
③m前1+m前2+……=m固+m液+m气
=
溶液质量
溶质质量
溶质的质量分数
×100%
根据化学方程式进行计算
根据质量守恒进行计算
杂质和生成的沉淀
溶液质量
一、有关溶质质量分数与化学方程式的综合计算
1、溶质质量分数解题步骤
2、溶液的稀释、浓缩、混合的计算
若要将氯化钠溶液稀释或浓缩,那么如何将溶质的质量分数减小或增大呢?
一、有关溶质质量分数与化学方程式的综合计算
氯化钠溶液
增加溶质的质量,可使溶质的质量分数增大。
蒸发溶剂,可使溶质的质量分数增大。
增加溶剂的质量,可使溶质的质量分数减少。
解:设需要加水的质量为x。
依据稀释前后溶质质量不变,则有:
100g×98%=(100g+x )×10%
解得:x=880g
答:需要水的质量为880g。
一、有关溶质质量分数与化学方程式的综合计算
例题1.把100g质量分数为98%的浓硫酸稀释成10%的稀硫酸,需要水的质量是多少?
例题2.100 g某盐酸恰好与13 g锌完全起反应。试计算这种盐酸中溶质的质量分数。
解:设这种盐酸溶液中溶质的质量为x。
Zn + 2HCl=ZnCl2 + H2↑
65 73
13g x
溶质的质量分数为:
答:这种盐酸溶液中溶质的质量分数为14.6%。
65
73
13g
x
=
x=14.6g
14.6g
100g
×100%=14.6%
一、有关溶质质量分数与化学方程式的综合计算
35
33.4
物质总质量/g
反应时间/s
0
1.6
解:设34g过氧化氢溶液中过氧化氢的质量为x。
2H2O2 == =2H2O+O2↑
过氧化氢溶液中溶质的质量分数为: ×100%=10%
答:过氧化氢溶液中溶质的质量分数为10%。
68 32
x 1.6g
68
32
x
1.6g
=
x = 3.4g
MnO2
3.4g
34g
例题3.实验室用34g过氧化氢溶液和1g二氧化锰制取氧气,实验的相关数据如图。
(1)反应生成氧气的质量为______g。
(2)计算反应前过氧化氢溶液中溶质的质量分数。
一、有关溶质质量分数与化学方程式的综合计算
稀硫酸的质量/g 10 10 10 10 10
剩余固体的质量/g 8.7 7.4 6.1 4.8 4.8
不考虑实验过程中的质量损失,请根据实验数据完成下列问题:
(1)如果小红用所得银制作一枚戒指,其质量不超过 g。
(2)计算所用稀硫酸中溶质的质量分数。(计算结果精确至0.1%)
4.8
Zn-65, S-32, O-16, H-1
一、有关溶质质量分数与化学方程式的综合计算
例题4.小红同学在网店花200元买了一个10 g的手镯(银锌合金),她想探究此手镯中银的含量,于是请化学老师和她一起探究,在实验室用足量的稀硫酸分多次与手镯反应,记录数据如下表:
解:由表格中的数据可知,10 g稀硫酸与1.3 g锌反应。
设所用稀硫酸中溶质的质量分数为x。
Zn + H2SO4══ZnSO4+H2↑
65 98
1.3 g 10 g×x
x=19.6%
答:所用稀硫酸中溶质的质量分数为19.6%。
一、有关溶质质量分数与化学方程式的综合计算
例题5.某市石灰石资源丰富,某课外小组同学为了测定石灰石中碳酸钙的质量分数,取石灰石样品10.0 g于烧杯中,将100 g稀盐酸分5次加入烧杯中,充分反应后(杂质不与稀盐酸反应),测得剩余固体的质量记录如表。请计算:
(1)X的值为______。
(2)该石灰石样品中碳酸钙的质量分数。
(3)求所用稀盐酸溶质的质量分数
2.5
Ca-40, Cl-35.5, O-16, H-1, C-12
一、有关溶质质量分数与化学方程式的综合计算
(3)每加入20 g稀盐酸对应2 g碳酸钙,设20 g稀盐酸中HCl的质量为x
CaCO3 + 2HCl==CaCl2 + H2O + CO2↑
100 73
2 g x
= x = 1.46 g
所用稀盐酸溶质的质量分数为 × 100% = 7.3%
答: (3)所用稀盐酸溶质的质量分数为7.3%。
解:(2)碳酸钙的质量为10.0 g - 2.5 g = 7.5 g
该石灰石样品中碳酸钙的质量分数为 × 100% = 75%
一、有关溶质质量分数与化学方程式的综合计算
0.2
Zn-65, S-32, O-16, H-1
一、有关溶质质量分数与化学方程式的综合计算
例题6.合金是重要的金属材料,常用来制造机械零件、仪表和日用品。某化学研究小组利用黄铜(铜、锌合金)进行了如图所示实验。
(1)生成氢气的质量为________g。
(2)计算过滤后所得溶液的溶质质量分数。(写出计算过程)
解:设参加反应锌的质量为x,生成硫酸锌的质量为y。
Zn+H2SO4 == ZnSO4+H2↑
65 161 2
x y 0.2 g
x=6.5 g y=16.1 g
过滤后所得溶液的溶质质量分数为 ×100%
=16.1%。
答:过滤后所得溶液的溶质质量分数为16.1%。
一、有关溶质质量分数与化学方程式的综合计算
知识归纳
在溶液中进行的化学反应,其相关计算应该注意的问题:
1.计算的理论依据是各纯物质的质量比,即不能将混合物直接代入计算。
2.求溶质的质量分数时,应首先明确溶质的成分,进而计算溶质的成分,最后依据公式计算溶质质量分数。
3.稀释前后溶质的质量不变。
课堂总结
一、溶质的质量分数=
二、饱和溶液中溶质的质量分数:
三、溶液的稀释
计算依据:稀释前后溶质的质量不变
稀释公式:m浓×c浓% = m稀×c稀%
=(m浓+m水)×c稀%
习题训练
1.在20℃时,将40 g硝酸钾固体加入100 g水中,充分搅拌后,仍有8.4 g硝酸钾固体未溶解。请填写下列空白:
(1)所得溶液是20℃时硝酸钾的_____溶液(填“饱和”或“不饱和”);
(2)20℃时硝酸钾的溶解度为______;
(3)所得溶液中硝酸钾的质量分数为______。
饱和
31.6g
24%
2.某温度时,蒸干35 g氯化钾溶液,得到7 g氯化钾,求该溶液中溶质的质量分数。
解:
习题训练
3.如图是A、B、C三种固体物质的溶解度曲线图,请结合图示回答下列问题:
(1)t2℃时,A、B、C三种物质的溶解度大小关系是 。
(2)t3℃时,将50gA物质加入到50g水中,充分溶解后,所得溶液的质量是 g。
(3)将t3℃时A、B、C的饱和溶液降温到t1℃后,所得溶液中溶质的质量分数的大小关系是 。
(4)将100g10%的甲溶液稀释到4%需加入 g水。
A=B>C
90
B>A>C
150
习题训练
4.实验室用15%的氯化钠溶液配制5%的氯化钠溶液。下列叙述错误的是( )
A.配制步骤是:计算、称量、溶解、装瓶贴标签
B.溶解时用玻璃棒搅拌是为了加快溶解速率
C.装瓶时,有少量溶液洒出对溶质的质量分数无影响
D.量水的体积时仰视读数,会使配得的溶液溶质质量分数偏小
A
谢谢聆听
同课章节目录
