1.2.1 有机化合物的分离、提纯 有机化合物组成的研究 练习题(含答案) 2023-2024学年高二下学期化学苏教版(2019)选择性必修3
文档属性
| 名称 | 1.2.1 有机化合物的分离、提纯 有机化合物组成的研究 练习题(含答案) 2023-2024学年高二下学期化学苏教版(2019)选择性必修3 |
|
|
| 格式 | docx | ||
| 文件大小 | 194.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-15 00:00:00 | ||
图片预览


文档简介
第二单元 科学家怎样研究有机物
第1课时 有机化合物的分离、提纯 有机化合物组成的研究
一、必备基础知识
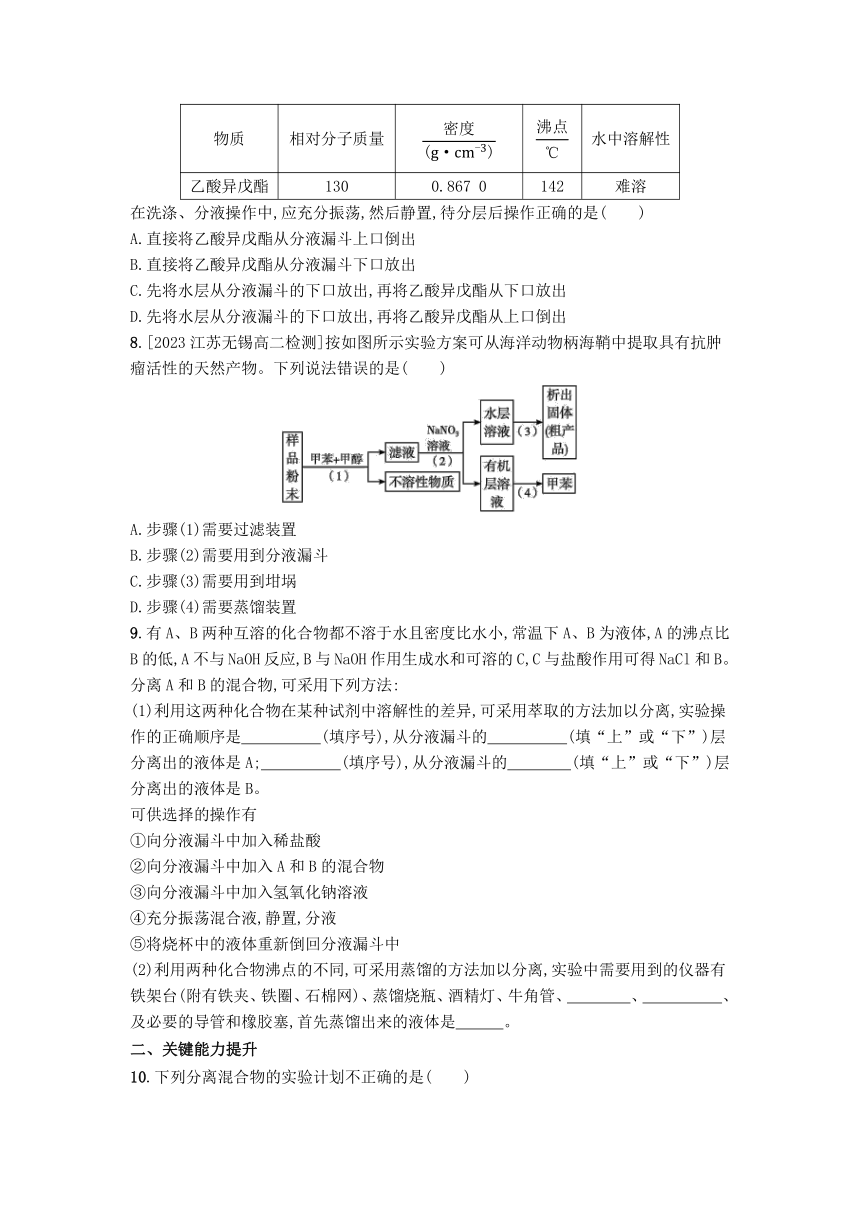
1.为了确定有机物中是否存在氮、氯、溴、硫等元素,应将有机物样品与下列哪种金属混合熔融后,再进行定性分析( )
A.Fe B.Si C.Cu D.Na
2.化学家从有机反应RH+Cl2(g)RCl(l)+HCl(g)中受到启发提出的,在农药和有机合成工业中可获得副产品的设想已成为事实,试指出从上述反应产物中分离得到盐酸的最佳方法是( )
A.水洗分液法 B.蒸馏法
C.升华法 D.有机溶剂萃取法
3.下列有关实验原理或操作正确的是( )
A.①分离CCl4和水
B.②洗涤沉淀时,向漏斗中加入适量水,搅拌并滤干
C.③液体分层,上层呈无色
D.④除去氯气中的少量氯化氢
4.下列有关实验的说法错误的是( )
A.在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点
B.用结晶法分离硝酸钾和氯化钠的混合物,用分液法分离水和四氯化碳的混合物
C.在重结晶实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失
D.作为重结晶实验的溶剂,杂质在此溶剂中的溶解度受温度影响应该很大
5.一定量的乙醇在氧气不足的情况下燃烧,得到CO2、CO和H2O的总质量为26.8 g,其中H2O的质量为10.8 g,则CO的质量是( )
A.1.4 g B.2.8 g
C.4.4 g D.在2.8 g和4.4 g之间
6.3.1 g某有机样品完全燃烧,燃烧后的气体混合物通入过量的澄清石灰水中,石灰水共增重7.1 g,然后过滤得到10 g沉淀。该有机样品可能是( )
A.乙二酸 B.乙醇
C.乙醛 D.甲醇和丙三醇的混合物
7.实验室制备乙酸异戊酯的有关信息如下:
物质 相对分子质量 水中溶解性
乙酸异戊酯 130 0.867 0 142 难溶
在洗涤、分液操作中,应充分振荡,然后静置,待分层后操作正确的是( )
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
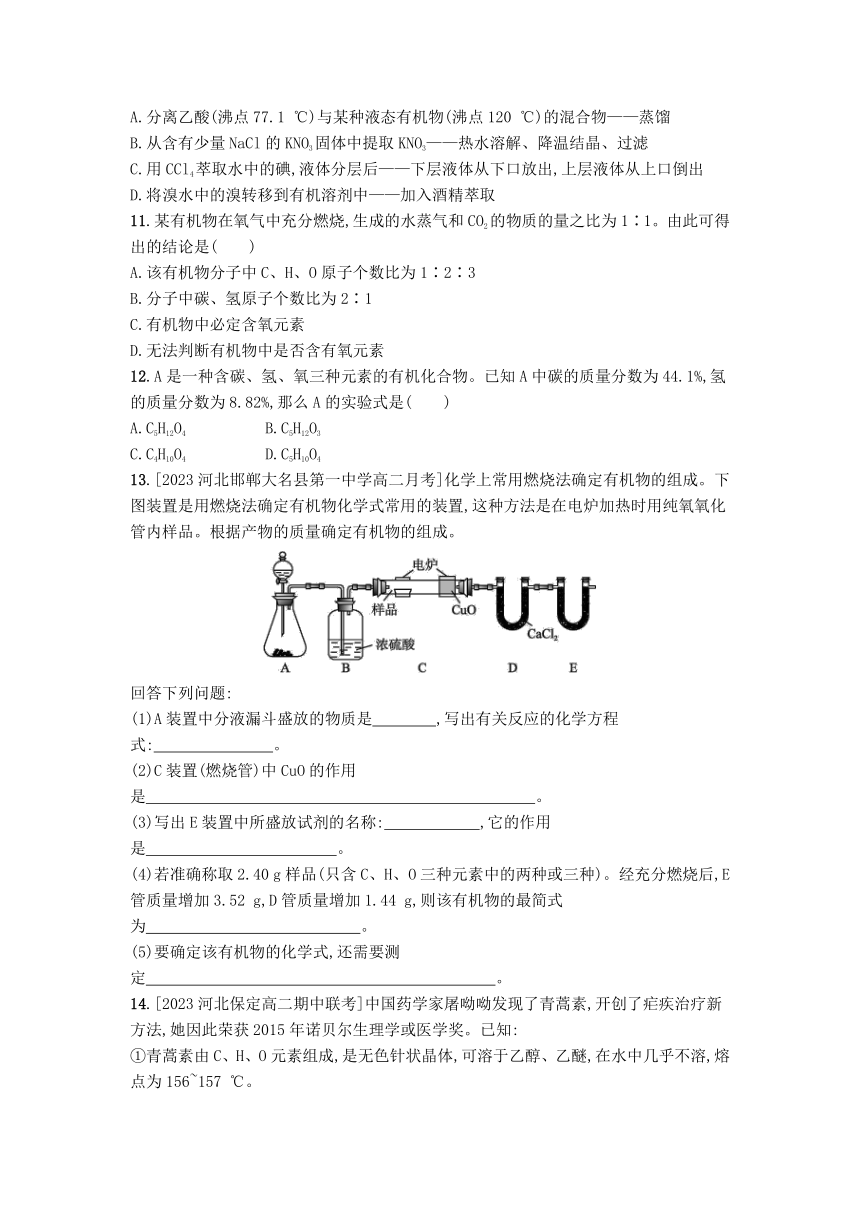
8.[2023江苏无锡高二检测]按如图所示实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。下列说法错误的是( )
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
9.有A、B两种互溶的化合物都不溶于水且密度比水小,常温下A、B为液体,A的沸点比B的低,A不与NaOH反应,B与NaOH作用生成水和可溶的C,C与盐酸作用可得NaCl和B。分离A和B的混合物,可采用下列方法:
(1)利用这两种化合物在某种试剂中溶解性的差异,可采用萃取的方法加以分离,实验操作的正确顺序是 (填序号),从分液漏斗的 (填“上”或“下”)层分离出的液体是A; (填序号),从分液漏斗的 (填“上”或“下”)层分离出的液体是B。
可供选择的操作有
①向分液漏斗中加入稀盐酸
②向分液漏斗中加入A和B的混合物
③向分液漏斗中加入氢氧化钠溶液
④充分振荡混合液,静置,分液
⑤将烧杯中的液体重新倒回分液漏斗中
(2)利用两种化合物沸点的不同,可采用蒸馏的方法加以分离,实验中需要用到的仪器有铁架台(附有铁夹、铁圈、石棉网)、蒸馏烧瓶、酒精灯、牛角管、 、 、 及必要的导管和橡胶塞,首先蒸馏出来的液体是 。
二、关键能力提升
10.下列分离混合物的实验计划不正确的是( )
A.分离乙酸(沸点77.1 ℃)与某种液态有机物(沸点120 ℃)的混合物——蒸馏
B.从含有少量NaCl的KNO3固体中提取KNO3——热水溶解、降温结晶、过滤
C.用CCl4萃取水中的碘,液体分层后——下层液体从下口放出,上层液体从上口倒出
D.将溴水中的溴转移到有机溶剂中——加入酒精萃取
11.某有机物在氧气中充分燃烧,生成的水蒸气和CO2的物质的量之比为1∶1。由此可得出的结论是( )
A.该有机物分子中C、H、O原子个数比为1∶2∶3
B.分子中碳、氢原子个数比为2∶1
C.有机物中必定含氧元素
D.无法判断有机物中是否含有氧元素
12.A是一种含碳、氢、氧三种元素的有机化合物。已知A中碳的质量分数为44.1%,氢的质量分数为8.82%,那么A的实验式是( )
A.C5H12O4 B.C5H12O3
C.C4H10O4 D.C5H10O4
13.[2023河北邯郸大名县第一中学高二月考]化学上常用燃烧法确定有机物的组成。下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品。根据产物的质量确定有机物的组成。
回答下列问题:
(1)A装置中分液漏斗盛放的物质是 ,写出有关反应的化学方程式: 。
(2)C装置(燃烧管)中CuO的作用是 。
(3)写出E装置中所盛放试剂的名称: ,它的作用是 。
(4)若准确称取2.40 g样品(只含C、H、O三种元素中的两种或三种)。经充分燃烧后,E管质量增加3.52 g,D管质量增加1.44 g,则该有机物的最简式为 。
(5)要确定该有机物的化学式,还需要测定 。
14.[2023河北保定高二期中联考]中国药学家屠呦呦发现了青蒿素,开创了疟疾治疗新方法,她因此荣获2015年诺贝尔生理学或医学奖。已知:
①青蒿素由C、H、O元素组成,是无色针状晶体,可溶于乙醇、乙醚,在水中几乎不溶,熔点为156~157 ℃。
②乙醚的沸点为34.5 ℃。③从青蒿中提取青蒿素的方法之一是以萃取原理为基础,主要有乙醚浸取法和汽油浸取法。
Ⅰ.实验室用乙醚提取青蒿素流程如图1所示。
图1
(1)实验前要对青蒿进行粉碎,其目的是 。
(2)操作Ⅱ的名称为 。
(3)操作Ⅲ的主要过程可能是 (填字母)。
A.加入乙醚进行萃取、分液
B.加入95%的乙醇,浓缩、结晶、过滤
C.加水溶解,蒸发浓缩、冷却结晶,过滤
Ⅱ.用如图2所示实验装置测定青蒿素实验式方法如下:将14.1 g青蒿素样品放在装置C硬质玻璃管中,缓缓通入空气数分钟后再充分燃烧,精确测定装置E和F实验前后质量,根据所测数据计算。
图2
(4)装置A中盛放物质的作用是 。
(5)该实验装置可能会产生误差,改进方法是 。
(6)用合理改进后的装置进行实验,测得的数据如表所示,通过质谱仪测得青蒿素的相对分子质量是282,结合以上数据,得出青蒿素的分子式为 。
装置 实验前/g 实验后/g
E 11.3 21.2
F 40.1 73.1
15.探究用环己烯粗品精制环己烯的方法。
已知实验室制取环己烯的化学原理:
+H2O
物质 密度/(g·cm-3) 熔点/℃ 沸点/℃ 溶解性
环己醇 0.96 25 161 可溶
环己烯 0.81 -103 83 难溶
(1)除去环己烯粗品中的杂质,需先加入饱和碳酸钠溶液,其主要目的是 。
(2)加入饱和碳酸钠溶液后,振荡、静置,环己烯在上层还是下层: 。
(3)静置后如何操作: 。
该操作用到的主要仪器是 。
16.薰衣草精油常用作芳香剂、驱虫剂的原料。“DIY”兴趣小组在实验室从新鲜薰衣草中提取少量精油。
查阅资料:薰衣草精油成分复杂,沸点范围100~220 ℃,相同温度时在水中溶解度小于在苯、四氯化碳(有毒、沸点76.8 ℃)等溶剂中的溶解度。
设计方案:小组讨论后提出如下提取方案。(在横线上填写操作名称)
(1)步骤① 在研钵中将薰衣草捣碎,转移至小烧杯中并加入适量蒸馏水,搅拌使充分溶解后 ;
(2)步骤② 在薰衣草水中加入适量CCl4进行 ;
(3)步骤③ 将CCl4层进行 。
方案实施:按预先设计的方案进行实验。
(4)步骤②使用到的主要仪器有 (填字母)。
具体操作为振荡、 、静置、分液。溶有精油的CCl4层在 (填“上”或“下”)层。
(5)步骤③使用如图实验装置,其中仪器e的名称为 ,冷却水从 (填字母)口通入。加热,收集温度在 ℃的馏分(该馏分可循环使用)。
交流反思:小组成员观察产品并进行讨论后,认为该方案主要有以下两个缺点:
缺点1 精油中某些成分有热敏性,受热后品质会发生改变;
缺点2 该方法提取的精油中残留少量CCl4。
(6)基于小组的交流、反思和分析,你认为该小组进一步的研究方向是 。
参考答案
一、必备基础知识
1.D 解析 将有机样品与金属钠混合熔融,氮、氯、溴、硫等元素将以NaCN、NaCl、NaBr、Na2S等形式存在,再用无机定性分析法测定。
2.A 解析 有机反应RH+Cl2(g)RCl(l)+HCl(g)中,HCl易溶于水,RH、RCl等不溶于水,从反应产物中分离得到盐酸,则水洗分液法可得到盐酸,故选A。
3.A 解析 CCl4和水不互溶,可用分液法分离,故A正确;洗涤沉淀,不能搅拌,应向漏斗中加适量水,使水自然流下,故B错误;碘易溶于苯且苯密度比水小,下层为水层接近无色,故C错误;氯气难溶于饱和食盐水溶液,气体应为长进短出,故D错误。
4.D 解析 在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点,故A正确。硝酸钾的溶解度随温度升高而急剧增大,氯化钠的溶解度随温度升高变化很小,所以用结晶法分离硝酸钾和氯化钠的混合物;水和四氯化碳不互溶,所以用分液法分离水和四氯化碳的混合物,故B正确。在重结晶实验中,温度降低被提纯物质的溶解度减小,则使用短颈漏斗趁热过滤是为了减少被提纯物质的损失,C正确。在重结晶实验中,要求被提纯物质在溶剂中的溶解度受温度的影响较大,杂质在此溶剂中的溶解度要很小或很大,故D错误。
5.B 解析 一定量的乙醇在氧气不足的情况下燃烧,得到CO2、CO和H2O的总质量为26.8 g,其中H2O的质量为10.8 g,则n(H2O)==0.6 mol,根据H原子守恒可知,n(H)=2n(H2O)=1.2 mol,故n(C2H5OH)==0.2 mol,根据碳原子守恒可知,n(CO)+n(CO2)=0.2 mol×2=0.4 mol,根据质量守恒可知,28 g·mol-1×n(CO)+44 g·mol-1×n(CO2)=26.8 g-10.8 g=16 g,联合解得,n(CO)=0.1 mol,m(CO)=0.1 mol×28 g·mol-1 =2.8 g,故答案为B。
6.D 解析 3.1 g该有机样品燃烧生成CO2、H2O的总质量为7.1 g,CO2与过量Ca(OH)2反应生成10 g CaCO3,则CO2物质的量为0.1 mol,即n(C)=0.1 mol,m(C)=0.1 mol×12 g·mol-1=1.2 g,m(H2O)=7.1 g-0.1 mol×44 g·mol-1=2.7 g,即n(H2O)=0.15 mol,n(H)=0.3 mol,m(H)=0.3 mol×1 g·mol-1=0.3 g,故该有机样品中氧元素的质量:m(O)=3.1 g-1.2 g-0.3 g=1.6 g,即n(O)==0.1 mol,则该有机样品中n(C)∶n(H)∶n(O)=0.1 mol∶0.3 mol∶0.1 mol=1∶3∶1,即最简式为CH3O,设其分子式为(CH3O)n,只有当甲醇和丙三醇按物质的量之比为1∶1混合时符合,D正确。
7.D 解析 乙酸异戊酯的密度比水的密度小,分液时在上层,应先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出。
8.C 解析 滤液与不溶物是用过滤的方法分离出的,A项正确;分离水层与有机层需要用分液漏斗,B项正确;溶液蒸发结晶应用蒸发皿,C项错误;可用蒸馏的方法从有机层中分离出甲苯,D项正确。
9.答案 (1)②③④ 上 ⑤①④ 上
(2)温度计 冷凝管 锥形瓶 A
解析 (1)采用萃取的方法加以分离,混合物中加NaOH溶液,A在上层,实验操作的正确顺序是:②向分液漏斗中加入A和B的混合物,③向分液漏斗中加入氢氧化钠溶液,④充分振荡混合液,静置,分液。从下口放出水和可溶的C,从上口分离出A。
提取并分离B的操作顺序是:⑤将烧杯中的液体重新倒回分液漏斗中,①向分液漏斗中加入稀盐酸,④充分振荡混合液,静置,分液,上层分离出的液体是B。
(2)在用蒸馏操作进行分离时,需要控制加热温度,冷却后用锥形瓶进行接收,即还缺少温度计、冷凝管和锥形瓶。先蒸出沸点低的A。
二、关键能力提升
10.D 解析 A中两种有机物互溶,但沸点不同,则选择蒸馏法可分离,故A正确;NaCl和KNO3的溶解度受温度影响不同,则热水溶解、降温结晶、过滤可分离,故B正确;碘不易溶于水,易溶于四氯化碳,则用分液漏斗萃取后分液可分离,分离混合物时,下层液体从下口放出,上层液体从上口倒出,故C正确;酒精与水互溶,则酒精不能作萃取剂,故D错误。
11.D 解析 含C、H或含C、H、O的有机物燃烧都生成二氧化碳和水,有机物在氧气中充分燃烧,生成的水蒸气和CO2的物质的量之比为1∶1,可确定n(C)∶n(H)=1∶(1×2)=1∶2,但不能确定是否含有氧元素,只有D正确。
12.A 解析 由于A中碳的质量分数为44.1%,氢的质量分数为8.82%,故A中氧的质量分数为1-44.1%-8.82%=47.08%。由此可算出N(C)∶N(H)∶N(O)=≈5∶12∶4,故该有机物的实验式为C5H12O4。
13.答案 (1)H2O2(或H2O) 2H2O22H2O+O2↑(或2Na2O2+2H2O===4NaOH+O2↑)
(2)使有机物充分氧化生成CO2和H2O
(3)碱石灰或生石灰或氢氧化钠 吸收CO2
(4)CH2O
(5)有机物的相对分子质量
解析 图示装置是用燃烧法确定有机物化学式常用的装置,A装置的作用是制造氧气;B装置的作用是除去氧气中的水,防止对测定产生干扰;C装置的作用是使有机物充分进行燃烧反应生成CO2和H2O;D装置的作用是吸收反应中产生的H2O,根据增重计算有机物中的H元素含量;E装置的作用是吸收反应中产生的CO2,根据增重计算有机物中的C元素含量。
(1)A装置为制备氧气的发生装置,氧气可由双氧水在二氧化锰催化下分解或水和过氧化钠反应制备,则分液漏斗中的液体可为双氧水或水,对应的化学方程式为2H2O22H2O+O2↑或2Na2O2+2H2O===4NaOH+O2↑。
(2)CuO的作用是使有机物充分氧化生成CO2和H2O。
(3)E装置的作用是完全吸收反应生成的CO2,可用碱石灰或生石灰或氢氧化钠来吸收。
(4)D管增重1.44 g,则n(H2O)==0.08 mol,n(H)=0.08 mol×2=0.16 mol。E管增重3.52 g,则n(CO2)==0.08 mol,n(C)=0.08 mol。样品总重2.40 g,则可得n(O)=
=0.08 mol,所以样品中n(C)∶n(H)∶n(O)=1∶2∶1,则该有机物的最简式为CH2O。
(5)要确定该有机物的化学式,还需知道该有机物的相对分子质量。
14.答案 (1)增大青蒿与乙醚的接触面积,提高青蒿素的浸出速率和浸取率
(2)蒸馏
(3)B
(4)除去空气中的CO2,以防干扰实验
(5)装置F后连接一个盛有碱石灰的干燥管或U形管
(6)C15H22O5
解析 (1)实验前要对青蒿进行粉碎,其目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸出速率和浸取率。
(2)青蒿素是无色针状晶体,可溶于乙醇、乙醚,将提取液进行操作Ⅱ得到乙醚,则操作Ⅱ的名称为蒸馏。
(3)操作Ⅲ是粗品得到青蒿素精品,青蒿素溶于乙醇、乙醚,在水中几乎不溶,故向粗品中加入95%的乙醇,浓缩、结晶、过滤,从而得到精品。
(4)为了能准确测定青蒿素燃烧生成的二氧化碳和水的质量,实验前应通入除去二氧化碳和水蒸气的空气,排除装置内的二氧化碳和水蒸气,防止干扰实验,所以实验装置A中盛放氢氧化钠溶液,吸收空气中的二氧化碳;青蒿素与氧气反应生成二氧化碳和水,装置E吸收水蒸气,装置F吸收二氧化碳。
(5)该实验装置可能会产生误差,主要是空气中二氧化碳和水蒸气会进入装置F中,因此改进方法是装置F后连接一个盛有碱石灰的干燥管或U形管。
(6)质谱仪测得青蒿素的相对分子质量是282,14.1 g青蒿素物质的量为0.05 mol,得到水的质量为9.9 g(物质的量为0.55 mol),二氧化碳的质量为33 g(物质的量为0.75 mol),根据关系式得到分子式为C15H22Ox,根据相对分子质量得到青蒿素的分子式为C15H22O5。
15.答案 (1)除去环己烯中的酸性杂质和部分环己醇
(2)上层
(3)将下层液体从分液漏斗下口放出,环己烯从分液漏斗上口倒出 分液漏斗、烧杯
16.答案 (1)过滤 (2)萃取、分液 (3)蒸馏 (4)b 放气 下 (5)蒸馏烧瓶 g 76.8 (6)选取无毒、高效、可进行低温提取精油的萃取剂
第1课时 有机化合物的分离、提纯 有机化合物组成的研究
一、必备基础知识
1.为了确定有机物中是否存在氮、氯、溴、硫等元素,应将有机物样品与下列哪种金属混合熔融后,再进行定性分析( )
A.Fe B.Si C.Cu D.Na
2.化学家从有机反应RH+Cl2(g)RCl(l)+HCl(g)中受到启发提出的,在农药和有机合成工业中可获得副产品的设想已成为事实,试指出从上述反应产物中分离得到盐酸的最佳方法是( )
A.水洗分液法 B.蒸馏法
C.升华法 D.有机溶剂萃取法
3.下列有关实验原理或操作正确的是( )
A.①分离CCl4和水
B.②洗涤沉淀时,向漏斗中加入适量水,搅拌并滤干
C.③液体分层,上层呈无色
D.④除去氯气中的少量氯化氢
4.下列有关实验的说法错误的是( )
A.在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点
B.用结晶法分离硝酸钾和氯化钠的混合物,用分液法分离水和四氯化碳的混合物
C.在重结晶实验中,使用短颈漏斗趁热过滤是为了减少被提纯物质的损失
D.作为重结晶实验的溶剂,杂质在此溶剂中的溶解度受温度影响应该很大
5.一定量的乙醇在氧气不足的情况下燃烧,得到CO2、CO和H2O的总质量为26.8 g,其中H2O的质量为10.8 g,则CO的质量是( )
A.1.4 g B.2.8 g
C.4.4 g D.在2.8 g和4.4 g之间
6.3.1 g某有机样品完全燃烧,燃烧后的气体混合物通入过量的澄清石灰水中,石灰水共增重7.1 g,然后过滤得到10 g沉淀。该有机样品可能是( )
A.乙二酸 B.乙醇
C.乙醛 D.甲醇和丙三醇的混合物
7.实验室制备乙酸异戊酯的有关信息如下:
物质 相对分子质量 水中溶解性
乙酸异戊酯 130 0.867 0 142 难溶
在洗涤、分液操作中,应充分振荡,然后静置,待分层后操作正确的是( )
A.直接将乙酸异戊酯从分液漏斗上口倒出
B.直接将乙酸异戊酯从分液漏斗下口放出
C.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从下口放出
D.先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出
8.[2023江苏无锡高二检测]按如图所示实验方案可从海洋动物柄海鞘中提取具有抗肿瘤活性的天然产物。下列说法错误的是( )
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.步骤(3)需要用到坩埚
D.步骤(4)需要蒸馏装置
9.有A、B两种互溶的化合物都不溶于水且密度比水小,常温下A、B为液体,A的沸点比B的低,A不与NaOH反应,B与NaOH作用生成水和可溶的C,C与盐酸作用可得NaCl和B。分离A和B的混合物,可采用下列方法:
(1)利用这两种化合物在某种试剂中溶解性的差异,可采用萃取的方法加以分离,实验操作的正确顺序是 (填序号),从分液漏斗的 (填“上”或“下”)层分离出的液体是A; (填序号),从分液漏斗的 (填“上”或“下”)层分离出的液体是B。
可供选择的操作有
①向分液漏斗中加入稀盐酸
②向分液漏斗中加入A和B的混合物
③向分液漏斗中加入氢氧化钠溶液
④充分振荡混合液,静置,分液
⑤将烧杯中的液体重新倒回分液漏斗中
(2)利用两种化合物沸点的不同,可采用蒸馏的方法加以分离,实验中需要用到的仪器有铁架台(附有铁夹、铁圈、石棉网)、蒸馏烧瓶、酒精灯、牛角管、 、 、 及必要的导管和橡胶塞,首先蒸馏出来的液体是 。
二、关键能力提升
10.下列分离混合物的实验计划不正确的是( )
A.分离乙酸(沸点77.1 ℃)与某种液态有机物(沸点120 ℃)的混合物——蒸馏
B.从含有少量NaCl的KNO3固体中提取KNO3——热水溶解、降温结晶、过滤
C.用CCl4萃取水中的碘,液体分层后——下层液体从下口放出,上层液体从上口倒出
D.将溴水中的溴转移到有机溶剂中——加入酒精萃取
11.某有机物在氧气中充分燃烧,生成的水蒸气和CO2的物质的量之比为1∶1。由此可得出的结论是( )
A.该有机物分子中C、H、O原子个数比为1∶2∶3
B.分子中碳、氢原子个数比为2∶1
C.有机物中必定含氧元素
D.无法判断有机物中是否含有氧元素
12.A是一种含碳、氢、氧三种元素的有机化合物。已知A中碳的质量分数为44.1%,氢的质量分数为8.82%,那么A的实验式是( )
A.C5H12O4 B.C5H12O3
C.C4H10O4 D.C5H10O4
13.[2023河北邯郸大名县第一中学高二月考]化学上常用燃烧法确定有机物的组成。下图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品。根据产物的质量确定有机物的组成。
回答下列问题:
(1)A装置中分液漏斗盛放的物质是 ,写出有关反应的化学方程式: 。
(2)C装置(燃烧管)中CuO的作用是 。
(3)写出E装置中所盛放试剂的名称: ,它的作用是 。
(4)若准确称取2.40 g样品(只含C、H、O三种元素中的两种或三种)。经充分燃烧后,E管质量增加3.52 g,D管质量增加1.44 g,则该有机物的最简式为 。
(5)要确定该有机物的化学式,还需要测定 。
14.[2023河北保定高二期中联考]中国药学家屠呦呦发现了青蒿素,开创了疟疾治疗新方法,她因此荣获2015年诺贝尔生理学或医学奖。已知:
①青蒿素由C、H、O元素组成,是无色针状晶体,可溶于乙醇、乙醚,在水中几乎不溶,熔点为156~157 ℃。
②乙醚的沸点为34.5 ℃。③从青蒿中提取青蒿素的方法之一是以萃取原理为基础,主要有乙醚浸取法和汽油浸取法。
Ⅰ.实验室用乙醚提取青蒿素流程如图1所示。
图1
(1)实验前要对青蒿进行粉碎,其目的是 。
(2)操作Ⅱ的名称为 。
(3)操作Ⅲ的主要过程可能是 (填字母)。
A.加入乙醚进行萃取、分液
B.加入95%的乙醇,浓缩、结晶、过滤
C.加水溶解,蒸发浓缩、冷却结晶,过滤
Ⅱ.用如图2所示实验装置测定青蒿素实验式方法如下:将14.1 g青蒿素样品放在装置C硬质玻璃管中,缓缓通入空气数分钟后再充分燃烧,精确测定装置E和F实验前后质量,根据所测数据计算。
图2
(4)装置A中盛放物质的作用是 。
(5)该实验装置可能会产生误差,改进方法是 。
(6)用合理改进后的装置进行实验,测得的数据如表所示,通过质谱仪测得青蒿素的相对分子质量是282,结合以上数据,得出青蒿素的分子式为 。
装置 实验前/g 实验后/g
E 11.3 21.2
F 40.1 73.1
15.探究用环己烯粗品精制环己烯的方法。
已知实验室制取环己烯的化学原理:
+H2O
物质 密度/(g·cm-3) 熔点/℃ 沸点/℃ 溶解性
环己醇 0.96 25 161 可溶
环己烯 0.81 -103 83 难溶
(1)除去环己烯粗品中的杂质,需先加入饱和碳酸钠溶液,其主要目的是 。
(2)加入饱和碳酸钠溶液后,振荡、静置,环己烯在上层还是下层: 。
(3)静置后如何操作: 。
该操作用到的主要仪器是 。
16.薰衣草精油常用作芳香剂、驱虫剂的原料。“DIY”兴趣小组在实验室从新鲜薰衣草中提取少量精油。
查阅资料:薰衣草精油成分复杂,沸点范围100~220 ℃,相同温度时在水中溶解度小于在苯、四氯化碳(有毒、沸点76.8 ℃)等溶剂中的溶解度。
设计方案:小组讨论后提出如下提取方案。(在横线上填写操作名称)
(1)步骤① 在研钵中将薰衣草捣碎,转移至小烧杯中并加入适量蒸馏水,搅拌使充分溶解后 ;
(2)步骤② 在薰衣草水中加入适量CCl4进行 ;
(3)步骤③ 将CCl4层进行 。
方案实施:按预先设计的方案进行实验。
(4)步骤②使用到的主要仪器有 (填字母)。
具体操作为振荡、 、静置、分液。溶有精油的CCl4层在 (填“上”或“下”)层。
(5)步骤③使用如图实验装置,其中仪器e的名称为 ,冷却水从 (填字母)口通入。加热,收集温度在 ℃的馏分(该馏分可循环使用)。
交流反思:小组成员观察产品并进行讨论后,认为该方案主要有以下两个缺点:
缺点1 精油中某些成分有热敏性,受热后品质会发生改变;
缺点2 该方法提取的精油中残留少量CCl4。
(6)基于小组的交流、反思和分析,你认为该小组进一步的研究方向是 。
参考答案
一、必备基础知识
1.D 解析 将有机样品与金属钠混合熔融,氮、氯、溴、硫等元素将以NaCN、NaCl、NaBr、Na2S等形式存在,再用无机定性分析法测定。
2.A 解析 有机反应RH+Cl2(g)RCl(l)+HCl(g)中,HCl易溶于水,RH、RCl等不溶于水,从反应产物中分离得到盐酸,则水洗分液法可得到盐酸,故选A。
3.A 解析 CCl4和水不互溶,可用分液法分离,故A正确;洗涤沉淀,不能搅拌,应向漏斗中加适量水,使水自然流下,故B错误;碘易溶于苯且苯密度比水小,下层为水层接近无色,故C错误;氯气难溶于饱和食盐水溶液,气体应为长进短出,故D错误。
4.D 解析 在蒸馏实验中,温度计的水银球位于支管口处是为了测出馏分的沸点,故A正确。硝酸钾的溶解度随温度升高而急剧增大,氯化钠的溶解度随温度升高变化很小,所以用结晶法分离硝酸钾和氯化钠的混合物;水和四氯化碳不互溶,所以用分液法分离水和四氯化碳的混合物,故B正确。在重结晶实验中,温度降低被提纯物质的溶解度减小,则使用短颈漏斗趁热过滤是为了减少被提纯物质的损失,C正确。在重结晶实验中,要求被提纯物质在溶剂中的溶解度受温度的影响较大,杂质在此溶剂中的溶解度要很小或很大,故D错误。
5.B 解析 一定量的乙醇在氧气不足的情况下燃烧,得到CO2、CO和H2O的总质量为26.8 g,其中H2O的质量为10.8 g,则n(H2O)==0.6 mol,根据H原子守恒可知,n(H)=2n(H2O)=1.2 mol,故n(C2H5OH)==0.2 mol,根据碳原子守恒可知,n(CO)+n(CO2)=0.2 mol×2=0.4 mol,根据质量守恒可知,28 g·mol-1×n(CO)+44 g·mol-1×n(CO2)=26.8 g-10.8 g=16 g,联合解得,n(CO)=0.1 mol,m(CO)=0.1 mol×28 g·mol-1 =2.8 g,故答案为B。
6.D 解析 3.1 g该有机样品燃烧生成CO2、H2O的总质量为7.1 g,CO2与过量Ca(OH)2反应生成10 g CaCO3,则CO2物质的量为0.1 mol,即n(C)=0.1 mol,m(C)=0.1 mol×12 g·mol-1=1.2 g,m(H2O)=7.1 g-0.1 mol×44 g·mol-1=2.7 g,即n(H2O)=0.15 mol,n(H)=0.3 mol,m(H)=0.3 mol×1 g·mol-1=0.3 g,故该有机样品中氧元素的质量:m(O)=3.1 g-1.2 g-0.3 g=1.6 g,即n(O)==0.1 mol,则该有机样品中n(C)∶n(H)∶n(O)=0.1 mol∶0.3 mol∶0.1 mol=1∶3∶1,即最简式为CH3O,设其分子式为(CH3O)n,只有当甲醇和丙三醇按物质的量之比为1∶1混合时符合,D正确。
7.D 解析 乙酸异戊酯的密度比水的密度小,分液时在上层,应先将水层从分液漏斗的下口放出,再将乙酸异戊酯从上口倒出。
8.C 解析 滤液与不溶物是用过滤的方法分离出的,A项正确;分离水层与有机层需要用分液漏斗,B项正确;溶液蒸发结晶应用蒸发皿,C项错误;可用蒸馏的方法从有机层中分离出甲苯,D项正确。
9.答案 (1)②③④ 上 ⑤①④ 上
(2)温度计 冷凝管 锥形瓶 A
解析 (1)采用萃取的方法加以分离,混合物中加NaOH溶液,A在上层,实验操作的正确顺序是:②向分液漏斗中加入A和B的混合物,③向分液漏斗中加入氢氧化钠溶液,④充分振荡混合液,静置,分液。从下口放出水和可溶的C,从上口分离出A。
提取并分离B的操作顺序是:⑤将烧杯中的液体重新倒回分液漏斗中,①向分液漏斗中加入稀盐酸,④充分振荡混合液,静置,分液,上层分离出的液体是B。
(2)在用蒸馏操作进行分离时,需要控制加热温度,冷却后用锥形瓶进行接收,即还缺少温度计、冷凝管和锥形瓶。先蒸出沸点低的A。
二、关键能力提升
10.D 解析 A中两种有机物互溶,但沸点不同,则选择蒸馏法可分离,故A正确;NaCl和KNO3的溶解度受温度影响不同,则热水溶解、降温结晶、过滤可分离,故B正确;碘不易溶于水,易溶于四氯化碳,则用分液漏斗萃取后分液可分离,分离混合物时,下层液体从下口放出,上层液体从上口倒出,故C正确;酒精与水互溶,则酒精不能作萃取剂,故D错误。
11.D 解析 含C、H或含C、H、O的有机物燃烧都生成二氧化碳和水,有机物在氧气中充分燃烧,生成的水蒸气和CO2的物质的量之比为1∶1,可确定n(C)∶n(H)=1∶(1×2)=1∶2,但不能确定是否含有氧元素,只有D正确。
12.A 解析 由于A中碳的质量分数为44.1%,氢的质量分数为8.82%,故A中氧的质量分数为1-44.1%-8.82%=47.08%。由此可算出N(C)∶N(H)∶N(O)=≈5∶12∶4,故该有机物的实验式为C5H12O4。
13.答案 (1)H2O2(或H2O) 2H2O22H2O+O2↑(或2Na2O2+2H2O===4NaOH+O2↑)
(2)使有机物充分氧化生成CO2和H2O
(3)碱石灰或生石灰或氢氧化钠 吸收CO2
(4)CH2O
(5)有机物的相对分子质量
解析 图示装置是用燃烧法确定有机物化学式常用的装置,A装置的作用是制造氧气;B装置的作用是除去氧气中的水,防止对测定产生干扰;C装置的作用是使有机物充分进行燃烧反应生成CO2和H2O;D装置的作用是吸收反应中产生的H2O,根据增重计算有机物中的H元素含量;E装置的作用是吸收反应中产生的CO2,根据增重计算有机物中的C元素含量。
(1)A装置为制备氧气的发生装置,氧气可由双氧水在二氧化锰催化下分解或水和过氧化钠反应制备,则分液漏斗中的液体可为双氧水或水,对应的化学方程式为2H2O22H2O+O2↑或2Na2O2+2H2O===4NaOH+O2↑。
(2)CuO的作用是使有机物充分氧化生成CO2和H2O。
(3)E装置的作用是完全吸收反应生成的CO2,可用碱石灰或生石灰或氢氧化钠来吸收。
(4)D管增重1.44 g,则n(H2O)==0.08 mol,n(H)=0.08 mol×2=0.16 mol。E管增重3.52 g,则n(CO2)==0.08 mol,n(C)=0.08 mol。样品总重2.40 g,则可得n(O)=
=0.08 mol,所以样品中n(C)∶n(H)∶n(O)=1∶2∶1,则该有机物的最简式为CH2O。
(5)要确定该有机物的化学式,还需知道该有机物的相对分子质量。
14.答案 (1)增大青蒿与乙醚的接触面积,提高青蒿素的浸出速率和浸取率
(2)蒸馏
(3)B
(4)除去空气中的CO2,以防干扰实验
(5)装置F后连接一个盛有碱石灰的干燥管或U形管
(6)C15H22O5
解析 (1)实验前要对青蒿进行粉碎,其目的是增大青蒿与乙醚的接触面积,提高青蒿素的浸出速率和浸取率。
(2)青蒿素是无色针状晶体,可溶于乙醇、乙醚,将提取液进行操作Ⅱ得到乙醚,则操作Ⅱ的名称为蒸馏。
(3)操作Ⅲ是粗品得到青蒿素精品,青蒿素溶于乙醇、乙醚,在水中几乎不溶,故向粗品中加入95%的乙醇,浓缩、结晶、过滤,从而得到精品。
(4)为了能准确测定青蒿素燃烧生成的二氧化碳和水的质量,实验前应通入除去二氧化碳和水蒸气的空气,排除装置内的二氧化碳和水蒸气,防止干扰实验,所以实验装置A中盛放氢氧化钠溶液,吸收空气中的二氧化碳;青蒿素与氧气反应生成二氧化碳和水,装置E吸收水蒸气,装置F吸收二氧化碳。
(5)该实验装置可能会产生误差,主要是空气中二氧化碳和水蒸气会进入装置F中,因此改进方法是装置F后连接一个盛有碱石灰的干燥管或U形管。
(6)质谱仪测得青蒿素的相对分子质量是282,14.1 g青蒿素物质的量为0.05 mol,得到水的质量为9.9 g(物质的量为0.55 mol),二氧化碳的质量为33 g(物质的量为0.75 mol),根据关系式得到分子式为C15H22Ox,根据相对分子质量得到青蒿素的分子式为C15H22O5。
15.答案 (1)除去环己烯中的酸性杂质和部分环己醇
(2)上层
(3)将下层液体从分液漏斗下口放出,环己烯从分液漏斗上口倒出 分液漏斗、烧杯
16.答案 (1)过滤 (2)萃取、分液 (3)蒸馏 (4)b 放气 下 (5)蒸馏烧瓶 g 76.8 (6)选取无毒、高效、可进行低温提取精油的萃取剂
