2.2.2 杂化轨道理论(含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 2.2.2 杂化轨道理论(含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修2 |

|
|
| 格式 | docx | ||
| 文件大小 | 285.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-15 21:26:40 | ||
图片预览


文档简介
2.2.2 杂化轨道理论——高二化学人教版(2019)选修二课时优化训练
1.用鲍林的杂化轨道理论解释CH4分子的正四面体形结构,下列说法不正确的是( )
A.C原子的4个杂化轨道的能量一样
B.C原子的sp3杂化轨道之间夹角一样
C.C原子的4个价层电子分别占据4个sp3杂化轨道
D.C原子有1个sp3杂化轨道由孤电子对占据
2.有机物CH3CHCH—C≡CH中标有“·”的碳原子的杂化方式依次为( )
A.sp、sp2、sp3 B.sp3、sp2、sp
C.sp2、sp、sp3 D.sp3、sp、sp2
3.关于乙烯分子中化学键的描述正确的是( )
A.C原子sp2杂化轨道形成σ键,未杂化的2p轨道形成π键
B.乙烯分子中有4个σ键、2个π键
C.C—H之间是两原子的sp2杂化轨道形成σ键,C—C之间是未杂化的2p轨道形成π键
D.C—C之间是sp2杂化轨道形成σ键,C—H之间是未杂化的2p轨道形成π键
4.在分子中,C—Br键采用的成键轨道是( )
A.sp-p B. C. D.
5.在乙烯分子中有5个键、1个键,它们分别是( )
A.杂化轨道形成键、未杂化的2p轨道形成键
B.杂化轨道形成键、未杂化的2p轨道形成键
C.C、H之间是杂化轨道形成的键,C、C之间是未参加杂化的2p轨道形成的键
D.C、C之间是杂化轨道形成的键,C、H之间是未参加杂化的2p轨道形成的键
6.在1个乙烯分子中有5个键和1个键,下列说法正确的是( )
A.杂化轨道形成键,未参与杂化的2p轨道形成键
B.杂化轨道形成键,未参与杂化的2p轨道形成键
C.C—H是杂化轨道形成的键,是未参与杂化的2p轨道形成的
D.是杂化轨道形成的键,C-H是未参与杂化的2p轨道形成的键
7.甲烷中的碳原子采用杂化,下列用*标注的碳原子的杂化类型和甲烷中的碳原子的杂化类型一致的是( )
A. B.
C. D.
8.下列关于杂化轨道的叙述中,不正确的是( )
A.分子中中心原子通过杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道只用于形成键或用于容纳未参与成键的孤电子对
C.和两个分子中中心原子N和C都是通过杂化轨道成键
D.用杂化轨道理论与VSEPR模型分析分子空间结构的结果常常相互矛盾
9.氯化亚砜可作为氯化剂和脱水剂。氯化亚砜分子的空间结构和中心原子(S)采取的杂化方式分别是( )
A.三角锥形、 B.V形、
C.平面三角形、 D.三角锥形、
10.下列对各分子中心原子的杂化轨道类型和分子空间结构描述不正确的是( )
A.分子中C原子为杂化,正四面体形
B.分子中S原子为杂化,Ⅴ形
C.分子中C原子为sp杂化,直线形
D.分子中B原子为杂化,三角锥形
11.氨气分子的空间结构是三角锥形,而甲烷分子的空间结构是正四面体形,这是因为( )
A.两种分子的中心原子的杂化轨道类型不同,中N原子为杂化,而中C原子是杂化
B.分子中氮原子形成3个杂化轨道,分子中碳原子形成4个杂化轨道
C.分子中中心原子上有一对未成键的孤电子对,它对成键电子对的排斥作用较强
D.氨气是四原子化合物,甲烷为五原子化合物
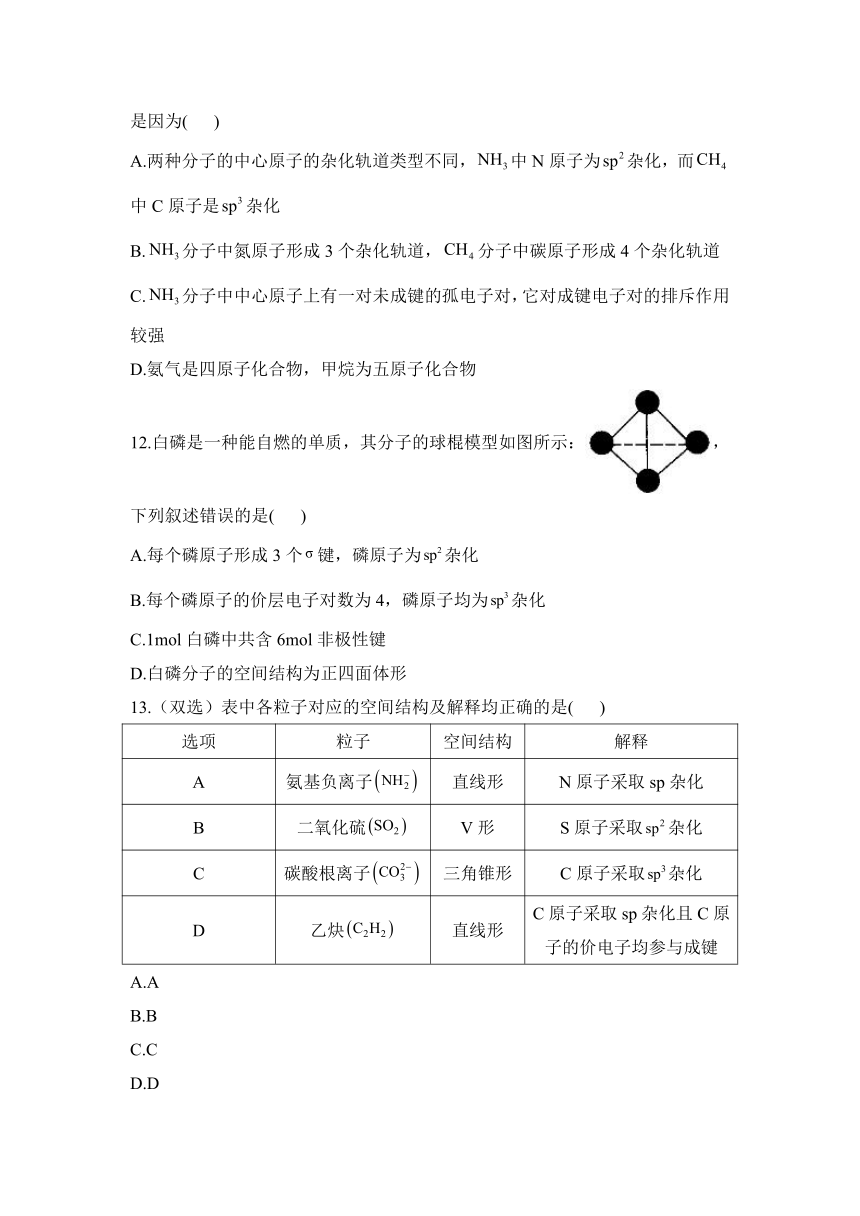
12.白磷是一种能自燃的单质,其分子的球棍模型如图所示:,下列叙述错误的是( )
A.每个磷原子形成3个键,磷原子为杂化
B.每个磷原子的价层电子对数为4,磷原子均为杂化
C.1mol白磷中共含6mol非极性键
D.白磷分子的空间结构为正四面体形
13.(双选)表中各粒子对应的空间结构及解释均正确的是( )
选项 粒子 空间结构 解释
A 氨基负离子 直线形 N原子采取sp杂化
B 二氧化硫 V形 S原子采取杂化
C 碳酸根离子 三角锥形 C原子采取杂化
D 乙炔 直线形 C原子采取sp杂化且C原子的价电子均参与成键
A.A
B.B
C.C
D.D
14.下列分子中的中心原子的杂化方式为sp杂化,分子的空间结构为直线形且分子中没有形成键的是( )
A.
B.
C.
D.
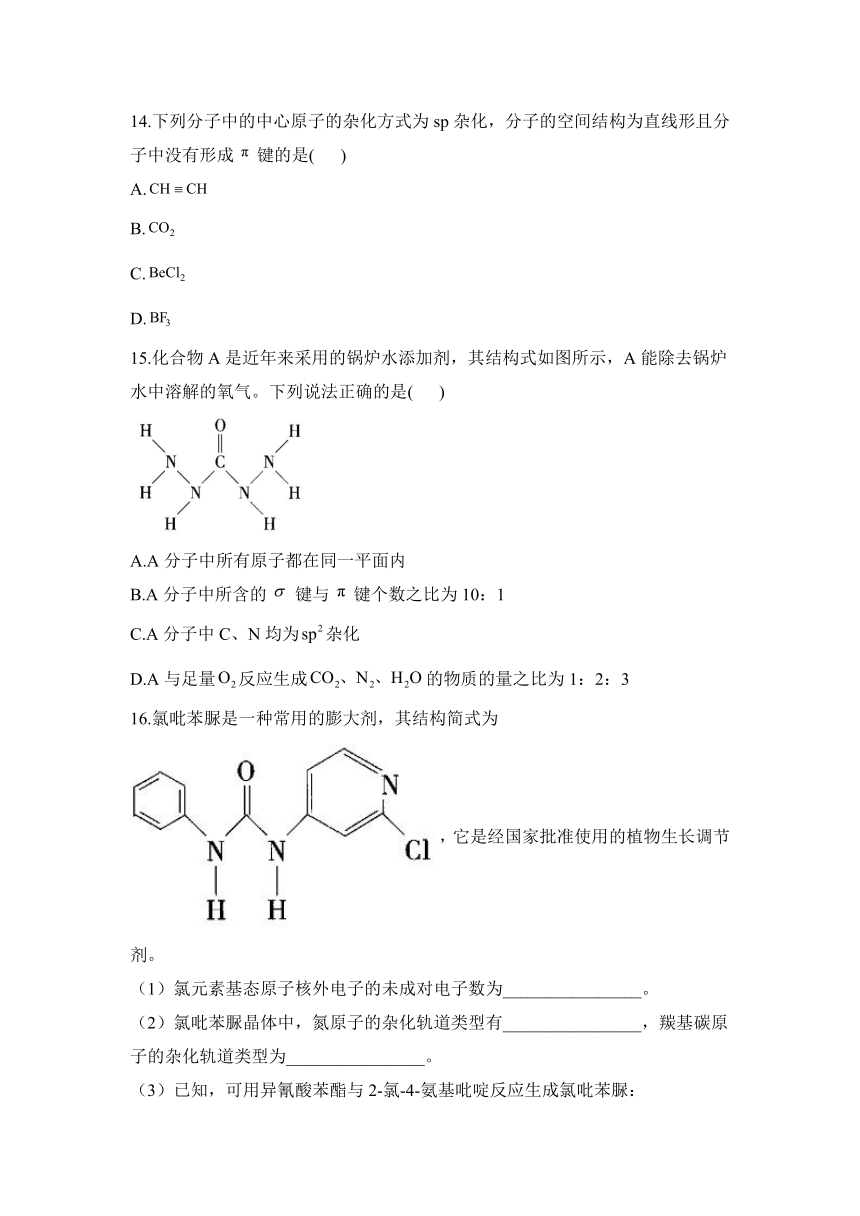
15.化合物A是近年来采用的锅炉水添加剂,其结构式如图所示,A能除去锅炉水中溶解的氧气。下列说法正确的是( )
A.A分子中所有原子都在同一平面内
B.A分子中所含的键与键个数之比为10:1
C.A分子中C、N均为杂化
D.A与足量反应生成的物质的量之比为1:2:3
16.氯吡苯脲是一种常用的膨大剂,其结构简式为,它是经国家批准使用的植物生长调节剂。
(1)氯元素基态原子核外电子的未成对电子数为________________。
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型有________________,羰基碳原子的杂化轨道类型为________________。
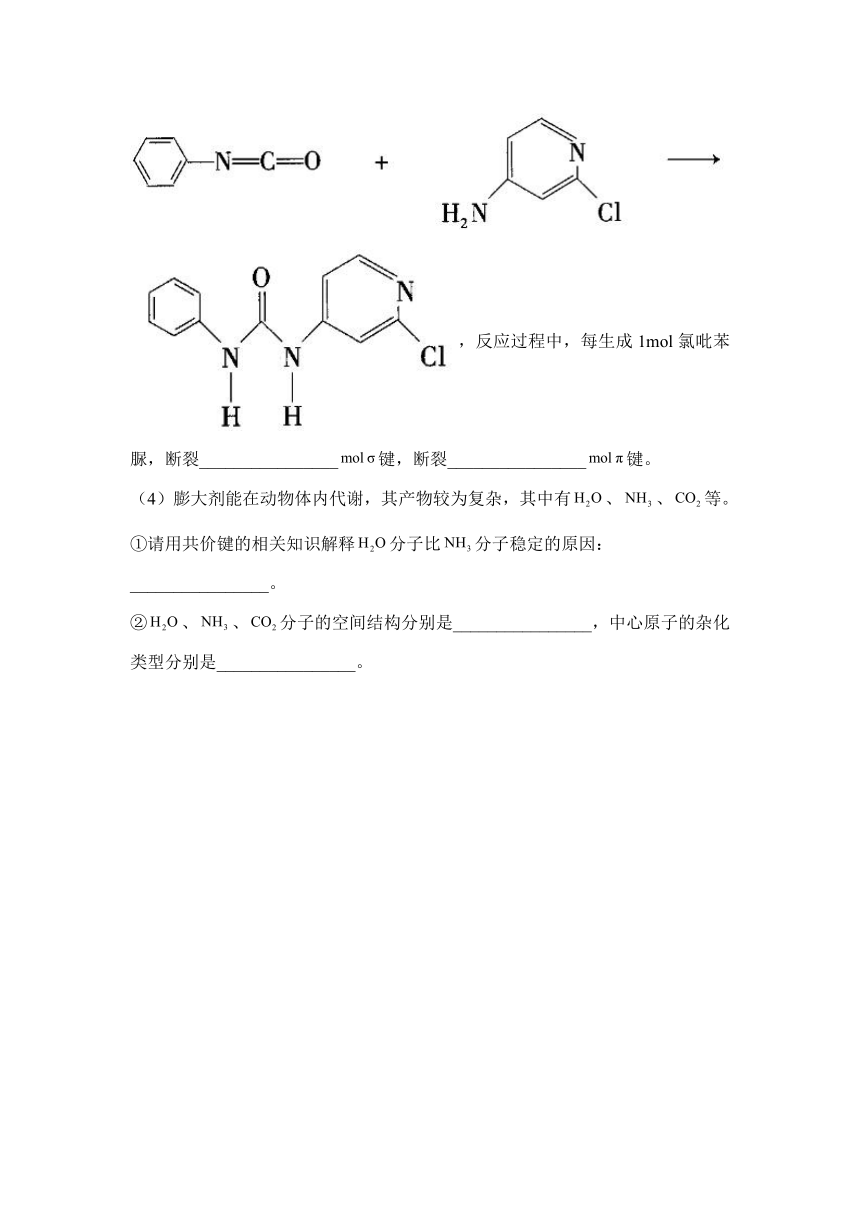
(3)已知,可用异氰酸苯酯与2-氯-4-氨基吡啶反应生成氯吡苯脲:
,反应过程中,每生成1mol氯吡苯脲,断裂________________键,断裂________________键。
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有、、等。
①请用共价键的相关知识解释分子比分子稳定的原因:________________。
②、、分子的空间结构分别是________________,中心原子的杂化类型分别是________________。
答案以及解析
1.答案:D
解析:甲烷中C原子采取sp3杂化,每个杂化轨道上1个电子分别与1个H原子上的电子结合形成共价键,这四个共价键完全相同,轨道间的夹角为109°28',形成正四面体形的分子。
2.答案:D
解析:甲基上C原子采取sp3杂化;碳碳双键上碳原子采取sp2杂化;碳碳三键的C原子采取sp杂化。
3.答案:D
解析:在乙烯分子中,每个碳原子的2s轨道与2个2p轨道杂化形成3个sp2杂化轨道,其中2个sp2杂化轨道分别与2个氢原子的1s轨道形成C—H σ键,另外1个sp2杂化轨道与另一个碳原子的sp2杂化轨道形成C—C σ键;2个碳原子中未参与杂化的2p轨道形成1个π键。
4.答案:C
解析:分子中的两个碳原子都是采取杂化,溴原子的价电子排布式为,4p轨道上有一个单电子,与碳原子的一个杂化轨道成键,故C—Br键采用的成键轨道是,C项正确。
5.答案:A
解析:乙烯分子中存在4个C—H键和1个C=C键,碳原子上没有孤电子对,形成3个键,则C原子采取杂化,碳氢键是杂化轨道形成的键,碳碳双键中有1个是杂化轨道形成的键,还有1个是未参加杂化的2p轨道形成的键,A正确。
6.答案:A
解析:在乙烯分子中碳原子与相连的氢原子、碳原子形成平面三角形,所以乙烯分子中每个碳原子均采取杂化,其中杂化轨道形成键,未参与杂化的2p轨道形成键。
7.答案:A
解析:中碳原子为饱和碳原子,采用杂化。A项,亚甲基碳原子为饱和碳原子,采用杂化;B、C项,C==C中的不饱和碳原子采用杂化;D项,中的不饱和碳原子采用sp杂化。A项符合题意。
8.答案:D
解析:中心原子采取杂化轨道成键的分子可能是正四面体形(如)、三角锥形(如)或者V形(如),A正确;键是由未参与杂化的轨道“肩并肩”重叠形成的,杂化轨道只用于形成键或用于容纳孤电子对,B正确;正四面体形的和三角锥形的中,中心原子C和N都是通过杂化轨道成键,C正确;杂化轨道理论和VSEPR模型都是为了解释分子的空间结构而提出的理论,两者不矛盾,可以先通过VSEPR模型判断出分子的空间结构,再判断出中心原子的杂化轨道类型,D错误。
9.答案:A
解析:根据价层电子对互斥理论确定微粒的空间结构,中S原子形成2个S—C键和1个S==O键,价层电子对数=键个数+孤电子对数=,杂化轨道数是4,故S原子采取杂化,孤电子对数为1,分子的空间结构为三角锥形。综上所述,A项正确。
10.答案:D
解析:分子中中心C原子的价层电子对数为,孤电子对数为0,则为杂化,空间结构为正四面体形,故A正确;分子中中心S原子的价层电子对数为,孤电子对数为2,则为杂化,空间结构为V形,故B正确;分子中中心C原子的价层电子对数为,孤电子对数为0,为sp杂化,空间结构为直线形,故C正确;分子中中心B原子的价层电子对数为,孤电子对数为0,则为杂化,空间结构为平面三角形,故D错误。
11.答案:C
解析:和中的中心原子都是杂化,都形成夹角为109°28'的四个杂化轨道,只是分子中N原子利用其中3个sp杂化轨道与3个H原子的1s轨道成键,另一个杂化轨道被孤电子对占据,所以分子为三角锥形,而分子中4个杂化轨道全部用于形成4个C—H键,所以分子为正四面体形。
12.答案:A
解析:由白磷分子的球棍模型图可知,每个磷原子均形成了3个键,且每个磷原子还有一对孤电子对,故价层电子对数为4,磷原子为杂化,A项错误,B项正确;由图可知C、D项正确。
13.答案:BD
解析:中中心N原子的价层电子对数为,孤电子对数为2,杂化轨道数为4,采取杂化,空间结构为V形,A项错误;中中心S原子的价层电子对数为,孤电子对数为1,杂化轨道数为3,采取杂化,空间结构为V形,B项正确;中中心C原子的价层电子对数为,不含孤电子对,杂化轨道数为3,采取杂化,空间结构为平面三角形,C项错误;中C原子采取sp杂化,且C原子的价电子均参与成键,空间结构为直线形,D项正确。
14.答案:C
解析:CHCH中含有碳碳三键,分子中有键,A项不符合题意;的结构式为O=C=O,分子中含有碳氧双键,含有键,B项不符合题意;氯化铍分子中,铍原子含有两个共价单键,不含孤电子对,所以价层电子对数是2,中心铍原子以sp杂化轨道成键,分子的空间结构为直线形,分子中不含键,C项符合题意;中B原子形成3个共价单键,不含孤电子对,所以价层电子对数是3,中心原子以杂化轨道成键,分子的空间结构为平面三角形,D项不符合题意。
15.答案:D
解析:因氨气分子空间结构为三角锥形,即氮原子与所连的三个原子不在同一平面,所以A分子中所有原子不可能共平面,A错误;1个A分子中含有11个键和1个键,键与键个数之比为11:1,B错误;A分子中N为杂化,C错误;1molA与足量反应生成的物质的量分别为1mol、2mol、3mol,D正确。
16.答案:(1)1
(2)、
(3)1 1
(4)①H—O键的键能大于H—N键的键能
②V形、三角锥形、直线形 、、sp
解析: (1)氯元素基态原子核外电子排布式是,所以未成对电子数为1。
(2)根据氯吡苯脲的结构简式可知,有2个氮原子均形成3个单键,孤电子对数为1,采取杂化,剩余1个氮原子形成1个双键和1个单键,孤电子对数为1,采取杂化;羰基碳原子形成2个单键和1个双键,采取杂化。
(3)由于键比键稳定,根据反应方程式可知,断裂的化学键为异氰酸苯酯分子中的N==C键中的键和2-氯-4-氨基吡啶分子中的N—H键。
(4)①O、N属于同周期元素,O的原子半径小于N,H—O键的键能大于H—N键的键能,所以分子比分子稳定。
②分子中O原子的价层电子对数=,孤电子对数为2,所以其空间结构为V形,O原子采取杂化;分子中N原子的价层电子对数=,孤电子对数为1,所以其空间结构为三角锥形,N原子采取杂化;分子中C原子的价层电子对数=,不含孤电子对,所以其空间结构为直线形,C原子采取sp杂化
1.用鲍林的杂化轨道理论解释CH4分子的正四面体形结构,下列说法不正确的是( )
A.C原子的4个杂化轨道的能量一样
B.C原子的sp3杂化轨道之间夹角一样
C.C原子的4个价层电子分别占据4个sp3杂化轨道
D.C原子有1个sp3杂化轨道由孤电子对占据
2.有机物CH3CHCH—C≡CH中标有“·”的碳原子的杂化方式依次为( )
A.sp、sp2、sp3 B.sp3、sp2、sp
C.sp2、sp、sp3 D.sp3、sp、sp2
3.关于乙烯分子中化学键的描述正确的是( )
A.C原子sp2杂化轨道形成σ键,未杂化的2p轨道形成π键
B.乙烯分子中有4个σ键、2个π键
C.C—H之间是两原子的sp2杂化轨道形成σ键,C—C之间是未杂化的2p轨道形成π键
D.C—C之间是sp2杂化轨道形成σ键,C—H之间是未杂化的2p轨道形成π键
4.在分子中,C—Br键采用的成键轨道是( )
A.sp-p B. C. D.
5.在乙烯分子中有5个键、1个键,它们分别是( )
A.杂化轨道形成键、未杂化的2p轨道形成键
B.杂化轨道形成键、未杂化的2p轨道形成键
C.C、H之间是杂化轨道形成的键,C、C之间是未参加杂化的2p轨道形成的键
D.C、C之间是杂化轨道形成的键,C、H之间是未参加杂化的2p轨道形成的键
6.在1个乙烯分子中有5个键和1个键,下列说法正确的是( )
A.杂化轨道形成键,未参与杂化的2p轨道形成键
B.杂化轨道形成键,未参与杂化的2p轨道形成键
C.C—H是杂化轨道形成的键,是未参与杂化的2p轨道形成的
D.是杂化轨道形成的键,C-H是未参与杂化的2p轨道形成的键
7.甲烷中的碳原子采用杂化,下列用*标注的碳原子的杂化类型和甲烷中的碳原子的杂化类型一致的是( )
A. B.
C. D.
8.下列关于杂化轨道的叙述中,不正确的是( )
A.分子中中心原子通过杂化轨道成键时,该分子不一定为正四面体结构
B.杂化轨道只用于形成键或用于容纳未参与成键的孤电子对
C.和两个分子中中心原子N和C都是通过杂化轨道成键
D.用杂化轨道理论与VSEPR模型分析分子空间结构的结果常常相互矛盾
9.氯化亚砜可作为氯化剂和脱水剂。氯化亚砜分子的空间结构和中心原子(S)采取的杂化方式分别是( )
A.三角锥形、 B.V形、
C.平面三角形、 D.三角锥形、
10.下列对各分子中心原子的杂化轨道类型和分子空间结构描述不正确的是( )
A.分子中C原子为杂化,正四面体形
B.分子中S原子为杂化,Ⅴ形
C.分子中C原子为sp杂化,直线形
D.分子中B原子为杂化,三角锥形
11.氨气分子的空间结构是三角锥形,而甲烷分子的空间结构是正四面体形,这是因为( )
A.两种分子的中心原子的杂化轨道类型不同,中N原子为杂化,而中C原子是杂化
B.分子中氮原子形成3个杂化轨道,分子中碳原子形成4个杂化轨道
C.分子中中心原子上有一对未成键的孤电子对,它对成键电子对的排斥作用较强
D.氨气是四原子化合物,甲烷为五原子化合物
12.白磷是一种能自燃的单质,其分子的球棍模型如图所示:,下列叙述错误的是( )
A.每个磷原子形成3个键,磷原子为杂化
B.每个磷原子的价层电子对数为4,磷原子均为杂化
C.1mol白磷中共含6mol非极性键
D.白磷分子的空间结构为正四面体形
13.(双选)表中各粒子对应的空间结构及解释均正确的是( )
选项 粒子 空间结构 解释
A 氨基负离子 直线形 N原子采取sp杂化
B 二氧化硫 V形 S原子采取杂化
C 碳酸根离子 三角锥形 C原子采取杂化
D 乙炔 直线形 C原子采取sp杂化且C原子的价电子均参与成键
A.A
B.B
C.C
D.D
14.下列分子中的中心原子的杂化方式为sp杂化,分子的空间结构为直线形且分子中没有形成键的是( )
A.
B.
C.
D.
15.化合物A是近年来采用的锅炉水添加剂,其结构式如图所示,A能除去锅炉水中溶解的氧气。下列说法正确的是( )
A.A分子中所有原子都在同一平面内
B.A分子中所含的键与键个数之比为10:1
C.A分子中C、N均为杂化
D.A与足量反应生成的物质的量之比为1:2:3
16.氯吡苯脲是一种常用的膨大剂,其结构简式为,它是经国家批准使用的植物生长调节剂。
(1)氯元素基态原子核外电子的未成对电子数为________________。
(2)氯吡苯脲晶体中,氮原子的杂化轨道类型有________________,羰基碳原子的杂化轨道类型为________________。
(3)已知,可用异氰酸苯酯与2-氯-4-氨基吡啶反应生成氯吡苯脲:
,反应过程中,每生成1mol氯吡苯脲,断裂________________键,断裂________________键。
(4)膨大剂能在动物体内代谢,其产物较为复杂,其中有、、等。
①请用共价键的相关知识解释分子比分子稳定的原因:________________。
②、、分子的空间结构分别是________________,中心原子的杂化类型分别是________________。
答案以及解析
1.答案:D
解析:甲烷中C原子采取sp3杂化,每个杂化轨道上1个电子分别与1个H原子上的电子结合形成共价键,这四个共价键完全相同,轨道间的夹角为109°28',形成正四面体形的分子。
2.答案:D
解析:甲基上C原子采取sp3杂化;碳碳双键上碳原子采取sp2杂化;碳碳三键的C原子采取sp杂化。
3.答案:D
解析:在乙烯分子中,每个碳原子的2s轨道与2个2p轨道杂化形成3个sp2杂化轨道,其中2个sp2杂化轨道分别与2个氢原子的1s轨道形成C—H σ键,另外1个sp2杂化轨道与另一个碳原子的sp2杂化轨道形成C—C σ键;2个碳原子中未参与杂化的2p轨道形成1个π键。
4.答案:C
解析:分子中的两个碳原子都是采取杂化,溴原子的价电子排布式为,4p轨道上有一个单电子,与碳原子的一个杂化轨道成键,故C—Br键采用的成键轨道是,C项正确。
5.答案:A
解析:乙烯分子中存在4个C—H键和1个C=C键,碳原子上没有孤电子对,形成3个键,则C原子采取杂化,碳氢键是杂化轨道形成的键,碳碳双键中有1个是杂化轨道形成的键,还有1个是未参加杂化的2p轨道形成的键,A正确。
6.答案:A
解析:在乙烯分子中碳原子与相连的氢原子、碳原子形成平面三角形,所以乙烯分子中每个碳原子均采取杂化,其中杂化轨道形成键,未参与杂化的2p轨道形成键。
7.答案:A
解析:中碳原子为饱和碳原子,采用杂化。A项,亚甲基碳原子为饱和碳原子,采用杂化;B、C项,C==C中的不饱和碳原子采用杂化;D项,中的不饱和碳原子采用sp杂化。A项符合题意。
8.答案:D
解析:中心原子采取杂化轨道成键的分子可能是正四面体形(如)、三角锥形(如)或者V形(如),A正确;键是由未参与杂化的轨道“肩并肩”重叠形成的,杂化轨道只用于形成键或用于容纳孤电子对,B正确;正四面体形的和三角锥形的中,中心原子C和N都是通过杂化轨道成键,C正确;杂化轨道理论和VSEPR模型都是为了解释分子的空间结构而提出的理论,两者不矛盾,可以先通过VSEPR模型判断出分子的空间结构,再判断出中心原子的杂化轨道类型,D错误。
9.答案:A
解析:根据价层电子对互斥理论确定微粒的空间结构,中S原子形成2个S—C键和1个S==O键,价层电子对数=键个数+孤电子对数=,杂化轨道数是4,故S原子采取杂化,孤电子对数为1,分子的空间结构为三角锥形。综上所述,A项正确。
10.答案:D
解析:分子中中心C原子的价层电子对数为,孤电子对数为0,则为杂化,空间结构为正四面体形,故A正确;分子中中心S原子的价层电子对数为,孤电子对数为2,则为杂化,空间结构为V形,故B正确;分子中中心C原子的价层电子对数为,孤电子对数为0,为sp杂化,空间结构为直线形,故C正确;分子中中心B原子的价层电子对数为,孤电子对数为0,则为杂化,空间结构为平面三角形,故D错误。
11.答案:C
解析:和中的中心原子都是杂化,都形成夹角为109°28'的四个杂化轨道,只是分子中N原子利用其中3个sp杂化轨道与3个H原子的1s轨道成键,另一个杂化轨道被孤电子对占据,所以分子为三角锥形,而分子中4个杂化轨道全部用于形成4个C—H键,所以分子为正四面体形。
12.答案:A
解析:由白磷分子的球棍模型图可知,每个磷原子均形成了3个键,且每个磷原子还有一对孤电子对,故价层电子对数为4,磷原子为杂化,A项错误,B项正确;由图可知C、D项正确。
13.答案:BD
解析:中中心N原子的价层电子对数为,孤电子对数为2,杂化轨道数为4,采取杂化,空间结构为V形,A项错误;中中心S原子的价层电子对数为,孤电子对数为1,杂化轨道数为3,采取杂化,空间结构为V形,B项正确;中中心C原子的价层电子对数为,不含孤电子对,杂化轨道数为3,采取杂化,空间结构为平面三角形,C项错误;中C原子采取sp杂化,且C原子的价电子均参与成键,空间结构为直线形,D项正确。
14.答案:C
解析:CHCH中含有碳碳三键,分子中有键,A项不符合题意;的结构式为O=C=O,分子中含有碳氧双键,含有键,B项不符合题意;氯化铍分子中,铍原子含有两个共价单键,不含孤电子对,所以价层电子对数是2,中心铍原子以sp杂化轨道成键,分子的空间结构为直线形,分子中不含键,C项符合题意;中B原子形成3个共价单键,不含孤电子对,所以价层电子对数是3,中心原子以杂化轨道成键,分子的空间结构为平面三角形,D项不符合题意。
15.答案:D
解析:因氨气分子空间结构为三角锥形,即氮原子与所连的三个原子不在同一平面,所以A分子中所有原子不可能共平面,A错误;1个A分子中含有11个键和1个键,键与键个数之比为11:1,B错误;A分子中N为杂化,C错误;1molA与足量反应生成的物质的量分别为1mol、2mol、3mol,D正确。
16.答案:(1)1
(2)、
(3)1 1
(4)①H—O键的键能大于H—N键的键能
②V形、三角锥形、直线形 、、sp
解析: (1)氯元素基态原子核外电子排布式是,所以未成对电子数为1。
(2)根据氯吡苯脲的结构简式可知,有2个氮原子均形成3个单键,孤电子对数为1,采取杂化,剩余1个氮原子形成1个双键和1个单键,孤电子对数为1,采取杂化;羰基碳原子形成2个单键和1个双键,采取杂化。
(3)由于键比键稳定,根据反应方程式可知,断裂的化学键为异氰酸苯酯分子中的N==C键中的键和2-氯-4-氨基吡啶分子中的N—H键。
(4)①O、N属于同周期元素,O的原子半径小于N,H—O键的键能大于H—N键的键能,所以分子比分子稳定。
②分子中O原子的价层电子对数=,孤电子对数为2,所以其空间结构为V形,O原子采取杂化;分子中N原子的价层电子对数=,孤电子对数为1,所以其空间结构为三角锥形,N原子采取杂化;分子中C原子的价层电子对数=,不含孤电子对,所以其空间结构为直线形,C原子采取sp杂化
