3.4.1 配合物与超分子(含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.4.1 配合物与超分子(含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 369.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-15 21:27:27 | ||
图片预览




文档简介
3.4.1 配合物与超分子——高二化学人教版(2019)选修二课时优化训练
1.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是( )
①H2O ②NH3 ③F- ④CN- ⑤CO
A.只有①② B.只有①②③
C.只有①②④ D.全部
2.在N中存在4个N—H共价键,则下列说法正确的是( )
A.4个共价键的键长完全相同
B.4个共价键的键长完全不同
C.原来的3个N—H的键长完全相同,但与通过配位键形成的N—H不同
D.4个N—H键长相同,但键能不同
3.下列关于配合物的说法中不正确的是( )
A.许多过渡金属离子对多种配体具有很强的结合力,因而过渡金属配合物远比主族金属配合物多
B.配合物中中心离子与配体间、配离子与酸根离子间都是以配位键结合
C.配合物中中心离子提供空轨道,配体提供孤对电子
D.中心离子所结合配体的个数称为配位数,不同离子的配位数可能不同
4.设为阿伏加德罗常数的值,关于的说法中正确的是( )
A.1mol 含有键的数目为16
B.中心原子的化合价为+2价
C.中心原子的配位数是5
D.含1mol 的溶液中加入足量溶液,产生2mol白色沉淀
5.某物质的分子结构为。下列对该物质的分析正确的是( )
A.该物质的分子中不存在σ键
B.该物质的分子中只含有共价键、配位键两种作用力
C.该物质是一种配合物,其中Ni原子为中心原子
D.该物质中C、N、O原子均存在孤对电子
6.向溶液中滴加几滴浓度为的氨水,首先形成蓝色沉淀,继续滴加氨水并振荡,沉淀溶解,得到深蓝色溶液,继续滴加8mL95%的乙醇,析出深蓝色的晶体。下列分析错误的是( )
A.深蓝色晶体的化学式为
B.属于配离子,为配体
C. 可表示为,离子空间结构一定为正四面体形
D.五水硫酸铜可表示为
7.下列关于超分子和配合物的叙述不正确的是( )
A.利用超分子的分子识别特征,可以分离和
B.配合物中只含配位键
C.中提供空轨道,中氧原子提供孤对电子,从而形成配位键
D.配合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有广泛应用
8.利用分子间作用力形成超分子进行“分子识别”,实现分子分离,是超分子化学的重要研究和应用领域。如图表示用“杯酚”对和进行分离的过程,下列对该过程的说法错误的是( )
A.能溶于甲苯,不溶于甲苯
B.能与“杯酚”形成超分子
C.不能与“杯酚”形成超分子
D.“杯酚”能够循环使用
9.有组成不同的3种含铂配合物,分别是、和,在液氨中它们之间有如下的转化关系:,下列关于这3种含铂配合物的说法正确的是( )
A.具有很强的碱性 B.3种含铂配合物的配位数均为6
C.3种含铂配合物都属于共价化合物 D.3种含铂配合物中Pt的化合价不同
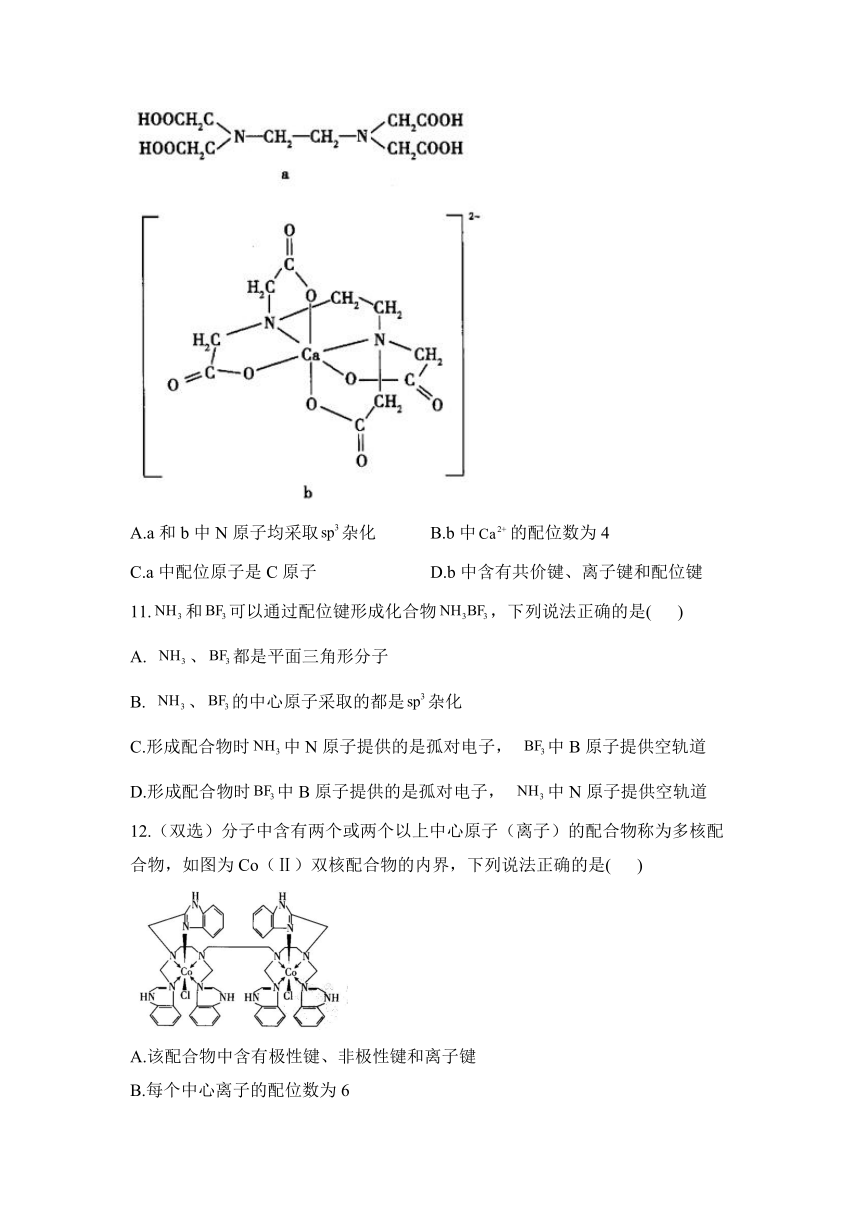
10.如图所示,a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物,b为EDTA与形成的螯合物。下列叙述正确的是( )
A.a和b中N原子均采取杂化 B.b中的配位数为4
C.a中配位原子是C原子 D.b中含有共价键、离子键和配位键
11.和可以通过配位键形成化合物,下列说法正确的是( )
A. 、都是平面三角形分子
B. 、的中心原子采取的都是杂化
C.形成配合物时中N原子提供的是孤对电子, 中B原子提供空轨道
D.形成配合物时中B原子提供的是孤对电子, 中N原子提供空轨道
12.(双选)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界,下列说法正确的是( )
A.该配合物中含有极性键、非极性键和离子键
B.每个中心离子的配位数为6
C.配合物中的C原子都是杂化
D.如图结构中所有原子不可能共平面
13.第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)基态的核外电子排布式为_______,配离子中,与形成配位键的原子是_________(填元素符号)。
(2)是一种很好的配体,氨分子是_________(填“极性”或“非极性”)分子,的沸点_________(填“高于”“等于”或“低于”)。
(3)科学家通过X射线测得胆矾的结构示意图可简单表示如下:
图中虚线表示的作用力为_________。
(4)胆矾溶液与氨水在一定条件下可以生成晶体。在晶体中,为平面正方形结构,呈正四面体结构的原子团是_________,其中心原子的杂化类型是_________。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态,该物质呈正四面体结构。易溶于_________(填序号)。
A.水
B.四氯化碳
C.苯
D.硫酸镍溶液
14.配位化合物在生产生活中有重要应用,请根据要求回答下列问题:
(1)光谱证实单质铝与强碱性溶液反应有生成,则中存在_______________(填序号)。
a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
(2)可形成两种钴的配合物,已知的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加溶液时,产生白色沉淀,在第二种配合物的溶液中加溶液时,则无明显现象。则第一种配合物的结构可表示为___________________,第二种配合物的结构可表示为______________。若在第二种配合物的溶液中滴加溶液,则产生的现象是____________。(提示:配合物的结构可表示为。)
答案以及解析
1.答案:D
解析:配体是含有孤对电子的阴离子或分子,这几种微粒的结构中都含有孤对电子,都能提供孤对电子与某些金属离子形成配合物。
2.答案:A
解析:N可看成NH3分子结合1个H+后形成的,在NH3分子中,中心原子氮原子采取sp3杂化,孤电子对占据1个轨道,3个未成键电子占据另3个杂化轨道,分别结合H原子形成3个σ键,由于孤电子对的排斥,所以NH3分子的空间结构为三角锥形,键角压缩至107°。当与H+相遇时,N原子的孤电子对会进入H+的空轨道,以配位键形成N,这样N原子就不再存在孤电子对,键角恢复至109°28',故N为正四面体形,4个N—H完全一致,N中的配位键与普通共价键形成过程不同,但性质相同。
3.答案:B
解析:许多过渡元素金属离子对多种配体具有很强的结合力,因而过渡金属配合物远比主族金属的配合物多,A项正确;配合物中中心离子与配体间是以配位键结合,配离子与酸根离子间是以离子键结合,B项错误;配合物中中心离子提供空轨道,配体提供孤对电子,C项正确;配位数指形成配离子时配体的个数,不同离子的配位数可能相同也可能不同,D项正确。
4.答案:D
解析:配离子中配体和中心离子的配位键属于键,有6个,配体5个中有15个键,共计21个键,故含有键的数目应为21,A不正确;根据电荷守恒,中心离子的化合价为+3价,B不正确;中心离子的配位数是6,C不正确;根据配合物的组成判断,1mol配合物在溶液中电离出1mol配离子和2mol氯离子,能与硝酸银发生反应生成2 mol AgCl白色沉淀,故D正确。
5.答案:C
解析:该物质的分子中存在单键、双键,则存在σ键,A项错误;该物质的分子中H、O原子间存在氢键和共价键、C与其他原子间存在共价键、Ni与N之间存在配位键,所以该物质的分子中含有氢键、共价键、配位键三种作用力,B项错误;Ni原子具有空轨道,是共用电子对的接受者,是配合物的中心原子,C项正确;C原子最外层的4个电子全部成键,没有孤对电子,D项错误。
6.答案:C
解析:铜离子和形成配位键,形成的配合物在乙醇中的溶解度降低,所以深蓝色晶体的化学式为,A正确;铜离子含有空轨道,中氮原子含有孤电子对,因此属于配离子,其中为配体,B正确;可表示为,离子空间结构为平面正方形,C错误;铜离子和水也可以形成配位键,所以五水硫酸铜可表示为,D正确。
7.答案:C
解析:配离子中的配体在溶液中很难电离,已知含0.1 mol氯化铬的水溶液用过量稀硝酸银溶液处理时,只得到0.2 mol AgCl沉淀,说明该配合物的外界有2个氯离子,则其内界只有一个氯离子,故C项正确。
8.答案:A
解析:能够与“杯酚”通过分子间作用力形成超分子,而不能,与“杯酚”形成的超分子不能溶于甲苯,但不能判断是否能溶于甲苯,故A错误;能够与“杯酚”通过分子间作用力形成超分子,故B正确;不能与“杯酚”通过分子间作用力形成超分子,故C正确;通过溶剂氯仿的作用,溶解“杯酚”而将不溶解的释放出来并沉淀,可实现将与“杯酚”分离,“杯酚”能够循环使用,故D正确。
9.答案:B
解析:氨气为碱性气体,碱性物质与反应:,实质为和外界离子氢离子反应,所以不具有很强的碱性,A项错误;配合物中,为中心离子,为配体,配位数为6,中,为中心离子,为配体,配位数为6,中,为中心离子,为配体,配位数为6,B项正确;和为共价化合物,为离子化合物,C项错误;3种配合物中Pt的化合价都为+4,D项错误。
10.答案:A
解析:A项,a中N原子有3对σ键电子对,含有1对孤对电子,b中N原子有4对σ键电子对,没有孤对电子,则a、b中N原子均采取杂化,正确;B项,b为配离子,的配位数为6,错误;C项,a不是配合物,错误;D项,b中钙离子与N、O之间形成配位键,其他原子之间形成共价键,不含离子键,错误。
11.答案:C
解析:是三角锥形分子,A项错误;中N原子的杂化轨道数=σ键数+孤对电子数=3+1=4,采取的是杂化,中B形成3个σ键,无孤对电子,B原子的杂化轨道数=σ
键数+孤对电子数=3+0=3,采取的是杂化,B项错误;中B原子有空轨道,N原子有孤对电子,所以提供孤对电子,提供空轨道,形成配位键,C项正确,D项错误。
12.答案:BD
解析:由图可知氯离子与中心离子形成配位键,所以该配合物中含有非极性共价键和极性共价键,不存在离子键,故A错误;图可知中心离子配位数为6,包括5个N原子和1个,故B正确;配合物中存在,其中C原子为杂化,故C错误;如图结构中部分C原子和全部N原子采取杂化,所以所有原子不能共平面,故D正确。
13.答案:(1);O
(2)极性;高于
(3)氢键、配位键
(4);
(5)BC
解析:(1)基态Cr原子的核外电子排布式为,则基态的核外电子排布式为;配离子中,提供空轨道,O原子提供孤电子对形成配位键,所以与形成配位键的原子是O。
(2)中正、负电中心不重合,氨分子是极性分子,分子间能形成氢键,其沸点高于。
(3)通过图像知,图中虚线表示的作用力有铜离子和水分子之间的配位键、水分子中氢原子和另一分子中氧原子之间的氢键。
(4)中S原子形成4个键,孤电子对数为,所以为正四面体结构,中心原子为杂化。
(5)正四面体是对称结构,所以是非极性分子,根据“相似相溶”规律知,易溶于非极性溶剂,苯、四氯化碳是非极性分子,所以易溶于苯、四氯化碳,故答案为BC。
14.答案:(1)acd
(2);;生成淡黄色沉淀
解析:(1)光谱证实单质Al与强碱性溶液反应有生成,可看作铝原子和三个羟基形成三对共用电子对,形成三个极性共价键,形成,溶解在强碱性溶液中,和结合形成,利用的是铝原子的空轨道和的孤对电子形成的配位键;中两个原子轨道“头碰头”相互重叠而形成的共价键,叫σ键,所以中也形成了σ键。
(2)由的结构可知,硫酸根离子为配合物的外界,在水溶液中以离子形式存在,所以会与钡离子结合生成白色沉淀,若加入溶液时无明显现象,说明硫酸根离子在内界,所以配合物的结构为;溴离子为配合物的外界,在水溶液中以离子形式存在,若加入溶液,会产生淡黄色沉淀溴化银
1.下列分子或离子中,能提供孤对电子与某些金属离子形成配位键的是( )
①H2O ②NH3 ③F- ④CN- ⑤CO
A.只有①② B.只有①②③
C.只有①②④ D.全部
2.在N中存在4个N—H共价键,则下列说法正确的是( )
A.4个共价键的键长完全相同
B.4个共价键的键长完全不同
C.原来的3个N—H的键长完全相同,但与通过配位键形成的N—H不同
D.4个N—H键长相同,但键能不同
3.下列关于配合物的说法中不正确的是( )
A.许多过渡金属离子对多种配体具有很强的结合力,因而过渡金属配合物远比主族金属配合物多
B.配合物中中心离子与配体间、配离子与酸根离子间都是以配位键结合
C.配合物中中心离子提供空轨道,配体提供孤对电子
D.中心离子所结合配体的个数称为配位数,不同离子的配位数可能不同
4.设为阿伏加德罗常数的值,关于的说法中正确的是( )
A.1mol 含有键的数目为16
B.中心原子的化合价为+2价
C.中心原子的配位数是5
D.含1mol 的溶液中加入足量溶液,产生2mol白色沉淀
5.某物质的分子结构为。下列对该物质的分析正确的是( )
A.该物质的分子中不存在σ键
B.该物质的分子中只含有共价键、配位键两种作用力
C.该物质是一种配合物,其中Ni原子为中心原子
D.该物质中C、N、O原子均存在孤对电子
6.向溶液中滴加几滴浓度为的氨水,首先形成蓝色沉淀,继续滴加氨水并振荡,沉淀溶解,得到深蓝色溶液,继续滴加8mL95%的乙醇,析出深蓝色的晶体。下列分析错误的是( )
A.深蓝色晶体的化学式为
B.属于配离子,为配体
C. 可表示为,离子空间结构一定为正四面体形
D.五水硫酸铜可表示为
7.下列关于超分子和配合物的叙述不正确的是( )
A.利用超分子的分子识别特征,可以分离和
B.配合物中只含配位键
C.中提供空轨道,中氧原子提供孤对电子,从而形成配位键
D.配合物在半导体等尖端技术、医学科学、催化反应和材料化学等领域都有广泛应用
8.利用分子间作用力形成超分子进行“分子识别”,实现分子分离,是超分子化学的重要研究和应用领域。如图表示用“杯酚”对和进行分离的过程,下列对该过程的说法错误的是( )
A.能溶于甲苯,不溶于甲苯
B.能与“杯酚”形成超分子
C.不能与“杯酚”形成超分子
D.“杯酚”能够循环使用
9.有组成不同的3种含铂配合物,分别是、和,在液氨中它们之间有如下的转化关系:,下列关于这3种含铂配合物的说法正确的是( )
A.具有很强的碱性 B.3种含铂配合物的配位数均为6
C.3种含铂配合物都属于共价化合物 D.3种含铂配合物中Pt的化合价不同
10.如图所示,a为乙二胺四乙酸(EDTA),易与金属离子形成螯合物,b为EDTA与形成的螯合物。下列叙述正确的是( )
A.a和b中N原子均采取杂化 B.b中的配位数为4
C.a中配位原子是C原子 D.b中含有共价键、离子键和配位键
11.和可以通过配位键形成化合物,下列说法正确的是( )
A. 、都是平面三角形分子
B. 、的中心原子采取的都是杂化
C.形成配合物时中N原子提供的是孤对电子, 中B原子提供空轨道
D.形成配合物时中B原子提供的是孤对电子, 中N原子提供空轨道
12.(双选)分子中含有两个或两个以上中心原子(离子)的配合物称为多核配合物,如图为Co(Ⅱ)双核配合物的内界,下列说法正确的是( )
A.该配合物中含有极性键、非极性键和离子键
B.每个中心离子的配位数为6
C.配合物中的C原子都是杂化
D.如图结构中所有原子不可能共平面
13.第四周期的Cr、Fe、Co、Ni、Cu、Zn等许多金属能形成配合物。
(1)基态的核外电子排布式为_______,配离子中,与形成配位键的原子是_________(填元素符号)。
(2)是一种很好的配体,氨分子是_________(填“极性”或“非极性”)分子,的沸点_________(填“高于”“等于”或“低于”)。
(3)科学家通过X射线测得胆矾的结构示意图可简单表示如下:
图中虚线表示的作用力为_________。
(4)胆矾溶液与氨水在一定条件下可以生成晶体。在晶体中,为平面正方形结构,呈正四面体结构的原子团是_________,其中心原子的杂化类型是_________。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态,该物质呈正四面体结构。易溶于_________(填序号)。
A.水
B.四氯化碳
C.苯
D.硫酸镍溶液
14.配位化合物在生产生活中有重要应用,请根据要求回答下列问题:
(1)光谱证实单质铝与强碱性溶液反应有生成,则中存在_______________(填序号)。
a.共价键 b.非极性键 c.配位键 d.σ键 e.π键
(2)可形成两种钴的配合物,已知的配位数是6,为确定钴的配合物的结构,现对两种配合物进行了如下实验:在第一种配合物的溶液中加溶液时,产生白色沉淀,在第二种配合物的溶液中加溶液时,则无明显现象。则第一种配合物的结构可表示为___________________,第二种配合物的结构可表示为______________。若在第二种配合物的溶液中滴加溶液,则产生的现象是____________。(提示:配合物的结构可表示为。)
答案以及解析
1.答案:D
解析:配体是含有孤对电子的阴离子或分子,这几种微粒的结构中都含有孤对电子,都能提供孤对电子与某些金属离子形成配合物。
2.答案:A
解析:N可看成NH3分子结合1个H+后形成的,在NH3分子中,中心原子氮原子采取sp3杂化,孤电子对占据1个轨道,3个未成键电子占据另3个杂化轨道,分别结合H原子形成3个σ键,由于孤电子对的排斥,所以NH3分子的空间结构为三角锥形,键角压缩至107°。当与H+相遇时,N原子的孤电子对会进入H+的空轨道,以配位键形成N,这样N原子就不再存在孤电子对,键角恢复至109°28',故N为正四面体形,4个N—H完全一致,N中的配位键与普通共价键形成过程不同,但性质相同。
3.答案:B
解析:许多过渡元素金属离子对多种配体具有很强的结合力,因而过渡金属配合物远比主族金属的配合物多,A项正确;配合物中中心离子与配体间是以配位键结合,配离子与酸根离子间是以离子键结合,B项错误;配合物中中心离子提供空轨道,配体提供孤对电子,C项正确;配位数指形成配离子时配体的个数,不同离子的配位数可能相同也可能不同,D项正确。
4.答案:D
解析:配离子中配体和中心离子的配位键属于键,有6个,配体5个中有15个键,共计21个键,故含有键的数目应为21,A不正确;根据电荷守恒,中心离子的化合价为+3价,B不正确;中心离子的配位数是6,C不正确;根据配合物的组成判断,1mol配合物在溶液中电离出1mol配离子和2mol氯离子,能与硝酸银发生反应生成2 mol AgCl白色沉淀,故D正确。
5.答案:C
解析:该物质的分子中存在单键、双键,则存在σ键,A项错误;该物质的分子中H、O原子间存在氢键和共价键、C与其他原子间存在共价键、Ni与N之间存在配位键,所以该物质的分子中含有氢键、共价键、配位键三种作用力,B项错误;Ni原子具有空轨道,是共用电子对的接受者,是配合物的中心原子,C项正确;C原子最外层的4个电子全部成键,没有孤对电子,D项错误。
6.答案:C
解析:铜离子和形成配位键,形成的配合物在乙醇中的溶解度降低,所以深蓝色晶体的化学式为,A正确;铜离子含有空轨道,中氮原子含有孤电子对,因此属于配离子,其中为配体,B正确;可表示为,离子空间结构为平面正方形,C错误;铜离子和水也可以形成配位键,所以五水硫酸铜可表示为,D正确。
7.答案:C
解析:配离子中的配体在溶液中很难电离,已知含0.1 mol氯化铬的水溶液用过量稀硝酸银溶液处理时,只得到0.2 mol AgCl沉淀,说明该配合物的外界有2个氯离子,则其内界只有一个氯离子,故C项正确。
8.答案:A
解析:能够与“杯酚”通过分子间作用力形成超分子,而不能,与“杯酚”形成的超分子不能溶于甲苯,但不能判断是否能溶于甲苯,故A错误;能够与“杯酚”通过分子间作用力形成超分子,故B正确;不能与“杯酚”通过分子间作用力形成超分子,故C正确;通过溶剂氯仿的作用,溶解“杯酚”而将不溶解的释放出来并沉淀,可实现将与“杯酚”分离,“杯酚”能够循环使用,故D正确。
9.答案:B
解析:氨气为碱性气体,碱性物质与反应:,实质为和外界离子氢离子反应,所以不具有很强的碱性,A项错误;配合物中,为中心离子,为配体,配位数为6,中,为中心离子,为配体,配位数为6,中,为中心离子,为配体,配位数为6,B项正确;和为共价化合物,为离子化合物,C项错误;3种配合物中Pt的化合价都为+4,D项错误。
10.答案:A
解析:A项,a中N原子有3对σ键电子对,含有1对孤对电子,b中N原子有4对σ键电子对,没有孤对电子,则a、b中N原子均采取杂化,正确;B项,b为配离子,的配位数为6,错误;C项,a不是配合物,错误;D项,b中钙离子与N、O之间形成配位键,其他原子之间形成共价键,不含离子键,错误。
11.答案:C
解析:是三角锥形分子,A项错误;中N原子的杂化轨道数=σ键数+孤对电子数=3+1=4,采取的是杂化,中B形成3个σ键,无孤对电子,B原子的杂化轨道数=σ
键数+孤对电子数=3+0=3,采取的是杂化,B项错误;中B原子有空轨道,N原子有孤对电子,所以提供孤对电子,提供空轨道,形成配位键,C项正确,D项错误。
12.答案:BD
解析:由图可知氯离子与中心离子形成配位键,所以该配合物中含有非极性共价键和极性共价键,不存在离子键,故A错误;图可知中心离子配位数为6,包括5个N原子和1个,故B正确;配合物中存在,其中C原子为杂化,故C错误;如图结构中部分C原子和全部N原子采取杂化,所以所有原子不能共平面,故D正确。
13.答案:(1);O
(2)极性;高于
(3)氢键、配位键
(4);
(5)BC
解析:(1)基态Cr原子的核外电子排布式为,则基态的核外电子排布式为;配离子中,提供空轨道,O原子提供孤电子对形成配位键,所以与形成配位键的原子是O。
(2)中正、负电中心不重合,氨分子是极性分子,分子间能形成氢键,其沸点高于。
(3)通过图像知,图中虚线表示的作用力有铜离子和水分子之间的配位键、水分子中氢原子和另一分子中氧原子之间的氢键。
(4)中S原子形成4个键,孤电子对数为,所以为正四面体结构,中心原子为杂化。
(5)正四面体是对称结构,所以是非极性分子,根据“相似相溶”规律知,易溶于非极性溶剂,苯、四氯化碳是非极性分子,所以易溶于苯、四氯化碳,故答案为BC。
14.答案:(1)acd
(2);;生成淡黄色沉淀
解析:(1)光谱证实单质Al与强碱性溶液反应有生成,可看作铝原子和三个羟基形成三对共用电子对,形成三个极性共价键,形成,溶解在强碱性溶液中,和结合形成,利用的是铝原子的空轨道和的孤对电子形成的配位键;中两个原子轨道“头碰头”相互重叠而形成的共价键,叫σ键,所以中也形成了σ键。
(2)由的结构可知,硫酸根离子为配合物的外界,在水溶液中以离子形式存在,所以会与钡离子结合生成白色沉淀,若加入溶液时无明显现象,说明硫酸根离子在内界,所以配合物的结构为;溴离子为配合物的外界,在水溶液中以离子形式存在,若加入溶液,会产生淡黄色沉淀溴化银
