3.3.1 金属晶体与离子晶体(含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.3.1 金属晶体与离子晶体(含解析)2023-2024学年高二上学期化学人教版(2019)选择性必修2 |  | |
| 格式 | docx | ||
| 文件大小 | 395.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-15 21:28:19 | ||
图片预览




文档简介
3.3.1 金属晶体与离子晶体——高二化学人教版(2019)选修二课时优化训练
1.金属晶体和离子晶体是重要的晶体类型。下列说法正确的是( )
A.金属晶体和离子晶体都能导电
B.在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用
C.金属晶体和离子晶体都可采取“紧密堆积”的方式
D.金属晶体和离子晶体中分别存在金属键和离子键等强烈的相互作用,很难断裂,因而都具有延展性
2.在金属晶体中,自由电子与金属原子碰撞时有能量传递,可以用此来解释金属的( )
A.延展性 B.导电性
C.导热性 D.还原性
3.只有阳离子而没有阴离子的晶体是( )
A.金属晶体 B.共价晶体
C.分子晶体 D.无法判断
4.下列说法不正确的是( )
A.中离子键的百分数为62%,则不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体
B.通常当作离子晶体来处理,因为是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近
C.是偏向离子晶体的过渡晶体,当作离子晶体来处理;是偏向共价晶体的过渡晶体,当作共价晶体来处理
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
5.根据下列晶体的相关性质,判断可能属于金属晶体的是( )
选项 晶体的相关性质
A 由分子间作用力结合而成,熔点低
B 固态或熔融态时易导电,熔点在1 000 ℃ 左右
C 由共价键结合成空间网状结构,熔点高
D 固体不导电,但溶于水或熔融后能导电
A.A B.B C.C D.D
6.下列有关石墨晶体的说法正确的是( )
①石墨层内作用力为共价键,层间靠范德华力维系
②石墨是混合型晶体
③石墨中的C为杂化
④石墨的熔、沸点都比金刚石的低
⑤石墨中碳原子个数和C—C键个数之比为1︰2
⑥石墨和金刚石的硬度相同
⑦石墨的导电性只能沿石墨平面的方向
A.全部 B.①②③⑦ C.仅②③⑦ D.①②⑤⑦
7.下列关于金属晶体的说法正确的是( )
A.用铂金做首饰不能用金属键理论解释 B.不同金属晶体中金属键的强度不同
C.Li、Na、K的熔点逐渐升高 D.金属导电和熔融电解质导电的原理一样
8.为了确定、、是否为离子化合物,可进行下列实验,其中合理的是( )
A.观察常温下的状态,是苍黄色液体,为无色液体。结论:和都是离子化合物
B.测定、、的熔点依次为73.5 ℃、2.8 ℃、-33 ℃。结论:、、都不是离子化合物
C.将、、分别溶解于水中,分别滴入用酸化的溶液,均产生白色沉淀。结论:、、都是离子化合物
D.测定、、的水溶液的导电性,发现它们都可以导电。结论:、、都是离子化合物
9.下图是金属晶体内部电子气理论图。电子气理论可以用来解释金属的某些性质,下列说法正确的是( )
A.金属能导电是因为金属阳离子在外加电场作用下定向移动
B.金属能导热是因为自由电子在热的作用下相互碰撞,从而发生热的传导
C.金属具有良好的延展性是因为在外力的作用下,金属晶体各原子层会发生相对滑动,但不会改变原来的排列方式,而且自由电子可以起到类似轴承中滚珠之间润滑剂的作用
D.合金与纯金属相比,由于增加了不同的金属或非金属,使电子数目增多,所以合金的延展性比纯金属强、硬度比纯金属小
10.如图为NaCl和CsCl的晶胞结构,下列说法错误的是( )
A.NaCl和CsCl都属于AB型离子晶体
B.NaCl和CsCl晶体中阴、阳离子个数比相同
C.NaCl和CsCl每个晶胞中所含阳离子数分别为4和1
D.NaCl和CsCl晶体中阳离子与阴离子的半径比相同
11.北京大学和中国科学院的化学工作者成功研制出碱金属与形成的球碳盐实验测知该物质属于离子晶体,具有良好的超导性。下列关于的组成和结构的分析中正确的是( )
A.晶体中既有离子键又有极性键 B.晶体的熔点比晶体的熔点低
C.该晶体熔化时能导电 D.分子中碳原子采取杂化
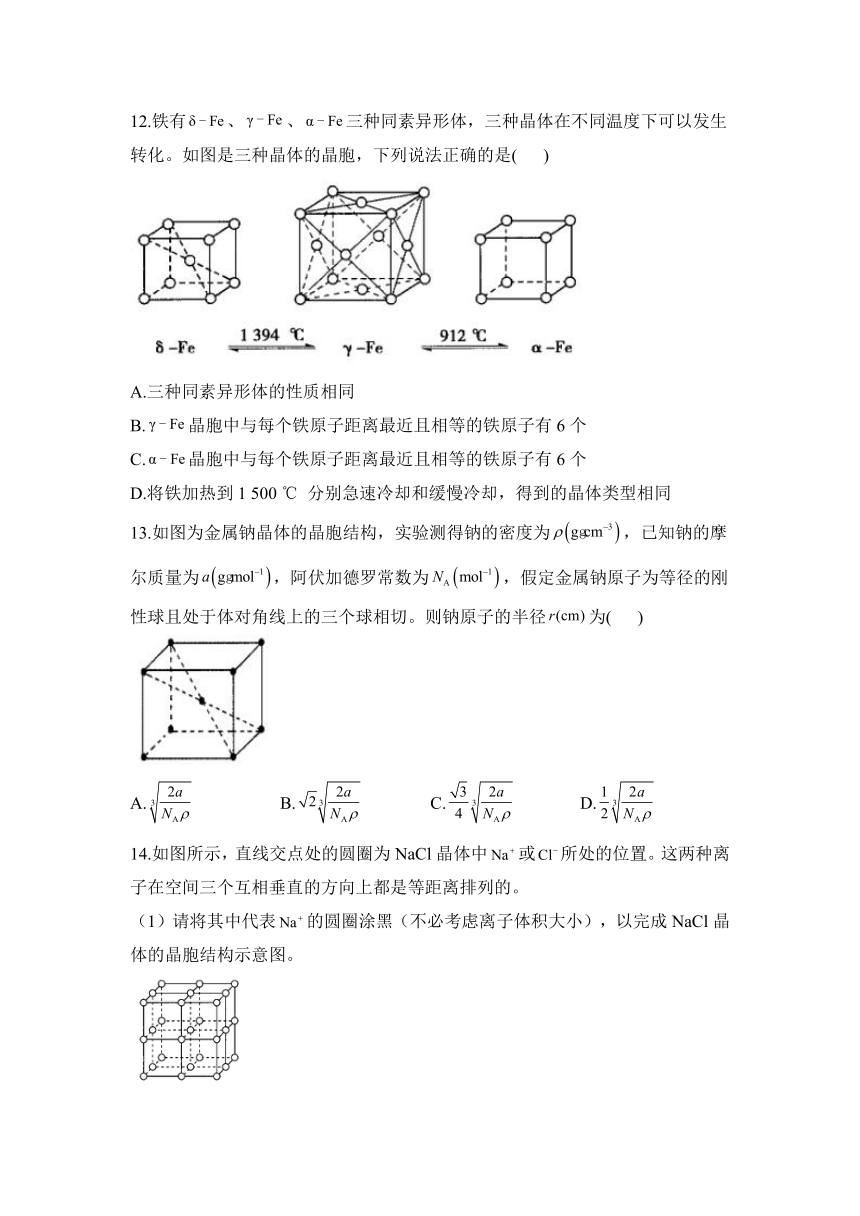
12.铁有、、三种同素异形体,三种晶体在不同温度下可以发生转化。如图是三种晶体的晶胞,下列说法正确的是( )
A.三种同素异形体的性质相同
B.晶胞中与每个铁原子距离最近且相等的铁原子有6个
C.晶胞中与每个铁原子距离最近且相等的铁原子有6个
D.将铁加热到1 500 ℃ 分别急速冷却和缓慢冷却,得到的晶体类型相同
13.如图为金属钠晶体的晶胞结构,实验测得钠的密度为,已知钠的摩尔质量为,阿伏加德罗常数为,假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切。则钠原子的半径为( )
A. B. C. D.
14.如图所示,直线交点处的圆圈为NaCl晶体中或所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)请将其中代表的圆圈涂黑(不必考虑离子体积大小),以完成NaCl晶体的晶胞结构示意图。
(2)晶体中,在每个的周围与它最近且距离相等的共有________个。
(3)在NaCl晶胞的顶点上、面上、棱上的或为该晶胞和与其相邻的晶胞所共有,一个晶胞中的个数等于________,即________(填计算式);的个数等于________,即________(填计算式)。
(4)设NaCl的摩尔质量为,食盐晶体的密度为,阿伏加德罗常数的值为。则食盐晶体中两个距离最近的钠离子中心间的距离为______cm。
15.现有原子序数依次递增且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,Y原子在基态时其最外层电子数是其内层电子数的2倍,Q原子在基态时其2p能级上有2个未成对电子,W元素的原子中3d能级上有4个未成对电子。回答下列问题:
(1)化合物的沸点比化合物的高,其主要原因是______________。
(2)元素W能形成多种配合物,如:等。
①基态的M层电子排布式为______________。
②在常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断晶体属于__________________(填晶体类型)晶体,该晶体中W的化合价为________________。
(3)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图所示,与一个阴离子距离最近且相等的所有阳离子为顶点构成的几何体为_________________。已知该晶体的密度为,阿伏加德罗常数的值为,则晶胞边长为______________cm。(用含的代数式表示)
16.过渡金属钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态Ti原子价层电子排布式为__________。
②Fe元素在元素周期表中的位置是__________。
(2)制备的反应为。
①上述化学方程式中非金属元素电负性由小到大的顺序为__________(用元素符号表示)。
②分子中所有原子均满足8电子稳定结构,分子中键和键的个数比为__________,中心原子的杂化方式为__________。
(3)Ni和La的合金是目前广泛使用的储氢材料,具有容量大、寿命高、耐低温等特点,在我国已实现了产业化。该合金的晶胞结构如图所示。
①该晶体的化学式为_________。
②已知该晶体的摩尔质量为,密度为。设为阿伏加德罗常数的值,则该晶胞的体积为________(用含的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:;标准状况下氢气的密度为;储氢能力=。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_________(结果保留整数)。
答案以及解析
1.答案:C
解析:离子晶体固态时不导电,如氯化钠固体不导电,故A错误;金属晶体中有“电子气”,能导电,金属晶体中的“电子气”属于整个晶体,不属于哪一个离子,故B错误;金属晶体和离子晶体都可采取“紧密堆积”的方式,共价晶体可采取“非紧密堆积”的方式,故C正确;离子晶体没有延展性,易断裂,故D错误。
2.答案:C
解析:金属具有延展性主要是因为金属在受到外力作用时,原子之间可以发生相对滑动,各层之间仍保持金属键的作用,A项错误;金属具有导电性主要是因为金属晶体内部存在自由移动的电子,在外加电场的作用下,自由电子在金属内部发生定向移动,B项错误;金属具有导热性主要是因为在金属晶体内部,自由电子与金属原子碰撞时有能量传递,C项正确;金属的还原性是金属的化学性质,与碰撞时能量传递无关,D项错误。
3.答案:A
解析:分子晶体和共价晶体中不存在离子,所以B、C两项不符合题意;金属晶体的构成微粒是金属阳离子和自由电子,没有阴离子,因此A项符合题意。
4.答案:C
解析:、均是偏向共价晶体的过渡晶体,当作共价晶体来处理,C项不正确。
5.答案:B
解析:A项,由分子间作用力结合而成的晶体属于分子晶体,错误。B项,金属晶体中有自由移动的电子,能导电,绝大多数金属在常温下为固体,熔点较高,所以固态或熔融态时易导电,熔点在1 000 ℃ 左右的晶体可能属于金属晶体,正确。C项,相邻原子之间通过共价键结合形成的空间网状结构的晶体属于共价晶体,错误。D项,固体不导电,说明晶体中无自由移动的带电微粒,则不可能为金属晶体,错误。
6.答案:B
解析:石墨的熔点比金刚石的高,④不正确;石墨中碳原子个数和C—C键个数之比为2︰3,⑤不正确;石墨质软,金刚石的硬度大,⑥不正确。综上所述,B项符合题意。
7.答案:B
解析:A项,用铂金做首饰,主要是因为铂金具有金属光泽,金属具有光泽是因为金属中的自由电子能够吸收可见光,可用金属键理论解释,错误。C项,碱金属元素原子的半径越大,金属键越弱,则其单质的熔、沸点越低,故熔点:Li>Na>K,错误。D项,金属导电依靠的是自由移动的电子,熔融电解质导电依靠的是自由移动的离子,二者导电原理不一样,错误。
8.答案:B
解析:离子化合物的熔、沸点较高,熔融态时可导电;某些分子晶体溶于水后也可以发生电离而导电,如HCl晶体等;HCl溶于水电离产生,也能与酸化的溶液反应产生白色沉淀,A、C、D项都不合理。
9.答案:C
解析:金属能导电是因为自由电子在外加电场作用下能定向移动,A项错误;金属能导热是因为自由电子在热的作用下与金属原子碰撞,从而发生热的传导,B项错误;合金与纯金属相比,由于增加了不同的金属或非金属,相当于填补了金属阳离子之间的空隙,所以一般情况下合金的延展性比纯金属弱、硬度比纯金属大,D项错误。
10.答案:D
解析:NaCl和CsCl都是由阴、阳离子通过离子键构成的晶体,阴、阳离子个数比都为1:1,均属于AB型离子晶体,A正确;由晶胞结构可知每个氯化钠晶胞中所含钠离子数和氯离子数均为4,每个氯化铯晶胞中所含铯离子数和氯离子数均为1,阴、阳离子个数比均为1:1,B正确;每个NaCl晶胞中所含数为,每个CsCl晶胞中所含数为1,C正确;钠离子半径小于铯离子半径,则阳离子与阴离子的半径比不同,D错误。
11.答案:C
解析:晶体中有和,故有离子键和共价键,但共价键均存在于同种元素C和C之间,为非极性键,A错误;晶体为离子晶体,而是分子晶体,离子晶体的熔点比分子晶体的熔点高,B错误;晶体中有和,该晶体熔化时能电离出自由移动的离子,故能导电,C正确;分子中每个碳原子只与周围的3个碳原子相连,分子中碳原子采取杂化,故D错误。
12.答案:C
解析:由于三种同素异形体的结构不同,所以三者的性质不同,A项错误;晶胞中与每个铁原子距离最近且相等的铁原子数为12,B项错误;晶胞中与每个铁原子距离最近且相等的铁原子数为6,C项正确;将铁加热到1 500 ℃ 分别急速冷却和缓慢冷却,会得到晶体类型不相同的铁,D项错误。
13.答案:C
解析:因为金属钠晶体采取体心立方堆积,所以在晶胞中含有钠原子数为,设晶胞边长为x,根据得,,,则晶胞的体对角线长度为,所以钠原子半径,答案为C。
14.答案:(1)如图所示(答案不唯一,合理即可)
(2)12
(3)4;;4;[答案不唯一,只要与第(1)问对应即可]
(4)
解析:(2)从NaCl晶胞结构可以看出,与顶点最近且距离相等的在面心,每个晶胞中有3个面心上的与顶点最近且等距,而每个顶点为8个晶胞共有,每个面心为2个晶胞共有,则与顶点最近且等距的面心共有个。
(3)根据离子晶体的晶胞,求阴、阳离子个数比的方法是均摊法。如(1)中所得NaCl晶胞中,含个数为,含个数为。
(4)设与的最近距离为,则两个最近的间的距离为,根据可得,即,所以两个间的最近距离为。
15.答案:(1)分子间存在氢键
(2);分子;0
(3)立方体;
解析:原子序数依次递增且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,则X是H元素;Y原子在基态时其最外层电子数是其内层电子数的2倍,则Y是C元素;Q原子在基态时其2p能级上有2个未成对电子,原子序数大于碳,则Q为O元素;Z的原子序数介于碳、氧之间,则Z为N元素;W元素的原子中3d能级上有4个未成对电子,价电子排布为,则W为Fe元素。
(1)化合物是,在氨分子之间除了存在范德华力外还存在氢键,使其沸点比分子间只有范德华力的化合物高。
(2)①Fe原子的核外电子排布为,失去4s能级上2个电子、3d能级上1个电子形成,基态的M层电子排布式为。②在常温下呈液态,熔、沸点较低,易溶于非极性溶剂,据此可判断晶体属于分子晶体,在化合物中所有元素正负化合价的代数和为0。
(3)晶胞中白色球数目为8,黑色球数目为,则白色球为钠离子、黑色球为氧离子,与一个氧离子距离最近且相等的钠离子有8个,形成立方体结构;在一个晶胞中含的个数是8,含有的个数是4,设晶胞边长为,则,整理可得。
16.答案:(1)①②第四周期第Ⅷ族
(2)①C(3)①②③1236
解析:(1)①Ti是22号元素,位于元素周期表中第四周期第ⅣB族,故基态Ti原子的价层电子排布为。②Fe是26号元素,位于元素周期表的第四周期第Ⅷ族。
(2)①方程式中涉及的非金属元素有三种:,中C元素显+4价、Cl元素显-1价,中Cl元素显+1价,O元素显-2价,电负性越大,对键合电子的吸引力越大,相互化合时该元素表现负价,故电负性:C(3)①根据该合金的晶胞图可知,晶胞中心有1个镍原子,其他8个镍原子位于晶胞面上,镧原子位于晶胞顶点,所以晶胞中含有的镍原子数为,晶胞中含有的镧原子数为,故晶体的化学式为。②一个晶胞的质量,根据,可得。③合金储氢后氢的密度,由定义式可知储氢能力
1.金属晶体和离子晶体是重要的晶体类型。下列说法正确的是( )
A.金属晶体和离子晶体都能导电
B.在镁晶体中,1个Mg2+只与2个价电子存在强烈的相互作用
C.金属晶体和离子晶体都可采取“紧密堆积”的方式
D.金属晶体和离子晶体中分别存在金属键和离子键等强烈的相互作用,很难断裂,因而都具有延展性
2.在金属晶体中,自由电子与金属原子碰撞时有能量传递,可以用此来解释金属的( )
A.延展性 B.导电性
C.导热性 D.还原性
3.只有阳离子而没有阴离子的晶体是( )
A.金属晶体 B.共价晶体
C.分子晶体 D.无法判断
4.下列说法不正确的是( )
A.中离子键的百分数为62%,则不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体
B.通常当作离子晶体来处理,因为是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近
C.是偏向离子晶体的过渡晶体,当作离子晶体来处理;是偏向共价晶体的过渡晶体,当作共价晶体来处理
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
5.根据下列晶体的相关性质,判断可能属于金属晶体的是( )
选项 晶体的相关性质
A 由分子间作用力结合而成,熔点低
B 固态或熔融态时易导电,熔点在1 000 ℃ 左右
C 由共价键结合成空间网状结构,熔点高
D 固体不导电,但溶于水或熔融后能导电
A.A B.B C.C D.D
6.下列有关石墨晶体的说法正确的是( )
①石墨层内作用力为共价键,层间靠范德华力维系
②石墨是混合型晶体
③石墨中的C为杂化
④石墨的熔、沸点都比金刚石的低
⑤石墨中碳原子个数和C—C键个数之比为1︰2
⑥石墨和金刚石的硬度相同
⑦石墨的导电性只能沿石墨平面的方向
A.全部 B.①②③⑦ C.仅②③⑦ D.①②⑤⑦
7.下列关于金属晶体的说法正确的是( )
A.用铂金做首饰不能用金属键理论解释 B.不同金属晶体中金属键的强度不同
C.Li、Na、K的熔点逐渐升高 D.金属导电和熔融电解质导电的原理一样
8.为了确定、、是否为离子化合物,可进行下列实验,其中合理的是( )
A.观察常温下的状态,是苍黄色液体,为无色液体。结论:和都是离子化合物
B.测定、、的熔点依次为73.5 ℃、2.8 ℃、-33 ℃。结论:、、都不是离子化合物
C.将、、分别溶解于水中,分别滴入用酸化的溶液,均产生白色沉淀。结论:、、都是离子化合物
D.测定、、的水溶液的导电性,发现它们都可以导电。结论:、、都是离子化合物
9.下图是金属晶体内部电子气理论图。电子气理论可以用来解释金属的某些性质,下列说法正确的是( )
A.金属能导电是因为金属阳离子在外加电场作用下定向移动
B.金属能导热是因为自由电子在热的作用下相互碰撞,从而发生热的传导
C.金属具有良好的延展性是因为在外力的作用下,金属晶体各原子层会发生相对滑动,但不会改变原来的排列方式,而且自由电子可以起到类似轴承中滚珠之间润滑剂的作用
D.合金与纯金属相比,由于增加了不同的金属或非金属,使电子数目增多,所以合金的延展性比纯金属强、硬度比纯金属小
10.如图为NaCl和CsCl的晶胞结构,下列说法错误的是( )
A.NaCl和CsCl都属于AB型离子晶体
B.NaCl和CsCl晶体中阴、阳离子个数比相同
C.NaCl和CsCl每个晶胞中所含阳离子数分别为4和1
D.NaCl和CsCl晶体中阳离子与阴离子的半径比相同
11.北京大学和中国科学院的化学工作者成功研制出碱金属与形成的球碳盐实验测知该物质属于离子晶体,具有良好的超导性。下列关于的组成和结构的分析中正确的是( )
A.晶体中既有离子键又有极性键 B.晶体的熔点比晶体的熔点低
C.该晶体熔化时能导电 D.分子中碳原子采取杂化
12.铁有、、三种同素异形体,三种晶体在不同温度下可以发生转化。如图是三种晶体的晶胞,下列说法正确的是( )
A.三种同素异形体的性质相同
B.晶胞中与每个铁原子距离最近且相等的铁原子有6个
C.晶胞中与每个铁原子距离最近且相等的铁原子有6个
D.将铁加热到1 500 ℃ 分别急速冷却和缓慢冷却,得到的晶体类型相同
13.如图为金属钠晶体的晶胞结构,实验测得钠的密度为,已知钠的摩尔质量为,阿伏加德罗常数为,假定金属钠原子为等径的刚性球且处于体对角线上的三个球相切。则钠原子的半径为( )
A. B. C. D.
14.如图所示,直线交点处的圆圈为NaCl晶体中或所处的位置。这两种离子在空间三个互相垂直的方向上都是等距离排列的。
(1)请将其中代表的圆圈涂黑(不必考虑离子体积大小),以完成NaCl晶体的晶胞结构示意图。
(2)晶体中,在每个的周围与它最近且距离相等的共有________个。
(3)在NaCl晶胞的顶点上、面上、棱上的或为该晶胞和与其相邻的晶胞所共有,一个晶胞中的个数等于________,即________(填计算式);的个数等于________,即________(填计算式)。
(4)设NaCl的摩尔质量为,食盐晶体的密度为,阿伏加德罗常数的值为。则食盐晶体中两个距离最近的钠离子中心间的距离为______cm。
15.现有原子序数依次递增且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,Y原子在基态时其最外层电子数是其内层电子数的2倍,Q原子在基态时其2p能级上有2个未成对电子,W元素的原子中3d能级上有4个未成对电子。回答下列问题:
(1)化合物的沸点比化合物的高,其主要原因是______________。
(2)元素W能形成多种配合物,如:等。
①基态的M层电子排布式为______________。
②在常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断晶体属于__________________(填晶体类型)晶体,该晶体中W的化合价为________________。
(3)Q和Na形成的一种只含有离子键的离子化合物的晶胞结构如图所示,与一个阴离子距离最近且相等的所有阳离子为顶点构成的几何体为_________________。已知该晶体的密度为,阿伏加德罗常数的值为,则晶胞边长为______________cm。(用含的代数式表示)
16.过渡金属钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金具有放氢温度低、价格适中等优点,是钛系储氢合金的代表。
①基态Ti原子价层电子排布式为__________。
②Fe元素在元素周期表中的位置是__________。
(2)制备的反应为。
①上述化学方程式中非金属元素电负性由小到大的顺序为__________(用元素符号表示)。
②分子中所有原子均满足8电子稳定结构,分子中键和键的个数比为__________,中心原子的杂化方式为__________。
(3)Ni和La的合金是目前广泛使用的储氢材料,具有容量大、寿命高、耐低温等特点,在我国已实现了产业化。该合金的晶胞结构如图所示。
①该晶体的化学式为_________。
②已知该晶体的摩尔质量为,密度为。设为阿伏加德罗常数的值,则该晶胞的体积为________(用含的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:;标准状况下氢气的密度为;储氢能力=。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为_________(结果保留整数)。
答案以及解析
1.答案:C
解析:离子晶体固态时不导电,如氯化钠固体不导电,故A错误;金属晶体中有“电子气”,能导电,金属晶体中的“电子气”属于整个晶体,不属于哪一个离子,故B错误;金属晶体和离子晶体都可采取“紧密堆积”的方式,共价晶体可采取“非紧密堆积”的方式,故C正确;离子晶体没有延展性,易断裂,故D错误。
2.答案:C
解析:金属具有延展性主要是因为金属在受到外力作用时,原子之间可以发生相对滑动,各层之间仍保持金属键的作用,A项错误;金属具有导电性主要是因为金属晶体内部存在自由移动的电子,在外加电场的作用下,自由电子在金属内部发生定向移动,B项错误;金属具有导热性主要是因为在金属晶体内部,自由电子与金属原子碰撞时有能量传递,C项正确;金属的还原性是金属的化学性质,与碰撞时能量传递无关,D项错误。
3.答案:A
解析:分子晶体和共价晶体中不存在离子,所以B、C两项不符合题意;金属晶体的构成微粒是金属阳离子和自由电子,没有阴离子,因此A项符合题意。
4.答案:C
解析:、均是偏向共价晶体的过渡晶体,当作共价晶体来处理,C项不正确。
5.答案:B
解析:A项,由分子间作用力结合而成的晶体属于分子晶体,错误。B项,金属晶体中有自由移动的电子,能导电,绝大多数金属在常温下为固体,熔点较高,所以固态或熔融态时易导电,熔点在1 000 ℃ 左右的晶体可能属于金属晶体,正确。C项,相邻原子之间通过共价键结合形成的空间网状结构的晶体属于共价晶体,错误。D项,固体不导电,说明晶体中无自由移动的带电微粒,则不可能为金属晶体,错误。
6.答案:B
解析:石墨的熔点比金刚石的高,④不正确;石墨中碳原子个数和C—C键个数之比为2︰3,⑤不正确;石墨质软,金刚石的硬度大,⑥不正确。综上所述,B项符合题意。
7.答案:B
解析:A项,用铂金做首饰,主要是因为铂金具有金属光泽,金属具有光泽是因为金属中的自由电子能够吸收可见光,可用金属键理论解释,错误。C项,碱金属元素原子的半径越大,金属键越弱,则其单质的熔、沸点越低,故熔点:Li>Na>K,错误。D项,金属导电依靠的是自由移动的电子,熔融电解质导电依靠的是自由移动的离子,二者导电原理不一样,错误。
8.答案:B
解析:离子化合物的熔、沸点较高,熔融态时可导电;某些分子晶体溶于水后也可以发生电离而导电,如HCl晶体等;HCl溶于水电离产生,也能与酸化的溶液反应产生白色沉淀,A、C、D项都不合理。
9.答案:C
解析:金属能导电是因为自由电子在外加电场作用下能定向移动,A项错误;金属能导热是因为自由电子在热的作用下与金属原子碰撞,从而发生热的传导,B项错误;合金与纯金属相比,由于增加了不同的金属或非金属,相当于填补了金属阳离子之间的空隙,所以一般情况下合金的延展性比纯金属弱、硬度比纯金属大,D项错误。
10.答案:D
解析:NaCl和CsCl都是由阴、阳离子通过离子键构成的晶体,阴、阳离子个数比都为1:1,均属于AB型离子晶体,A正确;由晶胞结构可知每个氯化钠晶胞中所含钠离子数和氯离子数均为4,每个氯化铯晶胞中所含铯离子数和氯离子数均为1,阴、阳离子个数比均为1:1,B正确;每个NaCl晶胞中所含数为,每个CsCl晶胞中所含数为1,C正确;钠离子半径小于铯离子半径,则阳离子与阴离子的半径比不同,D错误。
11.答案:C
解析:晶体中有和,故有离子键和共价键,但共价键均存在于同种元素C和C之间,为非极性键,A错误;晶体为离子晶体,而是分子晶体,离子晶体的熔点比分子晶体的熔点高,B错误;晶体中有和,该晶体熔化时能电离出自由移动的离子,故能导电,C正确;分子中每个碳原子只与周围的3个碳原子相连,分子中碳原子采取杂化,故D错误。
12.答案:C
解析:由于三种同素异形体的结构不同,所以三者的性质不同,A项错误;晶胞中与每个铁原子距离最近且相等的铁原子数为12,B项错误;晶胞中与每个铁原子距离最近且相等的铁原子数为6,C项正确;将铁加热到1 500 ℃ 分别急速冷却和缓慢冷却,会得到晶体类型不相同的铁,D项错误。
13.答案:C
解析:因为金属钠晶体采取体心立方堆积,所以在晶胞中含有钠原子数为,设晶胞边长为x,根据得,,,则晶胞的体对角线长度为,所以钠原子半径,答案为C。
14.答案:(1)如图所示(答案不唯一,合理即可)
(2)12
(3)4;;4;[答案不唯一,只要与第(1)问对应即可]
(4)
解析:(2)从NaCl晶胞结构可以看出,与顶点最近且距离相等的在面心,每个晶胞中有3个面心上的与顶点最近且等距,而每个顶点为8个晶胞共有,每个面心为2个晶胞共有,则与顶点最近且等距的面心共有个。
(3)根据离子晶体的晶胞,求阴、阳离子个数比的方法是均摊法。如(1)中所得NaCl晶胞中,含个数为,含个数为。
(4)设与的最近距离为,则两个最近的间的距离为,根据可得,即,所以两个间的最近距离为。
15.答案:(1)分子间存在氢键
(2);分子;0
(3)立方体;
解析:原子序数依次递增且都小于36的X、Y、Z、Q、W五种元素,其中X是原子半径最小的元素,则X是H元素;Y原子在基态时其最外层电子数是其内层电子数的2倍,则Y是C元素;Q原子在基态时其2p能级上有2个未成对电子,原子序数大于碳,则Q为O元素;Z的原子序数介于碳、氧之间,则Z为N元素;W元素的原子中3d能级上有4个未成对电子,价电子排布为,则W为Fe元素。
(1)化合物是,在氨分子之间除了存在范德华力外还存在氢键,使其沸点比分子间只有范德华力的化合物高。
(2)①Fe原子的核外电子排布为,失去4s能级上2个电子、3d能级上1个电子形成,基态的M层电子排布式为。②在常温下呈液态,熔、沸点较低,易溶于非极性溶剂,据此可判断晶体属于分子晶体,在化合物中所有元素正负化合价的代数和为0。
(3)晶胞中白色球数目为8,黑色球数目为,则白色球为钠离子、黑色球为氧离子,与一个氧离子距离最近且相等的钠离子有8个,形成立方体结构;在一个晶胞中含的个数是8,含有的个数是4,设晶胞边长为,则,整理可得。
16.答案:(1)①②第四周期第Ⅷ族
(2)①C
解析:(1)①Ti是22号元素,位于元素周期表中第四周期第ⅣB族,故基态Ti原子的价层电子排布为。②Fe是26号元素,位于元素周期表的第四周期第Ⅷ族。
(2)①方程式中涉及的非金属元素有三种:,中C元素显+4价、Cl元素显-1价,中Cl元素显+1价,O元素显-2价,电负性越大,对键合电子的吸引力越大,相互化合时该元素表现负价,故电负性:C
