化学人教版(2019)选择性必修2 1.1.1能层与能级、基态与激发态、原子光谱 课件(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 1.1.1能层与能级、基态与激发态、原子光谱 课件(共30张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-16 08:12:00 | ||
图片预览








文档简介
(共30张PPT)
第一章 原子结构与性质
第一节 原子结构
——课时1 能层与能级 原子光谱
绚丽多彩的烟花
焰色试验:
某些金属及其化合物在无色火焰中灼烧使火焰呈现特征颜色,据此判断试样所含金属元素,化学上把这种定性分析操作称为焰色试验。
问题导入
1、关于原子,我们知道多少呢?
原子:
化学反应的实质:
是组成分子的原子间的重新组合。
原子结构:
原子
原子核
核外电子(-) Z
质子(+) Z
中子(不带电) A-Z
是化学变化中最小的粒子
2、那么,构成原子的粒子,它们的相对空间位置和大小关系如何呢?
问题导入
1、划分依据:
2、能层序数:
3、符号表示:
4、能量关系:
能层
核外电子按能量不同分成能层,
分别1、2、3、4、5、6、7
分别用K、L、M、N、O、P、Q
能层越高,电子的能量越高,能量的高低顺序为E(K)3、那么,同一能层中电子的能量是否就相同的呢?
问题引入
能级
任一能层的能级总是从s能级开始,按s、p、d、f……排序,
1、划分依据:
2、种类代号:
3、表示方法:
4、能量关系:
5、最大容量:
同一能层,又按能量被分成不同能级。
s、p、d、f中每类能级最多可容纳的电子数依次为自然数1、3、5、7……的2倍。
同能层不同能级的能量顺序:E(ns)能层序号+能级代号,1s、2s、2p、3d、4f……
能级
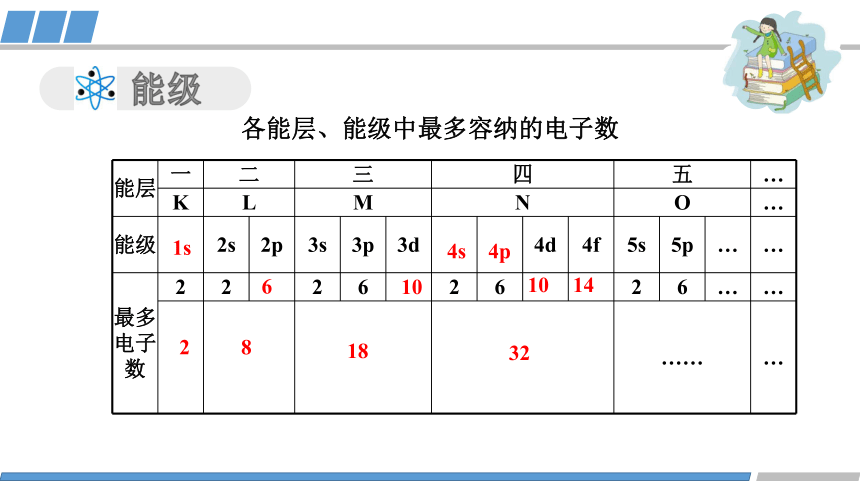
各能层、能级中最多容纳的电子数
能层 一 二 三 四 五 …
K L M N O …
能级 2s 2p 3s 3p 3d 4d 4f 5s 5p … …
最多 电子 数 2 2 2 6 2 6 2 6 … …
…… …
1s
4s
4p
6
10
10
14
2
8
18
32
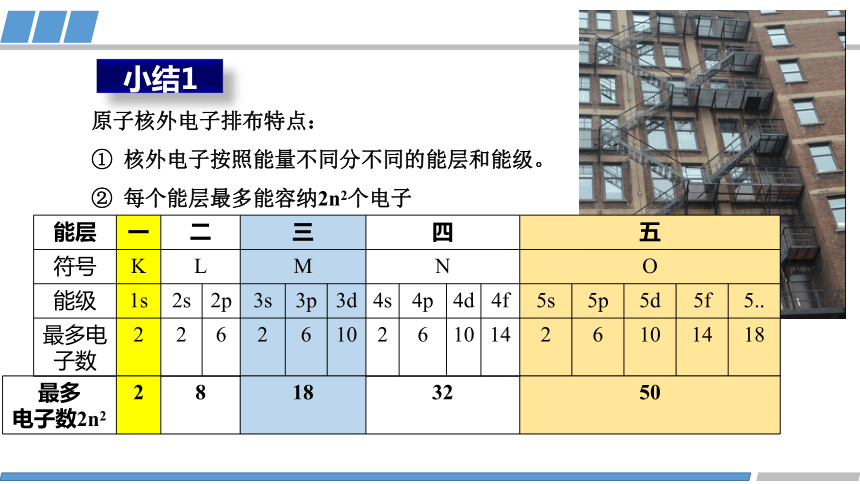
小结1
原子核外电子排布特点:
核外电子按照能量不同分不同的能层和能级。
每个能层最多能容纳2n2个电子
能层 一 二 三 四 五 符号 K L M N O 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 5..
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 10 14 18
最多 电子数2n2 2 8 18 32 50
4、那么,电子的能量和所在能级是否就一成不变的呢?
问题引入
基态与激发态
原子光谱
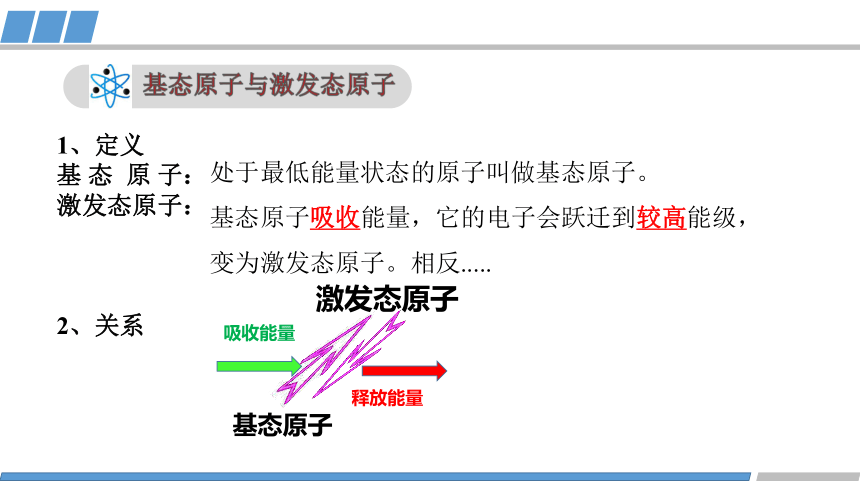
基态原子与激发态原子
处于最低能量状态的原子叫做基态原子。
基态原子吸收能量,它的电子会跃迁到较高能级,变为激发态原子。相反.....
1、定义
基 态 原 子:
激发态原子:
2、关系
基态原子
吸收能量
激发态原子
释放能量
5、我们知道,化学反应中的能量变化通常以热、光的形式呈现,那么,电子发生跃迁时能量变化又以什么形式呈现呢?
问题引入
原子光谱与光谱分析
不同元素的原子,电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各元素原子的吸收光谱或发射光谱,总称原子光谱。
霓虹灯
发射光谱(高跃到低)
吸收光谱(低跃到高)
1、原子光谱
定 义:
成 因:
类 型:
生活实例:
光(辐射)是电子跃迁能量变化的重要形式。
现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。焰色试验。
激发态
基态
2、光谱分析
定义:
应用:
灼
烧
焰色试验
发射光谱
原子理论发展史
丹麦物理学家--玻尔
波尔原子模型(1913年)
电子在原子核外空间的一定轨道上绕核做圆周运动,且不辐射能量
不同轨道上的电子能量不同,且能量不连续的(能量的“量子化”)
氢原子光谱图
思考讨论
问题1、每一能层最多可以容纳的电子数目是2n2,为什么原子的最外层电子数目不能超过8个(K层为最外层时不能超过2个电子)?
阅读教材:请同学们阅读课本第8-10页。
7
6
5
4
3
2
1
核
外
电
子
填
充
顺
序
图
1.构造原理:以光谱学事实为基础,随着核电荷数的递增,新增电子填入能级的顺序称为构造原理。
三、构造原理与电子排布式
能级交错
思考讨论
问题1、为什么原子最外层电子数目不能超过8个(K层为最外层时不能超过2个电子)?次外层电子数目不能超过18个(K层为次外层时不能超过2个),倒数第三层电子数目不能超过32个?
由于能级交错的原因,E nd >E (n+1)s 。当ns和np充满时(最多容纳8个电子),下一个电子不是填入nd,而是优先填入(n+1)s轨道中,从而形成新的能层,因此最外层电子数不可能超过8个。
同理,若最外层是第n层,次外层就是第(n-1)层。由于
E (n-1)f >E (n+1)s >E np,在第(n+1)层出现前,次外层只有(n-1)s、(n-1)p、(n-1)d上有电子,这三个能级最多可容纳18个电子,因此次外层电子数不超过18个。
例如,原子最外层是第五能层,次外层就是第四能层,由于
E4f >E6s>E5p,当第六层出现之前,次外层(第四层)只有在4s、4p和4d能级上有电子,这三个能级最多可容纳18个电子,也就是次外层不超过18个电子。
练习:根据构造原理,试试写出钠、钾、铁基态原子的电子排布式?
2.电子排布式:原子核外电子排布的一种表示方式。
用数字在能级符号右上角表明该能级上排布的电子数。
活动2:阅读课本P9表1-1,总结电子排布式的书写原则。
思考讨论
问题2:根据构造原理,写出稀有气体氦、氖、氩、氪、氙、氡基态原子的电子排布式?有没有发现它们的共同点?
2He: 1s2
10Ne: 1s22s22p6
18Ar: 1s22s22p63s23p6
36Kr: 1s22s22p63s23p64s24P6
54Xe: 1s22s22p63s23p63d104s24P64d104f145s25P6
86Rn: 1s22s22p63s23p63d104s24P64d104f145s25P65d106s26P6
×
√
√
√
√
×
2He: 1s2
10Ne: 1s22s22p6
18Ar: 1s22s22p63s23p6
36Kr: 1s22s22p63s23p63d104s24P6
54Xe: 1s22s22p63s23p63d104s24P64d105s25P6
86Rn: 1s22s22p63s23p63d104s24P64d104f145s25P65d106s26P6
已知电子排布式可以简化,如钠和钾的电子排布式可以分别简化为:[Ne]3S1和[Ar]4S1。请问方括号里符号的意义是什么?
思考讨论
练习:请分别写出26Fe、33As和35Br 基态原子的简化电子排布式。
问题3:As、Br和Fe元素常见的化合价是什么?找找化合价与电子排布式之间的联系。
思考讨论
价电子:一般指最外能级组中那些有可能参与化学反应的电子。
主族元素原子的价电子一般是在最外面能层的电子(即最外层电子)。
过渡元素原子的价电子则通常包括最外能级组的电子(即最外层电子和部分内层电子)。
问题4:写出25Mn、23V基态原子的价层电子排布式,试推测25Mn、23V两种元素可能的化合价。
思考讨论
25Mn: 3d54s2
Mn元素常见化合价有:+2、+3、+4、+5、+6、+7
23V: 3d34s2
V元素常见化合价有:+2、+3、+4、+5
课堂小结
原子的核外
电子排布
课堂小结
排布规律
表示方法
电子排布式
简化的电子排布式
价电子排布式
构造原理
第一章 原子结构与性质
第一节 原子结构
——课时1 能层与能级 原子光谱
绚丽多彩的烟花
焰色试验:
某些金属及其化合物在无色火焰中灼烧使火焰呈现特征颜色,据此判断试样所含金属元素,化学上把这种定性分析操作称为焰色试验。
问题导入
1、关于原子,我们知道多少呢?
原子:
化学反应的实质:
是组成分子的原子间的重新组合。
原子结构:
原子
原子核
核外电子(-) Z
质子(+) Z
中子(不带电) A-Z
是化学变化中最小的粒子
2、那么,构成原子的粒子,它们的相对空间位置和大小关系如何呢?
问题导入
1、划分依据:
2、能层序数:
3、符号表示:
4、能量关系:
能层
核外电子按能量不同分成能层,
分别1、2、3、4、5、6、7
分别用K、L、M、N、O、P、Q
能层越高,电子的能量越高,能量的高低顺序为E(K)
问题引入
能级
任一能层的能级总是从s能级开始,按s、p、d、f……排序,
1、划分依据:
2、种类代号:
3、表示方法:
4、能量关系:
5、最大容量:
同一能层,又按能量被分成不同能级。
s、p、d、f中每类能级最多可容纳的电子数依次为自然数1、3、5、7……的2倍。
同能层不同能级的能量顺序:E(ns)
能级
各能层、能级中最多容纳的电子数
能层 一 二 三 四 五 …
K L M N O …
能级 2s 2p 3s 3p 3d 4d 4f 5s 5p … …
最多 电子 数 2 2 2 6 2 6 2 6 … …
…… …
1s
4s
4p
6
10
10
14
2
8
18
32
小结1
原子核外电子排布特点:
核外电子按照能量不同分不同的能层和能级。
每个能层最多能容纳2n2个电子
能层 一 二 三 四 五 符号 K L M N O 能级 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 5d 5f 5..
最多电子数 2 2 6 2 6 10 2 6 10 14 2 6 10 14 18
最多 电子数2n2 2 8 18 32 50
4、那么,电子的能量和所在能级是否就一成不变的呢?
问题引入
基态与激发态
原子光谱
基态原子与激发态原子
处于最低能量状态的原子叫做基态原子。
基态原子吸收能量,它的电子会跃迁到较高能级,变为激发态原子。相反.....
1、定义
基 态 原 子:
激发态原子:
2、关系
基态原子
吸收能量
激发态原子
释放能量
5、我们知道,化学反应中的能量变化通常以热、光的形式呈现,那么,电子发生跃迁时能量变化又以什么形式呈现呢?
问题引入
原子光谱与光谱分析
不同元素的原子,电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各元素原子的吸收光谱或发射光谱,总称原子光谱。
霓虹灯
发射光谱(高跃到低)
吸收光谱(低跃到高)
1、原子光谱
定 义:
成 因:
类 型:
生活实例:
光(辐射)是电子跃迁能量变化的重要形式。
现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。焰色试验。
激发态
基态
2、光谱分析
定义:
应用:
灼
烧
焰色试验
发射光谱
原子理论发展史
丹麦物理学家--玻尔
波尔原子模型(1913年)
电子在原子核外空间的一定轨道上绕核做圆周运动,且不辐射能量
不同轨道上的电子能量不同,且能量不连续的(能量的“量子化”)
氢原子光谱图
思考讨论
问题1、每一能层最多可以容纳的电子数目是2n2,为什么原子的最外层电子数目不能超过8个(K层为最外层时不能超过2个电子)?
阅读教材:请同学们阅读课本第8-10页。
7
6
5
4
3
2
1
核
外
电
子
填
充
顺
序
图
1.构造原理:以光谱学事实为基础,随着核电荷数的递增,新增电子填入能级的顺序称为构造原理。
三、构造原理与电子排布式
能级交错
思考讨论
问题1、为什么原子最外层电子数目不能超过8个(K层为最外层时不能超过2个电子)?次外层电子数目不能超过18个(K层为次外层时不能超过2个),倒数第三层电子数目不能超过32个?
由于能级交错的原因,E nd >E (n+1)s 。当ns和np充满时(最多容纳8个电子),下一个电子不是填入nd,而是优先填入(n+1)s轨道中,从而形成新的能层,因此最外层电子数不可能超过8个。
同理,若最外层是第n层,次外层就是第(n-1)层。由于
E (n-1)f >E (n+1)s >E np,在第(n+1)层出现前,次外层只有(n-1)s、(n-1)p、(n-1)d上有电子,这三个能级最多可容纳18个电子,因此次外层电子数不超过18个。
例如,原子最外层是第五能层,次外层就是第四能层,由于
E4f >E6s>E5p,当第六层出现之前,次外层(第四层)只有在4s、4p和4d能级上有电子,这三个能级最多可容纳18个电子,也就是次外层不超过18个电子。
练习:根据构造原理,试试写出钠、钾、铁基态原子的电子排布式?
2.电子排布式:原子核外电子排布的一种表示方式。
用数字在能级符号右上角表明该能级上排布的电子数。
活动2:阅读课本P9表1-1,总结电子排布式的书写原则。
思考讨论
问题2:根据构造原理,写出稀有气体氦、氖、氩、氪、氙、氡基态原子的电子排布式?有没有发现它们的共同点?
2He: 1s2
10Ne: 1s22s22p6
18Ar: 1s22s22p63s23p6
36Kr: 1s22s22p63s23p64s24P6
54Xe: 1s22s22p63s23p63d104s24P64d104f145s25P6
86Rn: 1s22s22p63s23p63d104s24P64d104f145s25P65d106s26P6
×
√
√
√
√
×
2He: 1s2
10Ne: 1s22s22p6
18Ar: 1s22s22p63s23p6
36Kr: 1s22s22p63s23p63d104s24P6
54Xe: 1s22s22p63s23p63d104s24P64d105s25P6
86Rn: 1s22s22p63s23p63d104s24P64d104f145s25P65d106s26P6
已知电子排布式可以简化,如钠和钾的电子排布式可以分别简化为:[Ne]3S1和[Ar]4S1。请问方括号里符号的意义是什么?
思考讨论
练习:请分别写出26Fe、33As和35Br 基态原子的简化电子排布式。
问题3:As、Br和Fe元素常见的化合价是什么?找找化合价与电子排布式之间的联系。
思考讨论
价电子:一般指最外能级组中那些有可能参与化学反应的电子。
主族元素原子的价电子一般是在最外面能层的电子(即最外层电子)。
过渡元素原子的价电子则通常包括最外能级组的电子(即最外层电子和部分内层电子)。
问题4:写出25Mn、23V基态原子的价层电子排布式,试推测25Mn、23V两种元素可能的化合价。
思考讨论
25Mn: 3d54s2
Mn元素常见化合价有:+2、+3、+4、+5、+6、+7
23V: 3d34s2
V元素常见化合价有:+2、+3、+4、+5
课堂小结
原子的核外
电子排布
课堂小结
排布规律
表示方法
电子排布式
简化的电子排布式
价电子排布式
构造原理
