化学人教版(2019)必修第一册4.3.3化学键 分子间作用力 课件(共33张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.3.3化学键 分子间作用力 课件(共33张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 75.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-16 00:00:00 | ||
图片预览









文档简介
(共33张PPT)
第三课时 化学键 分子间作用力
第四章 物质结构 元素周期律
第三节 化学键
温故对比
离子化合物 共价化合物
概念
粒子间作用力
熔沸点
硬度
溶解性
导电性
融化时破坏的作用力
含离子键的化合物
只含共价键的化合物
一定有离子键,可能有共价键
只含共价键
较高
较大
一般较低,个别很高
一般较低,个别很大
一般可溶于水
一般可溶于水
在熔融状态或溶液中
熔融状态不导电,水溶液部分导电
一般破坏离子键
一般破坏分子间作用力
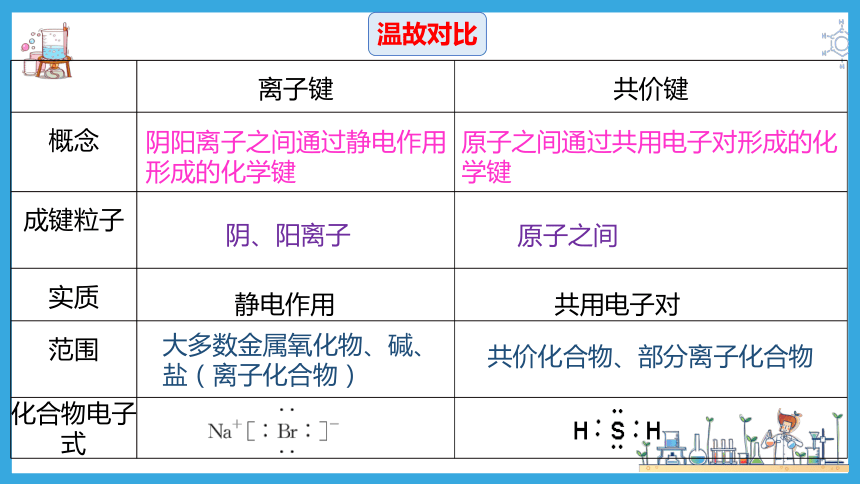
离子键 共价键
概念
成键粒子
实质
范围
化合物电子式
阴阳离子之间通过静电作用形成的化学键
原子之间通过共用电子对形成的化学键
阴、阳离子
原子之间
静电作用
共用电子对
大多数金属氧化物、碱、盐(离子化合物)
共价化合物、部分离子化合物
温故对比
素 养 要 求
1.了解化学键、分子间作用力的含义,能从化学键角度理解化学反应的实质。
2.掌握短周期元素的结构特点、在元素周期表中的位置及其重要化合物的性质。
3.结合元素周期表中“位、构、性”三者之间的关系及利用物质结构和性质进行综合推断。
【思考】粒子间存在有哪些作用力?
冰熔化
水汽化
水分解
0
100
1200
水三种变化与温度(℃)的关系
温度(℃)
H2O(s)
H2O(l)
H2O(g)
0℃
Q吸=6kJ/mol
100℃
Q吸=44kJ/mol
1200℃
Q吸=918kJ/mol
2H+O
HCl(g)
1000℃
Q吸=431kJ/mol
H+Cl
NaCl(s)
1413℃
Q吸=769kJ/mol
Na++Cl-
1
化 学 键
任务一 化学键
化学键
物质中相邻的原子之间强烈的相互作用叫做化学键
原子的价电子间的转移
原子的价电子间的共用
离子键
共价键
极性键
非极性键
形成
类别
1.定义:
一般的化学物质主要由离子键或共价键结合而成
2.分类:
金属键
任务一 化学键
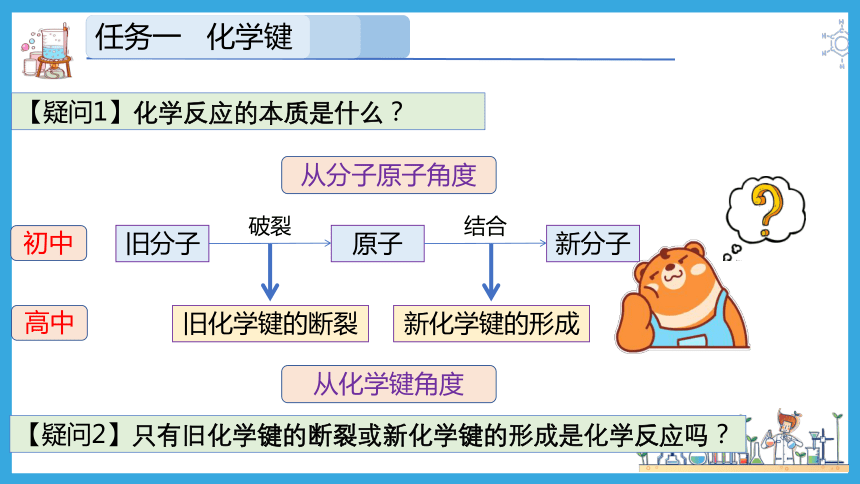
【疑问1】化学反应的本质是什么?
旧分子
破裂
原子
结合
新分子
旧化学键的断裂
新化学键的形成
【疑问2】只有旧化学键的断裂或新化学键的形成是化学反应吗?
初中
高中
从分子原子角度
从化学键角度
任务一 化学键
形成性质各异的微粒和物质,118种元素的原子构成物质已超过1亿种
3.意义:
4、 化学键的存在
(1)稀有气体单质中不存在化学键
(2)多原子单质分子中存在共价键,如:H2、O2、O3等
(3)共价化合物分子中只存在共价键,不存在离子键
(4)离子化合物中一定存在离子键,可能存在共价键
如:Na2O2、NaOH、NH4Cl、Na2SO4等
(5)离子化合物可由非金属构成,如:NH4NO3、NH4Cl
(6)金属单质中存在金属键
任务一 化学键
【疑问3】试判断下列反应分别断裂和形成了什么化学键?
注:①化学反应中反应物的一定有化学键的断裂,但并非所有的化学键均破裂
②离子化合物溶于水或熔化后均电离成为可自由移动的阴、阳离子,所以离
子键被破坏
①H2O + CaO = Ca(OH)2
断裂 ,形成 。
②2NaOH + H2SO4 =Na2SO4 + 2H2O
断裂 ,形成 。
③2Na2O2+ 2H2O = 4NaOH + O2↑
断裂 ,形成 。
任务一 化学键
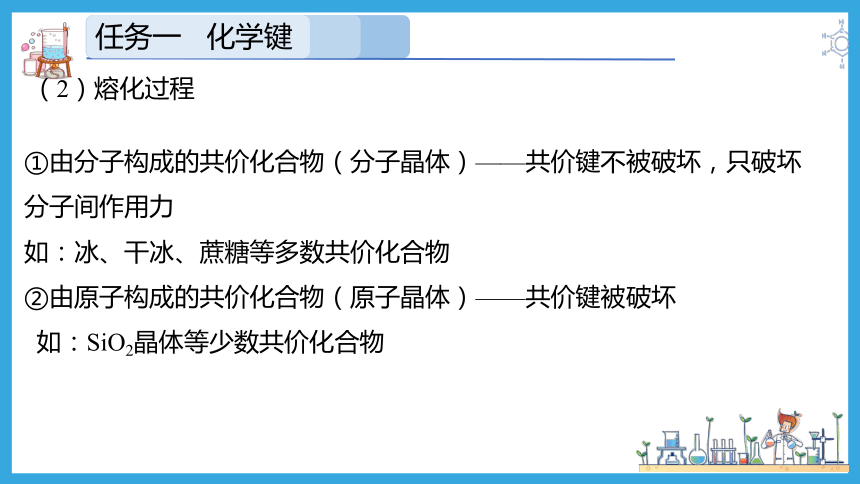
5.共价化合物的溶解或熔化过程中化学键的变化
a.与水反应——共价键被破坏
如:CO2、SO2等酸性氧化物(酸酐)
b.电解质溶于水——共价键被破坏
如:HCl、H2SO4、HNO3等强酸
c.非电解质溶于水——共价键不被破坏,只破坏分子间作用力
如:乙醇、蔗糖等
(1)溶解过程
任务一 化学键
①由分子构成的共价化合物(分子晶体)——共价键不被破坏,只破坏分子间作用力
如:冰、干冰、蔗糖等多数共价化合物
②由原子构成的共价化合物(原子晶体)——共价键被破坏
如:SiO2晶体等少数共价化合物
(2)熔化过程
1.下列物质熔化时,不需要破坏化学键的是( )
A. 食盐 B. 纯碱 C. 干冰 D. 冰
CD
2.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附 C.蔗糖溶于水 D.氯化氢气体溶于水
D
3.下列物质中,
(1)含离子键的物质是( )
(2)含非极性共价键的物质是( )
(3)含极性共价键的物质是( )
A、KF B、H2O C、 N2 D、 F2 E、CS2
F、CaCl2、 G、CH4 H、CCl4 I、Br2 J、PH3
A、F
B、E、G、H、J
C、D、I
典例·剖析
任务一 化学键
题后归纳
小结1:溶解过程
能与水反应的共价化合物
如SO2、CO2
共价键被破坏
属于共价化合物的电解质
如H2SO4、HCl
共价键断裂产生阴、阳离子
部分非电解质
如蔗糖、酒精
共价键不被破坏
小结2:熔化过程
离子化合物
溶解或熔化
离子键被破坏
电离(阴、阳离子)
共价化合物
由分子构成的,如H2O
由原子构成的,如SiO2
共价键不被破坏
共价键被破坏
任务一 化学键
小结3:单质的熔化或溶解过程
单质的特点 化学键变化 举例
由分子构成的固体单质 熔化或升华时只破坏分子间作用力,不破坏化学键 P4的熔化,I2的升华
由原子构成的单质 熔化时破坏共价键 金刚石或晶体硅
能与水反应的某些活泼非金属单质 溶于水后,分子内共价键被破坏 Cl2、F2等
2
知识拓展--分子间作用力
任务二 化学史---范德华
范德华
(道常称为范德·瓦耳斯或范德华,Johannes Diderik van der Waals,1837 -1923 ),荷兰物理学家。曾任阿姆斯特丹大学教授。对气体和夜体的状态方程所作的工作。获得1910年诺贝尔物理学奖。化学中有以他名学命名的范德华力(即分子间作用力)
1873年6月14日,他的博士论文《论气态与液态之连续性》在莱顿大学顺利通过答辩。他进入欧洲首屈一指的物理学家之列。在这篇论文中他提到两个前所未有的理论:一是克拉佩龙物态方程在高压下失效的真正原因是其没有考虑气体分子之间的吸引力: 二是创新导出能应用于高压气体下的物态方程,文章中称这个方程被叫“范德华方程”。科学家从范像华的论文入手,得出一个惊人的结论:壁虎之所以能在平滑的玻璃上爬行,是因为它脚趾的线毛分子与玻璃分子产生了强大的范德华力。
范 德 华 力
任务二 化学史---范德华
任务三 知识拓展--分子间作用力
1、范德华力定义:
分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质,化学键主要影响物质的化学性质
把分子聚集在一起的作用力叫做分子间作用力 (也叫范德华力),最初叫范德华力
3、强弱:
注意:分子间作用力的范围小,只有分子间的距离很小时才有
分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
2、范德华力存在:
任务三 知识拓展--分子间作用力
3、对物质的影响
化学键
分子间作用力
主要对物质物理性质中的熔沸点有较大的影响,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。
化学性质
物理性质
任务三 知识拓展--分子间作用力
思考:为什么HF、H2O和NH3的沸点会反常呢?
任务三 知识拓展--分子间作用力
1、概念:
在NH3、H2O、HF分子间存在着一种比分子间作用力稍强的相互作用力
N、O、F 的氢化物分子间
2、存在:
形成氢键条件:
①分子中有H原子
②分子中含X-H,X(指N、O、F)元素
HF、H2O、NH3、醇、酸(含—OH的有机物)
③表示方式 X-H…Y
任务三 知识拓展--分子间作用力
氢键比化学键弱,比分子间作用力强
可以把氢键看作是一种较强的分子间作用力
3、强弱:
4、作用:
①氢键的形成会使含有氢键的物质的熔、沸点大大升高
②氢键的形成对物质的溶解性也有影响
如:NH3、C2H5OH、CH3COOH 等极易溶于水。
③解释一些反常现象
任务三 知识拓展--分子间作用力
5.化学键、分子间作用力、氢键比较
化学键 分子间作用力 氢键
概念 物质中相邻的原子之间强烈的相互作用 分子间存在着将分子聚集在一起的作用力 N、O、F这些氢化物分子间的相互作用
存在 范围 相邻原子之间 分子间 HF、H2O、NH3等分子间
强弱 较强 很弱 比化学键弱,比分子间作用力强
对物质 性质的 影响 主要影响化学性质 只影响物理性质 随相对分子质量的增大,熔点、沸点升高 使得物质的熔点、沸点升高,在水中的溶解度增大
课堂小结
当 堂 练 习
3
任务四 限时训练
1.(2022·江苏宿迁高一期中)下列过程中化学键没有被破坏的是( )
A.水降温结冰 B.水电解得到氧气与氢气
C.SiO2晶体熔化 D.H2SO4溶于水
A
2.(2022·山东郓城第一中学高一期中)在下列变化过程中既有离子键被破坏又有共价键被破坏的是( )
A.硫酸氢钠溶于水 B.氯化钠熔化
C.SO2气体溶于水 D.碘晶体升华
A
任务四 限时训练
3.(2023·西安铁一中学高一检测)室温下,大小相同的A、B两集气瓶中,分别装有0.01 mol氨气和0.01 mol氯化氢,抽去如图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是( )
A.0.01 mol氨气中含0.03NA个共价键,
0.01 mol氯化氢含0.03NA个离子键
B.气体反应物的总体积为0.448 L
C.当玻璃片抽走后,可观察到集气瓶内出现白烟
D.该反应发生过程中,同时有共价键和离子键的断裂和生成
C
任务四 限时训练
4.(2023·广州六中高一检测)用NaClO可除去水体中过量氨氮(以NH3表示),以防止水体富营养化,其原理如图所示。下列有关叙述正确的是( )
A.原理中所涉及的元素的原子半径:Cl>Na>O>N>H
B.NH3、H2O、OH-所含的质子数
和电子数均相等
C.NaClO和HClO所含的化学
键类型相同
D.反应③有离子键和共价键的断裂和形成
D
任务四 限时训练
5.(2022·陕西咸阳高一月考)表中物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
选项 A B C D
物质 CaCl2 H2O2 Na2O2 NH4Cl
化学键类型 离子键、共价键 共价键 离子键 离子键、共价键
化合物类型 离子化合物 共价化合物 离子化合物 共价化合物
B
任务四 限时训练
6.(2022·福建翔安一中高一月考)Ⅰ.下列变化:
①干冰的气化 ②烧碱熔化 ③氯化钠溶于水 ④氯化氢溶于水 ⑤氯气溶于水 ⑥氯化铵受热分解
(1)未发生化学键破坏的是______(填序号,下同);仅发生离子键破坏的是________。
①
②③
(2)若上述物质都为纯净物时,属于共价化合物的是______;属于离子化合物的是________。
①④
②③⑥
任务四 限时训练
Ⅱ.减少交通事故除遵守交通法规和正确驾驶外,被动安全措施也极为重要,汽车的安全气囊内有叠氮化钠(NaN3)与硝酸铵(NH4NO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生反应,产生大量气体,充满气囊,从而保护驾乘人员安全。
(3)下列判断正确的是______(填字母)。
A.道路起雾与H2O分子中化学键断裂相关
B.NH4NO3中只含有极性共价键
C.NaN3受到猛烈撞击与NH4NO3发生反应时化学键一定断裂
D.NaN3、NH4NO3均属于离子化合物
CD
任务四 限时训练
(4)叠氮化钠是一种无色晶体,广泛用于汽车安全气囊及化工合成等。常见的两种制备方法:2NaNH2+N2O = NaN3+NaOH+NH3;
3NaNH2+NaNO3 = NaN3+3NaOH+NH3↑。
②NaOH固体中含有的化学键类型有____________________。
离子键、极性共价键
①写出NaNH2的电子式:________________。
第三课时 化学键 分子间作用力
第四章 物质结构 元素周期律
第三节 化学键
温故对比
离子化合物 共价化合物
概念
粒子间作用力
熔沸点
硬度
溶解性
导电性
融化时破坏的作用力
含离子键的化合物
只含共价键的化合物
一定有离子键,可能有共价键
只含共价键
较高
较大
一般较低,个别很高
一般较低,个别很大
一般可溶于水
一般可溶于水
在熔融状态或溶液中
熔融状态不导电,水溶液部分导电
一般破坏离子键
一般破坏分子间作用力
离子键 共价键
概念
成键粒子
实质
范围
化合物电子式
阴阳离子之间通过静电作用形成的化学键
原子之间通过共用电子对形成的化学键
阴、阳离子
原子之间
静电作用
共用电子对
大多数金属氧化物、碱、盐(离子化合物)
共价化合物、部分离子化合物
温故对比
素 养 要 求
1.了解化学键、分子间作用力的含义,能从化学键角度理解化学反应的实质。
2.掌握短周期元素的结构特点、在元素周期表中的位置及其重要化合物的性质。
3.结合元素周期表中“位、构、性”三者之间的关系及利用物质结构和性质进行综合推断。
【思考】粒子间存在有哪些作用力?
冰熔化
水汽化
水分解
0
100
1200
水三种变化与温度(℃)的关系
温度(℃)
H2O(s)
H2O(l)
H2O(g)
0℃
Q吸=6kJ/mol
100℃
Q吸=44kJ/mol
1200℃
Q吸=918kJ/mol
2H+O
HCl(g)
1000℃
Q吸=431kJ/mol
H+Cl
NaCl(s)
1413℃
Q吸=769kJ/mol
Na++Cl-
1
化 学 键
任务一 化学键
化学键
物质中相邻的原子之间强烈的相互作用叫做化学键
原子的价电子间的转移
原子的价电子间的共用
离子键
共价键
极性键
非极性键
形成
类别
1.定义:
一般的化学物质主要由离子键或共价键结合而成
2.分类:
金属键
任务一 化学键
【疑问1】化学反应的本质是什么?
旧分子
破裂
原子
结合
新分子
旧化学键的断裂
新化学键的形成
【疑问2】只有旧化学键的断裂或新化学键的形成是化学反应吗?
初中
高中
从分子原子角度
从化学键角度
任务一 化学键
形成性质各异的微粒和物质,118种元素的原子构成物质已超过1亿种
3.意义:
4、 化学键的存在
(1)稀有气体单质中不存在化学键
(2)多原子单质分子中存在共价键,如:H2、O2、O3等
(3)共价化合物分子中只存在共价键,不存在离子键
(4)离子化合物中一定存在离子键,可能存在共价键
如:Na2O2、NaOH、NH4Cl、Na2SO4等
(5)离子化合物可由非金属构成,如:NH4NO3、NH4Cl
(6)金属单质中存在金属键
任务一 化学键
【疑问3】试判断下列反应分别断裂和形成了什么化学键?
注:①化学反应中反应物的一定有化学键的断裂,但并非所有的化学键均破裂
②离子化合物溶于水或熔化后均电离成为可自由移动的阴、阳离子,所以离
子键被破坏
①H2O + CaO = Ca(OH)2
断裂 ,形成 。
②2NaOH + H2SO4 =Na2SO4 + 2H2O
断裂 ,形成 。
③2Na2O2+ 2H2O = 4NaOH + O2↑
断裂 ,形成 。
任务一 化学键
5.共价化合物的溶解或熔化过程中化学键的变化
a.与水反应——共价键被破坏
如:CO2、SO2等酸性氧化物(酸酐)
b.电解质溶于水——共价键被破坏
如:HCl、H2SO4、HNO3等强酸
c.非电解质溶于水——共价键不被破坏,只破坏分子间作用力
如:乙醇、蔗糖等
(1)溶解过程
任务一 化学键
①由分子构成的共价化合物(分子晶体)——共价键不被破坏,只破坏分子间作用力
如:冰、干冰、蔗糖等多数共价化合物
②由原子构成的共价化合物(原子晶体)——共价键被破坏
如:SiO2晶体等少数共价化合物
(2)熔化过程
1.下列物质熔化时,不需要破坏化学键的是( )
A. 食盐 B. 纯碱 C. 干冰 D. 冰
CD
2.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附 C.蔗糖溶于水 D.氯化氢气体溶于水
D
3.下列物质中,
(1)含离子键的物质是( )
(2)含非极性共价键的物质是( )
(3)含极性共价键的物质是( )
A、KF B、H2O C、 N2 D、 F2 E、CS2
F、CaCl2、 G、CH4 H、CCl4 I、Br2 J、PH3
A、F
B、E、G、H、J
C、D、I
典例·剖析
任务一 化学键
题后归纳
小结1:溶解过程
能与水反应的共价化合物
如SO2、CO2
共价键被破坏
属于共价化合物的电解质
如H2SO4、HCl
共价键断裂产生阴、阳离子
部分非电解质
如蔗糖、酒精
共价键不被破坏
小结2:熔化过程
离子化合物
溶解或熔化
离子键被破坏
电离(阴、阳离子)
共价化合物
由分子构成的,如H2O
由原子构成的,如SiO2
共价键不被破坏
共价键被破坏
任务一 化学键
小结3:单质的熔化或溶解过程
单质的特点 化学键变化 举例
由分子构成的固体单质 熔化或升华时只破坏分子间作用力,不破坏化学键 P4的熔化,I2的升华
由原子构成的单质 熔化时破坏共价键 金刚石或晶体硅
能与水反应的某些活泼非金属单质 溶于水后,分子内共价键被破坏 Cl2、F2等
2
知识拓展--分子间作用力
任务二 化学史---范德华
范德华
(道常称为范德·瓦耳斯或范德华,Johannes Diderik van der Waals,1837 -1923 ),荷兰物理学家。曾任阿姆斯特丹大学教授。对气体和夜体的状态方程所作的工作。获得1910年诺贝尔物理学奖。化学中有以他名学命名的范德华力(即分子间作用力)
1873年6月14日,他的博士论文《论气态与液态之连续性》在莱顿大学顺利通过答辩。他进入欧洲首屈一指的物理学家之列。在这篇论文中他提到两个前所未有的理论:一是克拉佩龙物态方程在高压下失效的真正原因是其没有考虑气体分子之间的吸引力: 二是创新导出能应用于高压气体下的物态方程,文章中称这个方程被叫“范德华方程”。科学家从范像华的论文入手,得出一个惊人的结论:壁虎之所以能在平滑的玻璃上爬行,是因为它脚趾的线毛分子与玻璃分子产生了强大的范德华力。
范 德 华 力
任务二 化学史---范德华
任务三 知识拓展--分子间作用力
1、范德华力定义:
分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质,化学键主要影响物质的化学性质
把分子聚集在一起的作用力叫做分子间作用力 (也叫范德华力),最初叫范德华力
3、强弱:
注意:分子间作用力的范围小,只有分子间的距离很小时才有
分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。
2、范德华力存在:
任务三 知识拓展--分子间作用力
3、对物质的影响
化学键
分子间作用力
主要对物质物理性质中的熔沸点有较大的影响,相对分子质量越大,分子间作用力越强,物质的熔沸点越高。
化学性质
物理性质
任务三 知识拓展--分子间作用力
思考:为什么HF、H2O和NH3的沸点会反常呢?
任务三 知识拓展--分子间作用力
1、概念:
在NH3、H2O、HF分子间存在着一种比分子间作用力稍强的相互作用力
N、O、F 的氢化物分子间
2、存在:
形成氢键条件:
①分子中有H原子
②分子中含X-H,X(指N、O、F)元素
HF、H2O、NH3、醇、酸(含—OH的有机物)
③表示方式 X-H…Y
任务三 知识拓展--分子间作用力
氢键比化学键弱,比分子间作用力强
可以把氢键看作是一种较强的分子间作用力
3、强弱:
4、作用:
①氢键的形成会使含有氢键的物质的熔、沸点大大升高
②氢键的形成对物质的溶解性也有影响
如:NH3、C2H5OH、CH3COOH 等极易溶于水。
③解释一些反常现象
任务三 知识拓展--分子间作用力
5.化学键、分子间作用力、氢键比较
化学键 分子间作用力 氢键
概念 物质中相邻的原子之间强烈的相互作用 分子间存在着将分子聚集在一起的作用力 N、O、F这些氢化物分子间的相互作用
存在 范围 相邻原子之间 分子间 HF、H2O、NH3等分子间
强弱 较强 很弱 比化学键弱,比分子间作用力强
对物质 性质的 影响 主要影响化学性质 只影响物理性质 随相对分子质量的增大,熔点、沸点升高 使得物质的熔点、沸点升高,在水中的溶解度增大
课堂小结
当 堂 练 习
3
任务四 限时训练
1.(2022·江苏宿迁高一期中)下列过程中化学键没有被破坏的是( )
A.水降温结冰 B.水电解得到氧气与氢气
C.SiO2晶体熔化 D.H2SO4溶于水
A
2.(2022·山东郓城第一中学高一期中)在下列变化过程中既有离子键被破坏又有共价键被破坏的是( )
A.硫酸氢钠溶于水 B.氯化钠熔化
C.SO2气体溶于水 D.碘晶体升华
A
任务四 限时训练
3.(2023·西安铁一中学高一检测)室温下,大小相同的A、B两集气瓶中,分别装有0.01 mol氨气和0.01 mol氯化氢,抽去如图所示装置中的玻璃片,使两种气体充分反应。下列说法正确的是( )
A.0.01 mol氨气中含0.03NA个共价键,
0.01 mol氯化氢含0.03NA个离子键
B.气体反应物的总体积为0.448 L
C.当玻璃片抽走后,可观察到集气瓶内出现白烟
D.该反应发生过程中,同时有共价键和离子键的断裂和生成
C
任务四 限时训练
4.(2023·广州六中高一检测)用NaClO可除去水体中过量氨氮(以NH3表示),以防止水体富营养化,其原理如图所示。下列有关叙述正确的是( )
A.原理中所涉及的元素的原子半径:Cl>Na>O>N>H
B.NH3、H2O、OH-所含的质子数
和电子数均相等
C.NaClO和HClO所含的化学
键类型相同
D.反应③有离子键和共价键的断裂和形成
D
任务四 限时训练
5.(2022·陕西咸阳高一月考)表中物质与其所含化学键类型、所属化合物类型完全正确的一组是( )
选项 A B C D
物质 CaCl2 H2O2 Na2O2 NH4Cl
化学键类型 离子键、共价键 共价键 离子键 离子键、共价键
化合物类型 离子化合物 共价化合物 离子化合物 共价化合物
B
任务四 限时训练
6.(2022·福建翔安一中高一月考)Ⅰ.下列变化:
①干冰的气化 ②烧碱熔化 ③氯化钠溶于水 ④氯化氢溶于水 ⑤氯气溶于水 ⑥氯化铵受热分解
(1)未发生化学键破坏的是______(填序号,下同);仅发生离子键破坏的是________。
①
②③
(2)若上述物质都为纯净物时,属于共价化合物的是______;属于离子化合物的是________。
①④
②③⑥
任务四 限时训练
Ⅱ.减少交通事故除遵守交通法规和正确驾驶外,被动安全措施也极为重要,汽车的安全气囊内有叠氮化钠(NaN3)与硝酸铵(NH4NO3)等物质。当汽车在高速行驶中受到猛烈撞击时,这些物质会迅速发生反应,产生大量气体,充满气囊,从而保护驾乘人员安全。
(3)下列判断正确的是______(填字母)。
A.道路起雾与H2O分子中化学键断裂相关
B.NH4NO3中只含有极性共价键
C.NaN3受到猛烈撞击与NH4NO3发生反应时化学键一定断裂
D.NaN3、NH4NO3均属于离子化合物
CD
任务四 限时训练
(4)叠氮化钠是一种无色晶体,广泛用于汽车安全气囊及化工合成等。常见的两种制备方法:2NaNH2+N2O = NaN3+NaOH+NH3;
3NaNH2+NaNO3 = NaN3+3NaOH+NH3↑。
②NaOH固体中含有的化学键类型有____________________。
离子键、极性共价键
①写出NaNH2的电子式:________________。
