专题3 从海水中获得的化学物质 章末自测题 (含解析)2023-2024学年高一化学苏教版(2019)必修1
文档属性
| 名称 | 专题3 从海水中获得的化学物质 章末自测题 (含解析)2023-2024学年高一化学苏教版(2019)必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 126.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-16 10:32:33 | ||
图片预览




文档简介
专题3 从海水中获得的化学物质 章末自测题 2023-2024学年高一化学苏教版(2019)必修1
一、选择题
1.下列电离方程式书写错误的是
A. B.
C. D.
2.下列有关钠的描述中错误的是( )
A.钠可以保存在煤油中,说明钠的密度比煤油的大且钠不与煤油发生反应
B.实验时钠需用镊子夹取,用后剩余的钠不能放回试剂瓶中
C.新切开的钠放置在空气中会迅速被氧化
D.钠能与氯化钠溶液发生化学反应
3.下列反应的离子方程式书写正确的是( )
A.向氨水中滴加盐酸:H++OH-=H2O
B.碳酸钙溶解于稀硝酸中:CO+2H+=CO2↑+H2O
C.将铜片投入稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.向氢氧化钠溶液中通入少量二氧化硫:SO2+OH-=HSO3-
4.某溶液中由水电离产生的c(OH-)= 1×10-14mol/L,满足此条件的溶液中一定可以大量共存的离子组是:( )
A.Al3+、Na+、、Cl- B.K+、Na+、Cl-、
C.K+、Na+、Cl-、 D.K+、、、
5.某地化工厂的贮氯罐意外发生泄漏,下列说法错误的是( )
A.紧急组织群众沿逆风方向疏散
B.消防队员向贮氯罐周围空气中喷洒稀NaOH溶液
C.处在该环境中的群众,应用浸有稀氨水的毛巾捂住鼻子,趴在低洼处等待救援
D.氯气是黄绿色、有刺激性气味的有毒气体,液氯贮存在钢瓶中。
6.将一小块金属钠放在坩埚中加热,不可能出现的现象是( )
A.钠熔成小球 B.钠剧烈燃烧
C.产生刺激性气味气体 D.生成淡黄色固体
7.下列离子方程式正确的是( )
A.用碳酸氢钠吸收SO2:SO2+2HCO =SO +2CO2↑+H2O
B.用氨水吸收SO2:SO2+2OH-=SO +H2O
C.用氢氧化钠溶液吸收Cl2:2Cl2+2OH-=3Cl-+ClO-+H2O
D.用大理石与醋酸制备CO2:CaCO3+2H+=Ca2++CO2↑+H2O
8.NA为阿伏加德罗常数,下列叙述错误的是( )
A.18 g H2O中含有的质子数为10NA
B.12 g金刚石中含有的共价键数为4NA
C.46 g NO2和N2O4混合气体中含有原子总数为3NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
9.下列指定反应的方程式不正确的是( )
A.向含有和的混合溶液中通入少量:
B.同体积同浓度的溶液与溶液混合:
C.铜与浓硝酸溶液反应:
D.保存溶液的试剂瓶用橡胶塞不用玻璃塞的原因是:
10.下列叙述中错误的是( )
A.过氧化钠是淡黄色的固体
B.氧化钠和过氧化钠都能与二氧化碳反应,产物不完全相同
C.碳酸钠固体中混有少量碳酸氢钠,可用加热的方法除去
D.质量相等的和分别与足量稀盐酸反应,产生的气体多
11.海水是重要的资源,可以制备一系列物质.下列说法错误的是( )
A.步骤②中,应先通 ,再通
B.步骤③中可将 晶体在 气流中加热脱水
C.除去粗盐中 、 、 等杂质,加入试剂及相关操作顺序可以是: 溶液 溶液 溶液→过滤→盐酸
D.步骤④、⑤、⑥反应中,溴元素均被氧化
12.下列离子方程式书写正确的是( )
A.NH4HCO3溶液与足量NaOH溶液反应:NH4++OH-=NH3 H2O
B.澄清石灰水与过量NaHCO3溶液反应:HCO3-+Ca2++OH-=CaCO3+H2O
C.氢氧化钠溶液通入过量SO2:OH-+SO2=HSO3-
D.Cl2与FeBr2物质的量之比1:1的离子反应方程式:Cl2 +2 Fe2+= 2Fe3++ 2Cl-
二、非选择题
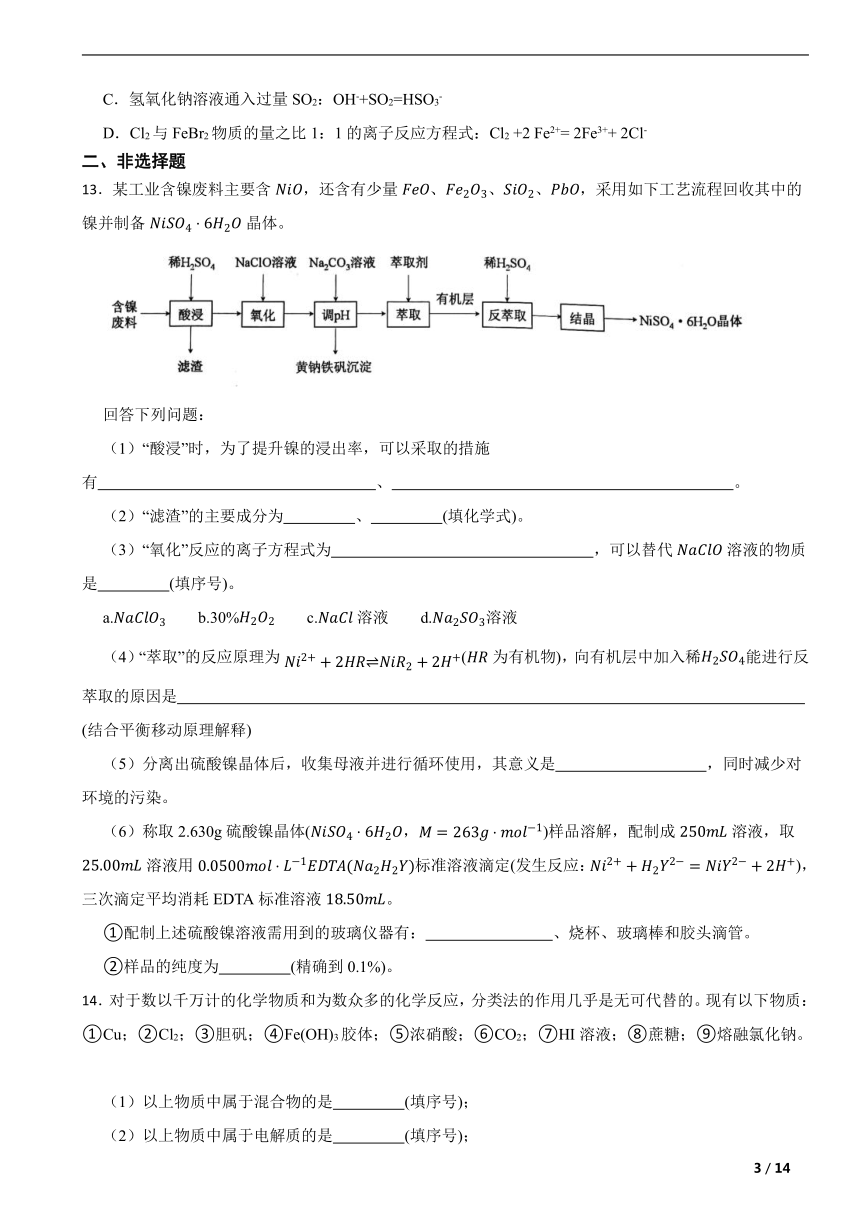
13.某工业含镍废料主要含,还含有少量、、、,采用如下工艺流程回收其中的镍并制备晶体。
回答下列问题:
(1)“酸浸”时,为了提升镍的浸出率,可以采取的措施有 、 。
(2)“滤渣”的主要成分为 、 (填化学式)。
(3)“氧化”反应的离子方程式为 ,可以替代溶液的物质是 (填序号)。
a. b.30% c.溶液 d.溶液
(4)“萃取”的反应原理为(为有机物),向有机层中加入稀能进行反萃取的原因是 (结合平衡移动原理解释)
(5)分离出硫酸镍晶体后,收集母液并进行循环使用,其意义是 ,同时减少对环境的污染。
(6)称取2.630g硫酸镍晶体(,)样品溶解,配制成溶液,取溶液用标准溶液滴定(发生反应:),三次滴定平均消耗EDTA标准溶液。
①配制上述硫酸镍溶液需用到的玻璃仪器有: 、烧杯、玻璃棒和胶头滴管。
②样品的纯度为 (精确到0.1%)。
14.对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。现有以下物质:①Cu;②Cl2;③胆矾;④Fe(OH)3胶体;⑤浓硝酸;⑥CO2;⑦HI溶液;⑧蔗糖;⑨熔融氯化钠。
(1)以上物质中属于混合物的是 (填序号);
(2)以上物质中属于电解质的是 (填序号);
(3)以上物质中能导电的是 (填序号);
(4)向④中逐滴滴加⑦,可观察到的现象是 ;
(5)将少量的①加入到⑤中,写出该化学反应方程式并用“双线桥”法标出电子转移方向和数目 。
15.按要求完成下列填空:
(1)I、漂白液有效成分的化学式 ;
(2)标准状况下,4.8g氧气的体积为 L;
(3)30mLK2SO4溶液中加入足量BaCl2溶液生成6.99g沉淀,则原溶液中K+的物质的量浓度为 mol/L。
(4)II、现有下列八种物质:①液态氯化氢②小苏打③CO2④葡萄糖⑤熔融硝酸钾⑥煤油⑦石墨⑧冰醋酸⑨KOH溶液⑩Cl2
上述八种物质中,属于非电解质的有 (填编号);
(5)属于电解质且能导电的有 (填编号);
(6)②在水溶液中的电离方程式 ;
16.某溶液Q中含有如表所示离子中的5种离子,且离子浓度均为(不考虑水的电离与离子水解)。现向溶液Q中加入足量稀氢溴酸,有单一气体R产生,经分析,反应前后阴离子种类不变。
阳离子 阴离子
已知在酸性溶液中会发生歧化反应。请回答下列问题:
(1)由“加入足量稀氢溴酸,……”“反应前后阴离子种类不变”推知:溶液Q中一定不含的阴离子有 (填数字)种。
(2)综合推断,溶液Q中一定含有的阳离子有 (填离子符号,下同)。产生气体R的反应中,原溶液中过量的离子是 。
(3)一定量溶液Q与氯气缓慢反应,反应后的溶液分为3份,分别进行以下操作,实验现象如图:
①铜粉参与的反应中,氧化产物是 (填离子符号)。
②当时,向溶液Q中通入氯气时发生反应的离子方程式为 ;假设不考虑与的反应,则根据实验现象可推算出V的范围为 。
答案解析部分
1.【答案】A
【解析】【解答】A.醋酸钠是强电解质,在溶液中完全电离出钠离子和醋酸根离子,电离方程式为,故A符合题意;
B.氢氧化钠是强电解质,在溶液中完全电离出钠离子和氢氧根离子,电离方程式为,故B不符合题意;
C.磷酸是中强酸,在溶液中分步电离,以一级为主,电离方程式为,故C不符合题意;
D.氢氰酸是一元弱酸,在溶液中部分电离出氰酸根离子和氢离子,电离方程式为,故D不符合题意;
故答案为:A。
【分析】A.醋酸钠是强电解质,完全电离;
B.氢氧化钠在溶液中完全电离为钠离子和氢氧根离子;
C.磷酸分步电离,以第一步电离为主;
D.HCN为一元弱酸,部分电离。
2.【答案】B
【解析】【解答】A.钠与煤油不发生反应,且钠的密度比煤油大,钠沉在煤油的底部,煤油可以使钠与空气和水蒸气隔绝,防止钠与氧气、水反应,A不符合题意;
B.钠是活泼金属,容易与空气中的水和氧气反应,为安全着想,切割取用后剩余的钠必须放回原试剂瓶中,B符合题意;
C.钠很活泼,新切开的钠,暴露在空气中,会迅速被氧气氧化为氧化钠,光亮的表面很快变暗,C不符合题意;
D.Na非常活泼,可与NaCl溶液中的水发生反应:2Na+2H2O=2NaOH+H2↑,D不符合题意;
故答案为:B。
【分析】钠化学性质很活泼,容易与空气中的水和氧气反应,用后剩余的钠应放回原试剂瓶,防止发生事故。
3.【答案】C
【解析】【解答】A.向氨水中滴加盐酸反应的离子方程式为:H++NH3·H2O=H2O+,A不符合题意;
B.碳酸钙溶解于稀硝酸中的离子方程式为:CaCO3+2H+=CO2↑+H2O+Ca2+,B不符合题意;
C.将铜片投入稀硝酸的离子方程式为:3Cu+8H++2NO=3Cu2++2NO↑+4H2O,C符合题意;
D.向氢氧化钠溶液中通入少量二氧化硫:SO2+2OH-=SO+ H2O,D不符合题意;
故答案为:C。
【分析】离子方程式的书写注意电荷守恒和物料守恒,同业要注意气体符号的标注。
A、氨水水解;
B、碳酸钙难溶于水,不能水解成碳酸根离子和钙离子;
D、氢氧化钠溶液中通入少量二氧化硫生成的是亚硫酸根离子;
4.【答案】B
【解析】【解答】A.Al3+与OH-发生反应,不能大量存在于碱溶液中,A不符合题意;
B. 四种离子彼此不反应,既能存在于酸性也能存在于碱性,能大量共存,B符合题意;
C. 与H+反应,不能大量存在于酸溶液中,C不符合题意;
D. NH4+与OH-反应,不能大量存在于碱溶液中,D不符合题意;
故答案为:B。
【分析】离子之间不生成气体、沉淀、弱电解质或不发生氧化还原反应、络合反应、双水解等反应时能大量共存。
5.【答案】C
【解析】【解答】A. 贮氯罐意外发生泄漏,氯气顺风移动,紧急组织群众沿逆风方向疏散,故A不符合题意;
B. 氯气能和NaOH溶液反应,所以消防队员向贮氯罐周围空气中喷洒稀NaOH溶液是正确的,故B不符合题意;
C. 氯气的密度比空气大,应该处在该环境中的群众,不能趴在低洼处,故C符合题意;
D. 氯气是黄绿色、有刺激性气味的有毒气体,液氯低温下与铁不反应,所以能贮存在钢瓶中,故D不符合题意;
故答案为:C。
【分析】A.氯气有毒,沿逆风方向疏散能减少吸入氯气的量;
B.氯气能与氢氧化钠反应;
D.干燥氯气与铁不反应。
6.【答案】C
【解析】【解答】钠在加热时,钠首先熔化成小球,继而剧烈燃烧,发出黄色火焰,燃烧生成淡黄色固体( )。因此不能出现的现象是产生刺激性气味气体,C项符合题意。
故答案为:C。
【分析】根据钠密度小,熔沸点较低,化学性质比较活泼,在坩埚中加热,于氧气燃烧,生成过氧化钠淡黄色固体解答;
7.【答案】A
【解析】【解答】A.离子方程式为:SO2+2HCO =SO +2CO2↑+H2O ,故A符合题意;
B.离子方程式为:SO2+2NH3 H2O=SO +H2O+2 ,故B不符合题意;
C.符合题意离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O ,故C不符合题意;
D.正确的离子方程式是:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2,故D不符合题意;
故答案为:A。
【分析】A.用碳酸氢钠吸收SO2,生成亚硫酸钠和二氧化碳
B.一水合氨是弱电解质,不能拆
C.电荷不守恒,
D.醋酸为弱电解质,不能拆
8.【答案】B
【解析】【解答】A. 18 g H2O的物质的量为1 mol,1个H2O分子中含有10个质子,则18 g H2O中含有10 mol(即10NA个)质子,故A不符合题意;
B. 金刚石中每个碳原子与周围的4个碳原子形成共价键,每个C—C键被2个碳原子共用,相当于每个碳原子只形成2个共价键,12 g金刚石中含有1 mol碳原子,共含有2 mol(即2NA个)共价键,故B不符合题意;
C. NO2和N2O4的最简式均为NO2,46 g NO2和N2O4的混合物含有1 mol “NO2”,共含有3 mol(即3NA个)原子,故C不符合题意;
D. Na与O2反应生成Na2O和Na2O2时,1个Na原子失去1个电子,故1 mol Na失去NA个电子,故D不符合题意
故答案为:B。
【分析】A、根据进行计算即可;
B、注意金刚石中每个碳原子与周围的4个碳原子形成共价键;
C、根据进行计算即可;
D、根据得失电子守恒进行作答。
9.【答案】A
【解析】【解答】 A.由于钙离子和碳酸根离子结合生成CaCO3沉淀,故向含有NaOH和Ca(OH)2的混合溶液中通入少量CO2的离子方程式为:Ca2++CO2+2OH-=CaCO3↓+H2O,A符合题意;
B.已知,H+结合OH-的能力比强,则同体积同浓度的NH4HSO4溶液与NaOH溶液混合:H++OH-=H2O,B不合题意;
C.铜与浓硝酸溶液反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,则其离子方程式为:,C不合题意;
D.保存NaOH溶液的试剂瓶用橡胶塞不用玻璃塞的原因是由于玻璃中的SiO2能与NaOH溶液反应,其离子方程式为:,D不合题意;
故答案为:A。
【分析】 A项中由于钙离子和碳酸根离子结合生成CaCO3沉淀,其它选项离子方程式书写正确。
10.【答案】D
【解析】【解答】A.过氧化钠是淡黄色的固体,故A不符合题意;
B.氧化钠和过氧化钠都能与二氧化碳反应,前者产物只有碳酸钠,后者产物是碳酸钠和氧气,故B不符合题意;
C.碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,因此碳酸钠固体中混有少量碳酸氢钠,可用加热的方法除去,故C不符合题意;
D.质量相等的和中碳酸氢钠的物质的量更大,分别与足量稀盐酸反应,根据碳原子守恒,因此后者产生的气体多,故D符合题意。
故答案为:D。
【分析】A、过氧化钠为淡黄色固体;
B、过氧化钠和二氧化碳反应生成碳酸钠和氧气;
C、碳酸氢钠加热生成碳酸钠;
D、结合原子守恒判断。
11.【答案】D
【解析】【解答】A.根据侯氏制碱法原理,步骤②中生成碳酸氢钠,先通入氨气可增大二氧化碳的溶解,利于析出碳酸氢钠,故A不符合题意;
B.HCl可抑制镁离子水解,则步骤③中可将MgCl2 6H2O晶体在HCl气流中加热脱水得到无水氯化镁,故B不符合题意;
C.碳酸钠一定在氯化钡之后,可除去Ca2+及过量Ba2+,则加入试剂及相关操作顺序可为NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸,故C不符合题意;
D.步骤④是溴离子被氧化为溴单质,步骤⑤是溴单质被还原为溴化氢,步骤⑥溴元素被氧化为溴单质,故D符合题意;
故答案为D。
【分析】海水中很多矿物质离子,可以利用,这道题主要是充分利用海水中的离子。
A.②中氨气极易溶于水,形成碱性环境,提高二氧化碳的吸收效率
B.③MgCl2.6H2O加热时很容易水解,通入氯化氢气体很好的抑制了水解
C.加入碳酸根的目的是除去钙离子和多余的钡离子,所以只需要保证钡离子加在碳酸根离子之前即可
D.根据溴元素的变化情况,④中被氧化,⑤被还原。⑥中被氧化
12.【答案】C
【解析】【解答】A.NaOH过量,则NH4HCO3完全反应,且参与反应的NH4+、HCO3-个数比为1:1,因此反应的离子方程式为:NH4++HCO3-+2OH-=NH3·H2O+H2O+CO32-,A不符合题意;
B.NaHCO3过量,则Ca(OH)2完全反应,参与反应的Ca2+、OH-的个数比为1:2,因此该反应的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O,B不符合题意;
C.过量SO2与NaOH溶液反应生成NaHSO3,因此该反应的离子方程式为:SO2+OH-=HSO3-,C符合题意;
D.Cl2与FeBr2物质的量1:1参与反应,其反应的离子方程式为:2Cl2+2Fe2++2Br-=2Fe3++Br2+4Cl-,D不符合题意;
故答案为:C
【分析】A、NaOH足量,则NH4+、HCO3-都与OH-反应;
B、NaHCO3过量,则Ca(OH)2完全反应;
C、SO2过量,则与NaOH反应后生成NaHSO3;
D、Cl2与FeBr2物质的量之比为1:1,则Fe2+、Br-均参与反应;
13.【答案】(1)有升高温度、适当增加硫酸浓度,;预先粉碎原料、多次浸取、延长浸出时间等
(2);
(3);ab
(4)是加入稀H2SO4. c(H+)增大,平衡,逆向移动,水层中Ni+增大
(5)提升镍的回收率
(6)250mL容量瓶;
【解析】【解答】(1)“酸浸”时,为了提升镍的浸出率,可以采取的措施有升高温度、适当增加硫酸浓度、预先粉碎原料、多次浸取、延长浸出时间等;
(2) 含镍废料中不和硫酸反应的就是“滤渣”,另外还有新生成的硫酸铅,所以其主要成分为、;
(3)“氧化”反应是次氯酸钠在酸性条件下氧化二价铁,其离子方程式为,有氧化性的就可以代替,所以可以选择ab;
(4)根据萃取反应原理可知,向有机层中加入稀能进行反萃取的原因:是加入稀H2SO4,c(H+)增大,平衡,逆向移动,水层中Ni+增大;
(5)分离出硫酸镍晶体后,收集母液并进行循环使用,其意义是:提升镍的回收率;
(6) ①配制溶液需用到的玻璃仪器有:容量瓶、烧杯、玻璃棒和胶头滴管,根据题意,还少的仪器应该是:250mL容量瓶;
②根据关系式,则,,则样品的纯度为。
【分析】加入稀硫酸后,滤渣为二氧化硅和硫酸铅,加入次氯酸钠后可以氧化二价铁,加入碳酸钠除出三价铁离子杂质,再经过萃取除杂,最后结晶得到产品,根据分析可作答。注意溶液配置的仪器和纯度计算公式。
14.【答案】(1)④⑤⑦
(2)③⑨
(3)①④⑤⑦⑨
(4)先生成沉淀,后沉淀溶解,溶液变为棕黄色
(5)
【解析】【解答】①Cu为金属单质,②Cl2为非金属单质,③胆矾的化学式为CuSO4·5H2O属于化合物,④Fe(OH)3胶体属于混合物,⑤浓硝酸属于混合物,⑥CO2属于化合物,⑦HI溶液属于混合物,⑧蔗糖属于纯净物,⑨熔融氯化钠属于化合物,综上分析有;
(1)以上物质中属于混合物的是:④⑤⑦;
(2)以上物质中属于电解质的是;③⑨;
(3)能导电的物质有金属单质、电解质溶液或者熔融的电解质、特殊非金属单质等,以上物质中能导电的是:①④⑤⑦⑨;
(4)胶体具有介稳性,向Fe(OH)3胶体中滴加HI溶液打破原有的平衡,Fe(OH)3胶体先转变为Fe(OH)3沉淀,继续滴加HI溶液则Fe(OH)3沉淀与HI反应生成Fe3+和H2O,再继续滴加HI溶液Fe3+会与 发生氧化还原反应生成I2和 ,故向④中逐滴滴加⑦,可观察到的现象是:先生成沉淀,后沉淀溶解,溶液变为棕黄色;
(5)Cu与浓HNO3发生氧化还原反应生成NO2、Cu(NO3)2和水,故答案为: 。
【分析】混合物是由多种物质组成,电解质是在水溶液或熔融状态下可以导电的化合物,能导电的物质是电解质溶液和混合物和金属单质等,向胶体中加酸,先聚沉,后溶解,根据氧化还原反应双线桥标转移电子即可
15.【答案】(1)NaClO
(2)3.36L
(3)2.0mol/L
(4)③④
(5)⑤
(6)NaHCO3=Na++
(7)MnO2+4H++2Cl-Mn2++Cl2+2H2O
【解析】【解答】(1)漂白液是氯气和氢氧化钠反应制得,有效成分的化学式为NaClO;
(2)标准状况下,4.8g氧气的体积为;
(3)K2SO4溶液中加入足量BaCl2溶液生成BaSO4,,则原溶液中K+的物质的量为,则原溶液中K+的物质的量浓度为;
(4)①液态氯化氢属于电解质,不能导电;②小苏打是盐,属于电解质,不能导电;③CO2属于非电解质不导电;④葡萄糖是非电解质,不能导电;⑤熔融硝酸钾能导电,属于电解质;⑥煤油属于混合物,不导电;⑦石墨是单质,能导电,既不是电解质也不是非电解质;⑧冰醋酸属于电解质,不导电;⑨KOH溶液是混合物,能导电;⑩Cl2是单质,既不是电解质也不是非电解质,不能导电;
在水溶液或者熔融状态都不导电的化合物,属于非电解质;属于非电解质的有③CO2④葡萄糖;
(5)在水溶液或者熔融状态都能导电的化合物,属于电解质;属于电解质且能导电的有⑤熔融硝酸钾;
(6)②小苏打是盐,在水溶液中的电离方程式NaHCO3=Na++;
(7)实验室利用浓盐酸和MnO2制取Cl2,离子方程式为MnO2+4H++2Cl-Mn2++Cl2+2H2O;
【分析】(1)漂白粉的有效成分是次氯酸钠;
(2)根据和V=nVm计算;
(3)生成的沉淀为硫酸钡,,再结合溶液呈电中性计算;
(4)非电解质是指在水溶液中和熔融状态下均不能导电的化合物;
(5)电解质是指在水溶液中或熔融状态下能导电的化合物;
(6)碳酸氢钠再水溶液中完全电离为钠离子和碳酸氢根离子;
(7)实验室通常加热浓盐酸和二氧化锰制备氯气。
16.【答案】(1)5
(2);
(3);;560;1120
【解析】【解答】由题干信息可得加入足量HBr后溶液中阴离子种类不变,溶液中原本就含有Br-,且与Br-不能共存的阳离子Ag+一定不存在;能与H+反应生成弱电解质的阴离子——、OH-、、S2-不存在;遇酸歧化生成SO2和S,加入过量HBr后并未出现沉淀,可得不存在;H+参与溶液中阴阳离子的反应生成一种气体,且该反应中的阴离子过量,推断为Fe2+与硝酸的氧化还原反应:,Fe2+全部被氧化为Fe3+而还有剩余。
已推出溶液中一定存在Br-、和Fe2+,一定不存在Ag+、、OH-、、S2-和,考虑到电荷守恒,可推得溶液中一定存在的另外两种离子为:、Mg2+。
(1)由题干信息可知溶液中本身就有Br-,会与H+反应的、OH-、、S2-和这5种阴离子一定不存在;
(2)结合反应现象与电荷守恒可推得溶液中一定存在的阳离子为Fe2+、Mg2+。Fe2+与硝酸的反应式为:,可得反应中Fe2+与的物质的量之比为3:1,两者浓度相等的情况下过量;
(3)氯气与Q溶液反应时,先后与Fe2+和Br-反应,反应式分别为:、。由加KSCN溶液变红和加AgNO3溶液生成浅黄色沉淀可得氯气与Fe2+完全反应,与部分Br-反应,V的范围应该在恰好将Fe2+全部氧化和恰好将Fe2+和Br-全部氧化之间。恰好将Fe2+全部氧化所需的氯气的体积,恰好将Fe2+和Br-全部氧化所需的氯气的体积,所以V的范围为:,当V=448mL时,还未将Fe2+全部反应完,所以反应式为:;
由向溶液加入铜粉得到含有铜离子的溶液可得Fe3+将Cu氧化,反应式为:,氧化产物为Cu2+。
【分析】
(1)由题干信息及酸性条件下,氢氧根离子、弱酸根离子、弱酸的酸式酸根离子不能共存判断;
(2)结合反应现象与电荷守恒判断;
(3)依据氧化还原反应的先后顺序判断。
1 / 1
一、选择题
1.下列电离方程式书写错误的是
A. B.
C. D.
2.下列有关钠的描述中错误的是( )
A.钠可以保存在煤油中,说明钠的密度比煤油的大且钠不与煤油发生反应
B.实验时钠需用镊子夹取,用后剩余的钠不能放回试剂瓶中
C.新切开的钠放置在空气中会迅速被氧化
D.钠能与氯化钠溶液发生化学反应
3.下列反应的离子方程式书写正确的是( )
A.向氨水中滴加盐酸:H++OH-=H2O
B.碳酸钙溶解于稀硝酸中:CO+2H+=CO2↑+H2O
C.将铜片投入稀硝酸:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
D.向氢氧化钠溶液中通入少量二氧化硫:SO2+OH-=HSO3-
4.某溶液中由水电离产生的c(OH-)= 1×10-14mol/L,满足此条件的溶液中一定可以大量共存的离子组是:( )
A.Al3+、Na+、、Cl- B.K+、Na+、Cl-、
C.K+、Na+、Cl-、 D.K+、、、
5.某地化工厂的贮氯罐意外发生泄漏,下列说法错误的是( )
A.紧急组织群众沿逆风方向疏散
B.消防队员向贮氯罐周围空气中喷洒稀NaOH溶液
C.处在该环境中的群众,应用浸有稀氨水的毛巾捂住鼻子,趴在低洼处等待救援
D.氯气是黄绿色、有刺激性气味的有毒气体,液氯贮存在钢瓶中。
6.将一小块金属钠放在坩埚中加热,不可能出现的现象是( )
A.钠熔成小球 B.钠剧烈燃烧
C.产生刺激性气味气体 D.生成淡黄色固体
7.下列离子方程式正确的是( )
A.用碳酸氢钠吸收SO2:SO2+2HCO =SO +2CO2↑+H2O
B.用氨水吸收SO2:SO2+2OH-=SO +H2O
C.用氢氧化钠溶液吸收Cl2:2Cl2+2OH-=3Cl-+ClO-+H2O
D.用大理石与醋酸制备CO2:CaCO3+2H+=Ca2++CO2↑+H2O
8.NA为阿伏加德罗常数,下列叙述错误的是( )
A.18 g H2O中含有的质子数为10NA
B.12 g金刚石中含有的共价键数为4NA
C.46 g NO2和N2O4混合气体中含有原子总数为3NA
D.1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去NA个电子
9.下列指定反应的方程式不正确的是( )
A.向含有和的混合溶液中通入少量:
B.同体积同浓度的溶液与溶液混合:
C.铜与浓硝酸溶液反应:
D.保存溶液的试剂瓶用橡胶塞不用玻璃塞的原因是:
10.下列叙述中错误的是( )
A.过氧化钠是淡黄色的固体
B.氧化钠和过氧化钠都能与二氧化碳反应,产物不完全相同
C.碳酸钠固体中混有少量碳酸氢钠,可用加热的方法除去
D.质量相等的和分别与足量稀盐酸反应,产生的气体多
11.海水是重要的资源,可以制备一系列物质.下列说法错误的是( )
A.步骤②中,应先通 ,再通
B.步骤③中可将 晶体在 气流中加热脱水
C.除去粗盐中 、 、 等杂质,加入试剂及相关操作顺序可以是: 溶液 溶液 溶液→过滤→盐酸
D.步骤④、⑤、⑥反应中,溴元素均被氧化
12.下列离子方程式书写正确的是( )
A.NH4HCO3溶液与足量NaOH溶液反应:NH4++OH-=NH3 H2O
B.澄清石灰水与过量NaHCO3溶液反应:HCO3-+Ca2++OH-=CaCO3+H2O
C.氢氧化钠溶液通入过量SO2:OH-+SO2=HSO3-
D.Cl2与FeBr2物质的量之比1:1的离子反应方程式:Cl2 +2 Fe2+= 2Fe3++ 2Cl-
二、非选择题
13.某工业含镍废料主要含,还含有少量、、、,采用如下工艺流程回收其中的镍并制备晶体。
回答下列问题:
(1)“酸浸”时,为了提升镍的浸出率,可以采取的措施有 、 。
(2)“滤渣”的主要成分为 、 (填化学式)。
(3)“氧化”反应的离子方程式为 ,可以替代溶液的物质是 (填序号)。
a. b.30% c.溶液 d.溶液
(4)“萃取”的反应原理为(为有机物),向有机层中加入稀能进行反萃取的原因是 (结合平衡移动原理解释)
(5)分离出硫酸镍晶体后,收集母液并进行循环使用,其意义是 ,同时减少对环境的污染。
(6)称取2.630g硫酸镍晶体(,)样品溶解,配制成溶液,取溶液用标准溶液滴定(发生反应:),三次滴定平均消耗EDTA标准溶液。
①配制上述硫酸镍溶液需用到的玻璃仪器有: 、烧杯、玻璃棒和胶头滴管。
②样品的纯度为 (精确到0.1%)。
14.对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。现有以下物质:①Cu;②Cl2;③胆矾;④Fe(OH)3胶体;⑤浓硝酸;⑥CO2;⑦HI溶液;⑧蔗糖;⑨熔融氯化钠。
(1)以上物质中属于混合物的是 (填序号);
(2)以上物质中属于电解质的是 (填序号);
(3)以上物质中能导电的是 (填序号);
(4)向④中逐滴滴加⑦,可观察到的现象是 ;
(5)将少量的①加入到⑤中,写出该化学反应方程式并用“双线桥”法标出电子转移方向和数目 。
15.按要求完成下列填空:
(1)I、漂白液有效成分的化学式 ;
(2)标准状况下,4.8g氧气的体积为 L;
(3)30mLK2SO4溶液中加入足量BaCl2溶液生成6.99g沉淀,则原溶液中K+的物质的量浓度为 mol/L。
(4)II、现有下列八种物质:①液态氯化氢②小苏打③CO2④葡萄糖⑤熔融硝酸钾⑥煤油⑦石墨⑧冰醋酸⑨KOH溶液⑩Cl2
上述八种物质中,属于非电解质的有 (填编号);
(5)属于电解质且能导电的有 (填编号);
(6)②在水溶液中的电离方程式 ;
16.某溶液Q中含有如表所示离子中的5种离子,且离子浓度均为(不考虑水的电离与离子水解)。现向溶液Q中加入足量稀氢溴酸,有单一气体R产生,经分析,反应前后阴离子种类不变。
阳离子 阴离子
已知在酸性溶液中会发生歧化反应。请回答下列问题:
(1)由“加入足量稀氢溴酸,……”“反应前后阴离子种类不变”推知:溶液Q中一定不含的阴离子有 (填数字)种。
(2)综合推断,溶液Q中一定含有的阳离子有 (填离子符号,下同)。产生气体R的反应中,原溶液中过量的离子是 。
(3)一定量溶液Q与氯气缓慢反应,反应后的溶液分为3份,分别进行以下操作,实验现象如图:
①铜粉参与的反应中,氧化产物是 (填离子符号)。
②当时,向溶液Q中通入氯气时发生反应的离子方程式为 ;假设不考虑与的反应,则根据实验现象可推算出V的范围为 。
答案解析部分
1.【答案】A
【解析】【解答】A.醋酸钠是强电解质,在溶液中完全电离出钠离子和醋酸根离子,电离方程式为,故A符合题意;
B.氢氧化钠是强电解质,在溶液中完全电离出钠离子和氢氧根离子,电离方程式为,故B不符合题意;
C.磷酸是中强酸,在溶液中分步电离,以一级为主,电离方程式为,故C不符合题意;
D.氢氰酸是一元弱酸,在溶液中部分电离出氰酸根离子和氢离子,电离方程式为,故D不符合题意;
故答案为:A。
【分析】A.醋酸钠是强电解质,完全电离;
B.氢氧化钠在溶液中完全电离为钠离子和氢氧根离子;
C.磷酸分步电离,以第一步电离为主;
D.HCN为一元弱酸,部分电离。
2.【答案】B
【解析】【解答】A.钠与煤油不发生反应,且钠的密度比煤油大,钠沉在煤油的底部,煤油可以使钠与空气和水蒸气隔绝,防止钠与氧气、水反应,A不符合题意;
B.钠是活泼金属,容易与空气中的水和氧气反应,为安全着想,切割取用后剩余的钠必须放回原试剂瓶中,B符合题意;
C.钠很活泼,新切开的钠,暴露在空气中,会迅速被氧气氧化为氧化钠,光亮的表面很快变暗,C不符合题意;
D.Na非常活泼,可与NaCl溶液中的水发生反应:2Na+2H2O=2NaOH+H2↑,D不符合题意;
故答案为:B。
【分析】钠化学性质很活泼,容易与空气中的水和氧气反应,用后剩余的钠应放回原试剂瓶,防止发生事故。
3.【答案】C
【解析】【解答】A.向氨水中滴加盐酸反应的离子方程式为:H++NH3·H2O=H2O+,A不符合题意;
B.碳酸钙溶解于稀硝酸中的离子方程式为:CaCO3+2H+=CO2↑+H2O+Ca2+,B不符合题意;
C.将铜片投入稀硝酸的离子方程式为:3Cu+8H++2NO=3Cu2++2NO↑+4H2O,C符合题意;
D.向氢氧化钠溶液中通入少量二氧化硫:SO2+2OH-=SO+ H2O,D不符合题意;
故答案为:C。
【分析】离子方程式的书写注意电荷守恒和物料守恒,同业要注意气体符号的标注。
A、氨水水解;
B、碳酸钙难溶于水,不能水解成碳酸根离子和钙离子;
D、氢氧化钠溶液中通入少量二氧化硫生成的是亚硫酸根离子;
4.【答案】B
【解析】【解答】A.Al3+与OH-发生反应,不能大量存在于碱溶液中,A不符合题意;
B. 四种离子彼此不反应,既能存在于酸性也能存在于碱性,能大量共存,B符合题意;
C. 与H+反应,不能大量存在于酸溶液中,C不符合题意;
D. NH4+与OH-反应,不能大量存在于碱溶液中,D不符合题意;
故答案为:B。
【分析】离子之间不生成气体、沉淀、弱电解质或不发生氧化还原反应、络合反应、双水解等反应时能大量共存。
5.【答案】C
【解析】【解答】A. 贮氯罐意外发生泄漏,氯气顺风移动,紧急组织群众沿逆风方向疏散,故A不符合题意;
B. 氯气能和NaOH溶液反应,所以消防队员向贮氯罐周围空气中喷洒稀NaOH溶液是正确的,故B不符合题意;
C. 氯气的密度比空气大,应该处在该环境中的群众,不能趴在低洼处,故C符合题意;
D. 氯气是黄绿色、有刺激性气味的有毒气体,液氯低温下与铁不反应,所以能贮存在钢瓶中,故D不符合题意;
故答案为:C。
【分析】A.氯气有毒,沿逆风方向疏散能减少吸入氯气的量;
B.氯气能与氢氧化钠反应;
D.干燥氯气与铁不反应。
6.【答案】C
【解析】【解答】钠在加热时,钠首先熔化成小球,继而剧烈燃烧,发出黄色火焰,燃烧生成淡黄色固体( )。因此不能出现的现象是产生刺激性气味气体,C项符合题意。
故答案为:C。
【分析】根据钠密度小,熔沸点较低,化学性质比较活泼,在坩埚中加热,于氧气燃烧,生成过氧化钠淡黄色固体解答;
7.【答案】A
【解析】【解答】A.离子方程式为:SO2+2HCO =SO +2CO2↑+H2O ,故A符合题意;
B.离子方程式为:SO2+2NH3 H2O=SO +H2O+2 ,故B不符合题意;
C.符合题意离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O ,故C不符合题意;
D.正确的离子方程式是:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2,故D不符合题意;
故答案为:A。
【分析】A.用碳酸氢钠吸收SO2,生成亚硫酸钠和二氧化碳
B.一水合氨是弱电解质,不能拆
C.电荷不守恒,
D.醋酸为弱电解质,不能拆
8.【答案】B
【解析】【解答】A. 18 g H2O的物质的量为1 mol,1个H2O分子中含有10个质子,则18 g H2O中含有10 mol(即10NA个)质子,故A不符合题意;
B. 金刚石中每个碳原子与周围的4个碳原子形成共价键,每个C—C键被2个碳原子共用,相当于每个碳原子只形成2个共价键,12 g金刚石中含有1 mol碳原子,共含有2 mol(即2NA个)共价键,故B不符合题意;
C. NO2和N2O4的最简式均为NO2,46 g NO2和N2O4的混合物含有1 mol “NO2”,共含有3 mol(即3NA个)原子,故C不符合题意;
D. Na与O2反应生成Na2O和Na2O2时,1个Na原子失去1个电子,故1 mol Na失去NA个电子,故D不符合题意
故答案为:B。
【分析】A、根据进行计算即可;
B、注意金刚石中每个碳原子与周围的4个碳原子形成共价键;
C、根据进行计算即可;
D、根据得失电子守恒进行作答。
9.【答案】A
【解析】【解答】 A.由于钙离子和碳酸根离子结合生成CaCO3沉淀,故向含有NaOH和Ca(OH)2的混合溶液中通入少量CO2的离子方程式为:Ca2++CO2+2OH-=CaCO3↓+H2O,A符合题意;
B.已知,H+结合OH-的能力比强,则同体积同浓度的NH4HSO4溶液与NaOH溶液混合:H++OH-=H2O,B不合题意;
C.铜与浓硝酸溶液反应方程式为:Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,则其离子方程式为:,C不合题意;
D.保存NaOH溶液的试剂瓶用橡胶塞不用玻璃塞的原因是由于玻璃中的SiO2能与NaOH溶液反应,其离子方程式为:,D不合题意;
故答案为:A。
【分析】 A项中由于钙离子和碳酸根离子结合生成CaCO3沉淀,其它选项离子方程式书写正确。
10.【答案】D
【解析】【解答】A.过氧化钠是淡黄色的固体,故A不符合题意;
B.氧化钠和过氧化钠都能与二氧化碳反应,前者产物只有碳酸钠,后者产物是碳酸钠和氧气,故B不符合题意;
C.碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,因此碳酸钠固体中混有少量碳酸氢钠,可用加热的方法除去,故C不符合题意;
D.质量相等的和中碳酸氢钠的物质的量更大,分别与足量稀盐酸反应,根据碳原子守恒,因此后者产生的气体多,故D符合题意。
故答案为:D。
【分析】A、过氧化钠为淡黄色固体;
B、过氧化钠和二氧化碳反应生成碳酸钠和氧气;
C、碳酸氢钠加热生成碳酸钠;
D、结合原子守恒判断。
11.【答案】D
【解析】【解答】A.根据侯氏制碱法原理,步骤②中生成碳酸氢钠,先通入氨气可增大二氧化碳的溶解,利于析出碳酸氢钠,故A不符合题意;
B.HCl可抑制镁离子水解,则步骤③中可将MgCl2 6H2O晶体在HCl气流中加热脱水得到无水氯化镁,故B不符合题意;
C.碳酸钠一定在氯化钡之后,可除去Ca2+及过量Ba2+,则加入试剂及相关操作顺序可为NaOH溶液→BaCl2溶液→Na2CO3溶液→过滤→盐酸,故C不符合题意;
D.步骤④是溴离子被氧化为溴单质,步骤⑤是溴单质被还原为溴化氢,步骤⑥溴元素被氧化为溴单质,故D符合题意;
故答案为D。
【分析】海水中很多矿物质离子,可以利用,这道题主要是充分利用海水中的离子。
A.②中氨气极易溶于水,形成碱性环境,提高二氧化碳的吸收效率
B.③MgCl2.6H2O加热时很容易水解,通入氯化氢气体很好的抑制了水解
C.加入碳酸根的目的是除去钙离子和多余的钡离子,所以只需要保证钡离子加在碳酸根离子之前即可
D.根据溴元素的变化情况,④中被氧化,⑤被还原。⑥中被氧化
12.【答案】C
【解析】【解答】A.NaOH过量,则NH4HCO3完全反应,且参与反应的NH4+、HCO3-个数比为1:1,因此反应的离子方程式为:NH4++HCO3-+2OH-=NH3·H2O+H2O+CO32-,A不符合题意;
B.NaHCO3过量,则Ca(OH)2完全反应,参与反应的Ca2+、OH-的个数比为1:2,因此该反应的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+CO32-+2H2O,B不符合题意;
C.过量SO2与NaOH溶液反应生成NaHSO3,因此该反应的离子方程式为:SO2+OH-=HSO3-,C符合题意;
D.Cl2与FeBr2物质的量1:1参与反应,其反应的离子方程式为:2Cl2+2Fe2++2Br-=2Fe3++Br2+4Cl-,D不符合题意;
故答案为:C
【分析】A、NaOH足量,则NH4+、HCO3-都与OH-反应;
B、NaHCO3过量,则Ca(OH)2完全反应;
C、SO2过量,则与NaOH反应后生成NaHSO3;
D、Cl2与FeBr2物质的量之比为1:1,则Fe2+、Br-均参与反应;
13.【答案】(1)有升高温度、适当增加硫酸浓度,;预先粉碎原料、多次浸取、延长浸出时间等
(2);
(3);ab
(4)是加入稀H2SO4. c(H+)增大,平衡,逆向移动,水层中Ni+增大
(5)提升镍的回收率
(6)250mL容量瓶;
【解析】【解答】(1)“酸浸”时,为了提升镍的浸出率,可以采取的措施有升高温度、适当增加硫酸浓度、预先粉碎原料、多次浸取、延长浸出时间等;
(2) 含镍废料中不和硫酸反应的就是“滤渣”,另外还有新生成的硫酸铅,所以其主要成分为、;
(3)“氧化”反应是次氯酸钠在酸性条件下氧化二价铁,其离子方程式为,有氧化性的就可以代替,所以可以选择ab;
(4)根据萃取反应原理可知,向有机层中加入稀能进行反萃取的原因:是加入稀H2SO4,c(H+)增大,平衡,逆向移动,水层中Ni+增大;
(5)分离出硫酸镍晶体后,收集母液并进行循环使用,其意义是:提升镍的回收率;
(6) ①配制溶液需用到的玻璃仪器有:容量瓶、烧杯、玻璃棒和胶头滴管,根据题意,还少的仪器应该是:250mL容量瓶;
②根据关系式,则,,则样品的纯度为。
【分析】加入稀硫酸后,滤渣为二氧化硅和硫酸铅,加入次氯酸钠后可以氧化二价铁,加入碳酸钠除出三价铁离子杂质,再经过萃取除杂,最后结晶得到产品,根据分析可作答。注意溶液配置的仪器和纯度计算公式。
14.【答案】(1)④⑤⑦
(2)③⑨
(3)①④⑤⑦⑨
(4)先生成沉淀,后沉淀溶解,溶液变为棕黄色
(5)
【解析】【解答】①Cu为金属单质,②Cl2为非金属单质,③胆矾的化学式为CuSO4·5H2O属于化合物,④Fe(OH)3胶体属于混合物,⑤浓硝酸属于混合物,⑥CO2属于化合物,⑦HI溶液属于混合物,⑧蔗糖属于纯净物,⑨熔融氯化钠属于化合物,综上分析有;
(1)以上物质中属于混合物的是:④⑤⑦;
(2)以上物质中属于电解质的是;③⑨;
(3)能导电的物质有金属单质、电解质溶液或者熔融的电解质、特殊非金属单质等,以上物质中能导电的是:①④⑤⑦⑨;
(4)胶体具有介稳性,向Fe(OH)3胶体中滴加HI溶液打破原有的平衡,Fe(OH)3胶体先转变为Fe(OH)3沉淀,继续滴加HI溶液则Fe(OH)3沉淀与HI反应生成Fe3+和H2O,再继续滴加HI溶液Fe3+会与 发生氧化还原反应生成I2和 ,故向④中逐滴滴加⑦,可观察到的现象是:先生成沉淀,后沉淀溶解,溶液变为棕黄色;
(5)Cu与浓HNO3发生氧化还原反应生成NO2、Cu(NO3)2和水,故答案为: 。
【分析】混合物是由多种物质组成,电解质是在水溶液或熔融状态下可以导电的化合物,能导电的物质是电解质溶液和混合物和金属单质等,向胶体中加酸,先聚沉,后溶解,根据氧化还原反应双线桥标转移电子即可
15.【答案】(1)NaClO
(2)3.36L
(3)2.0mol/L
(4)③④
(5)⑤
(6)NaHCO3=Na++
(7)MnO2+4H++2Cl-Mn2++Cl2+2H2O
【解析】【解答】(1)漂白液是氯气和氢氧化钠反应制得,有效成分的化学式为NaClO;
(2)标准状况下,4.8g氧气的体积为;
(3)K2SO4溶液中加入足量BaCl2溶液生成BaSO4,,则原溶液中K+的物质的量为,则原溶液中K+的物质的量浓度为;
(4)①液态氯化氢属于电解质,不能导电;②小苏打是盐,属于电解质,不能导电;③CO2属于非电解质不导电;④葡萄糖是非电解质,不能导电;⑤熔融硝酸钾能导电,属于电解质;⑥煤油属于混合物,不导电;⑦石墨是单质,能导电,既不是电解质也不是非电解质;⑧冰醋酸属于电解质,不导电;⑨KOH溶液是混合物,能导电;⑩Cl2是单质,既不是电解质也不是非电解质,不能导电;
在水溶液或者熔融状态都不导电的化合物,属于非电解质;属于非电解质的有③CO2④葡萄糖;
(5)在水溶液或者熔融状态都能导电的化合物,属于电解质;属于电解质且能导电的有⑤熔融硝酸钾;
(6)②小苏打是盐,在水溶液中的电离方程式NaHCO3=Na++;
(7)实验室利用浓盐酸和MnO2制取Cl2,离子方程式为MnO2+4H++2Cl-Mn2++Cl2+2H2O;
【分析】(1)漂白粉的有效成分是次氯酸钠;
(2)根据和V=nVm计算;
(3)生成的沉淀为硫酸钡,,再结合溶液呈电中性计算;
(4)非电解质是指在水溶液中和熔融状态下均不能导电的化合物;
(5)电解质是指在水溶液中或熔融状态下能导电的化合物;
(6)碳酸氢钠再水溶液中完全电离为钠离子和碳酸氢根离子;
(7)实验室通常加热浓盐酸和二氧化锰制备氯气。
16.【答案】(1)5
(2);
(3);;560;1120
【解析】【解答】由题干信息可得加入足量HBr后溶液中阴离子种类不变,溶液中原本就含有Br-,且与Br-不能共存的阳离子Ag+一定不存在;能与H+反应生成弱电解质的阴离子——、OH-、、S2-不存在;遇酸歧化生成SO2和S,加入过量HBr后并未出现沉淀,可得不存在;H+参与溶液中阴阳离子的反应生成一种气体,且该反应中的阴离子过量,推断为Fe2+与硝酸的氧化还原反应:,Fe2+全部被氧化为Fe3+而还有剩余。
已推出溶液中一定存在Br-、和Fe2+,一定不存在Ag+、、OH-、、S2-和,考虑到电荷守恒,可推得溶液中一定存在的另外两种离子为:、Mg2+。
(1)由题干信息可知溶液中本身就有Br-,会与H+反应的、OH-、、S2-和这5种阴离子一定不存在;
(2)结合反应现象与电荷守恒可推得溶液中一定存在的阳离子为Fe2+、Mg2+。Fe2+与硝酸的反应式为:,可得反应中Fe2+与的物质的量之比为3:1,两者浓度相等的情况下过量;
(3)氯气与Q溶液反应时,先后与Fe2+和Br-反应,反应式分别为:、。由加KSCN溶液变红和加AgNO3溶液生成浅黄色沉淀可得氯气与Fe2+完全反应,与部分Br-反应,V的范围应该在恰好将Fe2+全部氧化和恰好将Fe2+和Br-全部氧化之间。恰好将Fe2+全部氧化所需的氯气的体积,恰好将Fe2+和Br-全部氧化所需的氯气的体积,所以V的范围为:,当V=448mL时,还未将Fe2+全部反应完,所以反应式为:;
由向溶液加入铜粉得到含有铜离子的溶液可得Fe3+将Cu氧化,反应式为:,氧化产物为Cu2+。
【分析】
(1)由题干信息及酸性条件下,氢氧根离子、弱酸根离子、弱酸的酸式酸根离子不能共存判断;
(2)结合反应现象与电荷守恒判断;
(3)依据氧化还原反应的先后顺序判断。
1 / 1
