[寒假专练]华师大版科学七年级寒假预习专题_溶解度(含答案)
文档属性
| 名称 | [寒假专练]华师大版科学七年级寒假预习专题_溶解度(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 487.0KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2024-01-17 08:59:23 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
[寒假专练]华师大版科学七年级寒假预习专题:溶解度
一、单选题
1.如图,这是市面上常见的感冒药,食用前需要将药粉倒入水中充分溶解。下面几个选项中能作为判断溶解后的感冒药溶液是饱和溶液的依据是( )
A.该溶液颜色很深 B.该溶液味道很苦
C.感冒药溶解的很快 D.感冒药固体有剩余
2.硝酸钾和氯化铵的溶解度曲线如图1所示。某兴趣小组的同学进行了如图2所示实验,R是硝酸钾、氯化铵中的一种物质, 下列说法不正确的是( )
A.硝酸钾和氯化铵两种物质的溶解度均随温度的升高而增大
B.由图1可知:t1℃时,氯化铵饱和溶液中溶质与溶液的质量比为2:7
C.由图1和图2:烧杯内的物质R是硝酸钾①②③三种情况下,一定是饱和溶液的有②③
D.将t2℃下硝酸钾、氯化铵的饱和溶液降温到t1℃时,硝酸钾溶液析出的晶体多
3.一定温度下,有一杯食盐水,杯底尚有少量食盐固体不能溶解。现将新鲜的萝卜块放入其中(提示:新鲜萝卜在浓盐水中会失水),放置一段时间。则下列说法错误的是( )
A.原食盐水一定是饱和溶液 B.萝卜块质量一定减少
C.杯中的食盐固体一定全部溶解 D.溶液的质量一定增加
4.如图是物质a、b的溶解度曲线,图中Ⅰ、Ⅱ、Ⅲ、Ⅳ表示区域,当所加溶质处于Ⅳ区域时表示 ( )
A.a、b均饱和 B.a饱和,b不饱和
C.a不饱和,b饱和 D.a、b均不饱和
5.在温度不变时,某物质的溶液A经过下列变化,相关说法科学的是( )
溶液A 溶液B 溶液C
A.溶液B一定是饱和溶液
B.溶液B可能是饱和溶液
C.溶液C可能是饱和溶液
D.将溶液C再蒸发10g水,析出的晶体一定是5g
6.某温度下,一只烧杯中盛有20g水,放入2g熟石灰并搅拌,有白色固体沉淀到烧杯底部,则对于烧杯中的上层清液,说法正确的是( )
A.是白色溶液 B.是水
C.是不饱和溶液 D.是饱和溶液
7.20℃时,氯化钠的溶解度为36g/100 g水。对这句话理解错误的是( )
A.20℃时,100g水中最多能溶解氯化钠36g
B.20℃时,100g氯化钠饱和溶液中含氯化钠36g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100:36
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液
8.小科在家里用开水配制了一杯浓糖水,放置一会儿后,发现杯底有蔗糖固体析出,整个过程不考虑水分蒸发。这是因为( )
A.溶液中溶剂质量增多 B.杯里溶液的浓度增大了
C.杯里溶液中的溶质质量增多 D.温度下降,蔗糖的溶解度变小
9.A图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况。B图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一种物质后,甲试管中的固体增加,乙试管中的固体减少,则加入的物质最可能是( )
A.食盐 B.氢氧化钠 C.食用油 D.硝酸铵
10.20 ℃时,四个实验小组分别取不同质量的食盐,逐渐加入到各盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余食盐的质量。记录数据如表:
下列说法错误的是( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取食盐的质量/g 15 20 25 30
剩余食盐的质量/g 0 2 7 12
A.20 ℃时,50 g食盐饱和溶液中含有18 g食盐
B.用恒温蒸发溶剂的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.相同温度下,食盐在水中的溶解度与水的质量无关
11. t℃,将一定量A(不含结晶水)的不饱和溶液分成三等份,分别加热蒸发水,然后冷却至t℃,已知三份溶液分别蒸发水10g、20g、30g,析出A依次为ag、bg、cg,则a、b、c三者之间的关系是( )
A.c=a+b B.c=2b-a C.c=2a+b D.c=2a-b
二、填空题
12.小科在寒假通过微信公众号“胜哥课程”学习了《溶解度 》,对相关知识有了一定的了解。如图为A、B、C三种固体物质的溶解度曲线图(A、B、C析出晶体时均不含结晶水),根据曲线图回答下列问题:
(1)t1℃时,溶解度最大的物质是 。
(2)若将M点处C的不饱和溶液变为饱和溶液,可以选择的方法是 (填序号)。
①降低温度 ②增加溶质 ③蒸发溶剂
13.已知硝酸钾和氢氧化钠在水中的溶解度随着温度的升高而增大,则饱和的硝酸钾溶液可以通过 、 等方法,使其变成不饱和溶液。而不饱和的氢氧化钠溶液可以通过 、 、 等方法,使其变成饱和溶液。
14.t℃时将一定量某物质的不饱和溶液均分成三份,均加热蒸发溶剂,然后把温度降低至t℃,已知从二份溶液中蒸发的溶剂的质量分别为10g、20g,析出的晶体(不含结晶水)质量分别为a g、b g ,则t℃时,该物质的溶解度是 g,若第三份溶液蒸发的是30g水,则析出的晶体质量是 。(均用a 、b表示)
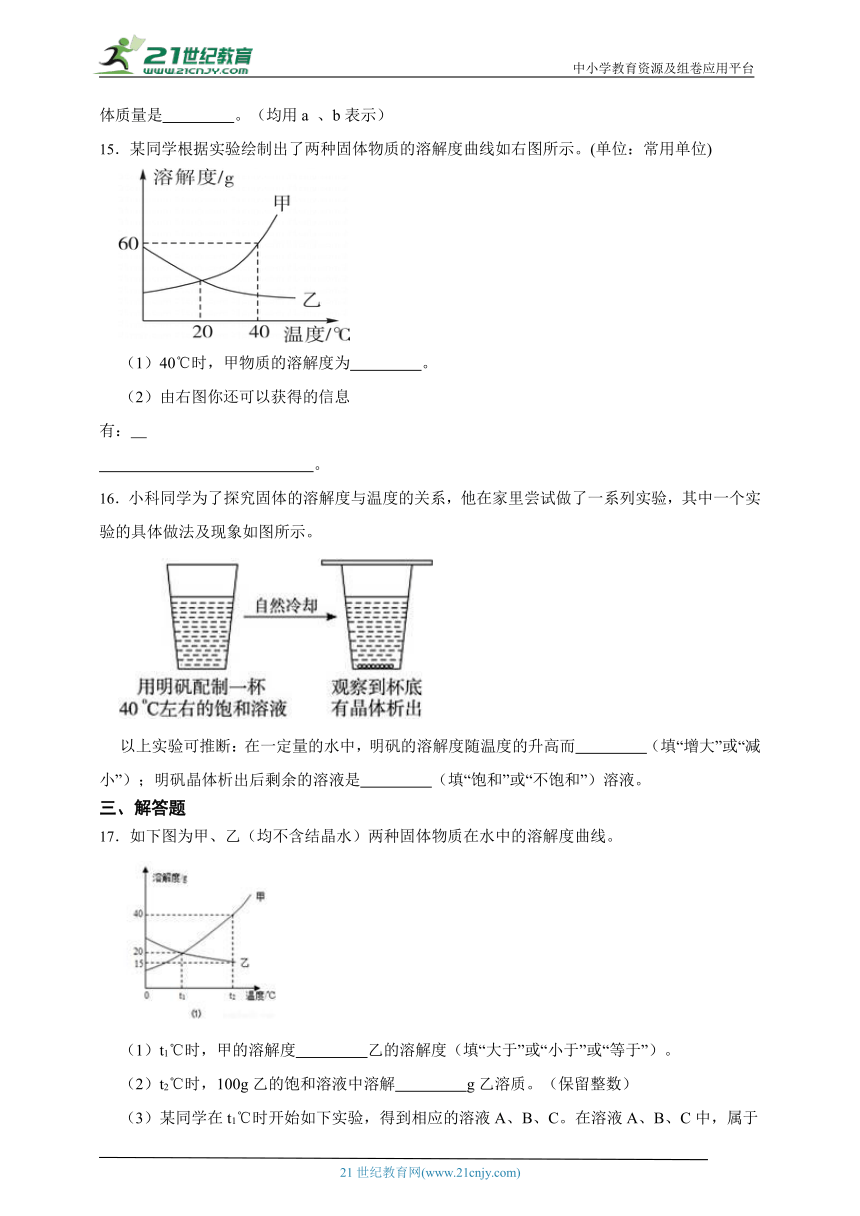
15.某同学根据实验绘制出了两种固体物质的溶解度曲线如右图所示。(单位:常用单位)
(1)40℃时,甲物质的溶解度为 。
(2)由右图你还可以获得的信息有: 。
16.小科同学为了探究固体的溶解度与温度的关系,他在家里尝试做了一系列实验,其中一个实验的具体做法及现象如图所示。
以上实验可推断:在一定量的水中,明矾的溶解度随温度的升高而 (填“增大”或“减小”);明矾晶体析出后剩余的溶液是 (填“饱和”或“不饱和”)溶液。
三、解答题
17.如下图为甲、乙(均不含结晶水)两种固体物质在水中的溶解度曲线。
(1)t1℃时,甲的溶解度 乙的溶解度(填“大于”或“小于”或“等于”)。
(2)t2℃时,100g乙的饱和溶液中溶解 g乙溶质。(保留整数)
(3)某同学在t1℃时开始如下实验,得到相应的溶液A、B、C。在溶液A、B、C中,属于饱和溶液的是 ;在溶液C中再加入25g甲后,充分搅拌,恢复到t1℃,所得溶液的质量为 。
答案解析部分
1.【答案】D
【知识点】饱和溶液与不饱和溶液
【解析】【分析】根据饱和溶液是不能继续溶解某物质的溶液分析。
【解答】溶液颜色很深、味道很苦、溶解很快都不能说明溶液是否饱和,而固体有剩余说明溶液一定不能继续溶解该物质,证明溶液一定是饱和溶液;
故选D。
2.【答案】D
【知识点】饱和溶液与不饱和溶液;固体溶解度的概念;溶解度的影响因素
【解析】【分析】(1)根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较;
(2)根据物质的溶解度曲线确定氯化铵的溶解度,然后计算溶质和溶液的质量之比;
(3)根据溶解度计算出水中最多溶解物质的质量,然后与加入的质量进行比较,确定溶液是否饱和;
(4)饱和溶液析出晶体的质量与溶解度的变化有关,还与溶液质量有关。 【解答】A.根据图片可知,硝酸钾和氯化铵两种物质的溶解度均随温度的升高而增大,故A正确不合题意;
B.由图1可知,t1℃时氯化铵溶解度是40g,氯化铵饱和溶液中溶质与溶液的质量比为:40g:(100g+40g)=2:7,故B正确不合题意;
C.结合图1和图2判断:升温到t2℃并且蒸发100g水,烧杯中没有析出固体,说明t2℃时该物质的溶解度大于或等于60g,由图1信息可知,t2℃时硝酸钾溶解度是60g,氯化铵溶解度小于60g,因此烧杯内的物质R是硝酸钾;
①中t1℃时,硝酸钾的溶解度为大于40g,则200g水最多溶解硝酸钾大于80g,那么溶解60g硝酸钾形成不饱和溶液;
②中t2℃时,硝酸钾的溶解度为60g,则100g水最多溶解硝酸钾为60g,即100g水溶解60g硝酸钾恰好饱和;
③中析出固体,一定是饱和溶液。
故C正确不合题意;
D.t2℃下硝酸钾的溶解度大于氯化铵的溶解度,而t1℃下硝酸钾的溶解度仍然大于氯化铵,但是二者的差值硝酸钾大于氯化铵,因此相同质量的饱和溶液析出的晶体更多,而题目没有说明溶液质量的关系,故D错误符合题意。
故选D。
3.【答案】C
【知识点】溶液的组成及特点;饱和溶液与不饱和溶液
【解析】【分析】(1)如果溶液中存在未溶的固体,那么溶液肯定饱和;
(2)根据“失水”确定萝卜的质量变化;
(3)根据溶解度的影响因素判断;
(4)溶液质量=溶质质量+溶剂质量。
【解答】原来的盐水中存在未溶的食盐固体,则肯定是饱和溶液,故A正确不合题意;
新鲜萝卜在盐水中会失去水分,则它的质量会减少,故B正确不合题意;
萝卜中的水分进入盐水溶液,则溶液的质量肯定增大,故D正确不合题意;
由于水的增多,那么溶解的食盐质量肯定会增大,但是否能够全部溶解,无法判断,故C错误符合题意。
故选C。
4.【答案】C
【知识点】饱和溶液与不饱和溶液;固体溶解度的概念
【解析】【分析】将溶质的质量与溶解度比较,大于溶解度时溶液饱和,小于溶解度时溶液不饱和,据此分析判断。
【解答】根据图片可知,在IV区域的点代表的溶质质量小于a的溶解度,因此a为不饱和溶液。
这些点代表的溶质质量大于b的溶解度,因此b为饱和溶液。
故选C。
5.【答案】B
【知识点】饱和溶液与不饱和溶液
【解析】【分析】(1)(2)(3)如果溶液中出现未溶的固体,那么溶液肯定饱和;如果没有出现未溶的固体,那么无法判断是否饱和;
根据溶液B是否饱和判断溶液C中析出晶体的质量,据此分析判断。
【解答】溶液A蒸发10g水时,并没有晶体析出,那么溶液B是否饱和无法判断,故A错误,B正确;
溶液B蒸发10g水后析出5g晶体得到溶液C,那么溶液C肯定饱和,故C错误;
如果溶液B已经达到饱和,那么10g水中最多溶解5g该物质,因此溶液C再蒸发10g水时,肯定析出晶体5g。如果溶液B没有达到饱和,那么蒸发10g时,不会马上出现晶体,而是等一段时间才会析出,因此10g水中最多溶解的物质质量肯定大约5g,故D错误。
故选B。
6.【答案】D
【知识点】饱和溶液与不饱和溶液
【解析】【分析】如果溶液底部有未溶的固体存在,那么溶液肯定饱和;如果没有未溶的固体存在,那么溶液是否饱和无法判断。
【解答】有白色固体沉淀到烧杯底部,说明氢氧化钙未全部溶解,溶液已经达到饱和。烧杯中的上层清液是无色透明的氢氧化钙饱和溶液,故D正确,而A、B、C错误。
故选D。
7.【答案】B
【知识点】固体溶解度的概念
【解析】【分析】根据溶解度的定义分析判断。
【解答】20℃时,氯化钠的溶解度为36g/100 g水。
A.20℃时,100g水中最多能溶解氯化钠36g,故A正确不合题意;
B.20℃时,136g氯化钠饱和溶液中含氯化钠36g,故B错误符合题意;
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100:36,故C正确不合题意;
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液,故D正确不合题意。
故选B。
8.【答案】D
【知识点】溶液的组成及特点;固体溶解度的概念
【解析】【分析】根据饱和溶液和溶解度的影响因素的知识判断。
【解答】糖水中,糖为溶质,而水为溶剂,蔗糖析出即溶质质量减小,而对溶剂质量没有影响,故A、C错误;
溶剂质量不变,而溶质质量减小,则溶液的溶质质量分数减小,即浓度减小,故B错误;
原来蔗糖全部溶解,现在蔗糖析出,这说明温度降低后,蔗糖的溶解度减小了,故D正确。
故选D。
9.【答案】D
【知识点】溶解时的吸热或放热现象;溶解度的影响因素
【解析】【分析】根据两种物质的溶解度随温度的变化规律分析判断。
【解答】根据A图可知,硝酸钾的溶解度随温度的降低而减小,氢氧化钙的溶解度随温度的降低而增大。根据B图可知,加入某种物质后,如果甲的固体增加,乙的固体减少,说明温度降低了。
加入食盐和食用油后,水的温度几乎不变,故A、C不合题意;
加入氢氧化钠后会放热,导致温度升高,故B不合题意;
加入硝酸铵后吸热,导致溶液温度降低,故D符合题意。
故选D。
10.【答案】A
【知识点】饱和溶液与不饱和溶液相互转变;固体溶解度的概念
【解析】【分析】(1)当溶液中出现剩余的食盐时,溶液达到饱和,用加入食盐的质量减去剩余食盐质量得到水中溶解的食盐质量;
(2)将不饱和溶液变成饱和溶液的方法:①蒸发溶剂;②增加溶剂;③改变温度;
(3)将溶质和溶剂的质量作比;
(4)根据物质溶解度的影响因素判断。
【解答】A.在第二组食盐中,出现剩余的食盐,则食盐溶液饱和,那么50g水中最多溶解食盐的质量为:20g-2g=18g。而50g饱和食盐溶液中,水的质量肯定小于50g,其中食盐的质量肯定小于18g,故A错误符合题意;
B.用恒温蒸发溶剂的方法可以使不饱和溶液变成饱和溶液,故B正确不合题意;
C.第二组溶液中溶质与溶剂的质量之比:18g:50g=9:25,故C正确不合题意;
D.食盐在水中的溶解度只与温度有关,故D正确不合题意。
故选A。
11.【答案】B
【知识点】固体溶解度的概念
【解析】【分析】当溶液饱和后,析出晶体的质量与蒸发水的质量成正比,据此列式计算即可。
【解答】第一份溶液蒸发10g水析出晶体ag,由于原来为不饱和溶液,因此二者之间不存在定量关系。
蒸发20g水时比蒸发10g水时多蒸发10g水,蒸发30g水时比较蒸发20g水时多蒸发10g水,因此前后两次多析出晶体的质量相等;
即b-a=c-b;
解得:c=2b-a。
故选B。
12.【答案】(1)C
(2)②③
【知识点】饱和溶液与不饱和溶液相互转变;固体溶解度的概念
【解析】【分析】(1)根据图像确定物质溶解度的大小;
(2)将不饱和溶液转化为饱和溶液的方法:①增加溶质;②蒸发溶剂;③改变温度,根据图像确定M点C的不饱和溶液变为饱和溶液的方法即可。
【解答】(1)根据图像可知,t1℃时,溶解度最大的物质是C;
(2)根据图像可知,物质C的溶解度随温度的升高而减小,因此将不饱和溶液变为饱和溶液的方法:升高温度;增加溶质;蒸发溶剂。②③正确。
13.【答案】加热(或升高温度);加水(或增加溶剂);加氢氧化钠(或增加溶质);恒温蒸发水(或恒温蒸发溶剂);降温(或降低温度)
【知识点】饱和溶液与不饱和溶液相互转变
【解析】【分析】根据饱和溶液和不饱和溶液相互转化的方法解答。
【解答】已知硝酸钾和氢氧化钠在水中的溶解度随着温度的升高而增大,则饱和的硝酸钾溶液可以通过加热(或升高温度)、加水(或增加溶剂)等方法,使其变成不饱和溶液。而不饱和的氢氧化钠溶液可以通过加氢氧化钠(或增加溶质)、恒温蒸发水(或恒温蒸发溶剂)、降温(或降低温度)等方法,使其变成饱和溶液。
14.【答案】10(b-a);2b-a
【知识点】固体溶解度的概念
【解析】【分析】(1)蒸发溶剂时,两份溶液先要变成饱和溶液,再析出晶体,则二者析出的晶体质量之差应该是饱和溶液中10g水中析出晶体的质量,最后根据“饱和溶液中溶质与溶剂质量成正比”计算出该物体的溶解度即可;
(2)30g比20g水多10g,则析出晶体的质量比bg应该多10g水中的晶体,据此计算即可。
【解答】(1)该物质的饱和溶液中,10g水中最多溶解晶体:b-a;
根据饱和溶液中溶质与溶剂质量成正比得到,该物体的溶解度:。
(2)30g水中析出晶体比20g水中析出晶体多(b-a)g,那么析出晶体为质量为:b+(b-a)=2b-a。
15.【答案】(1)60克
(2)甲物质的溶解度随着温度的升高而增大或乙物质的溶解度随着温度的升高而减小或20°c时甲、乙物质的溶解度相同
【知识点】溶解度的影响因素
【解析】【分析】(1)根据图像确定甲物质的溶解度;
(2)可根据图像描述两种物质的溶解度随温度的变化规律,或者描述两个图像交点的意义。
【解答】(1)根据图像可知,40℃时,甲物质的溶解度为60g;
(2)①根据图像可知,甲物质的溶解度随着温度的升高而增大(或乙物质的溶解度随着温度的升高而减小)。
②两个图像在20℃时相交,那么得到:20℃时,甲和乙两种物质的溶解度相同。
16.【答案】增大;饱和
【知识点】饱和溶液与不饱和溶液;溶解度的影响因素
【解析】【分析】(1)如果降低温度时有晶体析出,则说明晶体的溶解度随温度降低而减小,也就是随温度升高而增大;
(2)如果溶液有晶体析出,则溶液是饱和的;如果没有晶体析出,那么溶液可能饱和,也可能不饱和。
【解答】(1) 在一定量的水中,明矾的溶解度随温度的升高增大;
(2)明矾晶体析出后剩余的溶液是饱和溶液。
17.【答案】(1)等于
(2)13
(3)B;120g
【知识点】固体溶解度的概念
【解析】【分析】(1)根据图像分析解答;
(2)首先根据图像确定t2℃时乙的溶解度,再根据“相同温度下,同种物质饱和溶液的溶质质量分数相等”列方程计算即可。
(3)如果溶质质量大于或等于溶解度,那么溶液肯定饱和;否则,溶液不饱和。溶液质量=溶质质量+溶剂质量,据此分析解答。
【解答】(1)根据图像可知,两条曲线在t1℃时相交,即:t1℃时,甲的溶解度等于乙的溶解度。
(2)t2℃时,乙的溶解度为15g,
根据“相同温度下,同种物质饱和溶液的溶质质量分数相等”得到:;
解得:x≈13g。
(3)t1℃时,甲的溶解度为20g。A中溶质15g<20g,则A不饱和;B中溶质质量为20g,则B饱和。t2℃时,甲的溶解度为40g,因为20g<40g,所以不饱和。
t1℃时,甲的溶解度为20g,则恢复到t1℃时,溶液的质量为:100g+20g=120g。
试题分析部分
1、试卷总体分布分析
总分:48分
分值分布 客观题(占比) 26.0(54.2%)
主观题(占比) 22.0(45.8%)
题量分布 客观题(占比) 12(70.6%)
主观题(占比) 5(29.4%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
填空题 5(29.4%) 22.0(45.8%)
解答题 1(5.9%) 4.0(8.3%)
单选题 11(64.7%) 22.0(45.8%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (82.4%)
2 容易 (5.9%)
3 困难 (11.8%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 饱和溶液与不饱和溶液 16.0(33.3%) 1,2,3,4,5,6,16
2 饱和溶液与不饱和溶液相互转变 14.0(29.2%) 10,12,13
3 固体溶解度的概念 22.0(45.8%) 2,4,7,8,10,11,12,14,17
4 溶液的组成及特点 4.0(8.3%) 3,8
5 溶解度的影响因素 10.0(20.8%) 2,9,15,16
6 溶解时的吸热或放热现象 2.0(4.2%) 9
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
[寒假专练]华师大版科学七年级寒假预习专题:溶解度
一、单选题
1.如图,这是市面上常见的感冒药,食用前需要将药粉倒入水中充分溶解。下面几个选项中能作为判断溶解后的感冒药溶液是饱和溶液的依据是( )
A.该溶液颜色很深 B.该溶液味道很苦
C.感冒药溶解的很快 D.感冒药固体有剩余
2.硝酸钾和氯化铵的溶解度曲线如图1所示。某兴趣小组的同学进行了如图2所示实验,R是硝酸钾、氯化铵中的一种物质, 下列说法不正确的是( )
A.硝酸钾和氯化铵两种物质的溶解度均随温度的升高而增大
B.由图1可知:t1℃时,氯化铵饱和溶液中溶质与溶液的质量比为2:7
C.由图1和图2:烧杯内的物质R是硝酸钾①②③三种情况下,一定是饱和溶液的有②③
D.将t2℃下硝酸钾、氯化铵的饱和溶液降温到t1℃时,硝酸钾溶液析出的晶体多
3.一定温度下,有一杯食盐水,杯底尚有少量食盐固体不能溶解。现将新鲜的萝卜块放入其中(提示:新鲜萝卜在浓盐水中会失水),放置一段时间。则下列说法错误的是( )
A.原食盐水一定是饱和溶液 B.萝卜块质量一定减少
C.杯中的食盐固体一定全部溶解 D.溶液的质量一定增加
4.如图是物质a、b的溶解度曲线,图中Ⅰ、Ⅱ、Ⅲ、Ⅳ表示区域,当所加溶质处于Ⅳ区域时表示 ( )
A.a、b均饱和 B.a饱和,b不饱和
C.a不饱和,b饱和 D.a、b均不饱和
5.在温度不变时,某物质的溶液A经过下列变化,相关说法科学的是( )
溶液A 溶液B 溶液C
A.溶液B一定是饱和溶液
B.溶液B可能是饱和溶液
C.溶液C可能是饱和溶液
D.将溶液C再蒸发10g水,析出的晶体一定是5g
6.某温度下,一只烧杯中盛有20g水,放入2g熟石灰并搅拌,有白色固体沉淀到烧杯底部,则对于烧杯中的上层清液,说法正确的是( )
A.是白色溶液 B.是水
C.是不饱和溶液 D.是饱和溶液
7.20℃时,氯化钠的溶解度为36g/100 g水。对这句话理解错误的是( )
A.20℃时,100g水中最多能溶解氯化钠36g
B.20℃时,100g氯化钠饱和溶液中含氯化钠36g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100:36
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液
8.小科在家里用开水配制了一杯浓糖水,放置一会儿后,发现杯底有蔗糖固体析出,整个过程不考虑水分蒸发。这是因为( )
A.溶液中溶剂质量增多 B.杯里溶液的浓度增大了
C.杯里溶液中的溶质质量增多 D.温度下降,蔗糖的溶解度变小
9.A图表示硝酸钾和氢氧化钙的溶解度随温度变化的情况。B图中甲、乙试管分别盛有硝酸钾、氢氧化钙的饱和溶液,试管底部均有未溶解的固体。向烧杯中加入一种物质后,甲试管中的固体增加,乙试管中的固体减少,则加入的物质最可能是( )
A.食盐 B.氢氧化钠 C.食用油 D.硝酸铵
10.20 ℃时,四个实验小组分别取不同质量的食盐,逐渐加入到各盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余食盐的质量。记录数据如表:
下列说法错误的是( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取食盐的质量/g 15 20 25 30
剩余食盐的质量/g 0 2 7 12
A.20 ℃时,50 g食盐饱和溶液中含有18 g食盐
B.用恒温蒸发溶剂的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.相同温度下,食盐在水中的溶解度与水的质量无关
11. t℃,将一定量A(不含结晶水)的不饱和溶液分成三等份,分别加热蒸发水,然后冷却至t℃,已知三份溶液分别蒸发水10g、20g、30g,析出A依次为ag、bg、cg,则a、b、c三者之间的关系是( )
A.c=a+b B.c=2b-a C.c=2a+b D.c=2a-b
二、填空题
12.小科在寒假通过微信公众号“胜哥课程”学习了《溶解度 》,对相关知识有了一定的了解。如图为A、B、C三种固体物质的溶解度曲线图(A、B、C析出晶体时均不含结晶水),根据曲线图回答下列问题:
(1)t1℃时,溶解度最大的物质是 。
(2)若将M点处C的不饱和溶液变为饱和溶液,可以选择的方法是 (填序号)。
①降低温度 ②增加溶质 ③蒸发溶剂
13.已知硝酸钾和氢氧化钠在水中的溶解度随着温度的升高而增大,则饱和的硝酸钾溶液可以通过 、 等方法,使其变成不饱和溶液。而不饱和的氢氧化钠溶液可以通过 、 、 等方法,使其变成饱和溶液。
14.t℃时将一定量某物质的不饱和溶液均分成三份,均加热蒸发溶剂,然后把温度降低至t℃,已知从二份溶液中蒸发的溶剂的质量分别为10g、20g,析出的晶体(不含结晶水)质量分别为a g、b g ,则t℃时,该物质的溶解度是 g,若第三份溶液蒸发的是30g水,则析出的晶体质量是 。(均用a 、b表示)
15.某同学根据实验绘制出了两种固体物质的溶解度曲线如右图所示。(单位:常用单位)
(1)40℃时,甲物质的溶解度为 。
(2)由右图你还可以获得的信息有: 。
16.小科同学为了探究固体的溶解度与温度的关系,他在家里尝试做了一系列实验,其中一个实验的具体做法及现象如图所示。
以上实验可推断:在一定量的水中,明矾的溶解度随温度的升高而 (填“增大”或“减小”);明矾晶体析出后剩余的溶液是 (填“饱和”或“不饱和”)溶液。
三、解答题
17.如下图为甲、乙(均不含结晶水)两种固体物质在水中的溶解度曲线。
(1)t1℃时,甲的溶解度 乙的溶解度(填“大于”或“小于”或“等于”)。
(2)t2℃时,100g乙的饱和溶液中溶解 g乙溶质。(保留整数)
(3)某同学在t1℃时开始如下实验,得到相应的溶液A、B、C。在溶液A、B、C中,属于饱和溶液的是 ;在溶液C中再加入25g甲后,充分搅拌,恢复到t1℃,所得溶液的质量为 。
答案解析部分
1.【答案】D
【知识点】饱和溶液与不饱和溶液
【解析】【分析】根据饱和溶液是不能继续溶解某物质的溶液分析。
【解答】溶液颜色很深、味道很苦、溶解很快都不能说明溶液是否饱和,而固体有剩余说明溶液一定不能继续溶解该物质,证明溶液一定是饱和溶液;
故选D。
2.【答案】D
【知识点】饱和溶液与不饱和溶液;固体溶解度的概念;溶解度的影响因素
【解析】【分析】(1)根据物质的溶解度曲线可以判断某一温度时物质的溶解度大小比较;
(2)根据物质的溶解度曲线确定氯化铵的溶解度,然后计算溶质和溶液的质量之比;
(3)根据溶解度计算出水中最多溶解物质的质量,然后与加入的质量进行比较,确定溶液是否饱和;
(4)饱和溶液析出晶体的质量与溶解度的变化有关,还与溶液质量有关。 【解答】A.根据图片可知,硝酸钾和氯化铵两种物质的溶解度均随温度的升高而增大,故A正确不合题意;
B.由图1可知,t1℃时氯化铵溶解度是40g,氯化铵饱和溶液中溶质与溶液的质量比为:40g:(100g+40g)=2:7,故B正确不合题意;
C.结合图1和图2判断:升温到t2℃并且蒸发100g水,烧杯中没有析出固体,说明t2℃时该物质的溶解度大于或等于60g,由图1信息可知,t2℃时硝酸钾溶解度是60g,氯化铵溶解度小于60g,因此烧杯内的物质R是硝酸钾;
①中t1℃时,硝酸钾的溶解度为大于40g,则200g水最多溶解硝酸钾大于80g,那么溶解60g硝酸钾形成不饱和溶液;
②中t2℃时,硝酸钾的溶解度为60g,则100g水最多溶解硝酸钾为60g,即100g水溶解60g硝酸钾恰好饱和;
③中析出固体,一定是饱和溶液。
故C正确不合题意;
D.t2℃下硝酸钾的溶解度大于氯化铵的溶解度,而t1℃下硝酸钾的溶解度仍然大于氯化铵,但是二者的差值硝酸钾大于氯化铵,因此相同质量的饱和溶液析出的晶体更多,而题目没有说明溶液质量的关系,故D错误符合题意。
故选D。
3.【答案】C
【知识点】溶液的组成及特点;饱和溶液与不饱和溶液
【解析】【分析】(1)如果溶液中存在未溶的固体,那么溶液肯定饱和;
(2)根据“失水”确定萝卜的质量变化;
(3)根据溶解度的影响因素判断;
(4)溶液质量=溶质质量+溶剂质量。
【解答】原来的盐水中存在未溶的食盐固体,则肯定是饱和溶液,故A正确不合题意;
新鲜萝卜在盐水中会失去水分,则它的质量会减少,故B正确不合题意;
萝卜中的水分进入盐水溶液,则溶液的质量肯定增大,故D正确不合题意;
由于水的增多,那么溶解的食盐质量肯定会增大,但是否能够全部溶解,无法判断,故C错误符合题意。
故选C。
4.【答案】C
【知识点】饱和溶液与不饱和溶液;固体溶解度的概念
【解析】【分析】将溶质的质量与溶解度比较,大于溶解度时溶液饱和,小于溶解度时溶液不饱和,据此分析判断。
【解答】根据图片可知,在IV区域的点代表的溶质质量小于a的溶解度,因此a为不饱和溶液。
这些点代表的溶质质量大于b的溶解度,因此b为饱和溶液。
故选C。
5.【答案】B
【知识点】饱和溶液与不饱和溶液
【解析】【分析】(1)(2)(3)如果溶液中出现未溶的固体,那么溶液肯定饱和;如果没有出现未溶的固体,那么无法判断是否饱和;
根据溶液B是否饱和判断溶液C中析出晶体的质量,据此分析判断。
【解答】溶液A蒸发10g水时,并没有晶体析出,那么溶液B是否饱和无法判断,故A错误,B正确;
溶液B蒸发10g水后析出5g晶体得到溶液C,那么溶液C肯定饱和,故C错误;
如果溶液B已经达到饱和,那么10g水中最多溶解5g该物质,因此溶液C再蒸发10g水时,肯定析出晶体5g。如果溶液B没有达到饱和,那么蒸发10g时,不会马上出现晶体,而是等一段时间才会析出,因此10g水中最多溶解的物质质量肯定大约5g,故D错误。
故选B。
6.【答案】D
【知识点】饱和溶液与不饱和溶液
【解析】【分析】如果溶液底部有未溶的固体存在,那么溶液肯定饱和;如果没有未溶的固体存在,那么溶液是否饱和无法判断。
【解答】有白色固体沉淀到烧杯底部,说明氢氧化钙未全部溶解,溶液已经达到饱和。烧杯中的上层清液是无色透明的氢氧化钙饱和溶液,故D正确,而A、B、C错误。
故选D。
7.【答案】B
【知识点】固体溶解度的概念
【解析】【分析】根据溶解度的定义分析判断。
【解答】20℃时,氯化钠的溶解度为36g/100 g水。
A.20℃时,100g水中最多能溶解氯化钠36g,故A正确不合题意;
B.20℃时,136g氯化钠饱和溶液中含氯化钠36g,故B错误符合题意;
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100:36,故C正确不合题意;
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液,故D正确不合题意。
故选B。
8.【答案】D
【知识点】溶液的组成及特点;固体溶解度的概念
【解析】【分析】根据饱和溶液和溶解度的影响因素的知识判断。
【解答】糖水中,糖为溶质,而水为溶剂,蔗糖析出即溶质质量减小,而对溶剂质量没有影响,故A、C错误;
溶剂质量不变,而溶质质量减小,则溶液的溶质质量分数减小,即浓度减小,故B错误;
原来蔗糖全部溶解,现在蔗糖析出,这说明温度降低后,蔗糖的溶解度减小了,故D正确。
故选D。
9.【答案】D
【知识点】溶解时的吸热或放热现象;溶解度的影响因素
【解析】【分析】根据两种物质的溶解度随温度的变化规律分析判断。
【解答】根据A图可知,硝酸钾的溶解度随温度的降低而减小,氢氧化钙的溶解度随温度的降低而增大。根据B图可知,加入某种物质后,如果甲的固体增加,乙的固体减少,说明温度降低了。
加入食盐和食用油后,水的温度几乎不变,故A、C不合题意;
加入氢氧化钠后会放热,导致温度升高,故B不合题意;
加入硝酸铵后吸热,导致溶液温度降低,故D符合题意。
故选D。
10.【答案】A
【知识点】饱和溶液与不饱和溶液相互转变;固体溶解度的概念
【解析】【分析】(1)当溶液中出现剩余的食盐时,溶液达到饱和,用加入食盐的质量减去剩余食盐质量得到水中溶解的食盐质量;
(2)将不饱和溶液变成饱和溶液的方法:①蒸发溶剂;②增加溶剂;③改变温度;
(3)将溶质和溶剂的质量作比;
(4)根据物质溶解度的影响因素判断。
【解答】A.在第二组食盐中,出现剩余的食盐,则食盐溶液饱和,那么50g水中最多溶解食盐的质量为:20g-2g=18g。而50g饱和食盐溶液中,水的质量肯定小于50g,其中食盐的质量肯定小于18g,故A错误符合题意;
B.用恒温蒸发溶剂的方法可以使不饱和溶液变成饱和溶液,故B正确不合题意;
C.第二组溶液中溶质与溶剂的质量之比:18g:50g=9:25,故C正确不合题意;
D.食盐在水中的溶解度只与温度有关,故D正确不合题意。
故选A。
11.【答案】B
【知识点】固体溶解度的概念
【解析】【分析】当溶液饱和后,析出晶体的质量与蒸发水的质量成正比,据此列式计算即可。
【解答】第一份溶液蒸发10g水析出晶体ag,由于原来为不饱和溶液,因此二者之间不存在定量关系。
蒸发20g水时比蒸发10g水时多蒸发10g水,蒸发30g水时比较蒸发20g水时多蒸发10g水,因此前后两次多析出晶体的质量相等;
即b-a=c-b;
解得:c=2b-a。
故选B。
12.【答案】(1)C
(2)②③
【知识点】饱和溶液与不饱和溶液相互转变;固体溶解度的概念
【解析】【分析】(1)根据图像确定物质溶解度的大小;
(2)将不饱和溶液转化为饱和溶液的方法:①增加溶质;②蒸发溶剂;③改变温度,根据图像确定M点C的不饱和溶液变为饱和溶液的方法即可。
【解答】(1)根据图像可知,t1℃时,溶解度最大的物质是C;
(2)根据图像可知,物质C的溶解度随温度的升高而减小,因此将不饱和溶液变为饱和溶液的方法:升高温度;增加溶质;蒸发溶剂。②③正确。
13.【答案】加热(或升高温度);加水(或增加溶剂);加氢氧化钠(或增加溶质);恒温蒸发水(或恒温蒸发溶剂);降温(或降低温度)
【知识点】饱和溶液与不饱和溶液相互转变
【解析】【分析】根据饱和溶液和不饱和溶液相互转化的方法解答。
【解答】已知硝酸钾和氢氧化钠在水中的溶解度随着温度的升高而增大,则饱和的硝酸钾溶液可以通过加热(或升高温度)、加水(或增加溶剂)等方法,使其变成不饱和溶液。而不饱和的氢氧化钠溶液可以通过加氢氧化钠(或增加溶质)、恒温蒸发水(或恒温蒸发溶剂)、降温(或降低温度)等方法,使其变成饱和溶液。
14.【答案】10(b-a);2b-a
【知识点】固体溶解度的概念
【解析】【分析】(1)蒸发溶剂时,两份溶液先要变成饱和溶液,再析出晶体,则二者析出的晶体质量之差应该是饱和溶液中10g水中析出晶体的质量,最后根据“饱和溶液中溶质与溶剂质量成正比”计算出该物体的溶解度即可;
(2)30g比20g水多10g,则析出晶体的质量比bg应该多10g水中的晶体,据此计算即可。
【解答】(1)该物质的饱和溶液中,10g水中最多溶解晶体:b-a;
根据饱和溶液中溶质与溶剂质量成正比得到,该物体的溶解度:。
(2)30g水中析出晶体比20g水中析出晶体多(b-a)g,那么析出晶体为质量为:b+(b-a)=2b-a。
15.【答案】(1)60克
(2)甲物质的溶解度随着温度的升高而增大或乙物质的溶解度随着温度的升高而减小或20°c时甲、乙物质的溶解度相同
【知识点】溶解度的影响因素
【解析】【分析】(1)根据图像确定甲物质的溶解度;
(2)可根据图像描述两种物质的溶解度随温度的变化规律,或者描述两个图像交点的意义。
【解答】(1)根据图像可知,40℃时,甲物质的溶解度为60g;
(2)①根据图像可知,甲物质的溶解度随着温度的升高而增大(或乙物质的溶解度随着温度的升高而减小)。
②两个图像在20℃时相交,那么得到:20℃时,甲和乙两种物质的溶解度相同。
16.【答案】增大;饱和
【知识点】饱和溶液与不饱和溶液;溶解度的影响因素
【解析】【分析】(1)如果降低温度时有晶体析出,则说明晶体的溶解度随温度降低而减小,也就是随温度升高而增大;
(2)如果溶液有晶体析出,则溶液是饱和的;如果没有晶体析出,那么溶液可能饱和,也可能不饱和。
【解答】(1) 在一定量的水中,明矾的溶解度随温度的升高增大;
(2)明矾晶体析出后剩余的溶液是饱和溶液。
17.【答案】(1)等于
(2)13
(3)B;120g
【知识点】固体溶解度的概念
【解析】【分析】(1)根据图像分析解答;
(2)首先根据图像确定t2℃时乙的溶解度,再根据“相同温度下,同种物质饱和溶液的溶质质量分数相等”列方程计算即可。
(3)如果溶质质量大于或等于溶解度,那么溶液肯定饱和;否则,溶液不饱和。溶液质量=溶质质量+溶剂质量,据此分析解答。
【解答】(1)根据图像可知,两条曲线在t1℃时相交,即:t1℃时,甲的溶解度等于乙的溶解度。
(2)t2℃时,乙的溶解度为15g,
根据“相同温度下,同种物质饱和溶液的溶质质量分数相等”得到:;
解得:x≈13g。
(3)t1℃时,甲的溶解度为20g。A中溶质15g<20g,则A不饱和;B中溶质质量为20g,则B饱和。t2℃时,甲的溶解度为40g,因为20g<40g,所以不饱和。
t1℃时,甲的溶解度为20g,则恢复到t1℃时,溶液的质量为:100g+20g=120g。
试题分析部分
1、试卷总体分布分析
总分:48分
分值分布 客观题(占比) 26.0(54.2%)
主观题(占比) 22.0(45.8%)
题量分布 客观题(占比) 12(70.6%)
主观题(占比) 5(29.4%)
2、试卷题量分布分析
大题题型 题目量(占比) 分值(占比)
填空题 5(29.4%) 22.0(45.8%)
解答题 1(5.9%) 4.0(8.3%)
单选题 11(64.7%) 22.0(45.8%)
3、试卷难度结构分析
序号 难易度 占比
1 普通 (82.4%)
2 容易 (5.9%)
3 困难 (11.8%)
4、试卷知识点分析
序号 知识点(认知水平) 分值(占比) 对应题号
1 饱和溶液与不饱和溶液 16.0(33.3%) 1,2,3,4,5,6,16
2 饱和溶液与不饱和溶液相互转变 14.0(29.2%) 10,12,13
3 固体溶解度的概念 22.0(45.8%) 2,4,7,8,10,11,12,14,17
4 溶液的组成及特点 4.0(8.3%) 3,8
5 溶解度的影响因素 10.0(20.8%) 2,9,15,16
6 溶解时的吸热或放热现象 2.0(4.2%) 9
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
21世纪教育网(www.21cnjy.com)
同课章节目录
