化学人教版(2019)选择性必修2 2.3.2分子间作用力 课件(共20张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 2.3.2分子间作用力 课件(共20张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 7.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-16 20:47:47 | ||
图片预览






文档简介
(共20张PPT)
第二章
分子结构与性质
第三节 分子结构与物质的性质
课时2 分子间作用力
一、范德华力
气态水
液态水
固态水
气体降温加压
会液化
液体降温
会凝固
分子间普遍存在相互作用力
只有分子间充分接近时才有分子间的相互作用力,如固体和液体物质中。
不好好学的,罚抄我的全名
约翰尼斯·迪德里克·范·德·瓦耳斯
(Johannes Diderik van der Waals)
范德华
概念:广泛存在于分子与分子之间的一种作用力,称为范德华力
实质:分子间的一种静电作用
范德华力使得许多物质能以一定的凝聚态(固态和液态)存在。
范德华力没有方向性和饱和性:只要分子周围空间允许,分子总是尽可能多地吸引其他分子;
并不是所有分子间都存在范德华力,如果分子之间的距离足够远,分子之间便没有范德华力
一、范德华力
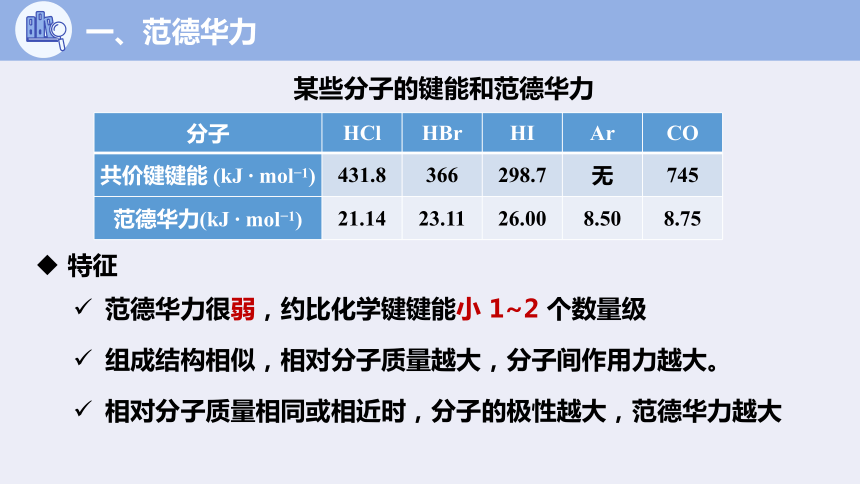
分子 HCl HBr HI Ar CO
共价键键能 (kJ mol 1) 431.8 366 298.7 无 745
范德华力(kJ mol 1) 21.14 23.11 26.00 8.50 8.75
某些分子的键能和范德华力
特征
范德华力很弱,约比化学键键能小 1~2 个数量级
组成结构相似,相对分子质量越大,分子间作用力越大。
相对分子质量相同或相近时,分子的极性越大,范德华力越大
一、范德华力
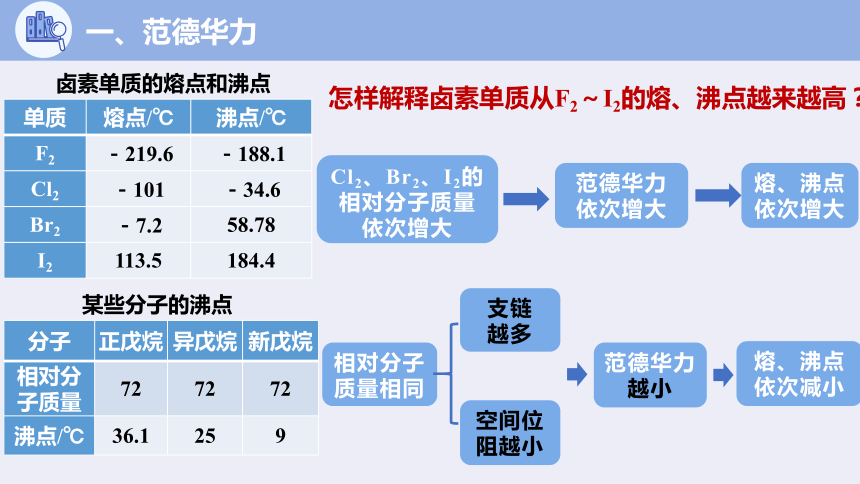
卤素单质的熔点和沸点
单质 熔点/℃ 沸点/℃
F2 -219.6 -188.1
Cl2 -101 -34.6
Br2 -7.2 58.78
I2 113.5 184.4
怎样解释卤素单质从F2~I2的熔、沸点越来越高?
Cl2、Br2、I2的相对分子质量依次增大
范德华力依次增大
熔、沸点依次增大
分子 正戊烷 异戊烷 新戊烷
相对分子质量 72 72 72
沸点/℃ 36.1 25 9
某些分子的沸点
相对分子质量相同
空间位阻越小
范德华力越小
熔、沸点依次减小
支链
越多
一、范德华力
总结:范德华力对物质性质的影响:
①组成结构相似,相对分子质量越大,范德华力越大,熔、沸点越高。
②相对分子质量相近,分子极性越大,范德华力越大,熔、沸点越高。
③同分异构体,支链越多,范德华力越小,熔、沸点越低。
分子 CH4 SiH4 GeH4 SnH4
相对分子质量 16 32 76.6 122.7
沸点/℃
第ⅣA族氢化物的相对分子质量
请大家预测第ⅣA族氢化物随着相对分子质量的增大,它们的沸点如何变化?那第ⅥA族呢?
–161.5
–112
–88
–52
除范德华力之外的另一种特殊的分子间作用力——氢键。
二、氢键
δ+
δ-
δ+
δ-
δ+
δ+
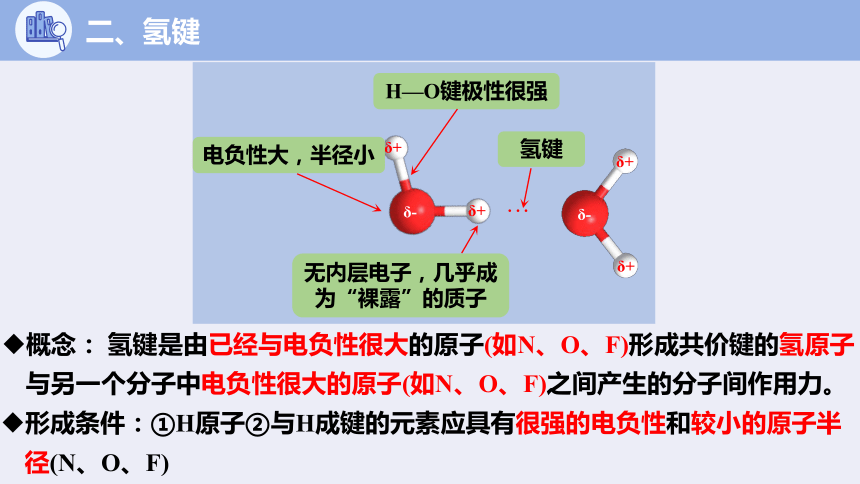
电负性大,半径小
无内层电子,几乎成为“裸露”的质子
H—O键极性很强
氢键
概念: 氢键是由已经与电负性很大的原子(如N、O、F)形成共价键的氢原子与另一个分子中电负性很大的原子(如N、O、F)之间产生的分子间作用力。
形成条件:①H原子②与H成键的元素应具有很强的电负性和较小的原子半径(N、O、F)
二、氢键
一个水分子最多能形成几个氢键?
水分子间形成以一个水分子为中心的正四面体结构,故每个水分子与相邻四个水分子形成四个氢键,而二个水分子共一个氢键,故一个水分子可形成二个氢键。
二、氢键
氢键如何用化学符号表示?
氢键通常用A—H…B表示,其中A、B为 、 、 中的一种,“—”表示 ,“…”表示形成的 。
N
O
F
共价键
氢键
H2O
HF
NH3
H2O
HF
NH3
练习:请表达出氢氟酸溶液中氢键的种类
二、氢键
氢键的特征:
氢键不是化学键,是一种特殊的分子间作用力。
键的强度:共价键>氢键 >范德华力
467 11 18.8
力
以冰晶体为例:
具有方向性和饱和性
方向性:X—H Y三个原子尽可能在同一条直线上。(能量最低,作用力最强);H原子沿受体杂原子的孤对电子电子方向靠近。
180°
饱和性:通常情况下,每个裸露的氢原子核只能形成一个氢键。
二、氢键
氢键存在键长和键能
氢键X—H···Y 键能/(kJ·mol-1) 键长/pm 代表性例子
F—H···F 28.1 255 (HF)n
O—H···O 18.8 276 冰
O—H···O 25.9 266 甲醇、乙醇
N—H···F 20.9 268 NH4F
N—H···O 20.9 286 CH3CONH2
N—H···N 5.4 338 NH3
氢键键长一般定义为A—H···B的长度,而不是H···B的长度。
氢键是电负性强的元素原子和氢原子之间的作用力。一般来说,电负性差值越大,则氢键的键能越大。
二、氢键
名称 熔点/℃ 沸点/℃
邻羟基苯甲醛 -7 196.5
对羟基苯甲醛 115 250
邻羟基苯甲醛
(熔点-7 ℃)
对羟基苯甲醛
(熔点115 ℃)
氢键不仅存在于分子间,还存在于分子内。
分子间氢键对熔沸点的影响大于分子内氢键
一旦分子内氢键形成,分子间氢键就无法形成了
分子内氢键:使物质熔、沸点降低。
分子间氢键:使物质熔、沸点升高。
二、氢键
生物大分子中的氢键
二、氢键
1、对物质熔沸点的影响
氢键使物质熔沸点显著增大;
分子间氢键对熔沸点的影响大于分子内氢键。
2、对物质溶解性的影响
若溶质与溶剂之间存在氢键,会增大溶质在溶剂中的溶解性
例如:NH3极易溶于水因为NH3与H2O之间形成了氢键
3、对液体黏度的影响
分子间形成氢键会使液体黏度增大,例如浓硫酸、甘油等
二、氢键
4、对水部分性质的解释
解释水和冰的密度不同:水的密度为1.0g/cm3,冰的密度为0.9g/cm3
冰中水分子大范围以氢键联结,形成相当疏松晶体,结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
氢键具有饱和性和方向性
二、氢键
4、对水部分性质的解释
解释水的密度变化:水在4℃时有最大密度:1.0g/cm3
冰晶结构受热不断破坏,分子间距减小,体积减小,密度增大;
分子间距受热不断增大,体积增大,密度减小;
4℃之前前者占优势,4℃时两者相当,4℃之后后者占优势
ρ
T
4
1
二、氢键
4、对水部分性质的解释
解释接近水的沸点时,水蒸气的相对分子质量测定值比按化学式H2O计算出来的相对分子质量大一些。
接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合,形成所谓的缔合水分子。
5、对水部分性质的解释
解释为什么醇类物质(如乙醇)与水可以互溶
CH3CH2O—H···O
H
H
溶质分子和溶剂分子之间形成氢键
二、氢键
范德华力
氢键
分子间的作用力
概念、本质、特征
范德华力对物质熔、沸点的影响
概念、实质
构成条件、特征
表示方法
氢键对物质性质的影响
第二章
分子结构与性质
第三节 分子结构与物质的性质
课时2 分子间作用力
一、范德华力
气态水
液态水
固态水
气体降温加压
会液化
液体降温
会凝固
分子间普遍存在相互作用力
只有分子间充分接近时才有分子间的相互作用力,如固体和液体物质中。
不好好学的,罚抄我的全名
约翰尼斯·迪德里克·范·德·瓦耳斯
(Johannes Diderik van der Waals)
范德华
概念:广泛存在于分子与分子之间的一种作用力,称为范德华力
实质:分子间的一种静电作用
范德华力使得许多物质能以一定的凝聚态(固态和液态)存在。
范德华力没有方向性和饱和性:只要分子周围空间允许,分子总是尽可能多地吸引其他分子;
并不是所有分子间都存在范德华力,如果分子之间的距离足够远,分子之间便没有范德华力
一、范德华力
分子 HCl HBr HI Ar CO
共价键键能 (kJ mol 1) 431.8 366 298.7 无 745
范德华力(kJ mol 1) 21.14 23.11 26.00 8.50 8.75
某些分子的键能和范德华力
特征
范德华力很弱,约比化学键键能小 1~2 个数量级
组成结构相似,相对分子质量越大,分子间作用力越大。
相对分子质量相同或相近时,分子的极性越大,范德华力越大
一、范德华力
卤素单质的熔点和沸点
单质 熔点/℃ 沸点/℃
F2 -219.6 -188.1
Cl2 -101 -34.6
Br2 -7.2 58.78
I2 113.5 184.4
怎样解释卤素单质从F2~I2的熔、沸点越来越高?
Cl2、Br2、I2的相对分子质量依次增大
范德华力依次增大
熔、沸点依次增大
分子 正戊烷 异戊烷 新戊烷
相对分子质量 72 72 72
沸点/℃ 36.1 25 9
某些分子的沸点
相对分子质量相同
空间位阻越小
范德华力越小
熔、沸点依次减小
支链
越多
一、范德华力
总结:范德华力对物质性质的影响:
①组成结构相似,相对分子质量越大,范德华力越大,熔、沸点越高。
②相对分子质量相近,分子极性越大,范德华力越大,熔、沸点越高。
③同分异构体,支链越多,范德华力越小,熔、沸点越低。
分子 CH4 SiH4 GeH4 SnH4
相对分子质量 16 32 76.6 122.7
沸点/℃
第ⅣA族氢化物的相对分子质量
请大家预测第ⅣA族氢化物随着相对分子质量的增大,它们的沸点如何变化?那第ⅥA族呢?
–161.5
–112
–88
–52
除范德华力之外的另一种特殊的分子间作用力——氢键。
二、氢键
δ+
δ-
δ+
δ-
δ+
δ+
电负性大,半径小
无内层电子,几乎成为“裸露”的质子
H—O键极性很强
氢键
概念: 氢键是由已经与电负性很大的原子(如N、O、F)形成共价键的氢原子与另一个分子中电负性很大的原子(如N、O、F)之间产生的分子间作用力。
形成条件:①H原子②与H成键的元素应具有很强的电负性和较小的原子半径(N、O、F)
二、氢键
一个水分子最多能形成几个氢键?
水分子间形成以一个水分子为中心的正四面体结构,故每个水分子与相邻四个水分子形成四个氢键,而二个水分子共一个氢键,故一个水分子可形成二个氢键。
二、氢键
氢键如何用化学符号表示?
氢键通常用A—H…B表示,其中A、B为 、 、 中的一种,“—”表示 ,“…”表示形成的 。
N
O
F
共价键
氢键
H2O
HF
NH3
H2O
HF
NH3
练习:请表达出氢氟酸溶液中氢键的种类
二、氢键
氢键的特征:
氢键不是化学键,是一种特殊的分子间作用力。
键的强度:共价键>氢键 >范德华力
467 11 18.8
力
以冰晶体为例:
具有方向性和饱和性
方向性:X—H Y三个原子尽可能在同一条直线上。(能量最低,作用力最强);H原子沿受体杂原子的孤对电子电子方向靠近。
180°
饱和性:通常情况下,每个裸露的氢原子核只能形成一个氢键。
二、氢键
氢键存在键长和键能
氢键X—H···Y 键能/(kJ·mol-1) 键长/pm 代表性例子
F—H···F 28.1 255 (HF)n
O—H···O 18.8 276 冰
O—H···O 25.9 266 甲醇、乙醇
N—H···F 20.9 268 NH4F
N—H···O 20.9 286 CH3CONH2
N—H···N 5.4 338 NH3
氢键键长一般定义为A—H···B的长度,而不是H···B的长度。
氢键是电负性强的元素原子和氢原子之间的作用力。一般来说,电负性差值越大,则氢键的键能越大。
二、氢键
名称 熔点/℃ 沸点/℃
邻羟基苯甲醛 -7 196.5
对羟基苯甲醛 115 250
邻羟基苯甲醛
(熔点-7 ℃)
对羟基苯甲醛
(熔点115 ℃)
氢键不仅存在于分子间,还存在于分子内。
分子间氢键对熔沸点的影响大于分子内氢键
一旦分子内氢键形成,分子间氢键就无法形成了
分子内氢键:使物质熔、沸点降低。
分子间氢键:使物质熔、沸点升高。
二、氢键
生物大分子中的氢键
二、氢键
1、对物质熔沸点的影响
氢键使物质熔沸点显著增大;
分子间氢键对熔沸点的影响大于分子内氢键。
2、对物质溶解性的影响
若溶质与溶剂之间存在氢键,会增大溶质在溶剂中的溶解性
例如:NH3极易溶于水因为NH3与H2O之间形成了氢键
3、对液体黏度的影响
分子间形成氢键会使液体黏度增大,例如浓硫酸、甘油等
二、氢键
4、对水部分性质的解释
解释水和冰的密度不同:水的密度为1.0g/cm3,冰的密度为0.9g/cm3
冰中水分子大范围以氢键联结,形成相当疏松晶体,结构中有许多空隙,造成体积膨胀,密度减小,因此冰能浮在水面上。
氢键具有饱和性和方向性
二、氢键
4、对水部分性质的解释
解释水的密度变化:水在4℃时有最大密度:1.0g/cm3
冰晶结构受热不断破坏,分子间距减小,体积减小,密度增大;
分子间距受热不断增大,体积增大,密度减小;
4℃之前前者占优势,4℃时两者相当,4℃之后后者占优势
ρ
T
4
1
二、氢键
4、对水部分性质的解释
解释接近水的沸点时,水蒸气的相对分子质量测定值比按化学式H2O计算出来的相对分子质量大一些。
接近水的沸点的水蒸气中存在相当量的水分子因氢键而相互缔合,形成所谓的缔合水分子。
5、对水部分性质的解释
解释为什么醇类物质(如乙醇)与水可以互溶
CH3CH2O—H···O
H
H
溶质分子和溶剂分子之间形成氢键
二、氢键
范德华力
氢键
分子间的作用力
概念、本质、特征
范德华力对物质熔、沸点的影响
概念、实质
构成条件、特征
表示方法
氢键对物质性质的影响
