化学人教版(2019)选择性必修1 4.3金属的腐蚀与防护 课件(共27张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 4.3金属的腐蚀与防护 课件(共27张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 27.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-16 20:48:34 | ||
图片预览






文档简介
(共27张PPT)
选择性必修1
第四章 化学反应与电能
第三节 金属的腐蚀与防护
01
03
02
宏观辨识与微观探析
科学态度与社会责任
科学探究与创新意识
通过观察到的实验现象,证据推理得到实验结论,初步形成分析推理、对比归纳的能力及宏观辨识与微观探析的核心素养。
通过对金属腐蚀原理的探析, 加深对与原电池工作原理的认识初步建立金属腐蚀的基本模型,提高设计实验能力、创新能力及模型认知能力。
通过创设真实有意义的教学情境,认识化学知识与人类生活的密切联系,体会化学科学的重要性,激发学生积极参与学习的激情,感受科学精神与社会责任核心素养。
学习目标
任务一 探究金属腐蚀的原理
品 名:一次性保暖贴
主要成分:铁粉、活性炭、食盐、水、蛭石、 吸水性树脂。
使用说明:使用时将外包装袋撕开,取出内袋,将保护纸揭下,贴在需要取暖或热敷部位的内衣外侧;严禁直接接触皮肤。
“暖宝宝”是冬天保暖措施之一, 请结合一次性保暖贴的说明书
思考讨论:保暖贴的发热原理是什么?
实验目的: 探究O2 是否参与反应
实验用品:铁-碳粉、食盐水、锥形瓶、导管(带塞)、烧杯
实验方案:
实验现象:
实验结论:
任务一 探究金属腐蚀的原理
如右图
实验目的: 探究O2 是否参与反应
实验用品:铁-碳粉、食盐水、锥形瓶、导管(带塞)、烧杯
实验方案:
实验现象:
实验结论:
任务一 探究金属腐蚀的原理
氧气参与反应
右端导管中的液面上升
如右图
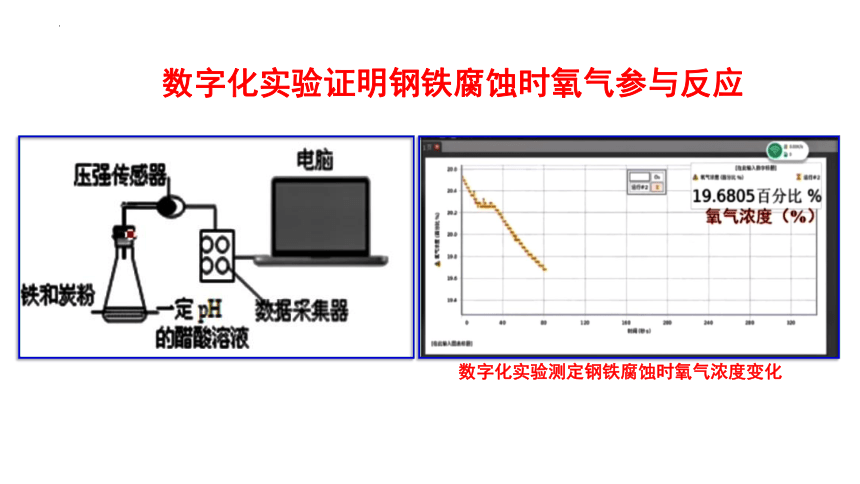
数字化实验证明钢铁腐蚀时氧气参与反应
数字化实验测定钢铁腐蚀时氧气浓度变化
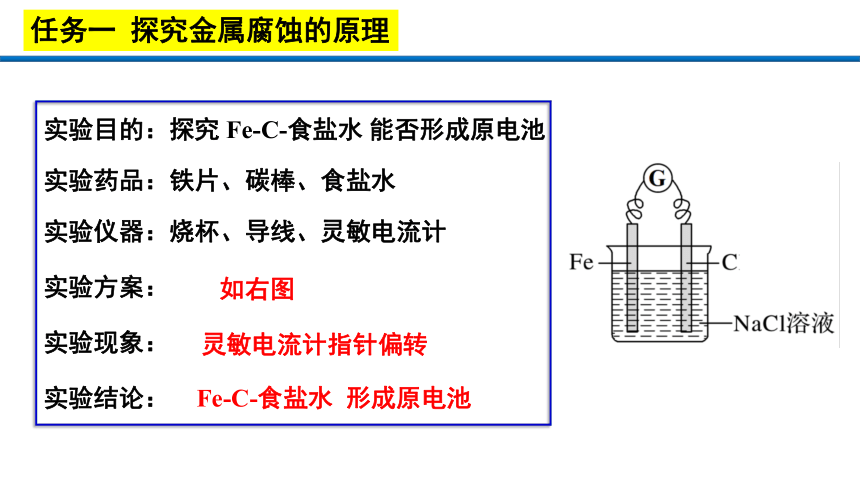
实验目的:探究 Fe-C-食盐水 能否形成原电池
实验药品:铁片、碳棒、食盐水
实验仪器:烧杯、导线、灵敏电流计
实验方案:
实验现象:
实验结论:
任务一 探究金属腐蚀的原理
Fe-C-食盐水 形成原电池
灵敏电流计指针偏转
如右图
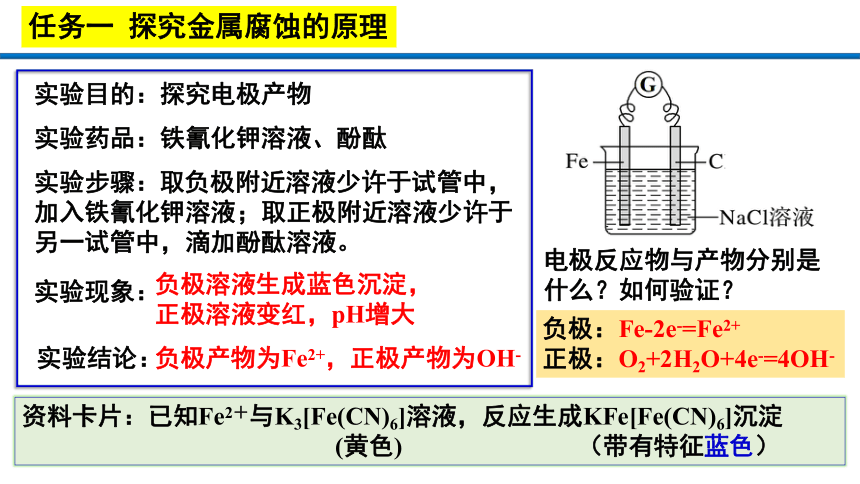
实验目的:探究电极产物
实验药品:铁氰化钾溶液、酚酞
实验步骤:
实验现象:
实验结论:
负极溶液生成蓝色沉淀,
正极溶液变红,pH增大
负极产物为Fe2+,正极产物为OH-
任务一 探究金属腐蚀的原理
负极:Fe-2e-=Fe2+
正极:O2+2H2O+4e-=4OH-
电极反应物与产物分别是
什么?如何验证?
资料卡片:已知Fe2+与K3[Fe(CN)6]溶液,反应生成KFe[Fe(CN)6]沉淀
(黄色) (带有特征蓝色)
取负极附近溶液少许于试管中,
加入铁氰化钾溶液;取正极附近溶液少许于
另一试管中,滴加酚酞溶液。
负极材料
离子导体
正极材料
电子导体
电极反应
电极产物
微观过程
电极
反应物
失电子
氧化反应
电子移动方向
自发的氧化还原反应
得电子
还原反应
Fe-2e-=Fe2+
O2+4e-+2H2O=4OH-
2Fe+O2+2H2O=2Fe(OH)2
/
Fe
Fe
/
O2
C
Fe2+
OH-
Fe(OH)3
Fe2O3 nH2O
宏观现象
原理维度
装置维度
NaCl溶液
导线
阳离子
阴离子
任务一 探究金属腐蚀的原理
吸氧腐蚀
模型构建
任务一 探究金属腐蚀的原理
文献研究表明SO2、NO2 会加重钢的腐蚀,请结合原电池原理来分析原因。
析氢腐蚀
负极:Fe - 2e- = Fe2+
正极:2H+ + 2e- = H2↑
总反应:
Fe +2H+ =
Fe2+ + H2↑
1.结合图像分析吸氧腐蚀
与析氢腐蚀时溶液的pH。
2. pH不同时,正极放电
物质不同的原因。
交流讨论:
酸性条件下析氢腐蚀与吸氧腐蚀同时发生;
pH在2.0~3.5时,主要发生
析氢腐蚀,pH≥4.0时主要发生吸氧腐蚀。
任务一 探究金属腐蚀的原理
不同pH条件下体系压强随时间的变化情况
水膜酸性较强,
c(H+)较大
氧化性
H+>O2
析氢腐蚀
2H++ 2e- = H2↑
水膜酸性较弱或呈
中性,c(H+)较小
氧化性
H+吸氧腐蚀
O2+2H2O+4e-=4OH-
或O2+4H++4e-=2H2O
浓度
性质
反应
影响
决定
归纳总结
负极材料
离子导体
正极材料
电化学腐蚀
中性或
弱酸性环境
酸性环境
e-
e-
/
得电子
还原反应
O2
C
OH-
/
C
H+
H2
/
失电子
氧化反应
Fe
Fe
Fe2+
/
Fe
Fe
Fe2+
吸氧腐蚀
析氢腐蚀
原电池反应
负极:
被腐蚀的金属
M -ne- = Mn+
正极:
不活泼金属
或杂质
离子导体:
潮湿空气或
电解质溶液
概括提升
模型完善
1. 含义:
金属或合金与周围的气体或液体发生氧化还原反应而引起损耗的现象。
2. 本质:
金属单质失电子被氧化成阳离子。
金属的腐蚀
输送原油的钢管在无水无氧的情况下被腐蚀而漏油
任务一 探究金属腐蚀的原理
化学腐蚀:
金属与其表面接触的一些物质(如O2, Cl2, SO2等 )直接反应而引起的腐蚀。
经济
据统计,我国每年因金属腐蚀而造成的损失
约占国民生产总值的3%~5%,远远超过各
项大灾损失的总和。
安全
腐蚀不仅造成经济损失,也常造成安全
事故。如油管因裂缝而漏油,引起着火
爆炸;桥梁因钢梁产生裂缝而塌陷等。
腐蚀的危害
【探究时间】3分钟
任务二 探究金属的防护方法
【探究内容】假如你们组是港珠澳大桥(主梁使用了约42万吨的钢铁)的设计成员,从金属腐蚀的本质及原理出发,设计防腐方案。
【探究要求】小组为单位,积极发言,互相启发,小组长负责整理记录。
【成果展示】小组代表分享成果
任务二 探究金属的防护方法
3、 电化学保护法
1、改变金属材料的组成,如不锈钢
2、在金属表面覆盖保护层,如电镀、喷漆
牺牲阳极法
(原电池原理)
外加电流法
(电解池原理)
海水
比Fe活泼的电极
海水
惰性电极
习近平总书记提出
“蓝色信念”
要进一步关心海洋、认识海洋、经略海洋,推动我国的海洋强国建设不断取得新成就。建设海洋强国是中国特色社会主义事业的重要组成部分。
双重防腐缓蚀剂
新型防腐材料:缓蚀涂层
扬波大海,走向深蓝,期待将来的你们,发现更多的防腐材料和技术。
任务三 金属腐蚀的应用
矛盾的对立统一规律揭示任何事物都具有两面性
哲学
化腐朽为神奇
金属腐蚀
化学能转化为电能
化学能转化为热能
动力电池
能量变化
探究金属腐蚀
的原理
装置要素与原理要素
实验探究与数据分析
金属的腐蚀
电化学腐蚀
化学腐蚀
金属的防护
切断原电池反应
给予金属电子
物质变化
腐蚀原理
的应用
原理维度
装置维度
电极反应物
电极产物
微观过程
宏观现象
负极
正极
电子导体
离子导体
从生活中来 到生活中去
发现问题
分析问题
解决问题
创造应用
课堂小结
析氢腐蚀 吸氧腐蚀
条件
电极反应 负极Fe(-)
正极C(+)
总反应 进一步反应
联系
水膜呈酸性
水膜酸性很弱或呈中性
2H +2e = H2
+
_
2Fe-4e =2Fe
2+
_
Fe-2e =Fe
2+
_
O2+2H2O+4e = 4OH
_
_
2Fe+2H2O+O2= 2 Fe(OH)2
Fe +2H =
+
Fe + H2
2+
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe2O3 · nH2O
通常两种腐蚀同时存在,但以吸氧腐蚀为主。
学习评价
食品脱氧剂可吸收氧气,减缓食品氧化作用,有效地抑制霉菌和好氧性细菌的生长,延长食品保质期。
请结合所学知识及实际需求,设计一款食品脱氧剂。
作业布置
敬请批评指正
谢 谢
选择性必修1
第四章 化学反应与电能
第三节 金属的腐蚀与防护
01
03
02
宏观辨识与微观探析
科学态度与社会责任
科学探究与创新意识
通过观察到的实验现象,证据推理得到实验结论,初步形成分析推理、对比归纳的能力及宏观辨识与微观探析的核心素养。
通过对金属腐蚀原理的探析, 加深对与原电池工作原理的认识初步建立金属腐蚀的基本模型,提高设计实验能力、创新能力及模型认知能力。
通过创设真实有意义的教学情境,认识化学知识与人类生活的密切联系,体会化学科学的重要性,激发学生积极参与学习的激情,感受科学精神与社会责任核心素养。
学习目标
任务一 探究金属腐蚀的原理
品 名:一次性保暖贴
主要成分:铁粉、活性炭、食盐、水、蛭石、 吸水性树脂。
使用说明:使用时将外包装袋撕开,取出内袋,将保护纸揭下,贴在需要取暖或热敷部位的内衣外侧;严禁直接接触皮肤。
“暖宝宝”是冬天保暖措施之一, 请结合一次性保暖贴的说明书
思考讨论:保暖贴的发热原理是什么?
实验目的: 探究O2 是否参与反应
实验用品:铁-碳粉、食盐水、锥形瓶、导管(带塞)、烧杯
实验方案:
实验现象:
实验结论:
任务一 探究金属腐蚀的原理
如右图
实验目的: 探究O2 是否参与反应
实验用品:铁-碳粉、食盐水、锥形瓶、导管(带塞)、烧杯
实验方案:
实验现象:
实验结论:
任务一 探究金属腐蚀的原理
氧气参与反应
右端导管中的液面上升
如右图
数字化实验证明钢铁腐蚀时氧气参与反应
数字化实验测定钢铁腐蚀时氧气浓度变化
实验目的:探究 Fe-C-食盐水 能否形成原电池
实验药品:铁片、碳棒、食盐水
实验仪器:烧杯、导线、灵敏电流计
实验方案:
实验现象:
实验结论:
任务一 探究金属腐蚀的原理
Fe-C-食盐水 形成原电池
灵敏电流计指针偏转
如右图
实验目的:探究电极产物
实验药品:铁氰化钾溶液、酚酞
实验步骤:
实验现象:
实验结论:
负极溶液生成蓝色沉淀,
正极溶液变红,pH增大
负极产物为Fe2+,正极产物为OH-
任务一 探究金属腐蚀的原理
负极:Fe-2e-=Fe2+
正极:O2+2H2O+4e-=4OH-
电极反应物与产物分别是
什么?如何验证?
资料卡片:已知Fe2+与K3[Fe(CN)6]溶液,反应生成KFe[Fe(CN)6]沉淀
(黄色) (带有特征蓝色)
取负极附近溶液少许于试管中,
加入铁氰化钾溶液;取正极附近溶液少许于
另一试管中,滴加酚酞溶液。
负极材料
离子导体
正极材料
电子导体
电极反应
电极产物
微观过程
电极
反应物
失电子
氧化反应
电子移动方向
自发的氧化还原反应
得电子
还原反应
Fe-2e-=Fe2+
O2+4e-+2H2O=4OH-
2Fe+O2+2H2O=2Fe(OH)2
/
Fe
Fe
/
O2
C
Fe2+
OH-
Fe(OH)3
Fe2O3 nH2O
宏观现象
原理维度
装置维度
NaCl溶液
导线
阳离子
阴离子
任务一 探究金属腐蚀的原理
吸氧腐蚀
模型构建
任务一 探究金属腐蚀的原理
文献研究表明SO2、NO2 会加重钢的腐蚀,请结合原电池原理来分析原因。
析氢腐蚀
负极:Fe - 2e- = Fe2+
正极:2H+ + 2e- = H2↑
总反应:
Fe +2H+ =
Fe2+ + H2↑
1.结合图像分析吸氧腐蚀
与析氢腐蚀时溶液的pH。
2. pH不同时,正极放电
物质不同的原因。
交流讨论:
酸性条件下析氢腐蚀与吸氧腐蚀同时发生;
pH在2.0~3.5时,主要发生
析氢腐蚀,pH≥4.0时主要发生吸氧腐蚀。
任务一 探究金属腐蚀的原理
不同pH条件下体系压强随时间的变化情况
水膜酸性较强,
c(H+)较大
氧化性
H+>O2
析氢腐蚀
2H++ 2e- = H2↑
水膜酸性较弱或呈
中性,c(H+)较小
氧化性
H+
O2+2H2O+4e-=4OH-
或O2+4H++4e-=2H2O
浓度
性质
反应
影响
决定
归纳总结
负极材料
离子导体
正极材料
电化学腐蚀
中性或
弱酸性环境
酸性环境
e-
e-
/
得电子
还原反应
O2
C
OH-
/
C
H+
H2
/
失电子
氧化反应
Fe
Fe
Fe2+
/
Fe
Fe
Fe2+
吸氧腐蚀
析氢腐蚀
原电池反应
负极:
被腐蚀的金属
M -ne- = Mn+
正极:
不活泼金属
或杂质
离子导体:
潮湿空气或
电解质溶液
概括提升
模型完善
1. 含义:
金属或合金与周围的气体或液体发生氧化还原反应而引起损耗的现象。
2. 本质:
金属单质失电子被氧化成阳离子。
金属的腐蚀
输送原油的钢管在无水无氧的情况下被腐蚀而漏油
任务一 探究金属腐蚀的原理
化学腐蚀:
金属与其表面接触的一些物质(如O2, Cl2, SO2等 )直接反应而引起的腐蚀。
经济
据统计,我国每年因金属腐蚀而造成的损失
约占国民生产总值的3%~5%,远远超过各
项大灾损失的总和。
安全
腐蚀不仅造成经济损失,也常造成安全
事故。如油管因裂缝而漏油,引起着火
爆炸;桥梁因钢梁产生裂缝而塌陷等。
腐蚀的危害
【探究时间】3分钟
任务二 探究金属的防护方法
【探究内容】假如你们组是港珠澳大桥(主梁使用了约42万吨的钢铁)的设计成员,从金属腐蚀的本质及原理出发,设计防腐方案。
【探究要求】小组为单位,积极发言,互相启发,小组长负责整理记录。
【成果展示】小组代表分享成果
任务二 探究金属的防护方法
3、 电化学保护法
1、改变金属材料的组成,如不锈钢
2、在金属表面覆盖保护层,如电镀、喷漆
牺牲阳极法
(原电池原理)
外加电流法
(电解池原理)
海水
比Fe活泼的电极
海水
惰性电极
习近平总书记提出
“蓝色信念”
要进一步关心海洋、认识海洋、经略海洋,推动我国的海洋强国建设不断取得新成就。建设海洋强国是中国特色社会主义事业的重要组成部分。
双重防腐缓蚀剂
新型防腐材料:缓蚀涂层
扬波大海,走向深蓝,期待将来的你们,发现更多的防腐材料和技术。
任务三 金属腐蚀的应用
矛盾的对立统一规律揭示任何事物都具有两面性
哲学
化腐朽为神奇
金属腐蚀
化学能转化为电能
化学能转化为热能
动力电池
能量变化
探究金属腐蚀
的原理
装置要素与原理要素
实验探究与数据分析
金属的腐蚀
电化学腐蚀
化学腐蚀
金属的防护
切断原电池反应
给予金属电子
物质变化
腐蚀原理
的应用
原理维度
装置维度
电极反应物
电极产物
微观过程
宏观现象
负极
正极
电子导体
离子导体
从生活中来 到生活中去
发现问题
分析问题
解决问题
创造应用
课堂小结
析氢腐蚀 吸氧腐蚀
条件
电极反应 负极Fe(-)
正极C(+)
总反应 进一步反应
联系
水膜呈酸性
水膜酸性很弱或呈中性
2H +2e = H2
+
_
2Fe-4e =2Fe
2+
_
Fe-2e =Fe
2+
_
O2+2H2O+4e = 4OH
_
_
2Fe+2H2O+O2= 2 Fe(OH)2
Fe +2H =
+
Fe + H2
2+
4Fe(OH)2+2H2O+O2=4Fe(OH)3
Fe2O3 · nH2O
通常两种腐蚀同时存在,但以吸氧腐蚀为主。
学习评价
食品脱氧剂可吸收氧气,减缓食品氧化作用,有效地抑制霉菌和好氧性细菌的生长,延长食品保质期。
请结合所学知识及实际需求,设计一款食品脱氧剂。
作业布置
敬请批评指正
谢 谢
