3.2.1元素与元素符号课件(共33张PPT内嵌视频)2023-2024学年度沪教版化学九年级上册
文档属性
| 名称 | 3.2.1元素与元素符号课件(共33张PPT内嵌视频)2023-2024学年度沪教版化学九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 10.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-16 00:00:00 | ||
图片预览







文档简介
(共33张PPT)
课时1 元素与元素符号
九年级上册
沪教版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1.知道元素的分类。
2.知道元素是组成物质的基本成分,不同种元素最本质的区别是质子数不同。形成“化学变化过程中原子不变,元素不变”的观念。
3.了解元素符号所表示的意义。会用元素符号来表示元素和
原子。
4.认识元素周期表并能从元素周期表中得到一些信息。
5.能区别单质和化合物,能从元素组成上认识氧化物。
难点
重点
重点
视频中说“钙是人体中含量最多的矿物质”,这里的“钙”指的是什么?
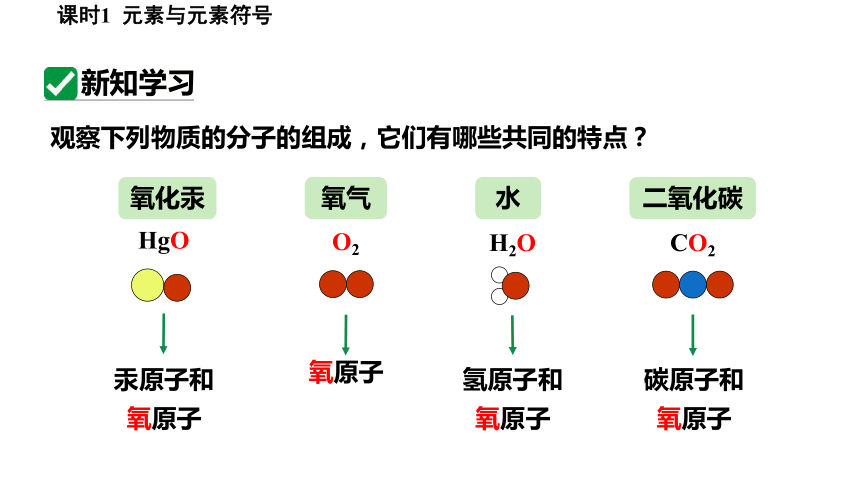
氧化汞
HgO
汞原子和
氧原子
水
H2O
氢原子和
氧原子
CO2
二氧化碳
碳原子和
氧原子
氧气
O2
氧原子
观察下列物质的分子的组成,它们有哪些共同的特点?
新知学习
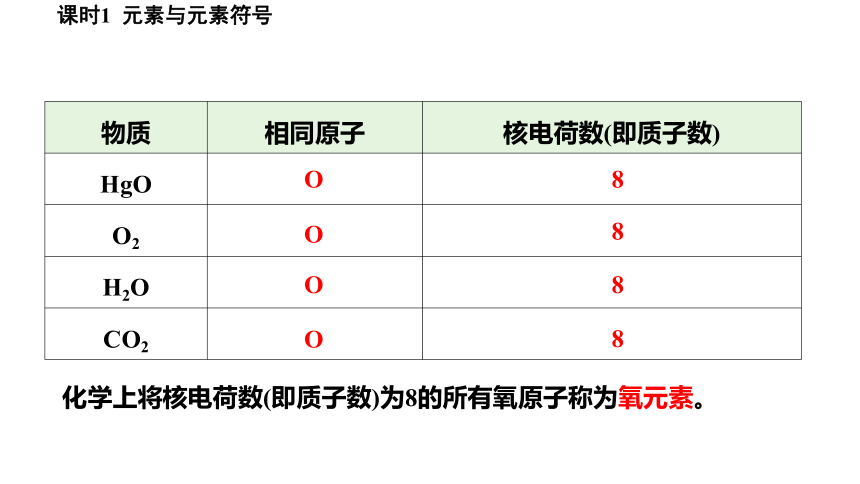
物质 相同原子 核电荷数(即质子数)
HgO
O2
H2O
CO2
8
8
8
8
O
O
O
O
化学上将核电荷数(即质子数)为8的所有氧原子称为氧元素。
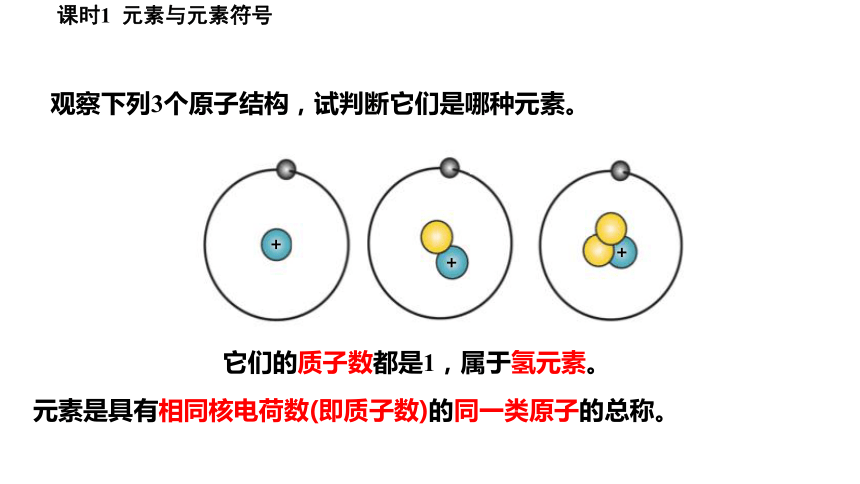
观察下列3个原子结构,试判断它们是哪种元素。
+
+
+
它们的质子数都是1,属于氢元素。
元素是具有相同核电荷数(即质子数)的同一类原子的总称。
1.元素的种类由质子数决定。
2.碳元素与氧元素的本质区别是原子的最外层电子数不同。
3.钠原子和钠离子属于同种元素。
4.质子数相同的微粒属于同一种元素。
判断下列说法是否正确
正确
错误
正确
错误
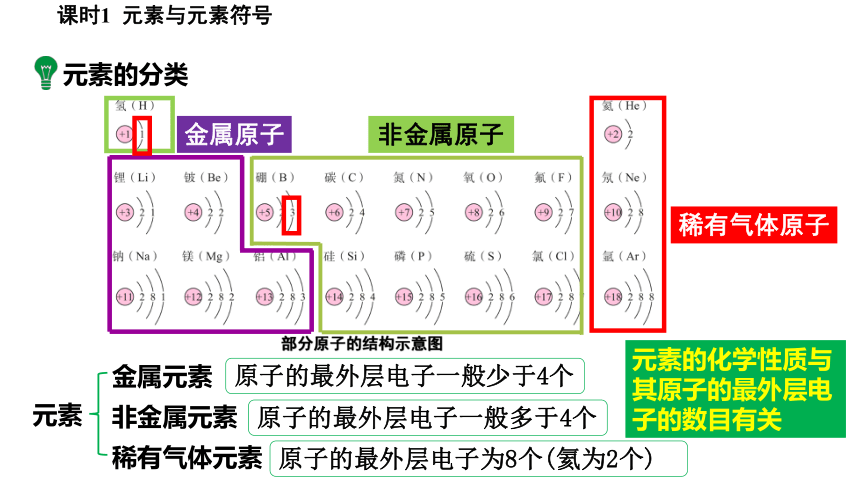
元素的化学性质与其原子的最外层电子的数目有关
元素的分类
部分原子的结构示意图
金属原子
非金属原子
稀有气体原子
原子的最外层电子一般少于4个
原子的最外层电子一般多于4个
原子的最外层电子为8个(氦为2个)
非金属元素
稀有气体元素
元素
金属元素
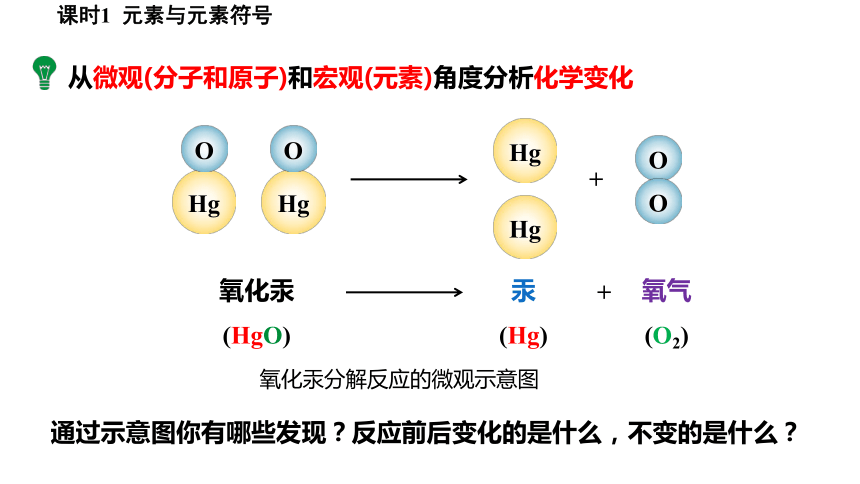
从微观(分子和原子)和宏观(元素)角度分析化学变化
Hg
O
Hg
O
O
O
Hg
Hg
+
氧化汞
(HgO)
汞
(Hg)
氧气
(O2)
+
氧化汞分解反应的微观示意图
通过示意图你有哪些发现?反应前后变化的是什么,不变的是什么?
如果用汉字来表示一百多种元素以及由它们组成的几千万种物质将十分麻烦 。另外,不同国家用不同的文字表示元素,将变得很难交流。
Oxygen
这里面装的是哪种化学物质?
国际规定:国际上统一采用元素拉丁文名称的第一个字母来表示元素,如果几种元素拉丁文名称的第一个字母相同时,就附加一个小写字母来区别。
氢(H)、氦(He)
碳(C)、氯(Cl)、钙(Ca)
氮(N)、氖(Ne)、钠(Na)
举例:
书写原则
(1)由一个字母表示的元素符号要大写。如:H、O、N等
(2)由两个字母表示的元素符号,第一个字母大写,第二个字母小写。
如: Cu 、Ca 、Ne、Na、Mg、 Mn等
碳 氧 镁
铝 铜 氯
O
C
Mg
Al
Cu
Cl
书写元素符号要规范
“一大二小”要分清
注意:容易写错的元素符号
钴 和 一氧化碳
钙 和 铜
银 和 汞
Co 和 CO
Ca 和 Cu
Ag 和 Hg
元素符号的意义
(1)元素符号的两种意义
宏观意义:
~表示一种元素
~表示一种物质(适用于由原子直接构成的物质)
微观意义:
~表示这种元素的一个原子
注意:当元素符号前有数字时,只有微观意义,没有宏观意义。
2Cl
2个氯原子
H
表示氢元素 1个氢原子
Cu
你能说出下列符号所表示的意义吗?
6Al
铜元素、
6个铝原子
铜、
1个铜原子
写出相应的化学符号:
5个氧原子: 氮元素 : n个钠原子:
5O
N
nNa
1869年2月,俄国科学家门捷列夫编制了他的第一张元素周期表,表中除收入了当时已知的63种元素外,还给尚未发现的元素留下了27个空位,并大胆地预言了11种未知的新元素和它们在元素周期表的位置,同时根据它们的性质取了名字,如类铝、类硼、类硅等,后来都得到了验证。
元素周期表的发现
原子序数=核电荷数 = 质子数 = 核外电子数
元素周期表按元素原子核电荷数递增的顺序给元素编了号,这个编号就是原子序数。
(1) 横行(周期):共有7个横行,每一横行叫一个周期,共7个周期。
(2) 纵行( 族 ):共有18个纵行,每一纵行叫一族,共16族
(其中8、9、10三个纵行共同组成一个族)。
(3) 每一格:每一格包括元素的原子序数、元素符号、元素名称、相对原子质量
(4) 元素周期表的起始:
元素周期表的规律
稀有气体元素
金属元素
非金属元素
元素周期表中元素所在单元格信息
原子序数
相对原子质量
元素符号
元素名称
原子序数=核电荷数 = 质子数 = 核外电子数
金属元素
稀有气体元素
核电荷数1~18的元素原子结构示意图
非金属元素
“钅”字旁(汞、金除外)
“石”字旁;
“氵”字旁;
“气”字头
“气”字头
根据上述示意图,你能得到什么信息?
(1)每一横行,从左到右,核电荷数(即质子数)依次增加,最外层电子数依次增加[由1增至8(第一周期为2)],电子层数相同,周期数等于电子层数。
(2)每一横行开头,都是金属元素(第一周期除外),靠近尾部的是非金属元素,结尾的是稀有气体元素。
(3)每一纵列,从上到下,电子层数依次增加,最外层电子数相同(He除外),化学性质相似。
元素之间随着原子序数的递增,元素的种类和性质呈现周期性的变化。
如果你已经知道了元素的原子序数,你能在元素周期表中查找元素吗?
根据原子序数,查找元素周期表可得:
(1)元素名称:铝
(2)元素符号:Al
(3)相对原子质量:26.98
已知元素的原子序数为13
元素周期表的意义
(1)是我们学习化学的重要工具。
(2)为寻找新元素提供了理论依据。
(3)在元素周期表中,位置越靠近的元素性质越相似,因此,可启发人们在元素周期表的一定区域内寻找新物质(如农药、催化剂、半导体材料等)。
单质、化合物和氧化物
(1)单质:由同种元素组成的纯净物。如氧气、氢气等。
(2)化合物:由两种或两种以上元素组成的纯净物。如氯酸钾、高锰酸
钾等。
(3)氧化物:由两种或两种以上元素组成的化合物,其中一种元素是氧。如水、二氧化碳等。
氧化物属于化合物吗?
物质
混合物
单质
化合物
金属单质
非金属单质
稀有气体单质
氧化物
其他
金属氧化物
非金属氧化物
纯净物
(按物质种类分)
(按元素种类分)
从元素视角认识物质分类
非金属单质:如C、H2、S等
空气、溶液、化石燃料、自然界中的水
如Fe、Cu、Hg等
如He、Ne、Ar等
如H2O、CO2等
如CaO、CuO等
书写
意义
元素符号
“一大二小”
宏观意义
微观意义
由原子构成的物质
元素与元素符号
元素周期表
结构、一格
规律
单质、化合物和氧化物
定义
分类
元素
1. 用“ ”和“ ”分别表示不同元素的原子, 则下图各选项中表示化合物的是( )
A
2.下列说法正确的是( )
A.氯化氢是由氢气和氯气混合而成的
B.氯化氢是由氢、氯两种元素组成的
C.氯化氢是由一个氢原子和一个氯原子构成的
D.一个氯化氢分子是由一个氢元素和一个氯元素组成的
B
D
3.下图是某化学变化的微观示意图,下列说法不正确的是( )
A.在化学变化中,分子可分为原子
B.在化学变化中,原子可重新组成新分子
C.在化学反应前后,原子的个数没有改变
D.在化学反应前后,元素的种类发生改变
表示一种原子
表示另一种原子
4.钋是目前已知最稀有的元素之一,由著名科学家居里夫人与丈夫皮埃尔 居里在1898年发现,为了纪念居里夫人的祖国波兰,两人将这种元素命名为钋。钋元素在元素周期表中的信息如图所示,下列说法正确的是( )
A.钋的相对原子质量为209 g
B.钋原子的核外电子数为84
C.钋原子的中子数为84
D.1个钋原子中,质子、中子、核外电子的粒子总数为209
B
5.缺锌会导致生长迟缓。下图为锌元素的信息,下列说法不正确的是
( )
A. 锌原子核内质子数是65
B. 锌原子的原子序数为30
C. 锌原子核外有四层电子
D. 锌在反应中易失去电子
A
物质
带一个单位正电荷
元素周期表
相对原子质量
元素
元素符号
分子
核外电子
中子
不带电
完成下列物质的构成框图
课时1 元素与元素符号
九年级上册
沪教版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1.知道元素的分类。
2.知道元素是组成物质的基本成分,不同种元素最本质的区别是质子数不同。形成“化学变化过程中原子不变,元素不变”的观念。
3.了解元素符号所表示的意义。会用元素符号来表示元素和
原子。
4.认识元素周期表并能从元素周期表中得到一些信息。
5.能区别单质和化合物,能从元素组成上认识氧化物。
难点
重点
重点
视频中说“钙是人体中含量最多的矿物质”,这里的“钙”指的是什么?
氧化汞
HgO
汞原子和
氧原子
水
H2O
氢原子和
氧原子
CO2
二氧化碳
碳原子和
氧原子
氧气
O2
氧原子
观察下列物质的分子的组成,它们有哪些共同的特点?
新知学习
物质 相同原子 核电荷数(即质子数)
HgO
O2
H2O
CO2
8
8
8
8
O
O
O
O
化学上将核电荷数(即质子数)为8的所有氧原子称为氧元素。
观察下列3个原子结构,试判断它们是哪种元素。
+
+
+
它们的质子数都是1,属于氢元素。
元素是具有相同核电荷数(即质子数)的同一类原子的总称。
1.元素的种类由质子数决定。
2.碳元素与氧元素的本质区别是原子的最外层电子数不同。
3.钠原子和钠离子属于同种元素。
4.质子数相同的微粒属于同一种元素。
判断下列说法是否正确
正确
错误
正确
错误
元素的化学性质与其原子的最外层电子的数目有关
元素的分类
部分原子的结构示意图
金属原子
非金属原子
稀有气体原子
原子的最外层电子一般少于4个
原子的最外层电子一般多于4个
原子的最外层电子为8个(氦为2个)
非金属元素
稀有气体元素
元素
金属元素
从微观(分子和原子)和宏观(元素)角度分析化学变化
Hg
O
Hg
O
O
O
Hg
Hg
+
氧化汞
(HgO)
汞
(Hg)
氧气
(O2)
+
氧化汞分解反应的微观示意图
通过示意图你有哪些发现?反应前后变化的是什么,不变的是什么?
如果用汉字来表示一百多种元素以及由它们组成的几千万种物质将十分麻烦 。另外,不同国家用不同的文字表示元素,将变得很难交流。
Oxygen
这里面装的是哪种化学物质?
国际规定:国际上统一采用元素拉丁文名称的第一个字母来表示元素,如果几种元素拉丁文名称的第一个字母相同时,就附加一个小写字母来区别。
氢(H)、氦(He)
碳(C)、氯(Cl)、钙(Ca)
氮(N)、氖(Ne)、钠(Na)
举例:
书写原则
(1)由一个字母表示的元素符号要大写。如:H、O、N等
(2)由两个字母表示的元素符号,第一个字母大写,第二个字母小写。
如: Cu 、Ca 、Ne、Na、Mg、 Mn等
碳 氧 镁
铝 铜 氯
O
C
Mg
Al
Cu
Cl
书写元素符号要规范
“一大二小”要分清
注意:容易写错的元素符号
钴 和 一氧化碳
钙 和 铜
银 和 汞
Co 和 CO
Ca 和 Cu
Ag 和 Hg
元素符号的意义
(1)元素符号的两种意义
宏观意义:
~表示一种元素
~表示一种物质(适用于由原子直接构成的物质)
微观意义:
~表示这种元素的一个原子
注意:当元素符号前有数字时,只有微观意义,没有宏观意义。
2Cl
2个氯原子
H
表示氢元素 1个氢原子
Cu
你能说出下列符号所表示的意义吗?
6Al
铜元素、
6个铝原子
铜、
1个铜原子
写出相应的化学符号:
5个氧原子: 氮元素 : n个钠原子:
5O
N
nNa
1869年2月,俄国科学家门捷列夫编制了他的第一张元素周期表,表中除收入了当时已知的63种元素外,还给尚未发现的元素留下了27个空位,并大胆地预言了11种未知的新元素和它们在元素周期表的位置,同时根据它们的性质取了名字,如类铝、类硼、类硅等,后来都得到了验证。
元素周期表的发现
原子序数=核电荷数 = 质子数 = 核外电子数
元素周期表按元素原子核电荷数递增的顺序给元素编了号,这个编号就是原子序数。
(1) 横行(周期):共有7个横行,每一横行叫一个周期,共7个周期。
(2) 纵行( 族 ):共有18个纵行,每一纵行叫一族,共16族
(其中8、9、10三个纵行共同组成一个族)。
(3) 每一格:每一格包括元素的原子序数、元素符号、元素名称、相对原子质量
(4) 元素周期表的起始:
元素周期表的规律
稀有气体元素
金属元素
非金属元素
元素周期表中元素所在单元格信息
原子序数
相对原子质量
元素符号
元素名称
原子序数=核电荷数 = 质子数 = 核外电子数
金属元素
稀有气体元素
核电荷数1~18的元素原子结构示意图
非金属元素
“钅”字旁(汞、金除外)
“石”字旁;
“氵”字旁;
“气”字头
“气”字头
根据上述示意图,你能得到什么信息?
(1)每一横行,从左到右,核电荷数(即质子数)依次增加,最外层电子数依次增加[由1增至8(第一周期为2)],电子层数相同,周期数等于电子层数。
(2)每一横行开头,都是金属元素(第一周期除外),靠近尾部的是非金属元素,结尾的是稀有气体元素。
(3)每一纵列,从上到下,电子层数依次增加,最外层电子数相同(He除外),化学性质相似。
元素之间随着原子序数的递增,元素的种类和性质呈现周期性的变化。
如果你已经知道了元素的原子序数,你能在元素周期表中查找元素吗?
根据原子序数,查找元素周期表可得:
(1)元素名称:铝
(2)元素符号:Al
(3)相对原子质量:26.98
已知元素的原子序数为13
元素周期表的意义
(1)是我们学习化学的重要工具。
(2)为寻找新元素提供了理论依据。
(3)在元素周期表中,位置越靠近的元素性质越相似,因此,可启发人们在元素周期表的一定区域内寻找新物质(如农药、催化剂、半导体材料等)。
单质、化合物和氧化物
(1)单质:由同种元素组成的纯净物。如氧气、氢气等。
(2)化合物:由两种或两种以上元素组成的纯净物。如氯酸钾、高锰酸
钾等。
(3)氧化物:由两种或两种以上元素组成的化合物,其中一种元素是氧。如水、二氧化碳等。
氧化物属于化合物吗?
物质
混合物
单质
化合物
金属单质
非金属单质
稀有气体单质
氧化物
其他
金属氧化物
非金属氧化物
纯净物
(按物质种类分)
(按元素种类分)
从元素视角认识物质分类
非金属单质:如C、H2、S等
空气、溶液、化石燃料、自然界中的水
如Fe、Cu、Hg等
如He、Ne、Ar等
如H2O、CO2等
如CaO、CuO等
书写
意义
元素符号
“一大二小”
宏观意义
微观意义
由原子构成的物质
元素与元素符号
元素周期表
结构、一格
规律
单质、化合物和氧化物
定义
分类
元素
1. 用“ ”和“ ”分别表示不同元素的原子, 则下图各选项中表示化合物的是( )
A
2.下列说法正确的是( )
A.氯化氢是由氢气和氯气混合而成的
B.氯化氢是由氢、氯两种元素组成的
C.氯化氢是由一个氢原子和一个氯原子构成的
D.一个氯化氢分子是由一个氢元素和一个氯元素组成的
B
D
3.下图是某化学变化的微观示意图,下列说法不正确的是( )
A.在化学变化中,分子可分为原子
B.在化学变化中,原子可重新组成新分子
C.在化学反应前后,原子的个数没有改变
D.在化学反应前后,元素的种类发生改变
表示一种原子
表示另一种原子
4.钋是目前已知最稀有的元素之一,由著名科学家居里夫人与丈夫皮埃尔 居里在1898年发现,为了纪念居里夫人的祖国波兰,两人将这种元素命名为钋。钋元素在元素周期表中的信息如图所示,下列说法正确的是( )
A.钋的相对原子质量为209 g
B.钋原子的核外电子数为84
C.钋原子的中子数为84
D.1个钋原子中,质子、中子、核外电子的粒子总数为209
B
5.缺锌会导致生长迟缓。下图为锌元素的信息,下列说法不正确的是
( )
A. 锌原子核内质子数是65
B. 锌原子的原子序数为30
C. 锌原子核外有四层电子
D. 锌在反应中易失去电子
A
物质
带一个单位正电荷
元素周期表
相对原子质量
元素
元素符号
分子
核外电子
中子
不带电
完成下列物质的构成框图
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
