4.1.1燃烧的条件完全燃烧与不完全燃烧课件(共35张PPT内嵌视频)2023-2024学年度沪教版化学九年级上册
文档属性
| 名称 | 4.1.1燃烧的条件完全燃烧与不完全燃烧课件(共35张PPT内嵌视频)2023-2024学年度沪教版化学九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 16.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-16 23:30:17 | ||
图片预览











文档简介
(共35张PPT)
九年级上册
沪教版
课时1 燃烧的条件 完全燃烧与不完全燃烧
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1. 通过生活中的具体案例或情境,认识燃烧需要三个条件。
2. 通过探究燃烧条件的系列实验,学习主动控制实验条件的研究方法,加深对“物质变化是有条件的”观念的理解,进一步学会有序观察、描述和记录实验现象,在分析实验现象得出结论的过程中再次强化证据意识。
3.认识CO的性质和用途。
4. 认识完全燃烧与不完全燃烧的区别。
难点
重点
重点
说到火,我们就会想到燃烧,火是物质燃烧时的一种现象。生活中处处离不开燃烧。
燃烧造福于人类,燃烧也会给人类带来灾难
回顾一下,下列物质燃烧的时候有什么现象?请你完善表格。
事例 观察到的现象
镁条的燃烧 耀眼的白光,放出热量,有白色物质生成
木炭在氧气中燃烧
铁丝在氧气中燃烧
发出白光,放热,生成可以使澄清石灰水变浑浊的气体
火星四射、放出大量的热、生成黑色固体
发光、放热、剧烈
你能总结出燃烧的特征吗?
有发光发热现象的一定是燃烧吗?
灯泡点亮时也会发光发热,但是没有新物质生成。
燃烧一定是化学变化
那么,什么反应一定是燃烧呢?
燃烧:一种发光、放热的剧烈的化学反应。
下列是生活中一些常见的物质,哪些能燃烧,哪些不能燃烧?
燃烧需要物质具有可燃性
燃烧需要哪些条件呢?
实验内容 实验现象 实验结论
用玻璃棒分别蘸取95%酒精、蒸馏水,置于酒精灯火焰上,观察两种物质是否可以燃烧
用坩埚钳分别夹取一小团棉花球、玻璃棒(或石棉绒),放到酒精灯火焰上,观察两种物质是否可以燃烧 物质必需是可燃物
蘸有酒精的玻璃棒燃烧,蘸有蒸馏水的玻璃棒不燃烧
棉花球燃烧,玻
璃棒(或石棉绒)
不燃烧
燃烧条件的探究
实验内容 实验现象 实验结论
分别点燃两支蜡烛,竖直放在平整的桌面上,将其中一支蜡烛用透明的玻璃杯罩住(尽量使玻璃杯口与桌面间不留空隙)
燃烧需要氧气
用玻璃杯罩住的蜡烛过一会儿就会熄灭
实验内容 实验现象 实验结论
用坩埚钳分别夹取一根小木条和小煤块,在酒精灯火焰上点燃,观察、比较使小木条和小煤块燃烧需要的时间
燃烧需温度达到可燃物的着火点
小木条先燃烧,小煤块后燃烧
着火点是物质固有的属性,一般不随外界条件的变化而变化。
燃烧的条件:
(1)物质具有可燃性;
(2)可燃物与氧气(或空气)接触;
(3)温度达到可燃物的着火点。
上述的三个条件和燃烧之间有什么关系?满足一个或者两个就可以燃烧,还是需要同时满足三个条件呢?
三者缺一不可,必须同时满足
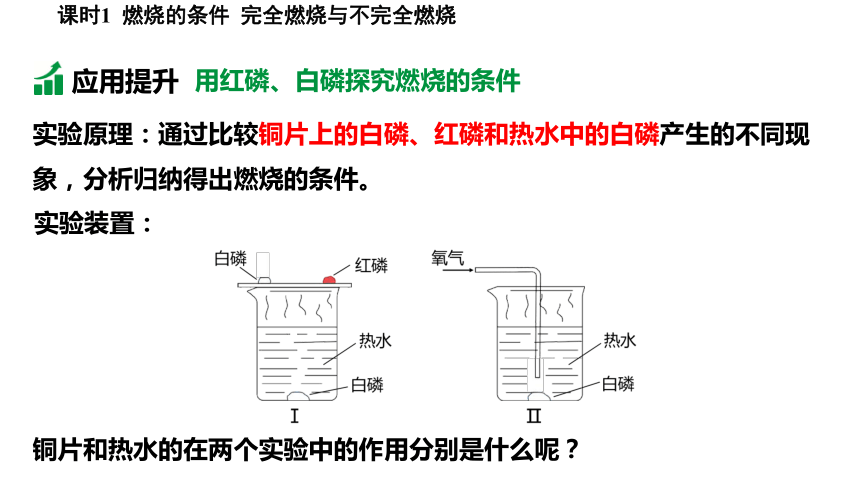
实验原理:通过比较铜片上的白磷、红磷和热水中的白磷产生的不同现象,分析归纳得出燃烧的条件。
实验装置:
用红磷、白磷探究燃烧的条件
应用提升
铜片和热水的在两个实验中的作用分别是什么呢?
观看实验视频,并记录实验现象
1.铜片上的白磷燃烧,红磷不燃烧;
2.铜片上的白磷燃烧,热水中白磷不燃烧;
3.热水中白磷不燃烧,通入氧气后白磷燃烧。
(1)由实验中薄铜片上的白磷燃烧而红磷不燃烧的事实,说明燃烧需要什么条件?
40℃
240℃
对比实验 相同条件 不同条件 实验现象
薄铜片上的白磷
有可燃物
与氧气(或空气)接触
加热到相同温度
达到燃烧所需的最低温度
白磷燃烧
实验结论:达到燃烧所需的最低温度
薄铜片上的红磷
未达到燃烧所需的最低温度
红磷不燃烧
(2)由薄铜片上的白磷燃烧而热水中的白磷不燃烧的事实,说明燃烧还需要什么条件?
对比实验 相同条件 不同条件 实验现象
薄铜片上白磷
有可燃物;
达到燃烧所需的最低温度
与氧气(或空气)接触
白磷燃烧
实验结论:可燃物与氧气(或空气)接触
热水中的白磷
不与氧气(或空气)接触
白磷不燃烧
(3)由本来在热水中不燃烧的白磷,在通入氧气(或空气)后燃烧的事实,再次说明燃烧需要什么条件?
对比实验 相同条件 不同条件 实验现象
热水中的白磷
有可燃物;
达到燃烧所需的最低温度
不与氧气(或空气)接触
白磷不燃烧
实验结论:可燃物与氧气(或空气)接触
向热水中的白磷通入氧气
与氧气(或空气)接触
白磷燃烧
控制变量法分析多因素影响的问题
一次只改变其中的某一个因素,而控制其他因素不变,使多因素的问题变成几个单因素的问题,分别加以研究,最后将几个单因素的问题的研究结果加以综合。这种方法叫控制变量法。
实验结论:
温度达到可燃物的着火点
氧气(或空气)
可燃物
缺一不可
大家回忆一下,我们以前学过的,铁丝、硫、木炭分别在空气和在氧气中燃烧,燃烧现象有何不同,是什么原因?
?
铁丝燃烧
硫粉燃烧
木炭燃烧
物质在空气中燃烧,实际上是与其中的氧气发生反应,由于空气中的氧气含量相对较少,因此在空气中燃烧不如在氧气中剧烈。即反应的剧烈程度与氧气的含量有关。
完全燃烧与不完全燃烧
碳 + 氧气(充足) 二氧化碳
点燃
CO2
C
O2
碳 + 氧气(不充足) 一氧化碳
CO
C
O2
点燃
观察下面两个反应的文字表达式,你有什么发现?
1. 完全燃烧与不完全燃烧
(1)完全燃烧:当氧气充足时,可燃物完全燃烧,燃烧得快,放出的热量多。
(2)不完全燃烧:当氧气不充足时,可燃物不完全燃烧,燃烧得慢,放出的热量少。
2. 完全燃烧的意义
(1)使有限的能源发挥最大的作用;
(2)降低环境污染的程度。
有什么方法可以促进可燃物的燃烧呢?
促进可燃物燃烧的方法:
①增大氧气的浓度
②增大可燃物与氧气的接触面积
冬季煤炉取暖,常常有煤气中毒的危险,是什么原因呢?
煤气中毒:一氧化碳极易与血液中的血红蛋白结合,使血红蛋白不能再与氧气结合,造成生物体内缺氧,严重时会危及生命。当一氧化碳在空气中的含量占到总体积的0.02%时,人在2h~3h后就会出现中毒症状。
生活小常识
CO除了毒性还有哪些性质呢?我们如何能避免一氧化碳中毒
一氧化碳
(1)物理性质
颜色 状态 气味 溶解性 密度
无色 气体 无味 难溶于水 比空气略小(1.250g/L)
一氧化碳与空气密度相近,只能用排水法收集
(2)化学性质
①可燃性
现象:一氧化碳燃烧产生蓝色火焰,放出热量,生成能使澄清石灰水变浑浊的气体。
一氧化碳 + 氧气 二氧化碳
CO
O2
CO2
点燃
注意:一氧化碳是可燃性气体,点燃之前要验纯。
用途:一氧化碳常用作气体燃料。
②还原性:一氧化碳在加热的条件下能将金属氧化物还原为金属单质,是冶炼金属的原料。
如:一氧化碳还原氧化铜
CO CuO Cu CO2
一氧化碳 + 氧化铜 铜 + 二氧化碳
加热
(1)用煤炉取暖时应加装烟囱,并注意通风。
(2)一氧化碳中毒时,轻者应呼吸大量新鲜空气,重者立即送往医院救治。
冬季煤炉取暖的质注意事项
结合以前学过的知识思考以下问题
(1)CO燃烧后的产物如何检验?
(2)H2和CO都具有可燃性,燃烧现象相似,如何检验一种可燃性气体是H2还是CO呢?
将燃烧后的产物通入到澄清石灰水中,澄清石灰水变浑浊,说明产物是二氧化碳
可根据产物的不同来检验,如检验水,将干冷的小烧杯罩在火焰上方,如烧杯内壁出现水珠,则为氢气;如将反应后的产物通入到澄清石灰水中,若石灰水变浑浊,则为一氧化碳
请用化学知识解释成语“钻木取火” “火上浇油”。
“钻木取火”:摩擦生热,使温度达到可燃物的着火点,引发燃烧。
“火上浇油”:油是可燃物,增加可燃物,使燃烧更剧烈。
燃烧
燃烧的条件
完全燃烧
与不完全燃烧
红磷、白磷燃烧探究
概念
条件
一氧化碳
化学性质:可燃性、毒性、还原性
物理性质:无色、无味的气体,难溶于水
完全燃烧与不完全燃烧
课堂小结
1. 下列叙述正确的是( )
A. 引起煤气中毒的主要成分是CO2
B. 为了便于及时发现煤气泄漏,煤气厂常在家用煤气中掺入微量具有难闻气味的气体
C. 冬天用煤炉取暖时,为了节约能源,应关闭门窗
D. CO和CO2都易溶于水
B
2. 选择氧气、一氧化碳或二氧化碳填空(用化学式填写)。
(1)能使带火星的木条复燃的是________;
(2)能用于灭火的是________;
(3)属于有毒气体的是________;
(4)绿色植物进行光作用吸收的是________,释放的是________;
(5)能在空气中燃烧的是________。
O2
CO2
CO
CO2
CO
O2
3.在“烹饪与营养”实践活动中,灶内的木材燃烧一段时间后火焰变小,某同学用长木棒挑开木材堆后,火焰重新变旺,这是因为( )
A. 灶内的木材变更多
B. 木材的着火点降低
C. 木材接触更多空气
D. 木材的导热性变强
C
4.已知白磷的着火点是40 ℃,红磷的着火点是240 ℃。如图实验,三支试管里面充满氮气,初始温度25 ℃,升温至60 ℃后,用注射器同时向②③试管中迅速注入足量氧气。下列说法有误的是( )
A. 只有②中有燃烧现象
B. 由①②现象说明可燃物达着火点未必燃烧
C. 若继续水浴升温,则③中一定会燃烧
D. 该实验能总结出燃烧的条件
C
5.2022年北京冬奥会完成了奥运史上首次机器人与机器人之间在水下的火炬传递。请从燃烧条件的角度回答以下问题:
(1)俗话说"水火不相容",请解释可燃物通常很难在水中燃烧的主要原因是。
水是一种极好的溶剂,可以溶解许多物质,包括氧气。当可燃物在水中时,水会吸收周围的热量,使其温度降低,从而使燃烧反应难以发生。此外,水中的氧气含量也很低,这也会限制燃烧反应的发生
(2)查阅相关资料,分析能在水下成功传递奥运火炬的原因。
请你观察家里的灶具并思考,做饭时怎样才能使燃料燃烧的更加的充分?
拓展与实践
九年级上册
沪教版
课时1 燃烧的条件 完全燃烧与不完全燃烧
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1. 通过生活中的具体案例或情境,认识燃烧需要三个条件。
2. 通过探究燃烧条件的系列实验,学习主动控制实验条件的研究方法,加深对“物质变化是有条件的”观念的理解,进一步学会有序观察、描述和记录实验现象,在分析实验现象得出结论的过程中再次强化证据意识。
3.认识CO的性质和用途。
4. 认识完全燃烧与不完全燃烧的区别。
难点
重点
重点
说到火,我们就会想到燃烧,火是物质燃烧时的一种现象。生活中处处离不开燃烧。
燃烧造福于人类,燃烧也会给人类带来灾难
回顾一下,下列物质燃烧的时候有什么现象?请你完善表格。
事例 观察到的现象
镁条的燃烧 耀眼的白光,放出热量,有白色物质生成
木炭在氧气中燃烧
铁丝在氧气中燃烧
发出白光,放热,生成可以使澄清石灰水变浑浊的气体
火星四射、放出大量的热、生成黑色固体
发光、放热、剧烈
你能总结出燃烧的特征吗?
有发光发热现象的一定是燃烧吗?
灯泡点亮时也会发光发热,但是没有新物质生成。
燃烧一定是化学变化
那么,什么反应一定是燃烧呢?
燃烧:一种发光、放热的剧烈的化学反应。
下列是生活中一些常见的物质,哪些能燃烧,哪些不能燃烧?
燃烧需要物质具有可燃性
燃烧需要哪些条件呢?
实验内容 实验现象 实验结论
用玻璃棒分别蘸取95%酒精、蒸馏水,置于酒精灯火焰上,观察两种物质是否可以燃烧
用坩埚钳分别夹取一小团棉花球、玻璃棒(或石棉绒),放到酒精灯火焰上,观察两种物质是否可以燃烧 物质必需是可燃物
蘸有酒精的玻璃棒燃烧,蘸有蒸馏水的玻璃棒不燃烧
棉花球燃烧,玻
璃棒(或石棉绒)
不燃烧
燃烧条件的探究
实验内容 实验现象 实验结论
分别点燃两支蜡烛,竖直放在平整的桌面上,将其中一支蜡烛用透明的玻璃杯罩住(尽量使玻璃杯口与桌面间不留空隙)
燃烧需要氧气
用玻璃杯罩住的蜡烛过一会儿就会熄灭
实验内容 实验现象 实验结论
用坩埚钳分别夹取一根小木条和小煤块,在酒精灯火焰上点燃,观察、比较使小木条和小煤块燃烧需要的时间
燃烧需温度达到可燃物的着火点
小木条先燃烧,小煤块后燃烧
着火点是物质固有的属性,一般不随外界条件的变化而变化。
燃烧的条件:
(1)物质具有可燃性;
(2)可燃物与氧气(或空气)接触;
(3)温度达到可燃物的着火点。
上述的三个条件和燃烧之间有什么关系?满足一个或者两个就可以燃烧,还是需要同时满足三个条件呢?
三者缺一不可,必须同时满足
实验原理:通过比较铜片上的白磷、红磷和热水中的白磷产生的不同现象,分析归纳得出燃烧的条件。
实验装置:
用红磷、白磷探究燃烧的条件
应用提升
铜片和热水的在两个实验中的作用分别是什么呢?
观看实验视频,并记录实验现象
1.铜片上的白磷燃烧,红磷不燃烧;
2.铜片上的白磷燃烧,热水中白磷不燃烧;
3.热水中白磷不燃烧,通入氧气后白磷燃烧。
(1)由实验中薄铜片上的白磷燃烧而红磷不燃烧的事实,说明燃烧需要什么条件?
40℃
240℃
对比实验 相同条件 不同条件 实验现象
薄铜片上的白磷
有可燃物
与氧气(或空气)接触
加热到相同温度
达到燃烧所需的最低温度
白磷燃烧
实验结论:达到燃烧所需的最低温度
薄铜片上的红磷
未达到燃烧所需的最低温度
红磷不燃烧
(2)由薄铜片上的白磷燃烧而热水中的白磷不燃烧的事实,说明燃烧还需要什么条件?
对比实验 相同条件 不同条件 实验现象
薄铜片上白磷
有可燃物;
达到燃烧所需的最低温度
与氧气(或空气)接触
白磷燃烧
实验结论:可燃物与氧气(或空气)接触
热水中的白磷
不与氧气(或空气)接触
白磷不燃烧
(3)由本来在热水中不燃烧的白磷,在通入氧气(或空气)后燃烧的事实,再次说明燃烧需要什么条件?
对比实验 相同条件 不同条件 实验现象
热水中的白磷
有可燃物;
达到燃烧所需的最低温度
不与氧气(或空气)接触
白磷不燃烧
实验结论:可燃物与氧气(或空气)接触
向热水中的白磷通入氧气
与氧气(或空气)接触
白磷燃烧
控制变量法分析多因素影响的问题
一次只改变其中的某一个因素,而控制其他因素不变,使多因素的问题变成几个单因素的问题,分别加以研究,最后将几个单因素的问题的研究结果加以综合。这种方法叫控制变量法。
实验结论:
温度达到可燃物的着火点
氧气(或空气)
可燃物
缺一不可
大家回忆一下,我们以前学过的,铁丝、硫、木炭分别在空气和在氧气中燃烧,燃烧现象有何不同,是什么原因?
?
铁丝燃烧
硫粉燃烧
木炭燃烧
物质在空气中燃烧,实际上是与其中的氧气发生反应,由于空气中的氧气含量相对较少,因此在空气中燃烧不如在氧气中剧烈。即反应的剧烈程度与氧气的含量有关。
完全燃烧与不完全燃烧
碳 + 氧气(充足) 二氧化碳
点燃
CO2
C
O2
碳 + 氧气(不充足) 一氧化碳
CO
C
O2
点燃
观察下面两个反应的文字表达式,你有什么发现?
1. 完全燃烧与不完全燃烧
(1)完全燃烧:当氧气充足时,可燃物完全燃烧,燃烧得快,放出的热量多。
(2)不完全燃烧:当氧气不充足时,可燃物不完全燃烧,燃烧得慢,放出的热量少。
2. 完全燃烧的意义
(1)使有限的能源发挥最大的作用;
(2)降低环境污染的程度。
有什么方法可以促进可燃物的燃烧呢?
促进可燃物燃烧的方法:
①增大氧气的浓度
②增大可燃物与氧气的接触面积
冬季煤炉取暖,常常有煤气中毒的危险,是什么原因呢?
煤气中毒:一氧化碳极易与血液中的血红蛋白结合,使血红蛋白不能再与氧气结合,造成生物体内缺氧,严重时会危及生命。当一氧化碳在空气中的含量占到总体积的0.02%时,人在2h~3h后就会出现中毒症状。
生活小常识
CO除了毒性还有哪些性质呢?我们如何能避免一氧化碳中毒
一氧化碳
(1)物理性质
颜色 状态 气味 溶解性 密度
无色 气体 无味 难溶于水 比空气略小(1.250g/L)
一氧化碳与空气密度相近,只能用排水法收集
(2)化学性质
①可燃性
现象:一氧化碳燃烧产生蓝色火焰,放出热量,生成能使澄清石灰水变浑浊的气体。
一氧化碳 + 氧气 二氧化碳
CO
O2
CO2
点燃
注意:一氧化碳是可燃性气体,点燃之前要验纯。
用途:一氧化碳常用作气体燃料。
②还原性:一氧化碳在加热的条件下能将金属氧化物还原为金属单质,是冶炼金属的原料。
如:一氧化碳还原氧化铜
CO CuO Cu CO2
一氧化碳 + 氧化铜 铜 + 二氧化碳
加热
(1)用煤炉取暖时应加装烟囱,并注意通风。
(2)一氧化碳中毒时,轻者应呼吸大量新鲜空气,重者立即送往医院救治。
冬季煤炉取暖的质注意事项
结合以前学过的知识思考以下问题
(1)CO燃烧后的产物如何检验?
(2)H2和CO都具有可燃性,燃烧现象相似,如何检验一种可燃性气体是H2还是CO呢?
将燃烧后的产物通入到澄清石灰水中,澄清石灰水变浑浊,说明产物是二氧化碳
可根据产物的不同来检验,如检验水,将干冷的小烧杯罩在火焰上方,如烧杯内壁出现水珠,则为氢气;如将反应后的产物通入到澄清石灰水中,若石灰水变浑浊,则为一氧化碳
请用化学知识解释成语“钻木取火” “火上浇油”。
“钻木取火”:摩擦生热,使温度达到可燃物的着火点,引发燃烧。
“火上浇油”:油是可燃物,增加可燃物,使燃烧更剧烈。
燃烧
燃烧的条件
完全燃烧
与不完全燃烧
红磷、白磷燃烧探究
概念
条件
一氧化碳
化学性质:可燃性、毒性、还原性
物理性质:无色、无味的气体,难溶于水
完全燃烧与不完全燃烧
课堂小结
1. 下列叙述正确的是( )
A. 引起煤气中毒的主要成分是CO2
B. 为了便于及时发现煤气泄漏,煤气厂常在家用煤气中掺入微量具有难闻气味的气体
C. 冬天用煤炉取暖时,为了节约能源,应关闭门窗
D. CO和CO2都易溶于水
B
2. 选择氧气、一氧化碳或二氧化碳填空(用化学式填写)。
(1)能使带火星的木条复燃的是________;
(2)能用于灭火的是________;
(3)属于有毒气体的是________;
(4)绿色植物进行光作用吸收的是________,释放的是________;
(5)能在空气中燃烧的是________。
O2
CO2
CO
CO2
CO
O2
3.在“烹饪与营养”实践活动中,灶内的木材燃烧一段时间后火焰变小,某同学用长木棒挑开木材堆后,火焰重新变旺,这是因为( )
A. 灶内的木材变更多
B. 木材的着火点降低
C. 木材接触更多空气
D. 木材的导热性变强
C
4.已知白磷的着火点是40 ℃,红磷的着火点是240 ℃。如图实验,三支试管里面充满氮气,初始温度25 ℃,升温至60 ℃后,用注射器同时向②③试管中迅速注入足量氧气。下列说法有误的是( )
A. 只有②中有燃烧现象
B. 由①②现象说明可燃物达着火点未必燃烧
C. 若继续水浴升温,则③中一定会燃烧
D. 该实验能总结出燃烧的条件
C
5.2022年北京冬奥会完成了奥运史上首次机器人与机器人之间在水下的火炬传递。请从燃烧条件的角度回答以下问题:
(1)俗话说"水火不相容",请解释可燃物通常很难在水中燃烧的主要原因是。
水是一种极好的溶剂,可以溶解许多物质,包括氧气。当可燃物在水中时,水会吸收周围的热量,使其温度降低,从而使燃烧反应难以发生。此外,水中的氧气含量也很低,这也会限制燃烧反应的发生
(2)查阅相关资料,分析能在水下成功传递奥运火炬的原因。
请你观察家里的灶具并思考,做饭时怎样才能使燃料燃烧的更加的充分?
拓展与实践
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
