4.3.1化学反应的表示方法课件(共24张PPT)2023-2024学年度沪教版化学九年级上册
文档属性
| 名称 | 4.3.1化学反应的表示方法课件(共24张PPT)2023-2024学年度沪教版化学九年级上册 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-16 00:00:00 | ||
图片预览








文档简介
(共24张PPT)
课时1 化学反应的表示方法
九年级上册
沪教版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1.知道什么是化学方程式,学会化学方程式的准确读法。
2.初步掌握化学方程式所能提供的信息,能够从宏观与微观、定性和定量的角度描述化学方程式。
3.了解书写化学方程式应遵守的两个原则,能够根据反应事实书写化学方程式。
4.初步学会用最小公倍数法、奇数配偶法、设“1”法配平化学方
程式。
难点
重点
难点
我们可以用哪些方式来描述碳燃烧的反应?
描述方式 特点
①图示
②语言表述
③文字表达式
④符号表达式
只知现象,不知反应物、生成物
知道反应物、生成物
碳+氧气 二氧化碳
点燃
具备文字表达的优点,且还知道物质的组成和构成
比语言表述更简便,且知道反应条件
C+O2 CO2
点燃
碳在氧气中燃烧生成二氧化碳
有没有一种既能表示反应的条件,又能表示反应前后的物质变化,还能准确揭示反应得到的各种物质的量的关系的表达方式呢?
C+O2
CO2
点燃
像这样用化学式来表示化学反应的式子叫化学方程式。
这个方程式表示了哪些含义呢?
如何书写化学方程式呢?
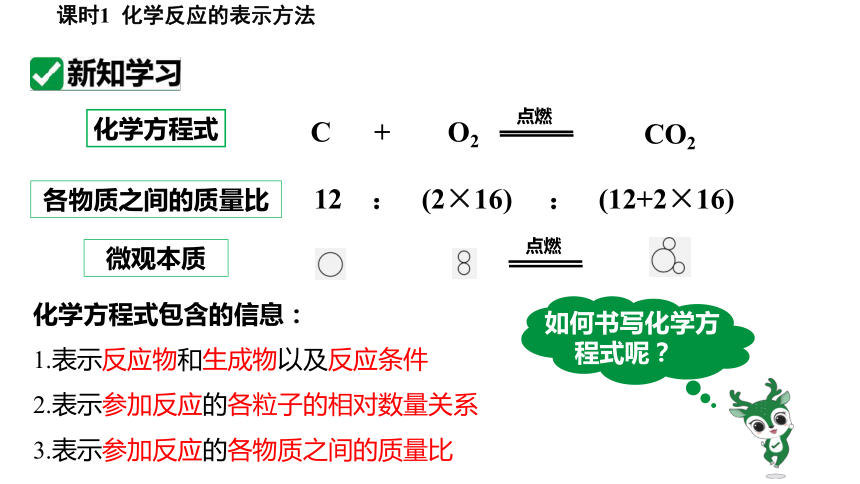
化学方程式
C + O2
CO2
点燃
各物质之间的质量比
微观本质
12 : (2×16) : (12+2×16)
点燃
化学方程式包含的信息:
1.表示反应物和生成物以及反应条件
2.表示参加反应的各粒子的相对数量关系
3.表示参加反应的各物质之间的质量比
如何书写化学方
程式呢?
请根据所学过的知识判断下列磷在氧气中燃烧的化学方程式是否正确,并说出原因。
(1)P + O2 ====== PO2
点燃
(2)P2 + O5 ====== P2O5
点燃
(3)P + O2 ====== P2O5
点燃
4P + 5O2 ====== 2P2O5
点燃
化学方程式书写的两个原则
①要以客观事实为基础
②要遵守质量守恒定律
不能凭空臆造事实上不存在的物质和化学反应
等号两边各个原子的
种类与数目必须相等
Fe+ O2 Fe3O4
Fe+ O2 Fe3O4
Fe+ O2 Fe3O4
请写出铁丝在氧气中燃烧的化学方程式。
1.根据实验事实,在式子的左、右两边写出反应物、生成物,并在左右两边之间画一条短线。
2.配平:使化学方程式遵循质量守恒定律。
3
2
3.注明化学反应发生的条件,将短线改成等号。
点燃
3
2
条件:点燃、加热(△)、高温、光照、通电、催化剂等
碳酸钠固体和稀盐酸反应:
气体
C+O2 CO2
点燃
固体
液体
Na2CO3+2HCl 2NaCl+H2O+CO2
气体 气体
当反应物中没有气体,生成物中有气体时,在生成物气体物质的化学式右边注 号;
如果反应物和生成物中都有气体,气体生成物就不用注 号。
碳和氧气反应
观察以下化学方程式你有什么发现?
硫酸铜溶液和氢氧化钠溶液反应
液体
CuSO4+2NaOH Cu(OH)2 + Na2SO4
液体
固体
Fe+CuSO4 FeSO4+Cu
固体 固体
溶液中的反应如果生成物中有固体,在固体物质的化学式右边要注 号。
铁和硫酸铜溶液反应
反应如果反应物和生成物中都有固体,则不需要注 号
根据事实写出反应物和生成物的化学式,中间用短横线相连.
配平化学方程式,并检验(等号两边各种原子的数目必须相等)
将短横线改写成 “ ”
注明反应发生条件以及生成物状态“↑ ”或“↓ ”
检查化学式是否正确,化学方程式是否配平,条件和物质状态是否标注,标注是否恰当。
化学方程式的书写步骤
(5)查:
(1)写:
(2)配:
(3)等:
(4)注:
如何配平化学方
程式呢
如何配平化学方程式?
(1)配平化学方程式的原则:
配平化学方程式就是在化学式前面配上适当的计量数,使式子(短线)左、右两边的每一种元素的原子总数相等,体现质量守恒定律(不能改变物质的化学式)。
4P + 5O2 2P2O5
从左右两端各出现一次、且原子个数相差较大、原子个数的最小公倍数也较大的元素入手配平,然后依次配平其他元素的原子个数。
①最小公倍数法
最小公倍数:2×5=10
2个O
5个O
点燃
O2前面计量数配5,P2O5前面配2,最后观察磷原子
P + O2 P2O5
(2)配平化学方程式的方法:
在化学方程式中有一种元素在多种物质中出现,且式子两边该元素的原子总数目为一奇一偶,这时就可以考虑用奇数配偶法。先变奇数为偶数,再观察配平。
②奇数配偶法
在H2O前面配“2”
2个O
1个O
H2 + O2 H2O
2H2 + O2 2H2O
点燃
将化学方程式中关键的化学式前的计量数定为1,然后据此去配平其他化学式前的化学计量数;若出现计量数为分数,化分数为整数。
③设“1”法
C2H2 + O2 CO2 + H2O
×2
×2
×2
×2
C2H2 + O2 CO2 + H2O
2
5
4
2
点燃
C2H2 + O2 CO2 + H2O
1
2
1
点燃
KClO3 KCl + O2
MnO2
MnO2
H2O2 H2O + O2
Fe2O3 + H2 Fe + H2O
Fe2O3 + CO Fe + CO2
Al + Fe3O4 Fe + Al2O3
高温
高温
高温
配平下列化学方程式
书写原则
化学方程式
① 以客观事实为基础;② 遵守质量守恒定律
书写步骤
写、配、等、注、查
配平方法
奇数配偶法
最小公倍数法
设“1”法
意义
质的方面
量的方面
1. 根据化学方程式不能获得的信息是( )
A. 反应物、生成物和反应条件
B. 各物质之间量的关系
C. 反应物、生成物之间的微粒个数比
D. 化学变化中的热量变化情况
D
2. 根据化学方程式2H2+O2 2H2O,填写下列信息:
(1)该反应的条件为________。
(2)该反应的反应物和生成物分别是____________、____。
(3)反应物的分子个数比为_____________。
(4)反应中H2、O2和H2O的质量比为______________________。
点燃
2∶1(或1∶2)
氢气、氧气
水
4∶32∶36(或1∶8∶9)
3. 下列化学方程式书写是否正确?如不正确,说明原因。
(1)氧化汞加热分解:HgO === Hg+O2↑
答:不正确,未配平,没有注明反应条件“ △ ”。
答:不正确,“↑”符号使用不当。
(3)过氧化氢在二氧化锰催化下分解:2H2O2 === 2H2O+O2
答:不正确,未注明MnO2催化的条件,O2未标明“↑”,未使用等号。
(2)硫在氧气中燃烧:S+O2↑ SO2
点燃
4.2022年北京冬奥会圆满结束,雪中微火、绿色低碳、节能环保给人留下深刻 的印象。以下是几届奥运会的火炬燃料,请用质量守恒定律进行分析。
年份 奥运会 火炬燃料 燃烧原理
1936年 柏林奥运会 镁管
1994年 利勒哈默尔冬奥会 石蜡 石蜡燃烧后生成二氧化碳和水,则石蜡中一定有________元素
2008年 北京奥运会 丙烷 C3H8+5O 4H O+3_____(填写化学式)
2022年 北京冬奥会 氢气 氢气燃烧实现“零排放”的原因是:
2Mg+O2 2MgO
碳、氢
CO2
2H2+O2 2H2O
5. 写出下列反应的化学方程式。
(1)铁丝在氧气中燃烧:______________________。
(2)氯酸钾在二氧化锰催化作用下受热分解:________________________。
(3)军事上用白磷作烟雾弹时白磷燃烧反应:________________________。
(4)天然气(主要成分为CH4)作燃料时发生的反应(完全燃烧):____________________________。
3Fe+2O2 Fe3O4
2KClO3 2KCl+3O2↑
4P+5O2 2P2O5
CH4+2O2 CO2+2H2O
CO2 + H2 CH3OH + H2O
6.烟道气中含有大量CO2,经“捕捉”可用于生产尿素、甲醇(CH3OH)等产品。用“捕捉”的CO2生产甲醇,反应的微观示意图如下,反应的化学方程式是
3
一定条件
课时1 化学反应的表示方法
九年级上册
沪教版
学习目标
新课引入
新知学习
课堂小结
1
2
3
4
1.知道什么是化学方程式,学会化学方程式的准确读法。
2.初步掌握化学方程式所能提供的信息,能够从宏观与微观、定性和定量的角度描述化学方程式。
3.了解书写化学方程式应遵守的两个原则,能够根据反应事实书写化学方程式。
4.初步学会用最小公倍数法、奇数配偶法、设“1”法配平化学方
程式。
难点
重点
难点
我们可以用哪些方式来描述碳燃烧的反应?
描述方式 特点
①图示
②语言表述
③文字表达式
④符号表达式
只知现象,不知反应物、生成物
知道反应物、生成物
碳+氧气 二氧化碳
点燃
具备文字表达的优点,且还知道物质的组成和构成
比语言表述更简便,且知道反应条件
C+O2 CO2
点燃
碳在氧气中燃烧生成二氧化碳
有没有一种既能表示反应的条件,又能表示反应前后的物质变化,还能准确揭示反应得到的各种物质的量的关系的表达方式呢?
C+O2
CO2
点燃
像这样用化学式来表示化学反应的式子叫化学方程式。
这个方程式表示了哪些含义呢?
如何书写化学方程式呢?
化学方程式
C + O2
CO2
点燃
各物质之间的质量比
微观本质
12 : (2×16) : (12+2×16)
点燃
化学方程式包含的信息:
1.表示反应物和生成物以及反应条件
2.表示参加反应的各粒子的相对数量关系
3.表示参加反应的各物质之间的质量比
如何书写化学方
程式呢?
请根据所学过的知识判断下列磷在氧气中燃烧的化学方程式是否正确,并说出原因。
(1)P + O2 ====== PO2
点燃
(2)P2 + O5 ====== P2O5
点燃
(3)P + O2 ====== P2O5
点燃
4P + 5O2 ====== 2P2O5
点燃
化学方程式书写的两个原则
①要以客观事实为基础
②要遵守质量守恒定律
不能凭空臆造事实上不存在的物质和化学反应
等号两边各个原子的
种类与数目必须相等
Fe+ O2 Fe3O4
Fe+ O2 Fe3O4
Fe+ O2 Fe3O4
请写出铁丝在氧气中燃烧的化学方程式。
1.根据实验事实,在式子的左、右两边写出反应物、生成物,并在左右两边之间画一条短线。
2.配平:使化学方程式遵循质量守恒定律。
3
2
3.注明化学反应发生的条件,将短线改成等号。
点燃
3
2
条件:点燃、加热(△)、高温、光照、通电、催化剂等
碳酸钠固体和稀盐酸反应:
气体
C+O2 CO2
点燃
固体
液体
Na2CO3+2HCl 2NaCl+H2O+CO2
气体 气体
当反应物中没有气体,生成物中有气体时,在生成物气体物质的化学式右边注 号;
如果反应物和生成物中都有气体,气体生成物就不用注 号。
碳和氧气反应
观察以下化学方程式你有什么发现?
硫酸铜溶液和氢氧化钠溶液反应
液体
CuSO4+2NaOH Cu(OH)2 + Na2SO4
液体
固体
Fe+CuSO4 FeSO4+Cu
固体 固体
溶液中的反应如果生成物中有固体,在固体物质的化学式右边要注 号。
铁和硫酸铜溶液反应
反应如果反应物和生成物中都有固体,则不需要注 号
根据事实写出反应物和生成物的化学式,中间用短横线相连.
配平化学方程式,并检验(等号两边各种原子的数目必须相等)
将短横线改写成 “ ”
注明反应发生条件以及生成物状态“↑ ”或“↓ ”
检查化学式是否正确,化学方程式是否配平,条件和物质状态是否标注,标注是否恰当。
化学方程式的书写步骤
(5)查:
(1)写:
(2)配:
(3)等:
(4)注:
如何配平化学方
程式呢
如何配平化学方程式?
(1)配平化学方程式的原则:
配平化学方程式就是在化学式前面配上适当的计量数,使式子(短线)左、右两边的每一种元素的原子总数相等,体现质量守恒定律(不能改变物质的化学式)。
4P + 5O2 2P2O5
从左右两端各出现一次、且原子个数相差较大、原子个数的最小公倍数也较大的元素入手配平,然后依次配平其他元素的原子个数。
①最小公倍数法
最小公倍数:2×5=10
2个O
5个O
点燃
O2前面计量数配5,P2O5前面配2,最后观察磷原子
P + O2 P2O5
(2)配平化学方程式的方法:
在化学方程式中有一种元素在多种物质中出现,且式子两边该元素的原子总数目为一奇一偶,这时就可以考虑用奇数配偶法。先变奇数为偶数,再观察配平。
②奇数配偶法
在H2O前面配“2”
2个O
1个O
H2 + O2 H2O
2H2 + O2 2H2O
点燃
将化学方程式中关键的化学式前的计量数定为1,然后据此去配平其他化学式前的化学计量数;若出现计量数为分数,化分数为整数。
③设“1”法
C2H2 + O2 CO2 + H2O
×2
×2
×2
×2
C2H2 + O2 CO2 + H2O
2
5
4
2
点燃
C2H2 + O2 CO2 + H2O
1
2
1
点燃
KClO3 KCl + O2
MnO2
MnO2
H2O2 H2O + O2
Fe2O3 + H2 Fe + H2O
Fe2O3 + CO Fe + CO2
Al + Fe3O4 Fe + Al2O3
高温
高温
高温
配平下列化学方程式
书写原则
化学方程式
① 以客观事实为基础;② 遵守质量守恒定律
书写步骤
写、配、等、注、查
配平方法
奇数配偶法
最小公倍数法
设“1”法
意义
质的方面
量的方面
1. 根据化学方程式不能获得的信息是( )
A. 反应物、生成物和反应条件
B. 各物质之间量的关系
C. 反应物、生成物之间的微粒个数比
D. 化学变化中的热量变化情况
D
2. 根据化学方程式2H2+O2 2H2O,填写下列信息:
(1)该反应的条件为________。
(2)该反应的反应物和生成物分别是____________、____。
(3)反应物的分子个数比为_____________。
(4)反应中H2、O2和H2O的质量比为______________________。
点燃
2∶1(或1∶2)
氢气、氧气
水
4∶32∶36(或1∶8∶9)
3. 下列化学方程式书写是否正确?如不正确,说明原因。
(1)氧化汞加热分解:HgO === Hg+O2↑
答:不正确,未配平,没有注明反应条件“ △ ”。
答:不正确,“↑”符号使用不当。
(3)过氧化氢在二氧化锰催化下分解:2H2O2 === 2H2O+O2
答:不正确,未注明MnO2催化的条件,O2未标明“↑”,未使用等号。
(2)硫在氧气中燃烧:S+O2↑ SO2
点燃
4.2022年北京冬奥会圆满结束,雪中微火、绿色低碳、节能环保给人留下深刻 的印象。以下是几届奥运会的火炬燃料,请用质量守恒定律进行分析。
年份 奥运会 火炬燃料 燃烧原理
1936年 柏林奥运会 镁管
1994年 利勒哈默尔冬奥会 石蜡 石蜡燃烧后生成二氧化碳和水,则石蜡中一定有________元素
2008年 北京奥运会 丙烷 C3H8+5O 4H O+3_____(填写化学式)
2022年 北京冬奥会 氢气 氢气燃烧实现“零排放”的原因是:
2Mg+O2 2MgO
碳、氢
CO2
2H2+O2 2H2O
5. 写出下列反应的化学方程式。
(1)铁丝在氧气中燃烧:______________________。
(2)氯酸钾在二氧化锰催化作用下受热分解:________________________。
(3)军事上用白磷作烟雾弹时白磷燃烧反应:________________________。
(4)天然气(主要成分为CH4)作燃料时发生的反应(完全燃烧):____________________________。
3Fe+2O2 Fe3O4
2KClO3 2KCl+3O2↑
4P+5O2 2P2O5
CH4+2O2 CO2+2H2O
CO2 + H2 CH3OH + H2O
6.烟道气中含有大量CO2,经“捕捉”可用于生产尿素、甲醇(CH3OH)等产品。用“捕捉”的CO2生产甲醇,反应的微观示意图如下,反应的化学方程式是
3
一定条件
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
