4.3课时1共价键课件(共33张PPT)2023-2024学年高一化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3课时1共价键课件(共33张PPT)2023-2024学年高一化学人教版(2019)必修第一册 |  | |
| 格式 | ppt | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 10:41:17 | ||
图片预览








文档简介
(共33张PPT)
第一章 物质结构
元素周期律
第三节 化学键 (共2课时)
第2课时 共价键
离子键的定义?
哪些元素化合时可形成离子键?
使阴、阳离子结合成化合物的静电作用。
一般是活泼金属和活泼非金属离子间能形成
复习
HCl分子不是通过离子键来形成,是通过什么方式结合的呢?
问题
Cl2 气体分子
H2 气体分子
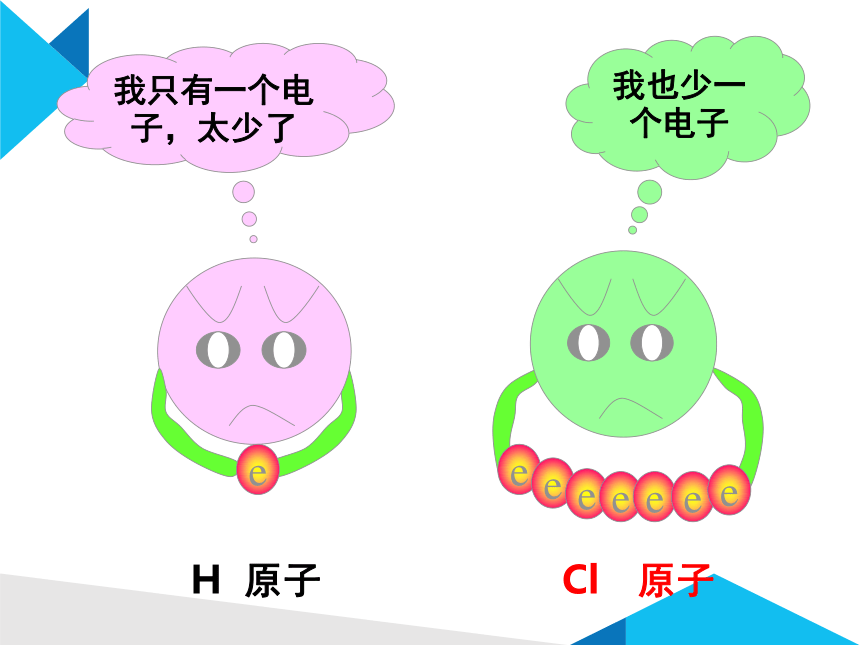
分开后,她们为什么不高兴?
让我们听听她们说些什么?
我只有一个电子,太少了
我也少一个电子
e
H 原子
Cl 原子
e
e
e
e
e
e
e
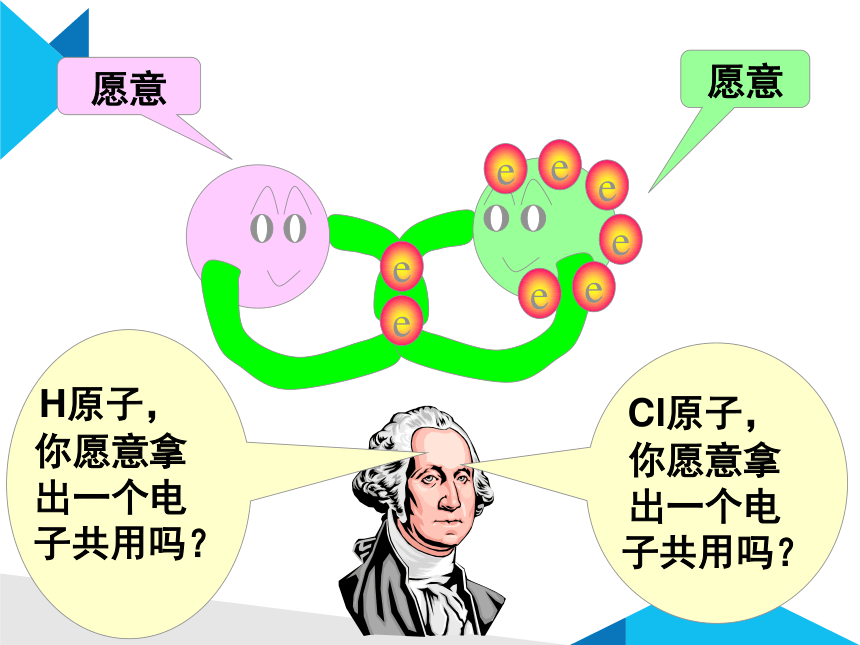
两位好!我是林和,我有一个好办法.你们每人拿出一个电子共用,就像共同分享快乐一样共同拥有
行吗?
e
好
啊
好
啊
e
e
e
e
e
e
e
愿意
愿意
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
e
e
e
e
e
e
e
e
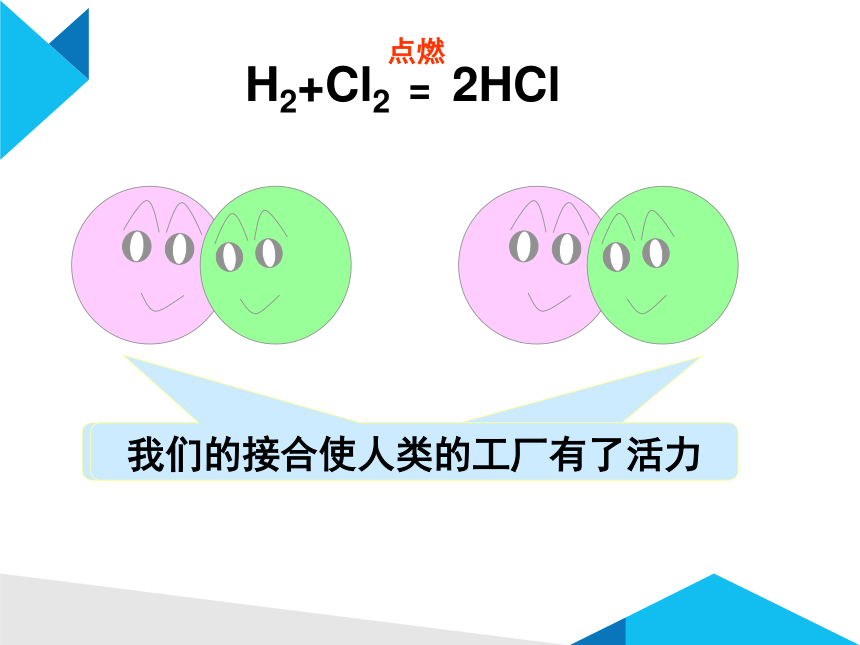
我们的接合使人类的生活多了一点味道
我们的接合使人类的工厂有了活力
H2+Cl2 = 2HCl
点燃
2、成键粒子:原子
3、成键作用力:“共用电子对”与两原子核的作用
4、成键规律:一般同种或不同种非金属元素之间
特殊:AlCl3、BeCl2
二、共价键的概念
1、定义:原子间通过共用电子对所形成的相互作用
讨论:只有非金属间才能形成共价键?
5、存在:非金属单质、共价化合物
共用电子对
共用电子对
共用电子对
共用电子对
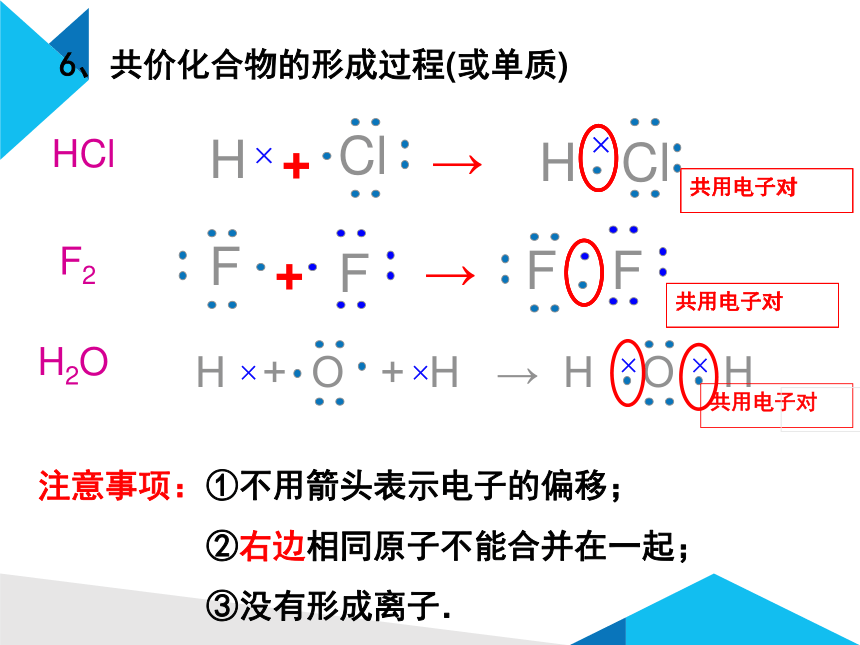
6、共价化合物的形成过程(或单质)
H + O + H → H O H
×
×
×
×
注意事项:①不用箭头表示电子的偏移;
②右边相同原子不能合并在一起;
③没有形成离子.
HCl
H2O
F2
×
H
Cl
+
→
×
H Cl
F
+
→
F
F
F
共用电子对
共用电子对
共用电子对
用一条短线来表示原子间的一对共用电子对,省略其余的电子。
H-H
Cl-Cl
O=C=O
N N
7、结构式:
H O O
H
O=C=O
H-O-O-H
CH4 CO2 H2O2
用电子式和结构式表示下列共价分子。
H
H
:
C
:
H
H
C
H
H
H
H
两原子形成共用电子对时,电子对一定在他们中间吗?与什么有关?
不一定,与提供共用电子的元素种类有关.
同种元素形成共价键共用电子对不偏移:非极性共价键.
不同元素形成共价键共用电子对偏移:极性共价键.
思考
键的极性特点
非极性键:电子对不偏向任何原子,成键两原子不出现正负两极。
电子对不偏移
极性键:电子对偏向得电子能力强的原子,使成键的两原子电荷分布不均匀,一个带部分正电荷,为正极,另一个带部分负电荷,为负极。
电子对偏向Cl
比 较 离子键 共价键
成键元素
成键微粒
成键本质
键的强弱
键的存在
非金属元素之间
活泼金属与非金属元素之间
阳离子 ~ 阴离子
原子 ~ 原子
静电作用
离子电荷数多、半径小的键强
原子半径小的键强
共用电子对
离子键和共价键的比较
只存于离子化合物
存于非金属单质、共价化合物、也可能存在离子化合物
(1)当一个化合物中只存在离子键时,该化合物是离子化合物。
含有离子键的化合物
只含有共价键的化合物
离子化合物定义:
共价化合物定义:
(2)当一个化合中同时存在离子键和共价键时,以离子键为主,该化合物也称为离子化合物。
(3)只有当化合物中只存在共价键时,该化合物才称为共价化合物。
(4)在离子化合物中一般既含有金属元素又含有非金属元素(含NH4+ 例外,如NH4Cl等);
共价化合物一般只含有非金属元素(例外如AlCl3)。
离子化合物与共价化合物有什么区别?
含有共价键的化合物一定是共价化合物。
全部由非金属元素组成的化合物一定是共价化合物。
在气态单质分子里一定有共价键。
如 NH4Cl 等铵盐
如:NaOH 、 Na2SO4
He、Ne等稀有气体
判断:
×
×
×
小 结
化学键
离子键
阴阳离子通过静电作用
共价键
通过共用电子对
化学变化的实质
旧键断裂,新键生成
共价化合物
只含有共价键
离子化合物
含有离子键
2、成键粒子:原子
3、成键作用力:“共用电子对”与两原子核的作用
4、成键规律:一般同种或不同种非金属元素之间
特殊:AlCl3、BeCl2
复习:共价键的概念
1、定义:原子间通过共用电子对所形成的相互作用
讨论:只有非金属间才能形成共价键?
5、存在:非金属单质、共价化合物
键的极性特点
非极性键:电子对不偏向任何原子,成键两原子不出现正负两极。
极性键:电子对偏向得电子能力强的原子,使成键的两原子电荷分布不均匀,一个带部分正电荷,为正极,另一个带部分负电荷,为负极。
Cl
··
··
H
··
··
H H
··
分子间作用力和氢键
冰液化、气化现象是物理变化还是化学变化?
冰液化、气化过程中有没有破坏其中的化学键?
那为什么冰液化、气化过程仍要吸收能量呢?
一、分子间作用力
(1)存在:分子间
概念:分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。
(2)强弱:比化学键弱
(3)主要影响物质的物理性质(熔沸点)
作用微粒 作用力强弱 大小范围
化学键
范德华力
原子之间
分子之间
微弱作用
分子间作用力与化学键的比较
强烈作用
125--836KJ/mol
2--20KJ/mol
F2
Cl2
Br2
I2
F2
Cl2
Br2
I2
沸点
熔点
相对分子质量
0
-50
-100
-150
-200
-250
50
100
150
200
250
50
100
150
200
250
温度/℃
卤素单质的熔、沸点与
相对分子质量的关系
0
-50
-100
-150
-200
-250
50
100
150
200
250
100
300
200
400
温度/℃
相对分子质量
×
×
×
500
×
×
×
×
CF4
CCl4
CBr4
CF4
CCl4
CBr4
CI4
沸点
熔点
四卤化碳的熔沸点与
相对分子质量的关系
分子间的作用力强弱(范德华力)
组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。
结论:
练习 比较下列物质的沸点高低
HCl HBr HI
36.5 81 128
物质中微粒间的作用力的类型与物质性质有密切关系。请与同学讨论下列问题,加深对物质结构与性质关系的认识。
1.氯化钠在熔化状态或水溶液中具有导电性,而液态氯化氢却不具有导电性。这是为什么
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么
二、氢键
1.氢键是一种特殊的分子间作用力,不是化学键
2.强弱:比化学键弱而比范德华力强
3.氢键的表示方法:X—H…Y
X、Y可以相同,也可以不同,(主要F、O、N)。
氢键对物质性质的影响
⑴氢键的存在使物质的熔沸点相对较高(如HF、H2O)。
(3)解释一些反常现象:如水结成冰时,为什么体积会膨胀。
(2)氢键的形成使某些物质在水中的溶解度增大(如NH3溶于水)
1、下列物质的分子中既含有极性键,又含有非极性键的是( )
A.CO2 B.H2O C.H2O2 D.H2
随堂练习
2.下列物质属于离子化合物的是( )
A.H2O B.Br2 C.CH4 D.CaCl2
3.下列物质中,属于共价化合物的是 ( )
A.Na2O B.NaCl C.HCl D.NaOH。
4下列关于氢键的说法正确的是( C )
A.由于氢键的作用,使NH3、H2O、HF的沸点反常,且沸点高低顺序为增大
B.氢键只能存在于分子间,不能存在于分子内
C.生命体中许多大分子内存在氢键
D.相同量的水在气态、液态和固态时均有氢键,且氢键的数目依次增多
5.下列过程破坏了化学键的是 (A )
A.氯化氢气体溶于水 B.溴蒸气被木炭吸附
C.碘升华 D.液氨汽化
谢谢观看
第一章 物质结构
元素周期律
第三节 化学键 (共2课时)
第2课时 共价键
离子键的定义?
哪些元素化合时可形成离子键?
使阴、阳离子结合成化合物的静电作用。
一般是活泼金属和活泼非金属离子间能形成
复习
HCl分子不是通过离子键来形成,是通过什么方式结合的呢?
问题
Cl2 气体分子
H2 气体分子
分开后,她们为什么不高兴?
让我们听听她们说些什么?
我只有一个电子,太少了
我也少一个电子
e
H 原子
Cl 原子
e
e
e
e
e
e
e
两位好!我是林和,我有一个好办法.你们每人拿出一个电子共用,就像共同分享快乐一样共同拥有
行吗?
e
好
啊
好
啊
e
e
e
e
e
e
e
愿意
愿意
H原子,你愿意拿出一个电子共用吗?
Cl原子,你愿意拿出一个电子共用吗?
e
e
e
e
e
e
e
e
我们的接合使人类的生活多了一点味道
我们的接合使人类的工厂有了活力
H2+Cl2 = 2HCl
点燃
2、成键粒子:原子
3、成键作用力:“共用电子对”与两原子核的作用
4、成键规律:一般同种或不同种非金属元素之间
特殊:AlCl3、BeCl2
二、共价键的概念
1、定义:原子间通过共用电子对所形成的相互作用
讨论:只有非金属间才能形成共价键?
5、存在:非金属单质、共价化合物
共用电子对
共用电子对
共用电子对
共用电子对
6、共价化合物的形成过程(或单质)
H + O + H → H O H
×
×
×
×
注意事项:①不用箭头表示电子的偏移;
②右边相同原子不能合并在一起;
③没有形成离子.
HCl
H2O
F2
×
H
Cl
+
→
×
H Cl
F
+
→
F
F
F
共用电子对
共用电子对
共用电子对
用一条短线来表示原子间的一对共用电子对,省略其余的电子。
H-H
Cl-Cl
O=C=O
N N
7、结构式:
H O O
H
O=C=O
H-O-O-H
CH4 CO2 H2O2
用电子式和结构式表示下列共价分子。
H
H
:
C
:
H
H
C
H
H
H
H
两原子形成共用电子对时,电子对一定在他们中间吗?与什么有关?
不一定,与提供共用电子的元素种类有关.
同种元素形成共价键共用电子对不偏移:非极性共价键.
不同元素形成共价键共用电子对偏移:极性共价键.
思考
键的极性特点
非极性键:电子对不偏向任何原子,成键两原子不出现正负两极。
电子对不偏移
极性键:电子对偏向得电子能力强的原子,使成键的两原子电荷分布不均匀,一个带部分正电荷,为正极,另一个带部分负电荷,为负极。
电子对偏向Cl
比 较 离子键 共价键
成键元素
成键微粒
成键本质
键的强弱
键的存在
非金属元素之间
活泼金属与非金属元素之间
阳离子 ~ 阴离子
原子 ~ 原子
静电作用
离子电荷数多、半径小的键强
原子半径小的键强
共用电子对
离子键和共价键的比较
只存于离子化合物
存于非金属单质、共价化合物、也可能存在离子化合物
(1)当一个化合物中只存在离子键时,该化合物是离子化合物。
含有离子键的化合物
只含有共价键的化合物
离子化合物定义:
共价化合物定义:
(2)当一个化合中同时存在离子键和共价键时,以离子键为主,该化合物也称为离子化合物。
(3)只有当化合物中只存在共价键时,该化合物才称为共价化合物。
(4)在离子化合物中一般既含有金属元素又含有非金属元素(含NH4+ 例外,如NH4Cl等);
共价化合物一般只含有非金属元素(例外如AlCl3)。
离子化合物与共价化合物有什么区别?
含有共价键的化合物一定是共价化合物。
全部由非金属元素组成的化合物一定是共价化合物。
在气态单质分子里一定有共价键。
如 NH4Cl 等铵盐
如:NaOH 、 Na2SO4
He、Ne等稀有气体
判断:
×
×
×
小 结
化学键
离子键
阴阳离子通过静电作用
共价键
通过共用电子对
化学变化的实质
旧键断裂,新键生成
共价化合物
只含有共价键
离子化合物
含有离子键
2、成键粒子:原子
3、成键作用力:“共用电子对”与两原子核的作用
4、成键规律:一般同种或不同种非金属元素之间
特殊:AlCl3、BeCl2
复习:共价键的概念
1、定义:原子间通过共用电子对所形成的相互作用
讨论:只有非金属间才能形成共价键?
5、存在:非金属单质、共价化合物
键的极性特点
非极性键:电子对不偏向任何原子,成键两原子不出现正负两极。
极性键:电子对偏向得电子能力强的原子,使成键的两原子电荷分布不均匀,一个带部分正电荷,为正极,另一个带部分负电荷,为负极。
Cl
··
··
H
··
··
H H
··
分子间作用力和氢键
冰液化、气化现象是物理变化还是化学变化?
冰液化、气化过程中有没有破坏其中的化学键?
那为什么冰液化、气化过程仍要吸收能量呢?
一、分子间作用力
(1)存在:分子间
概念:分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。
(2)强弱:比化学键弱
(3)主要影响物质的物理性质(熔沸点)
作用微粒 作用力强弱 大小范围
化学键
范德华力
原子之间
分子之间
微弱作用
分子间作用力与化学键的比较
强烈作用
125--836KJ/mol
2--20KJ/mol
F2
Cl2
Br2
I2
F2
Cl2
Br2
I2
沸点
熔点
相对分子质量
0
-50
-100
-150
-200
-250
50
100
150
200
250
50
100
150
200
250
温度/℃
卤素单质的熔、沸点与
相对分子质量的关系
0
-50
-100
-150
-200
-250
50
100
150
200
250
100
300
200
400
温度/℃
相对分子质量
×
×
×
500
×
×
×
×
CF4
CCl4
CBr4
CF4
CCl4
CBr4
CI4
沸点
熔点
四卤化碳的熔沸点与
相对分子质量的关系
分子间的作用力强弱(范德华力)
组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。
结论:
练习 比较下列物质的沸点高低
HCl HBr HI
36.5 81 128
物质中微粒间的作用力的类型与物质性质有密切关系。请与同学讨论下列问题,加深对物质结构与性质关系的认识。
1.氯化钠在熔化状态或水溶液中具有导电性,而液态氯化氢却不具有导电性。这是为什么
2.干冰受热汽化转化为二氧化碳气体,而二氧化碳气体在加热条件下却不易被分解。这是为什么
二、氢键
1.氢键是一种特殊的分子间作用力,不是化学键
2.强弱:比化学键弱而比范德华力强
3.氢键的表示方法:X—H…Y
X、Y可以相同,也可以不同,(主要F、O、N)。
氢键对物质性质的影响
⑴氢键的存在使物质的熔沸点相对较高(如HF、H2O)。
(3)解释一些反常现象:如水结成冰时,为什么体积会膨胀。
(2)氢键的形成使某些物质在水中的溶解度增大(如NH3溶于水)
1、下列物质的分子中既含有极性键,又含有非极性键的是( )
A.CO2 B.H2O C.H2O2 D.H2
随堂练习
2.下列物质属于离子化合物的是( )
A.H2O B.Br2 C.CH4 D.CaCl2
3.下列物质中,属于共价化合物的是 ( )
A.Na2O B.NaCl C.HCl D.NaOH。
4下列关于氢键的说法正确的是( C )
A.由于氢键的作用,使NH3、H2O、HF的沸点反常,且沸点高低顺序为增大
B.氢键只能存在于分子间,不能存在于分子内
C.生命体中许多大分子内存在氢键
D.相同量的水在气态、液态和固态时均有氢键,且氢键的数目依次增多
5.下列过程破坏了化学键的是 (A )
A.氯化氢气体溶于水 B.溴蒸气被木炭吸附
C.碘升华 D.液氨汽化
谢谢观看
