4.3课时2离子键课件(共26张PPT)2023-2024学年高一化学人教版(2019)必修第一册
文档属性
| 名称 | 4.3课时2离子键课件(共26张PPT)2023-2024学年高一化学人教版(2019)必修第一册 |

|
|
| 格式 | ppt | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 10:42:17 | ||
图片预览





文档简介
(共26张PPT)
第一章 物质结构 元素周期律
第三节 化学键 (共2课时)
第1课时 离子键
元素的原子通过什么作用形成如此丰富多彩的物质呢?
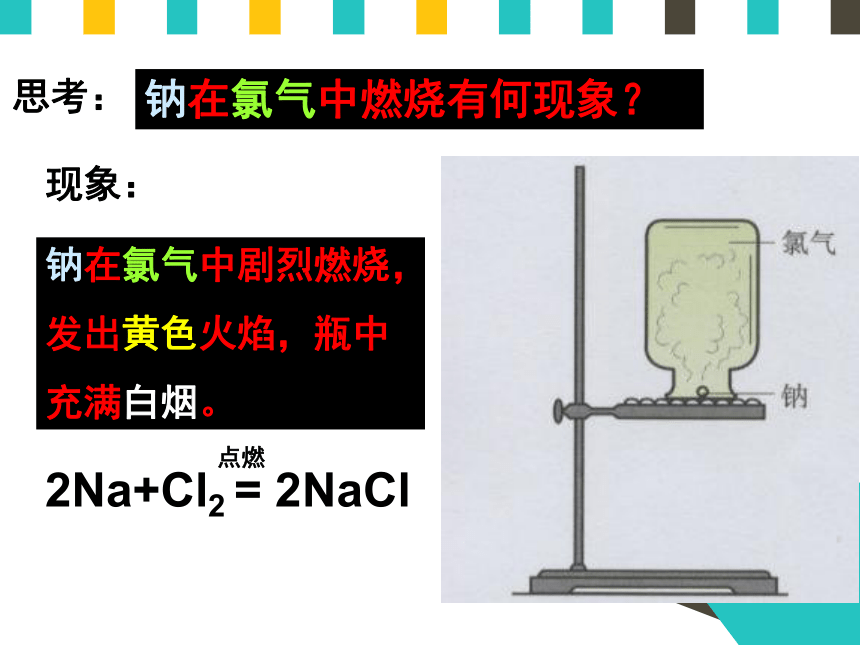
钠在氯气中燃烧有何现象?
现象:
钠在氯气中剧烈燃烧,
发出黄色火焰,瓶中
充满白烟。
思考:
2Na+Cl2 = 2NaCl
点燃
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
Na
+11
8
1
2
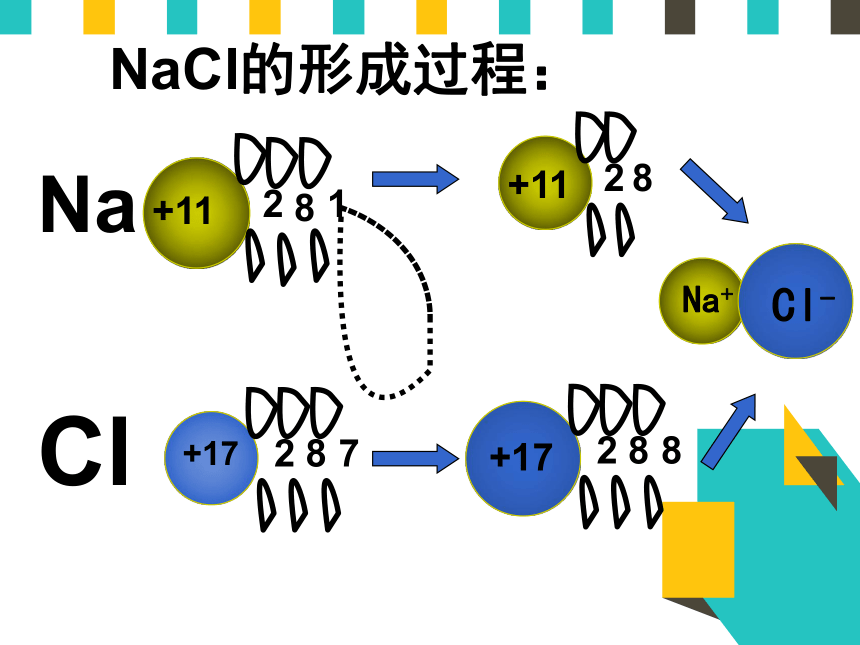
NaCl的形成过程:
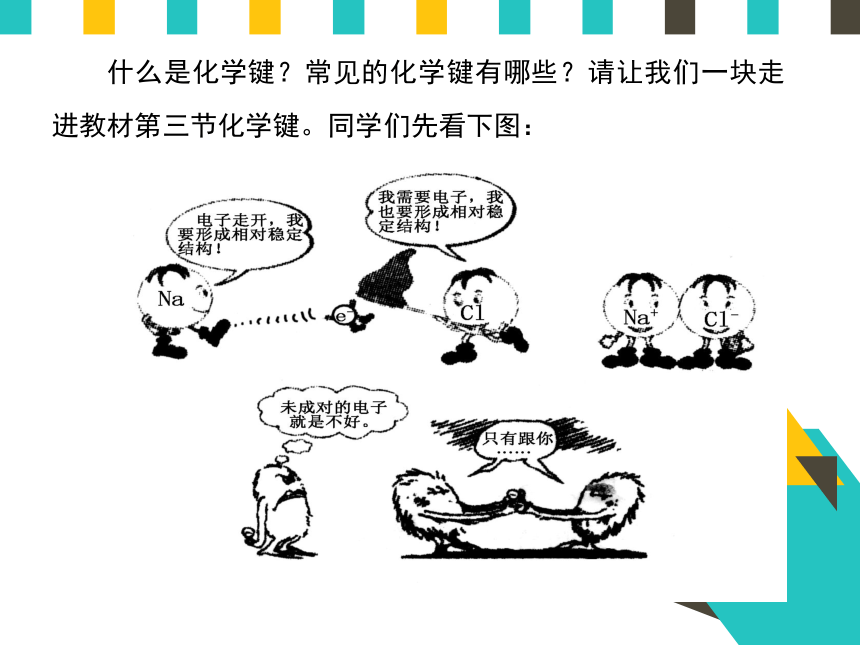
1、Na+离子和Cl-离子间的静电相互吸引作用
2、阴阳离子间电子与电子、原子核与原子核间的相互排斥作用
3、阴阳离子接近到某一定距离时,当吸引和排斥作用达到平衡,阴阳离子间形成稳定的化学键。
像NaCl这样,使阴、阳离子结合成化合物的静电作用,叫离子键。
一、离子键
1、定义:
使阴阳离子结合成化合物的静电作用,叫做离子键。
2、本质及形成条件
成键原因:
成键粒子:
成键本质:
成键元素:
原子间通过电子得失形成稳定结构
阴阳离子
静电作用(静电吸引和静电排斥)
活泼的金属元素(ⅠA,ⅡA)
和活泼的非金属元素( ⅥA,ⅦA)
注意:金属离子(铵根离子)和酸根离子(或活泼非金属元素) 之间也是离子键.
3、离子化合物— 含有离子键的化合物
强碱、活泼金属氧化物、
大部分盐
4、电子式:
在元素符号周围用小黑点(或×)来表示原子的最外层电子,这种式子叫做电子式。
(1) 原子的电子式:
H
O
Cl
Mg
Na
(2) 简单离子的电子式:
一般用 表示
R
n-
即离子符号
简单 阳离子
简单 阴离子
Cl
O
2-
Na
Cl
Na
Na
O
2-
Na
Cl
Mg
2
Cl
(3) 离子化合物:
由阳离子的电子式和阴离子的电子式组合而成.
注意:相同的离子不能写在一起,一般对称排列.
5、用电子式表示离子化合物的形成过程
①左侧写原子的电子式;
②用弧形箭头表示电子转移的方向;
③中间用 连接;
④右侧写离子化合物的电子式。
例:用电子式表示NaCl的离子键的形成过程
Na×
Cl
×
× ×
× ×
× ×
Cl
× ×
× ×
[ ]-
× ×
× ×
画箭号
方括号
电荷数
Na+
+
练习:用电子式表示下列形成过程
Br
Mg
Br
(2)MgBr2
(1) K2S
Mg
2
Br
Br
S
K
K
S
2-
K
+
K
+
注
意
箭头左方相同的微粒可以合并,
箭头右方相同的微粒不可以合并。
1、离子键:使阴阳离子结合成化合物的静电作用,叫做离子键。
2、离子化合物:含有离子键的化合物一定是离子化合物
3、电子式: 用电子式表示物质
用电子式表示物质形成过程
黄
白烟
2Na+Cl2 = 2NaCl
点燃
失去
得到
最外层上的1个电子
带1个单位的正电荷
氯离子
静电作用
带相反电荷离子之间的相互作用称为离子键
阴、阳离子间的静电作用
由离子键构成的化合物
KCl、MgCl2、CaCl2、ZnSO4、NaOH
活泼非金属
活泼金属
1、下列说法正确的是( )
A、离子键就是阴阳离子间的静电引力
B、所有金属元素与所有非金属间都能形成离子键
C、钠原子与氯原子结合成氯化钠后体系很稳定
D、在离子化合物氯化钙中,两个氯原子间也存在离子键
C
2、下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是( )
A、10和19 B、6和16
C、11和17 D、14和8
C
3、下列电子式是否正确
:O: [:Na:]+ [:S:]-2
:
:
:
:
Ca2+[:Cl:]2- Na2+[:O:]2-
:
:
:
:
:
:
×
×
×
×
×
4. 写出下列粒子的电子式:
(1) H H+; S S2-;
(2) Na2O
溴化钾(KBr)的形成过程
溴化钙(CaBr2)的形成过程
硫化钾(K2S)的形成过程
5. 用电子式表示下列离子化合物的形成过程:
谢谢观看
第一章 物质结构 元素周期律
第三节 化学键 (共2课时)
第1课时 离子键
元素的原子通过什么作用形成如此丰富多彩的物质呢?
钠在氯气中燃烧有何现象?
现象:
钠在氯气中剧烈燃烧,
发出黄色火焰,瓶中
充满白烟。
思考:
2Na+Cl2 = 2NaCl
点燃
Cl
+17
8
7
2
+11
8
2
+17
8
8
2
Na+
Cl-
Na
+11
8
1
2
NaCl的形成过程:
1、Na+离子和Cl-离子间的静电相互吸引作用
2、阴阳离子间电子与电子、原子核与原子核间的相互排斥作用
3、阴阳离子接近到某一定距离时,当吸引和排斥作用达到平衡,阴阳离子间形成稳定的化学键。
像NaCl这样,使阴、阳离子结合成化合物的静电作用,叫离子键。
一、离子键
1、定义:
使阴阳离子结合成化合物的静电作用,叫做离子键。
2、本质及形成条件
成键原因:
成键粒子:
成键本质:
成键元素:
原子间通过电子得失形成稳定结构
阴阳离子
静电作用(静电吸引和静电排斥)
活泼的金属元素(ⅠA,ⅡA)
和活泼的非金属元素( ⅥA,ⅦA)
注意:金属离子(铵根离子)和酸根离子(或活泼非金属元素) 之间也是离子键.
3、离子化合物— 含有离子键的化合物
强碱、活泼金属氧化物、
大部分盐
4、电子式:
在元素符号周围用小黑点(或×)来表示原子的最外层电子,这种式子叫做电子式。
(1) 原子的电子式:
H
O
Cl
Mg
Na
(2) 简单离子的电子式:
一般用 表示
R
n-
即离子符号
简单 阳离子
简单 阴离子
Cl
O
2-
Na
Cl
Na
Na
O
2-
Na
Cl
Mg
2
Cl
(3) 离子化合物:
由阳离子的电子式和阴离子的电子式组合而成.
注意:相同的离子不能写在一起,一般对称排列.
5、用电子式表示离子化合物的形成过程
①左侧写原子的电子式;
②用弧形箭头表示电子转移的方向;
③中间用 连接;
④右侧写离子化合物的电子式。
例:用电子式表示NaCl的离子键的形成过程
Na×
Cl
×
× ×
× ×
× ×
Cl
× ×
× ×
[ ]-
× ×
× ×
画箭号
方括号
电荷数
Na+
+
练习:用电子式表示下列形成过程
Br
Mg
Br
(2)MgBr2
(1) K2S
Mg
2
Br
Br
S
K
K
S
2-
K
+
K
+
注
意
箭头左方相同的微粒可以合并,
箭头右方相同的微粒不可以合并。
1、离子键:使阴阳离子结合成化合物的静电作用,叫做离子键。
2、离子化合物:含有离子键的化合物一定是离子化合物
3、电子式: 用电子式表示物质
用电子式表示物质形成过程
黄
白烟
2Na+Cl2 = 2NaCl
点燃
失去
得到
最外层上的1个电子
带1个单位的正电荷
氯离子
静电作用
带相反电荷离子之间的相互作用称为离子键
阴、阳离子间的静电作用
由离子键构成的化合物
KCl、MgCl2、CaCl2、ZnSO4、NaOH
活泼非金属
活泼金属
1、下列说法正确的是( )
A、离子键就是阴阳离子间的静电引力
B、所有金属元素与所有非金属间都能形成离子键
C、钠原子与氯原子结合成氯化钠后体系很稳定
D、在离子化合物氯化钙中,两个氯原子间也存在离子键
C
2、下列各数值表示有关元素的原子序数,能以离子键相互结合成稳定化合物的是( )
A、10和19 B、6和16
C、11和17 D、14和8
C
3、下列电子式是否正确
:O: [:Na:]+ [:S:]-2
:
:
:
:
Ca2+[:Cl:]2- Na2+[:O:]2-
:
:
:
:
:
:
×
×
×
×
×
4. 写出下列粒子的电子式:
(1) H H+; S S2-;
(2) Na2O
溴化钾(KBr)的形成过程
溴化钙(CaBr2)的形成过程
硫化钾(K2S)的形成过程
5. 用电子式表示下列离子化合物的形成过程:
谢谢观看
