重庆市2023-2024学年高二上学期1月期末联合检测化学试题(PDF含答案)
文档属性
| 名称 | 重庆市2023-2024学年高二上学期1月期末联合检测化学试题(PDF含答案) |  | |
| 格式 | |||
| 文件大小 | 792.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-17 11:32:26 | ||
图片预览



文档简介
2023 年秋高二(上)期末联合检测试卷
化 学
化学测试卷共 4 页,满分 100 分。考试时间 75 分钟。
可能用到的相对原子质量:H-1 C-12 O-16
一、选择题:本大题共 14小题,每小题 3分,共 42分。在每小题给出的四个选项中,只有一项符合题目要求。
1. 十二生肖兽首铜像是我国的国宝,兽首上的褶皱和绒毛等细微处,都清晰逼真,其历经二百多年而不锈蚀,
堪称一绝。下列有关说法正确的是
A.在兽首铜像表面镀了一层锌
B.金属铜的活动性小,不与空气中的物质反应
C.用外加电流法对它们进行了保护,所以不锈蚀
D.在铸造它的铜中添加了金、银、锡、锌,增强了抗锈蚀能力
2. 下列溶液因水解而呈酸性的是
A.NH4Cl B.H2SO4 C.CaC2O4 D.KHCO3
3. 草酸铁铵[(NH4)3Fe(C2O4)3]常用于电镀工业,下列有关其中元素的说法正确的是
A.基态铁原子的价层电子排布式为 3d64s2 B.第一电离能:O>N>C
C.N 元素在周期表的 sp 区 D.C、N、O 的最高正化合价依次升高
4. 下列事实能用勒夏特列原理解释的是
A.将猪肉放入冰箱中冷藏 B.打开可乐瓶盖立即有气泡冒出
C.工业上合成 NH3 温度控制在 400~500℃ D.H2O2 溶液中加少量 MnO2固体,促进 H2O2分解
5. 下列说法正确的是
A.活化分子之间的碰撞叫做有效碰撞 B.生铁中含碳,生铁抗腐蚀能力比纯铁弱
C.工业上合成氨压强越大越好 D.蒸干AlCl3和Al2(SO4)3溶液,所得固体成分相同
6. 下列各组离子在溶液中能大量共存的是
- - 2-
A.HCO3 、NO K
+ -
、 、OH 3 B.Fe
3+ + +、SO4 、H 、Cu
2
2- 2- + -
C CO SO Ca2+ Al3+ D NH HCO [Al(OH) ]- Na+. 3 、 4 、 、 . 4 、 3 、 4 、
7. 氢气可用于烟气的脱氮、脱硫,其反应为 4H2(g)+2NO(g)+SO2(g) N2(g)+S(l)+4H2O(g) ΔH<0。下
列有关说法不正确的是
A.该反应的 ΔS<0
B.当 v 正(SO2)=v 逆(N2)时,反应达到平衡
C.使用高效催化剂可提高 NO 的平衡转化率
D.升高温度,正、逆反应速率均增大,化学平衡逆向移动
8. 相同温度下,1L 0.01 mol L-1· 氨水与 100mL 0.1mol -1·L 氨水相比,下列数值中,前者大于后者的是
A.NH3·H2O 的电离程度 B.NH3·H2O 的电离常数
C.溶液的 pH D.中和二者消耗 H2SO4的物质的量
9. 下列离子方程式书写正确的是
2-
A.Na2CO3 溶液水解:CO 2H O H CO 2OH
-
3 + 2 2 3+
B.Mg(OH) + -2沉淀溶解平衡:Mg(OH)
2
2(s)=Mg (aq)+2OH (aq)
C.碳酸钙与醋酸反应:CaCO3+2H
+ Ca2+= +CO2↑+H2O
电解
D.惰性电极电解足量 CuSO4溶液:2Cu
2++2H2O 2Cu+O
+
2↑+4H
高二(上)期末联合检测试卷(化学)第 1 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
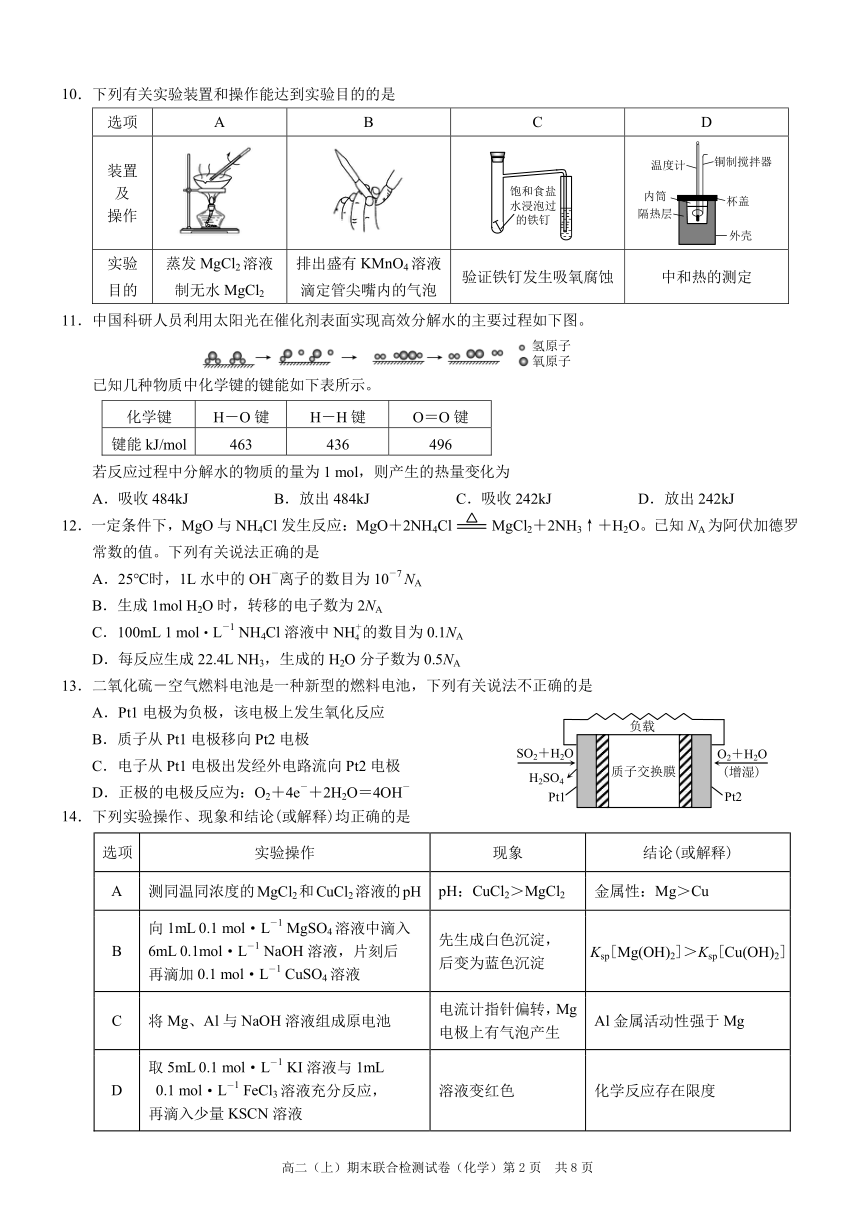
10.下列有关实验装置和操作能达到实验目的的是
选项 A B C D
铜制搅拌器
装置 温度计
及 饱和食盐 内筒
水浸泡过 杯盖
操作 隔热层 的铁钉
外壳
实验 蒸发 MgCl2溶液 排出盛有 KMnO4溶液
验证铁钉发生吸氧腐蚀 中和热的测定
目的 制无水 MgCl2 滴定管尖嘴内的气泡
11.中国科研人员利用太阳光在催化剂表面实现高效分解水的主要过程如下图。
氢原子
氧原子
已知几种物质中化学键的键 能如下表所 示。
化学键 H-O 键 H-H 键 O=O 键
键能 kJ/mol 463 436 496
若反应过程中分解水的物质的量为 1 mol,则产生的热量变化为
A.吸收 484kJ B.放出 484kJ C.吸收 242kJ D.放出 242kJ
12.一定条件下,MgO 与 NH Cl 发生反应:MgO+2NH Cl 4 4 MgCl2+2NH3↑+H2O。已知 NA为阿伏加德罗
常数的值。下列有关说法正确的是
A.25℃时,1L - -水中的 OH 离子的数目为 10 7 NA
B.生成 1mol H2O 时,转移的电子数为 2NA
C.100mL 1 mol·L-1 NH4Cl 溶液中 NH
+
4 的数目为 0.1NA
D.每反应生成 22.4L NH3,生成的 H2O 分子数为 0.5NA
13.二氧化硫-空气燃料电池是一种新型的燃料电池,下列有关说法不正确的是
A.Pt1 电极为负极,该电极上发生氧化反应
负载
B.质子从 Pt1 电极移向 Pt2 电极
SO2+H2O O2+H2O
C.电子从 Pt1 电极出发经外电路流向 Pt2 电极
H SO 质子交换膜 (增湿) 2 4
D - -.正极的电极反应为:O2+4e +2H2O=4OH Pt1 Pt2
14.下列实验操作、现象和结论(或解释)均正确的是
选 项 实验操作 现象 结论(或解释)
A 测同温同浓度的MgCl2和CuCl2溶液的pH pH:CuCl2>MgCl2 金属性:Mg>Cu
-1
向 1mL 0.1 mol·L MgSO4溶液中滴入
先生成白色沉淀,
B 6mL 0.1mol·L-1 NaOH 溶液,片刻后 K
sp
[Mg(OH)2]>Ksp[Cu(OH)2]
后变为蓝色沉淀
再滴加 0.1 mol L-1· CuSO4 溶液
电流计指针偏转,Mg
C 将 Mg、Al 与 NaOH 溶液组成原电池 Al 金属活动性强于 Mg
电极上有气泡产生
取 5mL 0.1 mol -1·L KI 溶液与 1mL
D 0.1 mol -1·L FeCl3 溶液充分反应, 溶液变红色 化学反应存在限度
再滴入少量 KSCN 溶液
高二(上)期末联合检测试卷(化学)第 2 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
二、非选择题(本大题共 4小题,共 58分)
15.(14 分)储氢材料是当今研究的重点课题之一。X、Y 是两种金属元素,都可制得储氢材料,X 元素的基态
原子价层电子排布式为 3d24s2,由它制得的储氢材料为 X(BH4)3;Y 是短周期主族元素,其部分电离能(单
位:kJ mol-1· )数据如下表所示:
I1 I2 I3 I4 I5
738 1451 7733 10540 13630
(1)X、Y 两元素的元素符号分别是 、 。
(2)Y 元素在周期表中的位置是 。
(3)元素 Y 的基态原子具有 种空间运动状态不同的电子。
(4)X(BH4)3中所含化学键类型为 ,基态 B 原子的轨道表示式为 。
5 LiH YH r(Li+) r(H-( ) 与 2 一样,都是具有良好发展前景的储氢材料。 )(填“>”或“<”);YH2的
电子式为 。
16.(15 分)MnO2 的用途很多,如用作电极材料和催化剂等。下图为由富锰废料(含 MnO2、MnCO3、FeCO3
和少量 Al2O3、NiO)制备 MnO2和回收金属资源的工艺流程图。
(1)H O (2)NaOH 溶液
稀硫酸 含 SO2 废气
2 2 MnS KMnO4
浆液 上层清液 氧化,调 pH 系列操作
富锰废料 化浆 吸收 滤液 沉镍 转化 MnO2
沉铁、铝
下层浆液
NiS 母液
滤渣
已知:有关金属离子沉淀的相关 pH 见下表。
Fe3+ Al3+金属离子 Fe2+ Ni2+ Mn2+
开始沉淀时的 pH 2.2 3.6 7.5 7.5 8.8
完全沉淀时的 pH 3.2 4.7 9.5 9.5 10.8
(1)KMnO4 中,Mn 元素的化合价为 ;基态 Mn 原子的价层电子排布式为 。
(2)提高“化浆”速率的措施是 (任写一种)。
(3)流程中加入 H2O2 的主要目的是 ;“调 pH”时,应当调节 pH 的范围是 。
(4)“转化”过程中主要反应的离子方程式为 。
+ -
(5)“沉镍”时,当 Ni2 恰好完全沉淀时,溶液中的 c(S2 )= mol·L-1,所发生的反应为:
MnS(s)+Ni2+(aq) NiS(s)+Mn2+(aq),则此反应的平衡常数 K= 。[已知此温度下
K (NiS)=1.1×10-21 -sp ,Ksp(MnS)=4.4×10
14]
17.(15 分)硫代硫酸钠(Na2S2O3)主要用于照相业作定影剂,其次作鞣革时重铬酸盐的还原剂。实验室制备
Na2S2O3的装置如下图所示。
浓硫酸
Na SO Na2S 和2 3
溶液 Na2CO3
溶液
A B C D
高二(上)期末联合检测试卷(化学)第 3 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
(1)盛装浓硫酸的仪器名称是 。
(2)B 装置的作用为 ,D 装置中的试剂是 。
(3)Na2S 溶液呈碱性的主要原因是 (用离子方程式表示);常温下,pH=10 的 Na2S 溶液中,
+水电离出的 c(H )= ;Na2CO3溶液中,离子浓度由大到小的顺序是 (填离子符号)。
(4)取 20mL 上述制备的 Na2S2O3溶液于锥形瓶中,将其调整呈弱酸性,滴入 2 滴淀粉溶液(溶液无色),
cmol L-1
2-
I -
2-
用 · 的标准 2 溶液滴定,消耗标准 I2 溶液 VmL。(已知:I2+2S2O3 =2I +S4O6 )。
①盛装标准 I2 溶液的滴定管是 滴定管(填“酸式”或“碱式”)。
②滴定达到终点时的现象是 。
③Na2S2O3溶液的浓度为 mol L
-1
· 。
18.(14 分)让二氧化碳能够成功转化为人类可以利用的能源,是许多科学家正在研究的课题。
(1)我国科学家利用 CO2合成淀粉的研究已取得成功,其涉及的关键反应如下:
Ⅰ.CO2(g) 3H
-
+ 12(g) CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ mol
-1
·
Ⅲ.CO(g)+2H2(g) CH3OH(g) ΔH3
①反应Ⅲ中 ΔH3= kJ·mol
-1。
②在一定条件下,向容积恒为 1 L 的容器中按 n(CO2)︰n(H2)=1︰3 的比例通入气体,只发生反应Ⅰ,
下列情况可以说明反应Ⅰ已经达到平衡的是 。
A.混合气体密度不再改变 B.混合气体平均相对分子质量不再改变
C.容器内的压强不再改变 D.容器中 CO2 与 H2的物质的量之比不再改变
(2)一定条件下,向 1L 恒容密闭容器中充入 1mol CO2 和 2mol H2,只发生反应Ⅰ。测得 5min 时 CO2的转
化率在 5 种不同温度下的变化如下图 1 所示。
①温度为 T4 K 时,在 0~5min 内 H2 的平均反应速率 v(H2)= 。
②温度为 T K -时,反应Ⅰ的平衡常数 K= L2 mol 25 · 。
X Y CO2 转化率/% 电源
a CO2
60
c
50 b Pt Cu
CH3OH
0 T T T T T 稀 H2SO4 稀 H SO CH
C2H4 2 4 4
1 2 3 4 5 温度/K 阳离子交换膜
图 1 图 2
(3)科学研究人员用图 2 所示装置原理,实现了 CO2 的回收利用。
①X 为电源的 极。
②写出生成 C2H4的电极反应式 。
③在一定条件下,该装置 Cu 电极附近制得的 CH3OH、CH4、C2H4 的物质的量之比为 2︰1︰1,则当 Pt
电极附近有 6.72L 气体产生时(已折算为标准状况,不考虑水蒸气,忽略气体的溶解),制得的 CH3OH
的质量为 g。
高二(上)期末联合检测试卷(化学)第 4 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
2023 年秋高二(上)期末联合检测试卷
化学 参考答案
1~5 DAABB 6~10 BCADC 11~14CADD
3.A
【解析】
B.第一电离能:N>O>C;
C.N 元素在周期表的 p 区;
D.O 元素没有最高正化合价。
4.B
【解析】
A.与反应速度有关,与平衡移动无关;
B.可乐中存在 CO2(g)+H2O(l) H2CO3(aq)平衡,打开可乐瓶盖,减小压强,平衡逆向移动;
C.工业上合成 NH3 温度控制在 400~500℃是为了增大反应速率;
D.MnO2 作催化剂,与平衡移动无关。
5.B
【解析】
A.能够发生化学反应的碰撞才叫有效碰撞;
B.由于生铁中含碳,容易形成原电池而发生腐蚀;
C.工业上合成氨的压强为 10MPq~30Mpa,不是越大越好;
D.蒸干 AlCl3 和 Al2(SO4)3 溶液,分别得到固体成分分别是 Al (OH)3 和 Al2(SO4)3。
6.B
【解析】
A.HCO-3 与 OH
-
发生反应;
C.CO2- 2+ 3+3 与 Ca 、Al 都要反应;
D.HCO- 3 与[Al(OH) ]
-
4 反应生成 Al(OH)3 沉淀。
7.C
【解析】
A.该反应的正反应是气体分子数减少的反应,故 ΔS<0;
B.v 正(SO2)=v 逆(N2),所以正、逆反应速率相等,反应达到平衡;
C.使用催化剂不能使化学平衡发生移动,不可能提高 NO 的平衡转化率;
D.该反应正反应是放热反应,升高温度平衡逆向移动,正、逆反应速率均增大。
8.A.
【解析】溶液越稀,电离程度越大。
9.D
【解析】
A.CO2-3 水解的离子方程式要分步书写;
高二(上)期末联合检测试卷(化学)第 5 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
B.应把“=”改成可逆符号;
C.醋酸是弱酸,书写离子方程式不能拆。
10.C
【解析】
A +.由于 Mg2 要水解,蒸发 MgCl2 溶液得到 Mg(OH)2 或 MgO;
B.KMnO4溶液不能盛装在碱式滴定管中;
D.铜制搅拌器要导热。
11.C
催化分解
【解析】水分解的反应式为 2H2O 2H2↑+O2↑,2mol H2O 分解,吸收的热量为
2×2×463-2×436-496=484kJ,1mol 水分解吸收的热量为 242 kJ。
12.A
【解析】
B.该反应不是氧化还原反应,没有电子转移;
C.NH+4 要水解,故离子数目小于 0.1NA;
D.NH3没有说明状态,无法计算。
13.D
【解析】由图 SO2→H2SO4,S 的化合价升高,Pt1 是负极,Pt2 是正极,
-
正极的电极反应式为:O2+4e +4H
+=2H2O
14.D
【解析】
A.现象应该是 pH:MgCl2>CuCl2,
B.所加 NaOH 过量,生成 Mg(OH)2 后,再滴加 CuSO4溶液生成 Cu(OH)2,不能说明 Cu(OH)2是 Mg(OH)2 转化
而来;
C.将 Mg、Al 与 NaOH 溶液组成原电池,由于 Mg 不与 NaOH 溶液反应, 但 Mg 金属活动性强于 Al。
15.(14 分)
(1)Ti(1 分) Mg(1 分)
(2)第三周期ⅡA 族(2 分)
(3)6(2 分)
1s 2s 2p
(4)离子键、共价键(2 分) ↑ ↓ ↑ ↓ ↑ (2 分)
(5)<(2 分) (2 分)
【解析】X 元素的基态原子价层电子排布式为 3d24s2,X 为 Ti;Y 是短周期主族元素,其 I3 是 I2的 5 倍多,其
最外层应为 2 个电子,且核外电子数大于 5,故 Y 为 Mg;基态 Mg 原子的轨道表示式为
。 有 6 种不同的轨道,有 6 种空间运动状态不同的电子。
高二(上)期末联合检测试卷(化学)第 6 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
16.(15 分)
(1)+7 (1分) 3d54s2(2分)
(2)搅拌、适当增加化浆时间、适当升温、适当增大硫酸浓度、粉碎废料等;(2 分)
3 Fe2+ Fe3+( )将 氧化为 ,便于除去(2 分) 4.7≤pH<7.5(2 分)
(4)2MnO- 2+4 +3Mn +2H2O=5MnO
+
2↓+4H (2 分)
(5)1.1×10-16(2 分) 4×107(2 分)
- K (NiS) 1.1 10 21 c(Mn2 ) K (MnS) 4.4 10 14
【解析】(5)c(S2 )= sp
-
=1.1×10
16;K= sp =4×107
c(Ni2 ) 1.0 10 5 c(Ni2 ) Ksp (NiS) 1.1 10
21
17.(15 分)
(1)分液漏斗(1 分)
(2)安全装置和缓冲气流(2 分)NaOH 溶液(1 分)
3 S2- H O HS- OH-( ) + 2 + (2 分) 10
-4mol/L(2 分)
c(Na+) c(CO2-) c(OH- +> -3 > )>c(HCO3 )>c(H )(2 分)
(4)①酸式(1 分) ②当滴入最后半滴标准液时,溶液由无色变为蓝色,且半分钟内不褪色(2 分)
③0.1cV(2 分)
2 cV 10 3
【解析】n(S O2-2 3 )=2n(I
-3
2)=2×cV×10 mol; c(Na2S2O3)= =0.1cV
20 10 3
18.(14 分,每空 2 分)
(1)①-90.2 ②BC
(2)①0.36mol/(L·min) ②4
(3)①正 2CO 12H+ -② 2+ +12e =C2H4+4H2O ③2.4
【解析】(1)反应Ⅲ=反应Ⅰ-反应Ⅱ,ΔH3=ΔH1-ΔH2=-49.0 kJ/mol-41.2 kJ/mol=-90.2 kJ/mol。
0.6mol
(2)①CO2(g)+3H2(g) CH3OH(g)+H 1L2O(g),v(H2)=3v(CO2)= 3=0.36mol/(L·min)
5min
②CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始 1 2
转化 0.5 1.5 0.5 0.5
平衡 0.5 0.5 0.5 0.5
0.5 0.5
K 1 1 4
0.5 0.5
( )3
1 1
高二(上)期末联合检测试卷(化学)第 7 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
6.72
(3)③由图可知:Pt 是阳极,产生的气体为 O2,n(O2)= =0.3mol 22.4
设 CH3OH 为 x mol,则 CH4、C2H4 均为 0.5x mol。根据得失电子守恒,得:
1.2
0.3×4=6x+8×0.5x+6×2×0.5x,解得 x= 0.075,m(CH3OH)=0.075×32=2.4g。
16
高二(上)期末联合检测试卷(化学)第 8 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
化 学
化学测试卷共 4 页,满分 100 分。考试时间 75 分钟。
可能用到的相对原子质量:H-1 C-12 O-16
一、选择题:本大题共 14小题,每小题 3分,共 42分。在每小题给出的四个选项中,只有一项符合题目要求。
1. 十二生肖兽首铜像是我国的国宝,兽首上的褶皱和绒毛等细微处,都清晰逼真,其历经二百多年而不锈蚀,
堪称一绝。下列有关说法正确的是
A.在兽首铜像表面镀了一层锌
B.金属铜的活动性小,不与空气中的物质反应
C.用外加电流法对它们进行了保护,所以不锈蚀
D.在铸造它的铜中添加了金、银、锡、锌,增强了抗锈蚀能力
2. 下列溶液因水解而呈酸性的是
A.NH4Cl B.H2SO4 C.CaC2O4 D.KHCO3
3. 草酸铁铵[(NH4)3Fe(C2O4)3]常用于电镀工业,下列有关其中元素的说法正确的是
A.基态铁原子的价层电子排布式为 3d64s2 B.第一电离能:O>N>C
C.N 元素在周期表的 sp 区 D.C、N、O 的最高正化合价依次升高
4. 下列事实能用勒夏特列原理解释的是
A.将猪肉放入冰箱中冷藏 B.打开可乐瓶盖立即有气泡冒出
C.工业上合成 NH3 温度控制在 400~500℃ D.H2O2 溶液中加少量 MnO2固体,促进 H2O2分解
5. 下列说法正确的是
A.活化分子之间的碰撞叫做有效碰撞 B.生铁中含碳,生铁抗腐蚀能力比纯铁弱
C.工业上合成氨压强越大越好 D.蒸干AlCl3和Al2(SO4)3溶液,所得固体成分相同
6. 下列各组离子在溶液中能大量共存的是
- - 2-
A.HCO3 、NO K
+ -
、 、OH 3 B.Fe
3+ + +、SO4 、H 、Cu
2
2- 2- + -
C CO SO Ca2+ Al3+ D NH HCO [Al(OH) ]- Na+. 3 、 4 、 、 . 4 、 3 、 4 、
7. 氢气可用于烟气的脱氮、脱硫,其反应为 4H2(g)+2NO(g)+SO2(g) N2(g)+S(l)+4H2O(g) ΔH<0。下
列有关说法不正确的是
A.该反应的 ΔS<0
B.当 v 正(SO2)=v 逆(N2)时,反应达到平衡
C.使用高效催化剂可提高 NO 的平衡转化率
D.升高温度,正、逆反应速率均增大,化学平衡逆向移动
8. 相同温度下,1L 0.01 mol L-1· 氨水与 100mL 0.1mol -1·L 氨水相比,下列数值中,前者大于后者的是
A.NH3·H2O 的电离程度 B.NH3·H2O 的电离常数
C.溶液的 pH D.中和二者消耗 H2SO4的物质的量
9. 下列离子方程式书写正确的是
2-
A.Na2CO3 溶液水解:CO 2H O H CO 2OH
-
3 + 2 2 3+
B.Mg(OH) + -2沉淀溶解平衡:Mg(OH)
2
2(s)=Mg (aq)+2OH (aq)
C.碳酸钙与醋酸反应:CaCO3+2H
+ Ca2+= +CO2↑+H2O
电解
D.惰性电极电解足量 CuSO4溶液:2Cu
2++2H2O 2Cu+O
+
2↑+4H
高二(上)期末联合检测试卷(化学)第 1 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
10.下列有关实验装置和操作能达到实验目的的是
选项 A B C D
铜制搅拌器
装置 温度计
及 饱和食盐 内筒
水浸泡过 杯盖
操作 隔热层 的铁钉
外壳
实验 蒸发 MgCl2溶液 排出盛有 KMnO4溶液
验证铁钉发生吸氧腐蚀 中和热的测定
目的 制无水 MgCl2 滴定管尖嘴内的气泡
11.中国科研人员利用太阳光在催化剂表面实现高效分解水的主要过程如下图。
氢原子
氧原子
已知几种物质中化学键的键 能如下表所 示。
化学键 H-O 键 H-H 键 O=O 键
键能 kJ/mol 463 436 496
若反应过程中分解水的物质的量为 1 mol,则产生的热量变化为
A.吸收 484kJ B.放出 484kJ C.吸收 242kJ D.放出 242kJ
12.一定条件下,MgO 与 NH Cl 发生反应:MgO+2NH Cl 4 4 MgCl2+2NH3↑+H2O。已知 NA为阿伏加德罗
常数的值。下列有关说法正确的是
A.25℃时,1L - -水中的 OH 离子的数目为 10 7 NA
B.生成 1mol H2O 时,转移的电子数为 2NA
C.100mL 1 mol·L-1 NH4Cl 溶液中 NH
+
4 的数目为 0.1NA
D.每反应生成 22.4L NH3,生成的 H2O 分子数为 0.5NA
13.二氧化硫-空气燃料电池是一种新型的燃料电池,下列有关说法不正确的是
A.Pt1 电极为负极,该电极上发生氧化反应
负载
B.质子从 Pt1 电极移向 Pt2 电极
SO2+H2O O2+H2O
C.电子从 Pt1 电极出发经外电路流向 Pt2 电极
H SO 质子交换膜 (增湿) 2 4
D - -.正极的电极反应为:O2+4e +2H2O=4OH Pt1 Pt2
14.下列实验操作、现象和结论(或解释)均正确的是
选 项 实验操作 现象 结论(或解释)
A 测同温同浓度的MgCl2和CuCl2溶液的pH pH:CuCl2>MgCl2 金属性:Mg>Cu
-1
向 1mL 0.1 mol·L MgSO4溶液中滴入
先生成白色沉淀,
B 6mL 0.1mol·L-1 NaOH 溶液,片刻后 K
sp
[Mg(OH)2]>Ksp[Cu(OH)2]
后变为蓝色沉淀
再滴加 0.1 mol L-1· CuSO4 溶液
电流计指针偏转,Mg
C 将 Mg、Al 与 NaOH 溶液组成原电池 Al 金属活动性强于 Mg
电极上有气泡产生
取 5mL 0.1 mol -1·L KI 溶液与 1mL
D 0.1 mol -1·L FeCl3 溶液充分反应, 溶液变红色 化学反应存在限度
再滴入少量 KSCN 溶液
高二(上)期末联合检测试卷(化学)第 2 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
二、非选择题(本大题共 4小题,共 58分)
15.(14 分)储氢材料是当今研究的重点课题之一。X、Y 是两种金属元素,都可制得储氢材料,X 元素的基态
原子价层电子排布式为 3d24s2,由它制得的储氢材料为 X(BH4)3;Y 是短周期主族元素,其部分电离能(单
位:kJ mol-1· )数据如下表所示:
I1 I2 I3 I4 I5
738 1451 7733 10540 13630
(1)X、Y 两元素的元素符号分别是 、 。
(2)Y 元素在周期表中的位置是 。
(3)元素 Y 的基态原子具有 种空间运动状态不同的电子。
(4)X(BH4)3中所含化学键类型为 ,基态 B 原子的轨道表示式为 。
5 LiH YH r(Li+) r(H-( ) 与 2 一样,都是具有良好发展前景的储氢材料。 )(填“>”或“<”);YH2的
电子式为 。
16.(15 分)MnO2 的用途很多,如用作电极材料和催化剂等。下图为由富锰废料(含 MnO2、MnCO3、FeCO3
和少量 Al2O3、NiO)制备 MnO2和回收金属资源的工艺流程图。
(1)H O (2)NaOH 溶液
稀硫酸 含 SO2 废气
2 2 MnS KMnO4
浆液 上层清液 氧化,调 pH 系列操作
富锰废料 化浆 吸收 滤液 沉镍 转化 MnO2
沉铁、铝
下层浆液
NiS 母液
滤渣
已知:有关金属离子沉淀的相关 pH 见下表。
Fe3+ Al3+金属离子 Fe2+ Ni2+ Mn2+
开始沉淀时的 pH 2.2 3.6 7.5 7.5 8.8
完全沉淀时的 pH 3.2 4.7 9.5 9.5 10.8
(1)KMnO4 中,Mn 元素的化合价为 ;基态 Mn 原子的价层电子排布式为 。
(2)提高“化浆”速率的措施是 (任写一种)。
(3)流程中加入 H2O2 的主要目的是 ;“调 pH”时,应当调节 pH 的范围是 。
(4)“转化”过程中主要反应的离子方程式为 。
+ -
(5)“沉镍”时,当 Ni2 恰好完全沉淀时,溶液中的 c(S2 )= mol·L-1,所发生的反应为:
MnS(s)+Ni2+(aq) NiS(s)+Mn2+(aq),则此反应的平衡常数 K= 。[已知此温度下
K (NiS)=1.1×10-21 -sp ,Ksp(MnS)=4.4×10
14]
17.(15 分)硫代硫酸钠(Na2S2O3)主要用于照相业作定影剂,其次作鞣革时重铬酸盐的还原剂。实验室制备
Na2S2O3的装置如下图所示。
浓硫酸
Na SO Na2S 和2 3
溶液 Na2CO3
溶液
A B C D
高二(上)期末联合检测试卷(化学)第 3 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
(1)盛装浓硫酸的仪器名称是 。
(2)B 装置的作用为 ,D 装置中的试剂是 。
(3)Na2S 溶液呈碱性的主要原因是 (用离子方程式表示);常温下,pH=10 的 Na2S 溶液中,
+水电离出的 c(H )= ;Na2CO3溶液中,离子浓度由大到小的顺序是 (填离子符号)。
(4)取 20mL 上述制备的 Na2S2O3溶液于锥形瓶中,将其调整呈弱酸性,滴入 2 滴淀粉溶液(溶液无色),
cmol L-1
2-
I -
2-
用 · 的标准 2 溶液滴定,消耗标准 I2 溶液 VmL。(已知:I2+2S2O3 =2I +S4O6 )。
①盛装标准 I2 溶液的滴定管是 滴定管(填“酸式”或“碱式”)。
②滴定达到终点时的现象是 。
③Na2S2O3溶液的浓度为 mol L
-1
· 。
18.(14 分)让二氧化碳能够成功转化为人类可以利用的能源,是许多科学家正在研究的课题。
(1)我国科学家利用 CO2合成淀粉的研究已取得成功,其涉及的关键反应如下:
Ⅰ.CO2(g) 3H
-
+ 12(g) CH3OH(g)+H2O(g) ΔH1=-49.0 kJ·mol
Ⅱ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41.2 kJ mol
-1
·
Ⅲ.CO(g)+2H2(g) CH3OH(g) ΔH3
①反应Ⅲ中 ΔH3= kJ·mol
-1。
②在一定条件下,向容积恒为 1 L 的容器中按 n(CO2)︰n(H2)=1︰3 的比例通入气体,只发生反应Ⅰ,
下列情况可以说明反应Ⅰ已经达到平衡的是 。
A.混合气体密度不再改变 B.混合气体平均相对分子质量不再改变
C.容器内的压强不再改变 D.容器中 CO2 与 H2的物质的量之比不再改变
(2)一定条件下,向 1L 恒容密闭容器中充入 1mol CO2 和 2mol H2,只发生反应Ⅰ。测得 5min 时 CO2的转
化率在 5 种不同温度下的变化如下图 1 所示。
①温度为 T4 K 时,在 0~5min 内 H2 的平均反应速率 v(H2)= 。
②温度为 T K -时,反应Ⅰ的平衡常数 K= L2 mol 25 · 。
X Y CO2 转化率/% 电源
a CO2
60
c
50 b Pt Cu
CH3OH
0 T T T T T 稀 H2SO4 稀 H SO CH
C2H4 2 4 4
1 2 3 4 5 温度/K 阳离子交换膜
图 1 图 2
(3)科学研究人员用图 2 所示装置原理,实现了 CO2 的回收利用。
①X 为电源的 极。
②写出生成 C2H4的电极反应式 。
③在一定条件下,该装置 Cu 电极附近制得的 CH3OH、CH4、C2H4 的物质的量之比为 2︰1︰1,则当 Pt
电极附近有 6.72L 气体产生时(已折算为标准状况,不考虑水蒸气,忽略气体的溶解),制得的 CH3OH
的质量为 g。
高二(上)期末联合检测试卷(化学)第 4 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
2023 年秋高二(上)期末联合检测试卷
化学 参考答案
1~5 DAABB 6~10 BCADC 11~14CADD
3.A
【解析】
B.第一电离能:N>O>C;
C.N 元素在周期表的 p 区;
D.O 元素没有最高正化合价。
4.B
【解析】
A.与反应速度有关,与平衡移动无关;
B.可乐中存在 CO2(g)+H2O(l) H2CO3(aq)平衡,打开可乐瓶盖,减小压强,平衡逆向移动;
C.工业上合成 NH3 温度控制在 400~500℃是为了增大反应速率;
D.MnO2 作催化剂,与平衡移动无关。
5.B
【解析】
A.能够发生化学反应的碰撞才叫有效碰撞;
B.由于生铁中含碳,容易形成原电池而发生腐蚀;
C.工业上合成氨的压强为 10MPq~30Mpa,不是越大越好;
D.蒸干 AlCl3 和 Al2(SO4)3 溶液,分别得到固体成分分别是 Al (OH)3 和 Al2(SO4)3。
6.B
【解析】
A.HCO-3 与 OH
-
发生反应;
C.CO2- 2+ 3+3 与 Ca 、Al 都要反应;
D.HCO- 3 与[Al(OH) ]
-
4 反应生成 Al(OH)3 沉淀。
7.C
【解析】
A.该反应的正反应是气体分子数减少的反应,故 ΔS<0;
B.v 正(SO2)=v 逆(N2),所以正、逆反应速率相等,反应达到平衡;
C.使用催化剂不能使化学平衡发生移动,不可能提高 NO 的平衡转化率;
D.该反应正反应是放热反应,升高温度平衡逆向移动,正、逆反应速率均增大。
8.A.
【解析】溶液越稀,电离程度越大。
9.D
【解析】
A.CO2-3 水解的离子方程式要分步书写;
高二(上)期末联合检测试卷(化学)第 5 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
B.应把“=”改成可逆符号;
C.醋酸是弱酸,书写离子方程式不能拆。
10.C
【解析】
A +.由于 Mg2 要水解,蒸发 MgCl2 溶液得到 Mg(OH)2 或 MgO;
B.KMnO4溶液不能盛装在碱式滴定管中;
D.铜制搅拌器要导热。
11.C
催化分解
【解析】水分解的反应式为 2H2O 2H2↑+O2↑,2mol H2O 分解,吸收的热量为
2×2×463-2×436-496=484kJ,1mol 水分解吸收的热量为 242 kJ。
12.A
【解析】
B.该反应不是氧化还原反应,没有电子转移;
C.NH+4 要水解,故离子数目小于 0.1NA;
D.NH3没有说明状态,无法计算。
13.D
【解析】由图 SO2→H2SO4,S 的化合价升高,Pt1 是负极,Pt2 是正极,
-
正极的电极反应式为:O2+4e +4H
+=2H2O
14.D
【解析】
A.现象应该是 pH:MgCl2>CuCl2,
B.所加 NaOH 过量,生成 Mg(OH)2 后,再滴加 CuSO4溶液生成 Cu(OH)2,不能说明 Cu(OH)2是 Mg(OH)2 转化
而来;
C.将 Mg、Al 与 NaOH 溶液组成原电池,由于 Mg 不与 NaOH 溶液反应, 但 Mg 金属活动性强于 Al。
15.(14 分)
(1)Ti(1 分) Mg(1 分)
(2)第三周期ⅡA 族(2 分)
(3)6(2 分)
1s 2s 2p
(4)离子键、共价键(2 分) ↑ ↓ ↑ ↓ ↑ (2 分)
(5)<(2 分) (2 分)
【解析】X 元素的基态原子价层电子排布式为 3d24s2,X 为 Ti;Y 是短周期主族元素,其 I3 是 I2的 5 倍多,其
最外层应为 2 个电子,且核外电子数大于 5,故 Y 为 Mg;基态 Mg 原子的轨道表示式为
。 有 6 种不同的轨道,有 6 种空间运动状态不同的电子。
高二(上)期末联合检测试卷(化学)第 6 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
16.(15 分)
(1)+7 (1分) 3d54s2(2分)
(2)搅拌、适当增加化浆时间、适当升温、适当增大硫酸浓度、粉碎废料等;(2 分)
3 Fe2+ Fe3+( )将 氧化为 ,便于除去(2 分) 4.7≤pH<7.5(2 分)
(4)2MnO- 2+4 +3Mn +2H2O=5MnO
+
2↓+4H (2 分)
(5)1.1×10-16(2 分) 4×107(2 分)
- K (NiS) 1.1 10 21 c(Mn2 ) K (MnS) 4.4 10 14
【解析】(5)c(S2 )= sp
-
=1.1×10
16;K= sp =4×107
c(Ni2 ) 1.0 10 5 c(Ni2 ) Ksp (NiS) 1.1 10
21
17.(15 分)
(1)分液漏斗(1 分)
(2)安全装置和缓冲气流(2 分)NaOH 溶液(1 分)
3 S2- H O HS- OH-( ) + 2 + (2 分) 10
-4mol/L(2 分)
c(Na+) c(CO2-) c(OH- +> -3 > )>c(HCO3 )>c(H )(2 分)
(4)①酸式(1 分) ②当滴入最后半滴标准液时,溶液由无色变为蓝色,且半分钟内不褪色(2 分)
③0.1cV(2 分)
2 cV 10 3
【解析】n(S O2-2 3 )=2n(I
-3
2)=2×cV×10 mol; c(Na2S2O3)= =0.1cV
20 10 3
18.(14 分,每空 2 分)
(1)①-90.2 ②BC
(2)①0.36mol/(L·min) ②4
(3)①正 2CO 12H+ -② 2+ +12e =C2H4+4H2O ③2.4
【解析】(1)反应Ⅲ=反应Ⅰ-反应Ⅱ,ΔH3=ΔH1-ΔH2=-49.0 kJ/mol-41.2 kJ/mol=-90.2 kJ/mol。
0.6mol
(2)①CO2(g)+3H2(g) CH3OH(g)+H 1L2O(g),v(H2)=3v(CO2)= 3=0.36mol/(L·min)
5min
②CO2(g)+3H2(g) CH3OH(g)+H2O(g)
起始 1 2
转化 0.5 1.5 0.5 0.5
平衡 0.5 0.5 0.5 0.5
0.5 0.5
K 1 1 4
0.5 0.5
( )3
1 1
高二(上)期末联合检测试卷(化学)第 7 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
6.72
(3)③由图可知:Pt 是阳极,产生的气体为 O2,n(O2)= =0.3mol 22.4
设 CH3OH 为 x mol,则 CH4、C2H4 均为 0.5x mol。根据得失电子守恒,得:
1.2
0.3×4=6x+8×0.5x+6×2×0.5x,解得 x= 0.075,m(CH3OH)=0.075×32=2.4g。
16
高二(上)期末联合检测试卷(化学)第 8 页 共 8 页
{#{QQABbYYAggCgAAAAARgCQQUqCEEQkAGCAIoOhBAMIAAAgQFABCA=}#}
同课章节目录
