辽宁省鞍山市普通高中2023-2024学年高一上学期1月质量检测(期末考试)化学试题(含答案)
文档属性
| 名称 | 辽宁省鞍山市普通高中2023-2024学年高一上学期1月质量检测(期末考试)化学试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 694.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-17 15:17:43 | ||
图片预览


文档简介
鞍山市普通高中2023-2024学年度上学期高一质量监测
化学
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 Al-27 Cl-35.5
一、单项选择题:本题共15小题,每小题3分,共45分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.生活中处处有化学,下列叙述正确的是( )
A.俗称铁红,常用作油漆、涂料的红色颜料
B.由于硬铝材料密度小、强度低,具有较好的抗腐蚀能力,可用作飞机外壳材料
C.北京冬奥会场馆使用跨临界直冷技术由水制冰面,此过程涉及到某些化学变化
D.由血细胞和血浆组成的人体血液属于溶液
2.下列气体中,可用碱石灰干燥的是( )
A. B. C. D.
3.日本核污水排放问题引发全球民众的广泛关注,核污染水中含高达64种核放射性元素如氚等,其中对海洋生物的危害较大,下列有关说法错误的是( )
A.碘元素位于第Ⅶ族 B.的中子数比核外电子数多23
C.转化为的过程不属于化学变化 D. 与互为同素异形体
4.下列各组离子在溶液中可以大量共存的是( )
A.、、、 B.、、、
C.、、、 D.、、、
5.下列有关离子方程式书写正确的是( )
A.通入水中:
B.与水反应:
C.向氯化亚铁溶液中加入产生红褐色沉淀:
D.向饱和氯化铝溶液中滴加几滴稀氢氧化钠溶液:
6.设是阿伏加德罗常数的值,下列说法正确的是( )
A.醋酸钠溶液含有的数目为
B.与的混合气体中含有原子数为
C.所含离子数为
D.所含质子数为
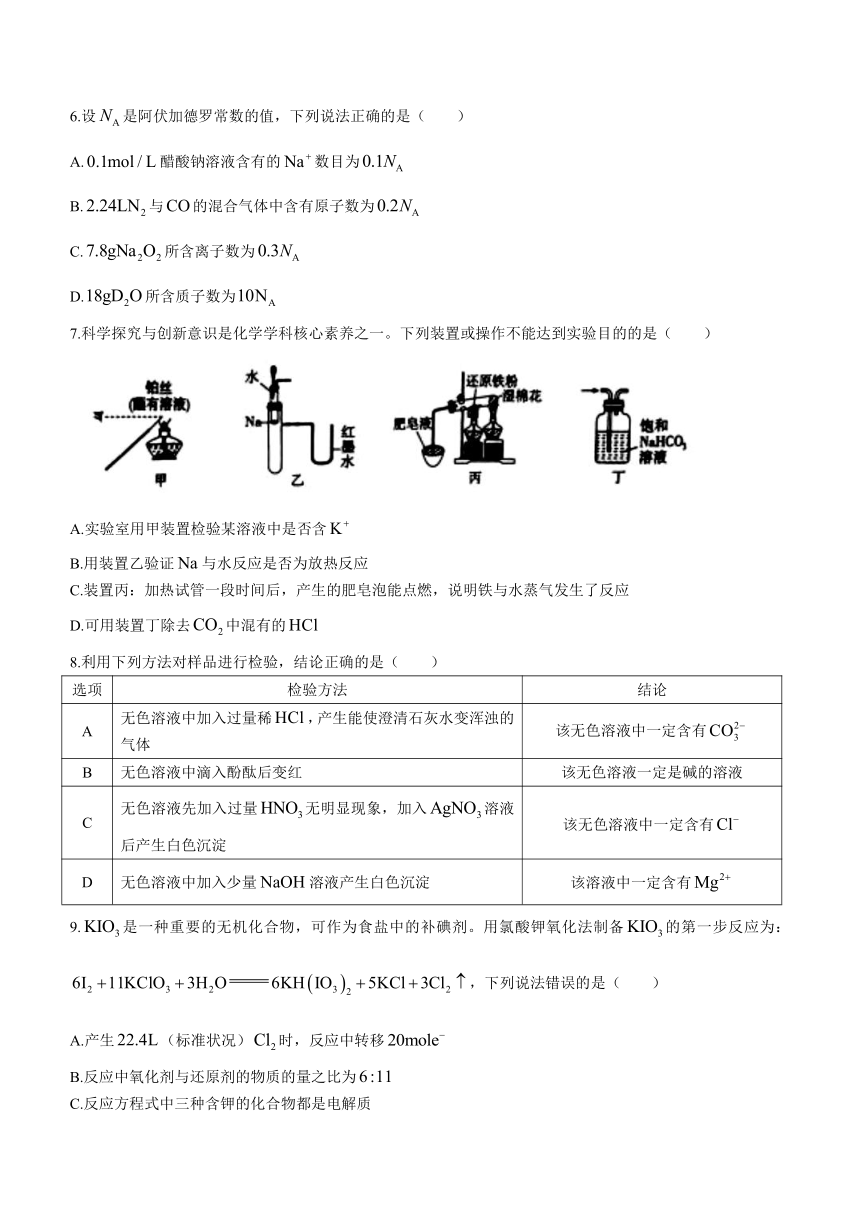
7.科学探究与创新意识是化学学科核心素养之一。下列装置或操作不能达到实验目的的是( )
A.实验室用甲装置检验某溶液中是否含
B.用装置乙验证与水反应是否为放热反应
C.装置丙:加热试管一段时间后,产生的肥皂泡能点燃,说明铁与水蒸气发生了反应
D.可用装置丁除去中混有的
8.利用下列方法对样品进行检验,结论正确的是( )
选项 检验方法 结论
A 无色溶液中加入过量稀,产生能使澄清石灰水变浑浊的气体 该无色溶液中一定含有
B 无色溶液中滴入酚酞后变红 该无色溶液一定是碱的溶液
C 无色溶液先加入过量无明显现象,加入溶液后产生白色沉淀 该无色溶液中一定含有
D 无色溶液中加入少量溶液产生白色沉淀 该溶液中一定含有
9.是一种重要的无机化合物,可作为食盐中的补碘剂。用氯酸钾氧化法制备的第一步反应为:,下列说法错误的是( )
A.产生(标准状况)时,反应中转移
B.反应中氧化剂与还原剂的物质的量之比为
C.反应方程式中三种含钾的化合物都是电解质
D.可用湿润的淀粉碘化钾试纸检验氯气的生成
10.铁是人体必需的微量元素,可通过化学实验的方法检验食品中的铁元素。通过挤压成熟南果梨获得液体并将其过滤,得到无色透明果汁,甲、乙、丙三名同学利用南果梨汁做了检验南果梨中铁元素的探究实验,已知南果梨中维生素(具有还原性)、可溶性糖等含量均高于其他普通水果。下列说法正确的是( )
A.甲同学向南果梨汁中加入适量溶液,无明显现象,可以证明南果梨不含铁元素
B.乙同学向高锰酸钾溶液中滴加少量南果梨汁,高锰酸钾溶液褪色,可以证明南果梨汁中含有二价铁
C.丙同学向南果梨汁中滴加几滴稀硝酸(具有氧化性),再滴加几滴溶液,梨汁变红,可以证明在该过程中实现了二价铁到三价铁的转化。
D.若南果梨中存在铁元素,其可能以二价铁的形式存在
11.配制的溶液,部分实验操作示意图如下:
下列说法正确的是( )
A.定容时,仰视容量瓶的刻度线,使配得的溶液浓度偏高
B.上述实验操作步骤的正确顺序为②①④③
C.实验中需用的仪器有天平、容量瓶、烧杯、玻璃棒、胶头滴管等
D.用托盘天平称量固体的质量为
12.将镁、铝合金溶于的稀硫酸,向得到的溶液中加入的氢氧化钠溶液并使沉淀达到最大值,则该氢氧化钠溶液的体积为( )
A. B. C. D.
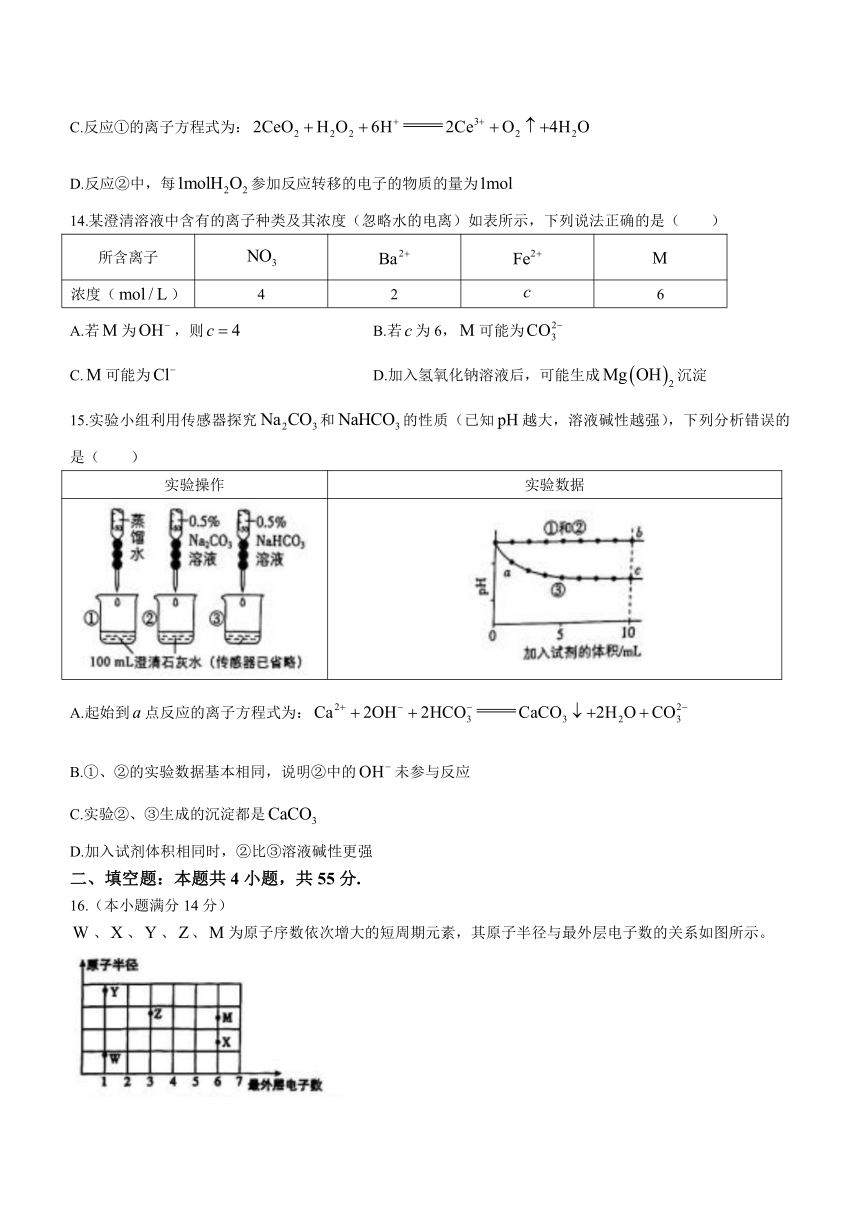
13.金属铈()是稀土元素之一,铈的化合物催化分解的反应历程如图所示,下列说法正确的是( )
A.反应①中作氧化剂
B.氧化性:
C.反应①的离子方程式为:
D.反应②中,每参加反应转移的电子的物质的量为
14.某澄清溶液中含有的离子种类及其浓度(忽略水的电离)如表所示,下列说法正确的是( )
所含离子
浓度() 4 2 6
A.若为,则 B.若为6,可能为
C.可能为 D.加入氢氧化钠溶液后,可能生成沉淀
15.实验小组利用传感器探究和的性质(已知越大,溶液碱性越强),下列分析错误的是( )
实验操作 实验数据
A.起始到点反应的离子方程式为:
B.①、②的实验数据基本相同,说明②中的未参与反应
C.实验②、③生成的沉淀都是
D.加入试剂体积相同时,②比③溶液碱性更强
二、填空题:本题共4小题,共55分.
16.(本小题满分14分)
、、、、为原子序数依次增大的短周期元素,其原子半径与最外层电子数的关系如图所示。
(1)在、、、、五种元素中,金属性最强的元素在周期表中的位置为:______;
(2)、、、四种元素中,原子半径由大到小的顺序为______(填元素符号);
(3)元素的氧化物可与元素最高价氧化物对应的水化物的溶液发生化学反应,离子方程式为________________________________________________;
(4)元素与形成的电子总数为18的分子的结构式为____________。元素与按原子数形成的化合物的电子式为____________,其含有的化学键类型为____________;
(5)的气态氢化物在通常状况下,加热到时由液态变为气态,加热到时发生分解反应,请从物质结构角度解释这两种变化过程中所需温度差异的原因____________。
17.(本小题满分15分)
实验室可用如图所示装置(夹持装置未画出)制取氯酸钾、次氯酸钾和探究氯水的性质。
图中:①为实验室用和浓盐酸制氯气的发生装置;②试管里盛有的溶液,并置于热水浴中;③试管里盛有的溶液,并置于冷水浴中;④试管里盛有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)组装①方框内发生装置不必要的实验仪器有______
a.圆底烧瓶 b.烧杯 c.酒精灯 d.温度计
(2)从实验安全角度考虑,指出存在问题的装置代号及改进措施__________________;
(3)已知次氯酸盐受热不稳定,则本实验制取氯酸钾所用装置为______(填装置代号),其制备原理可用离子方程式表示为____________________________________;
(4)实验中随着时间的延长(持续通入)④中试管里溶液的颜色发生了一系列变化,请填写下表中的空白:
实验现象 原因
溶液起初从紫色渐变为 Ⅰ 色 氯气与水反应产生的使石蕊变色
随后溶液逐渐变为无色 Ⅱ
然后溶液从无色逐渐变为浅黄绿色 Ⅲ
(5)实验结束后,用玻璃棒蘸取④中溶液于试纸上,可观察到的现象是______。
18.(本小题满分14分)
工业制铝一般是从铝土矿(主要成分是,含有杂质)中得到纯净的,然后电解熔融得到铝,其简易流程如下图。请回答下列问题:
已知:
(1)试剂为:____________,试剂为:____________(均填化学式);
(2)若试剂为澄清溶液,则溶液与试剂发生反应的离子方程式为:________________________;
(3)操作Ⅰ中所需的玻璃仪器为:烧杯、漏斗和____________;
(4)将不溶物溶于过量盐酸,向所得溶液中加入过量铁粉,铁粉参与反应的化学方程式为____________________________________________________________;
(5)已知氧化性:,则不溶物与氢碘酸(的水溶液)发生反应的离子方程式为:____________________________________________________________;
19.(本小题满分12分)
草酸()是实验室中常见的一种有机化学品,请回答下列问题:
(1)中碳的化合价为____________;
(2)已知在加热条件下可分解为3种氧化物,其分解的方程式为____________;
(3)时,将置于一真空体积恒定的密闭容器中,加热使其充分分解,恢复至原温度,此时容器内的压强为。打开活塞,使小室(体积可忽略)内盛有的足量落入容器,电火花不断引燃下充分反应,恢复至原温度,此时容器内的压强为。
①草酸充分分解后,测得容器内气体的密度为,则容器的体积为______:
②电火花不断引燃充分反应后,剩余气体的成分为______,其物质的量为______;
③____________。
鞍山市普通高中2023-2024学年度上学期高一质量监测化学
答案及评分标准
一、选择题(共15小题,每小题只有一个正确答案,每小题3分,共45分)
1-5 ABDBC 6-10 CACBD 11-15 BACCА
二、填空题:本题共4题,共55分。
注意:本试题中所有涉及方程式书写的阅卷原则遵循:1.化学方程式与离子方程式未按要求书写的不给分;2.条件未标明的不扣分
16.(本小题满分14分)
(1)第三周期Ⅰ族(2分,写汉字不给分)
(2)(2分)
(3)(2分)
(4)(2分);(2分);离子键、共价键(2分,写对一个给1分,共价键可以答为“非极性共价键”)
(5)水由液态变为气态克服的是分子间作用力,分解则需要破坏共价键,由于共价键强度远大于分子间作用力,故分解点远高于沸点(2分,意思对即给分,采分点:1.分析两种变化需克服的作用;2.阐述两种作用之间强度的相对大小)
17.(本小题满分15分)
(1)bd(2分,漏选1分,错选不给分)
(2)⑤ 去掉单孔塞,使整套装置与环境连通(2分,装置代号不写但改正办法对给1分;改正办法意思对即给分,采分点:“不能密闭”“避免压强增大”“与环境或空气连通”)
(3)②(1分);
(2分)
(4)Ⅰ:红(2分);
Ⅱ:产生将石蕊溶液漂白(2分);
Ⅲ:过量的溶于水(2分)
(5)b(2分)
18.(本小题满分14分)
(1)(2分,写汉字不给分);
(2分,写汉字不给分)
(2)(2分)
(3)玻璃棒(2分)
(4) (4分,漏写给2分,错写不给分)
(5)(2分,碘单质标“!”的不扣分)
19.(本小题满分12分)
(1)+3(2分)
(2)(2分,水标“↑”的不扣分)
(3)①5(2分);
②(2分);(2分);
③(2分)
化学
考试时间:75分钟 满分:100分
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Mg-24 Al-27 Cl-35.5
一、单项选择题:本题共15小题,每小题3分,共45分.在每小题给出的四个选项中,只有一项是符合题目要求的.
1.生活中处处有化学,下列叙述正确的是( )
A.俗称铁红,常用作油漆、涂料的红色颜料
B.由于硬铝材料密度小、强度低,具有较好的抗腐蚀能力,可用作飞机外壳材料
C.北京冬奥会场馆使用跨临界直冷技术由水制冰面,此过程涉及到某些化学变化
D.由血细胞和血浆组成的人体血液属于溶液
2.下列气体中,可用碱石灰干燥的是( )
A. B. C. D.
3.日本核污水排放问题引发全球民众的广泛关注,核污染水中含高达64种核放射性元素如氚等,其中对海洋生物的危害较大,下列有关说法错误的是( )
A.碘元素位于第Ⅶ族 B.的中子数比核外电子数多23
C.转化为的过程不属于化学变化 D. 与互为同素异形体
4.下列各组离子在溶液中可以大量共存的是( )
A.、、、 B.、、、
C.、、、 D.、、、
5.下列有关离子方程式书写正确的是( )
A.通入水中:
B.与水反应:
C.向氯化亚铁溶液中加入产生红褐色沉淀:
D.向饱和氯化铝溶液中滴加几滴稀氢氧化钠溶液:
6.设是阿伏加德罗常数的值,下列说法正确的是( )
A.醋酸钠溶液含有的数目为
B.与的混合气体中含有原子数为
C.所含离子数为
D.所含质子数为
7.科学探究与创新意识是化学学科核心素养之一。下列装置或操作不能达到实验目的的是( )
A.实验室用甲装置检验某溶液中是否含
B.用装置乙验证与水反应是否为放热反应
C.装置丙:加热试管一段时间后,产生的肥皂泡能点燃,说明铁与水蒸气发生了反应
D.可用装置丁除去中混有的
8.利用下列方法对样品进行检验,结论正确的是( )
选项 检验方法 结论
A 无色溶液中加入过量稀,产生能使澄清石灰水变浑浊的气体 该无色溶液中一定含有
B 无色溶液中滴入酚酞后变红 该无色溶液一定是碱的溶液
C 无色溶液先加入过量无明显现象,加入溶液后产生白色沉淀 该无色溶液中一定含有
D 无色溶液中加入少量溶液产生白色沉淀 该溶液中一定含有
9.是一种重要的无机化合物,可作为食盐中的补碘剂。用氯酸钾氧化法制备的第一步反应为:,下列说法错误的是( )
A.产生(标准状况)时,反应中转移
B.反应中氧化剂与还原剂的物质的量之比为
C.反应方程式中三种含钾的化合物都是电解质
D.可用湿润的淀粉碘化钾试纸检验氯气的生成
10.铁是人体必需的微量元素,可通过化学实验的方法检验食品中的铁元素。通过挤压成熟南果梨获得液体并将其过滤,得到无色透明果汁,甲、乙、丙三名同学利用南果梨汁做了检验南果梨中铁元素的探究实验,已知南果梨中维生素(具有还原性)、可溶性糖等含量均高于其他普通水果。下列说法正确的是( )
A.甲同学向南果梨汁中加入适量溶液,无明显现象,可以证明南果梨不含铁元素
B.乙同学向高锰酸钾溶液中滴加少量南果梨汁,高锰酸钾溶液褪色,可以证明南果梨汁中含有二价铁
C.丙同学向南果梨汁中滴加几滴稀硝酸(具有氧化性),再滴加几滴溶液,梨汁变红,可以证明在该过程中实现了二价铁到三价铁的转化。
D.若南果梨中存在铁元素,其可能以二价铁的形式存在
11.配制的溶液,部分实验操作示意图如下:
下列说法正确的是( )
A.定容时,仰视容量瓶的刻度线,使配得的溶液浓度偏高
B.上述实验操作步骤的正确顺序为②①④③
C.实验中需用的仪器有天平、容量瓶、烧杯、玻璃棒、胶头滴管等
D.用托盘天平称量固体的质量为
12.将镁、铝合金溶于的稀硫酸,向得到的溶液中加入的氢氧化钠溶液并使沉淀达到最大值,则该氢氧化钠溶液的体积为( )
A. B. C. D.
13.金属铈()是稀土元素之一,铈的化合物催化分解的反应历程如图所示,下列说法正确的是( )
A.反应①中作氧化剂
B.氧化性:
C.反应①的离子方程式为:
D.反应②中,每参加反应转移的电子的物质的量为
14.某澄清溶液中含有的离子种类及其浓度(忽略水的电离)如表所示,下列说法正确的是( )
所含离子
浓度() 4 2 6
A.若为,则 B.若为6,可能为
C.可能为 D.加入氢氧化钠溶液后,可能生成沉淀
15.实验小组利用传感器探究和的性质(已知越大,溶液碱性越强),下列分析错误的是( )
实验操作 实验数据
A.起始到点反应的离子方程式为:
B.①、②的实验数据基本相同,说明②中的未参与反应
C.实验②、③生成的沉淀都是
D.加入试剂体积相同时,②比③溶液碱性更强
二、填空题:本题共4小题,共55分.
16.(本小题满分14分)
、、、、为原子序数依次增大的短周期元素,其原子半径与最外层电子数的关系如图所示。
(1)在、、、、五种元素中,金属性最强的元素在周期表中的位置为:______;
(2)、、、四种元素中,原子半径由大到小的顺序为______(填元素符号);
(3)元素的氧化物可与元素最高价氧化物对应的水化物的溶液发生化学反应,离子方程式为________________________________________________;
(4)元素与形成的电子总数为18的分子的结构式为____________。元素与按原子数形成的化合物的电子式为____________,其含有的化学键类型为____________;
(5)的气态氢化物在通常状况下,加热到时由液态变为气态,加热到时发生分解反应,请从物质结构角度解释这两种变化过程中所需温度差异的原因____________。
17.(本小题满分15分)
实验室可用如图所示装置(夹持装置未画出)制取氯酸钾、次氯酸钾和探究氯水的性质。
图中:①为实验室用和浓盐酸制氯气的发生装置;②试管里盛有的溶液,并置于热水浴中;③试管里盛有的溶液,并置于冷水浴中;④试管里盛有紫色石蕊试液;⑤为尾气吸收装置。
请填写下列空白:
(1)组装①方框内发生装置不必要的实验仪器有______
a.圆底烧瓶 b.烧杯 c.酒精灯 d.温度计
(2)从实验安全角度考虑,指出存在问题的装置代号及改进措施__________________;
(3)已知次氯酸盐受热不稳定,则本实验制取氯酸钾所用装置为______(填装置代号),其制备原理可用离子方程式表示为____________________________________;
(4)实验中随着时间的延长(持续通入)④中试管里溶液的颜色发生了一系列变化,请填写下表中的空白:
实验现象 原因
溶液起初从紫色渐变为 Ⅰ 色 氯气与水反应产生的使石蕊变色
随后溶液逐渐变为无色 Ⅱ
然后溶液从无色逐渐变为浅黄绿色 Ⅲ
(5)实验结束后,用玻璃棒蘸取④中溶液于试纸上,可观察到的现象是______。
18.(本小题满分14分)
工业制铝一般是从铝土矿(主要成分是,含有杂质)中得到纯净的,然后电解熔融得到铝,其简易流程如下图。请回答下列问题:
已知:
(1)试剂为:____________,试剂为:____________(均填化学式);
(2)若试剂为澄清溶液,则溶液与试剂发生反应的离子方程式为:________________________;
(3)操作Ⅰ中所需的玻璃仪器为:烧杯、漏斗和____________;
(4)将不溶物溶于过量盐酸,向所得溶液中加入过量铁粉,铁粉参与反应的化学方程式为____________________________________________________________;
(5)已知氧化性:,则不溶物与氢碘酸(的水溶液)发生反应的离子方程式为:____________________________________________________________;
19.(本小题满分12分)
草酸()是实验室中常见的一种有机化学品,请回答下列问题:
(1)中碳的化合价为____________;
(2)已知在加热条件下可分解为3种氧化物,其分解的方程式为____________;
(3)时,将置于一真空体积恒定的密闭容器中,加热使其充分分解,恢复至原温度,此时容器内的压强为。打开活塞,使小室(体积可忽略)内盛有的足量落入容器,电火花不断引燃下充分反应,恢复至原温度,此时容器内的压强为。
①草酸充分分解后,测得容器内气体的密度为,则容器的体积为______:
②电火花不断引燃充分反应后,剩余气体的成分为______,其物质的量为______;
③____________。
鞍山市普通高中2023-2024学年度上学期高一质量监测化学
答案及评分标准
一、选择题(共15小题,每小题只有一个正确答案,每小题3分,共45分)
1-5 ABDBC 6-10 CACBD 11-15 BACCА
二、填空题:本题共4题,共55分。
注意:本试题中所有涉及方程式书写的阅卷原则遵循:1.化学方程式与离子方程式未按要求书写的不给分;2.条件未标明的不扣分
16.(本小题满分14分)
(1)第三周期Ⅰ族(2分,写汉字不给分)
(2)(2分)
(3)(2分)
(4)(2分);(2分);离子键、共价键(2分,写对一个给1分,共价键可以答为“非极性共价键”)
(5)水由液态变为气态克服的是分子间作用力,分解则需要破坏共价键,由于共价键强度远大于分子间作用力,故分解点远高于沸点(2分,意思对即给分,采分点:1.分析两种变化需克服的作用;2.阐述两种作用之间强度的相对大小)
17.(本小题满分15分)
(1)bd(2分,漏选1分,错选不给分)
(2)⑤ 去掉单孔塞,使整套装置与环境连通(2分,装置代号不写但改正办法对给1分;改正办法意思对即给分,采分点:“不能密闭”“避免压强增大”“与环境或空气连通”)
(3)②(1分);
(2分)
(4)Ⅰ:红(2分);
Ⅱ:产生将石蕊溶液漂白(2分);
Ⅲ:过量的溶于水(2分)
(5)b(2分)
18.(本小题满分14分)
(1)(2分,写汉字不给分);
(2分,写汉字不给分)
(2)(2分)
(3)玻璃棒(2分)
(4) (4分,漏写给2分,错写不给分)
(5)(2分,碘单质标“!”的不扣分)
19.(本小题满分12分)
(1)+3(2分)
(2)(2分,水标“↑”的不扣分)
(3)①5(2分);
②(2分);(2分);
③(2分)
同课章节目录
