4.2课时1元素性质的周期性变化规律课件(共18张PPT)2023-2024学年高一化学人教版(2019)必修第一册
文档属性
| 名称 | 4.2课时1元素性质的周期性变化规律课件(共18张PPT)2023-2024学年高一化学人教版(2019)必修第一册 |  | |
| 格式 | ppt | ||
| 文件大小 | 951.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-17 15:54:09 | ||
图片预览



文档简介
(共18张PPT)
第四章 物质结构 元素周期律
第1课时
元素性质的周期性变化规律
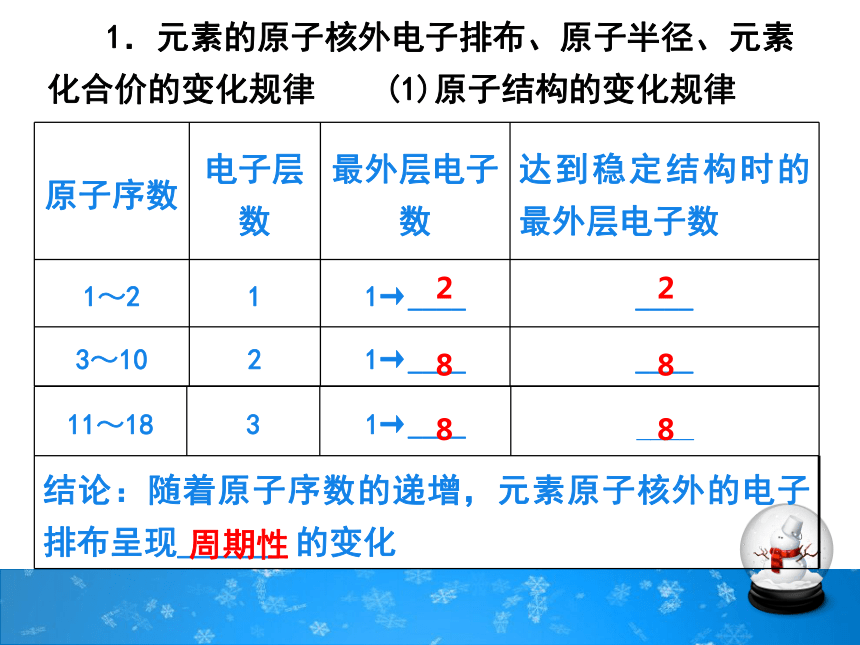
原子序数 电子层数 最外层电子数 达到稳定结构时的最外层电子数
1~2 1 1→____ ____
3~10 2 1→____ ____
11~18 3 1→____ ____
结论:随着原子序数的递增,元素原子核外的电子排布呈现______ 的变化
周期性
1.元素的原子核外电子排布、原子半径、元素化合价的变化规律 (1)原子结构的变化规律
2
2
8
8
8
8
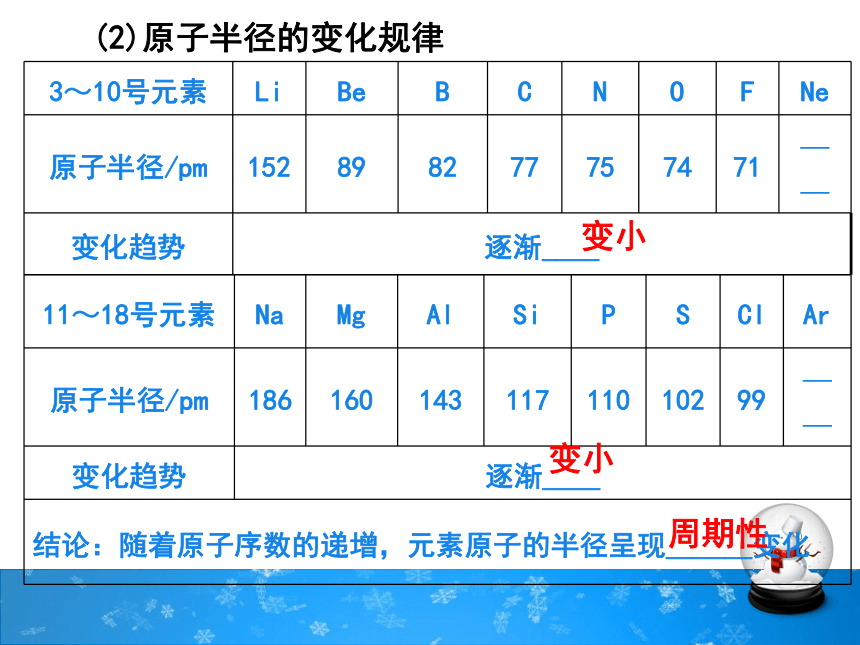
3~10号元素 Li Be B C N O F Ne
原子半径/pm 152 89 82 77 75 74 71 ——
变化趋势 逐渐____
(2)原子半径的变化规律
11~18号元素 Na Mg Al Si P S Cl Ar
原子半径/pm 186 160 143 117 110 102 99 ——
变化趋势 逐渐____
结论:随着原子序数的递增,元素原子的半径呈现______变化
变小
变小
周期性
(3)元素主要化合价的变化规律
原子序数 主要化合价的变化
1~2 +1 0
3~10 +1 ____
____ -1 0
11~18 +1 ____
____ -1 0
结论:随着原子序数的递增,元素的主要化合价呈______变化
+5
-4
+7
-4
周期性
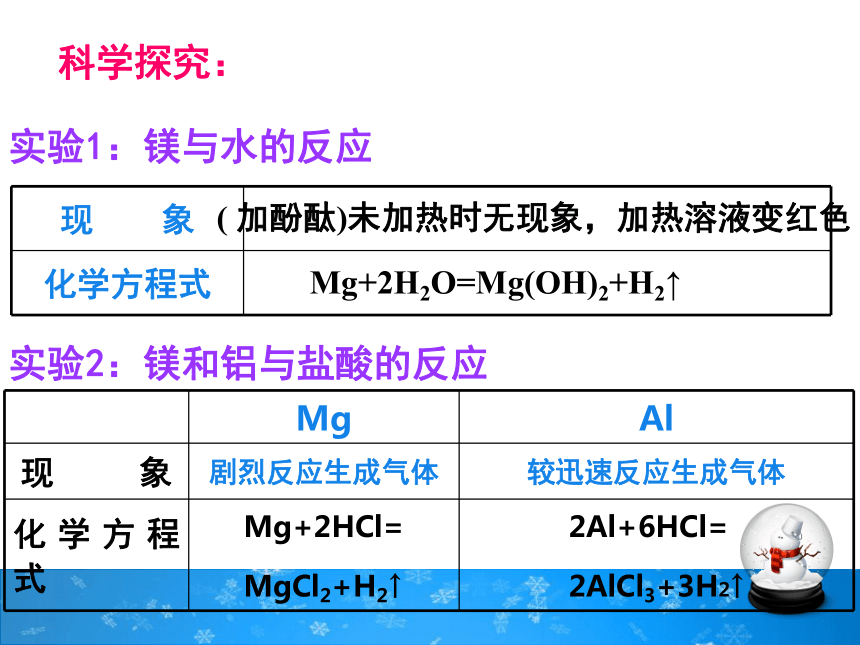
科学探究:
实验1:镁与水的反应
现 象
化学方程式
( 加酚酞)未加热时无现象,加热溶液变红色
Mg+2H2O=Mg(OH)2+H2↑
实验2:镁和铝与盐酸的反应
Mg Al
现 象 剧烈反应生成气体 较迅速反应生成气体
化学方程式 Mg+2HCl=
MgCl2+H2↑ 2Al+6HCl=
2AlCl3+3H2↑
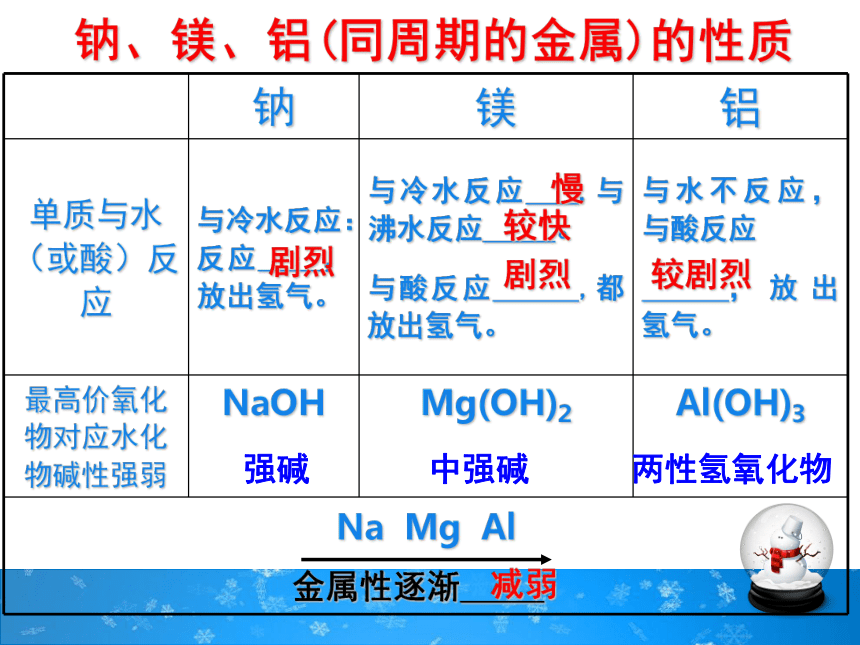
钠、镁、铝(同周期的金属)的性质
钠 镁 铝
单质与水(或酸)反应 与冷水反应:反应 ,放出氢气。 与冷水反应 ,与沸水反应 。
与酸反应 ,都放出氢气。 与水不反应,与酸反应
,放出氢气。
最高价氧化物对应水化物碱性强弱 NaOH Mg(OH)2 Al(OH)3
Na Mg Al
金属性逐渐 。
剧烈
慢
较快
强碱 中强碱 两性氢氧化物
减弱
剧烈
较剧烈
小结:元素金属性强弱的判断
①金属单质与水(或酸)反应置换出H2的难易程度(越易置换出氢气,说明金属性 )
②最高价氧化物的水化物——氢氧化物的碱性强弱(碱性越强,则金属性 )
④金属单质之间的置换
(金属性 的置换金属性 的)
③金属活动性顺序表
(位置越靠前,说明金属性 )
⑤金属阳离子氧化性的强弱
(对应金属阳离子氧化性越弱,金属性 )
越强
越强
强
弱
越强
越强
14Si 15P 16S 17Cl
最高价 最高价氧化物
氧化物的水化物及其酸性强弱
单质与H2反应条件
气态氢化物
及其稳定性
结论
H2SiO3 H3PO4 H2SO4 HClO4
弱酸 中强酸 强酸 超强酸
酸性逐渐增强
高温 加热 加热 点燃或光照
SiH4 PH3 H2S HCl
稳定性逐渐增强
非金属性逐渐增强
SiO2 P2O5 SO3 Cl2O7
硅、磷、硫、氯(同周期的非金属)的性质
①单质与H2化合的难易程度
(与H2化合越容易,说明非金属性 )
②形成的气态氢化物的稳定性
(形成的气态氢化物越稳定,则非金属性 )
③最高价氧化物的水化物——最高价含氧酸酸性的强弱(酸性越强,说明非金属性 )
④非金属单质之间的置换
(非金属性 的置换非金属性 的)
⑤非金属阴离子还原性的强弱
(对应非金属阴离子还原性越弱,非金属性 )
越强
越强
强
弱
越强
越强
小结:元素非金属性强弱的判断
随着原子序数的递增
元素原子的核外电子排布呈现周期性变化
元素原子半径呈现周期性变化
元素化合价呈现周期性变化
元素的化学性质呈现周期性变化
元素的性质随着元素原子序数的递增而呈现周期性的变化—
元素性质的周期性变化实质:是元素原子的核外电子排布的周期性变化。
元素周期律
发现:
4.
原子半径逐渐减小
元素金属性逐渐减弱,非金属性逐渐增强
非金属性逐渐减弱
原子半径逐渐增大
元素金属性逐渐增强
1.(双选题)不能说明钠的金属性比镁强的事实是( )
A.钠的硬度比镁小
B.NaOH的碱性比Mg(OH)2强
C.钠与冷水反应剧烈,镁与冷水不易反应
D.钠的熔点比镁低
AD
练习:
2.用1~18号元素及其形成化合物的化学式填空。
(1)原子半径最小的元素是 ____________。
(2)除稀有气体外,原子半径最大的元素是________________,
它的原子结构示意图是____________。
(3)与水反应最剧烈的金属是____________。
(4)最高价氧化物对应水化物碱性最强的是___________________________________________________。
H
Na
Na
NaOH
(5)最高价氧化物对应水化物为两性氢氧化物的是___________________________。
(6)气态氢化物的水溶液呈碱性的元素是____________________________。
(7)最稳定的气态氢化物是 __________________________________。
(8)金属性最强的元素是____________,非金属性最强的元素是____________。
(9)酸性最强的最高价氧化物对应的水化物是__________________________________________________。
Al(OH)3
N
HF
Na
F
HClO4
综合拓展
周期表中元素性质的变化规律
同周期(自左至右) 同主族(从上到下)
原子半径 减小 增大
主要化合价 +1~+7
-4~-1 相似(最高正价相同)
金属性 减弱 增强
非金属性 增强 减弱
单质 氧化性 增强 减弱
还原性 减弱 增强
(续上表)
离子 阳离子氧化性 增强 减弱
阴离子还原性 减弱 增强
氢化物 稳定性 增强 减弱
还原性 减弱 增强
最高价
氧化物
水化物 酸性 增强 减弱
碱性 减弱 增强
谢谢观看
第四章 物质结构 元素周期律
第1课时
元素性质的周期性变化规律
原子序数 电子层数 最外层电子数 达到稳定结构时的最外层电子数
1~2 1 1→____ ____
3~10 2 1→____ ____
11~18 3 1→____ ____
结论:随着原子序数的递增,元素原子核外的电子排布呈现______ 的变化
周期性
1.元素的原子核外电子排布、原子半径、元素化合价的变化规律 (1)原子结构的变化规律
2
2
8
8
8
8
3~10号元素 Li Be B C N O F Ne
原子半径/pm 152 89 82 77 75 74 71 ——
变化趋势 逐渐____
(2)原子半径的变化规律
11~18号元素 Na Mg Al Si P S Cl Ar
原子半径/pm 186 160 143 117 110 102 99 ——
变化趋势 逐渐____
结论:随着原子序数的递增,元素原子的半径呈现______变化
变小
变小
周期性
(3)元素主要化合价的变化规律
原子序数 主要化合价的变化
1~2 +1 0
3~10 +1 ____
____ -1 0
11~18 +1 ____
____ -1 0
结论:随着原子序数的递增,元素的主要化合价呈______变化
+5
-4
+7
-4
周期性
科学探究:
实验1:镁与水的反应
现 象
化学方程式
( 加酚酞)未加热时无现象,加热溶液变红色
Mg+2H2O=Mg(OH)2+H2↑
实验2:镁和铝与盐酸的反应
Mg Al
现 象 剧烈反应生成气体 较迅速反应生成气体
化学方程式 Mg+2HCl=
MgCl2+H2↑ 2Al+6HCl=
2AlCl3+3H2↑
钠、镁、铝(同周期的金属)的性质
钠 镁 铝
单质与水(或酸)反应 与冷水反应:反应 ,放出氢气。 与冷水反应 ,与沸水反应 。
与酸反应 ,都放出氢气。 与水不反应,与酸反应
,放出氢气。
最高价氧化物对应水化物碱性强弱 NaOH Mg(OH)2 Al(OH)3
Na Mg Al
金属性逐渐 。
剧烈
慢
较快
强碱 中强碱 两性氢氧化物
减弱
剧烈
较剧烈
小结:元素金属性强弱的判断
①金属单质与水(或酸)反应置换出H2的难易程度(越易置换出氢气,说明金属性 )
②最高价氧化物的水化物——氢氧化物的碱性强弱(碱性越强,则金属性 )
④金属单质之间的置换
(金属性 的置换金属性 的)
③金属活动性顺序表
(位置越靠前,说明金属性 )
⑤金属阳离子氧化性的强弱
(对应金属阳离子氧化性越弱,金属性 )
越强
越强
强
弱
越强
越强
14Si 15P 16S 17Cl
最高价 最高价氧化物
氧化物的水化物及其酸性强弱
单质与H2反应条件
气态氢化物
及其稳定性
结论
H2SiO3 H3PO4 H2SO4 HClO4
弱酸 中强酸 强酸 超强酸
酸性逐渐增强
高温 加热 加热 点燃或光照
SiH4 PH3 H2S HCl
稳定性逐渐增强
非金属性逐渐增强
SiO2 P2O5 SO3 Cl2O7
硅、磷、硫、氯(同周期的非金属)的性质
①单质与H2化合的难易程度
(与H2化合越容易,说明非金属性 )
②形成的气态氢化物的稳定性
(形成的气态氢化物越稳定,则非金属性 )
③最高价氧化物的水化物——最高价含氧酸酸性的强弱(酸性越强,说明非金属性 )
④非金属单质之间的置换
(非金属性 的置换非金属性 的)
⑤非金属阴离子还原性的强弱
(对应非金属阴离子还原性越弱,非金属性 )
越强
越强
强
弱
越强
越强
小结:元素非金属性强弱的判断
随着原子序数的递增
元素原子的核外电子排布呈现周期性变化
元素原子半径呈现周期性变化
元素化合价呈现周期性变化
元素的化学性质呈现周期性变化
元素的性质随着元素原子序数的递增而呈现周期性的变化—
元素性质的周期性变化实质:是元素原子的核外电子排布的周期性变化。
元素周期律
发现:
4.
原子半径逐渐减小
元素金属性逐渐减弱,非金属性逐渐增强
非金属性逐渐减弱
原子半径逐渐增大
元素金属性逐渐增强
1.(双选题)不能说明钠的金属性比镁强的事实是( )
A.钠的硬度比镁小
B.NaOH的碱性比Mg(OH)2强
C.钠与冷水反应剧烈,镁与冷水不易反应
D.钠的熔点比镁低
AD
练习:
2.用1~18号元素及其形成化合物的化学式填空。
(1)原子半径最小的元素是 ____________。
(2)除稀有气体外,原子半径最大的元素是________________,
它的原子结构示意图是____________。
(3)与水反应最剧烈的金属是____________。
(4)最高价氧化物对应水化物碱性最强的是___________________________________________________。
H
Na
Na
NaOH
(5)最高价氧化物对应水化物为两性氢氧化物的是___________________________。
(6)气态氢化物的水溶液呈碱性的元素是____________________________。
(7)最稳定的气态氢化物是 __________________________________。
(8)金属性最强的元素是____________,非金属性最强的元素是____________。
(9)酸性最强的最高价氧化物对应的水化物是__________________________________________________。
Al(OH)3
N
HF
Na
F
HClO4
综合拓展
周期表中元素性质的变化规律
同周期(自左至右) 同主族(从上到下)
原子半径 减小 增大
主要化合价 +1~+7
-4~-1 相似(最高正价相同)
金属性 减弱 增强
非金属性 增强 减弱
单质 氧化性 增强 减弱
还原性 减弱 增强
(续上表)
离子 阳离子氧化性 增强 减弱
阴离子还原性 减弱 增强
氢化物 稳定性 增强 减弱
还原性 减弱 增强
最高价
氧化物
水化物 酸性 增强 减弱
碱性 减弱 增强
谢谢观看
