化学人教版(2019)选择性必修3 1.1.2有机化合物的结构特点 课件(共42张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 1.1.2有机化合物的结构特点 课件(共42张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 67.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-17 16:42:27 | ||
图片预览





文档简介
(共42张PPT)
第一节
有机化合物的结构特点
第2课时
第一章
有机化合物的结构特点与研究方法
共价键的极性与有机反应
2
有机化合物中的共价键的类型
1
本节重点
本节难点
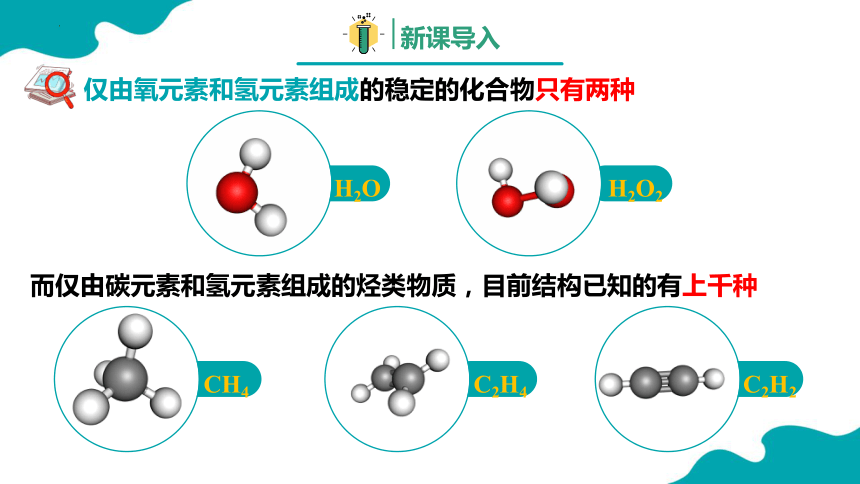
仅由氧元素和氢元素组成的稳定的化合物只有两种
而仅由碳元素和氢元素组成的烃类物质,目前结构已知的有上千种
C2H2
C2H4
CH4
H2O2
H2O
有机化合物分子结构的复杂多变与碳原子的成键特点、碳原子间的结合方式,以及分子中各原子在空间的排布有着密切关系。
碳原子的成键有哪些特点呢?
有机化合物中碳原子的成键特点
元素周期表中的位置
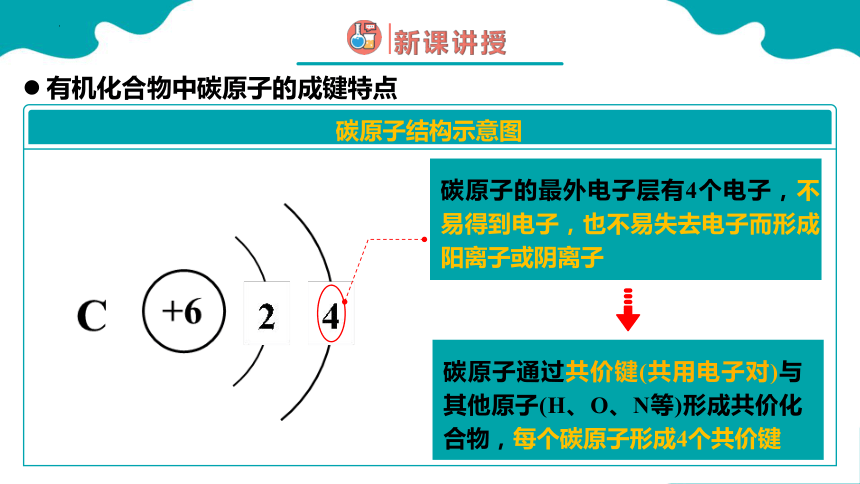
碳元素位于元素周期表中:第二周期 ⅣA族
碳原子的最外电子层有4个电子,不易得到电子,也不易失去电子而形成阳离子或阴离子
有机化合物中碳原子的成键特点
碳原子得失电子情况
碳原子结构示意图
碳原子通过共价键(共用电子对)与其他原子(H、O、N等)形成共价化合物,每个碳原子形成4个共价键
有机化合物中碳原子的成键特点
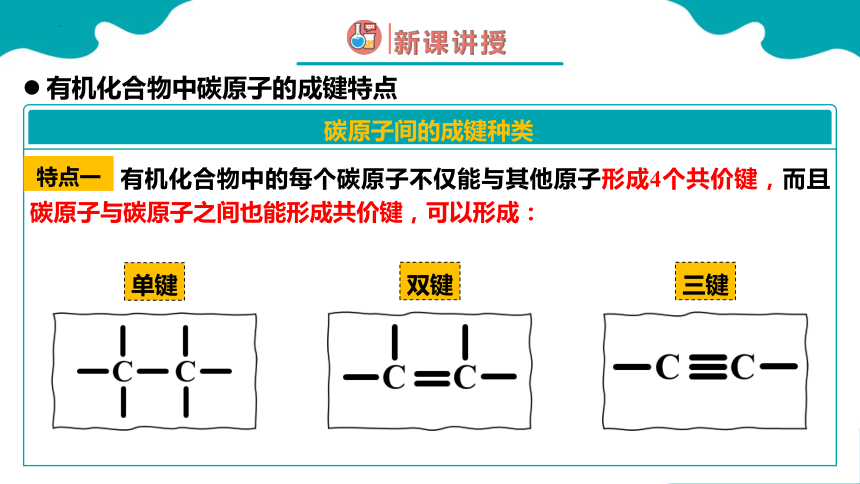
碳原子间的成键种类
有机化合物中的每个碳原子不仅能与其他原子形成4个共价键,而且碳原子与碳原子之间也能形成共价键,可以形成:
特点一
单键
双键
三键
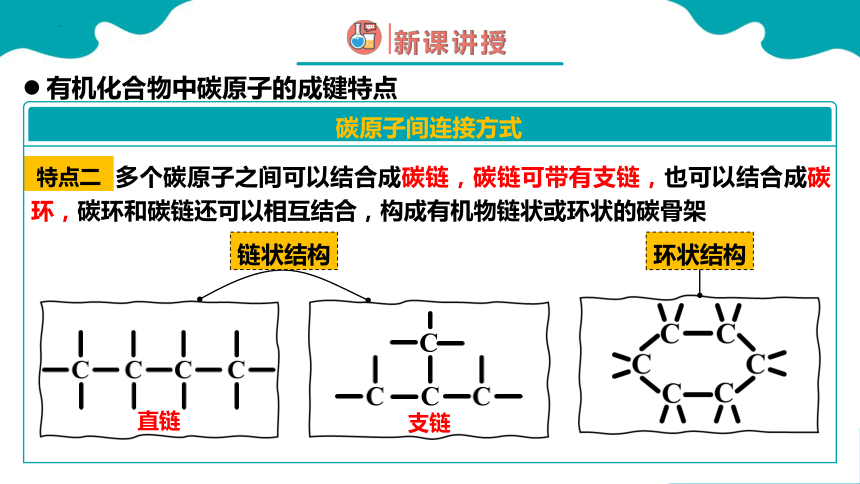
特点二
多个碳原子之间可以结合成碳链,碳链可带有支链,也可以结合成碳环,碳环和碳链还可以相互结合,构成有机物链状或环状的碳骨架
有机化合物中碳原子的成键特点
碳原子间连接方式
环状结构
链状结构
支链
大鹿化学工作室制作,侵权必究
直链
有机化合物中碳原子的成键特点
碳原子间的成键方式
碳原子不但可以和碳形成共价键,而且可以和H、O、N、S等原子成键
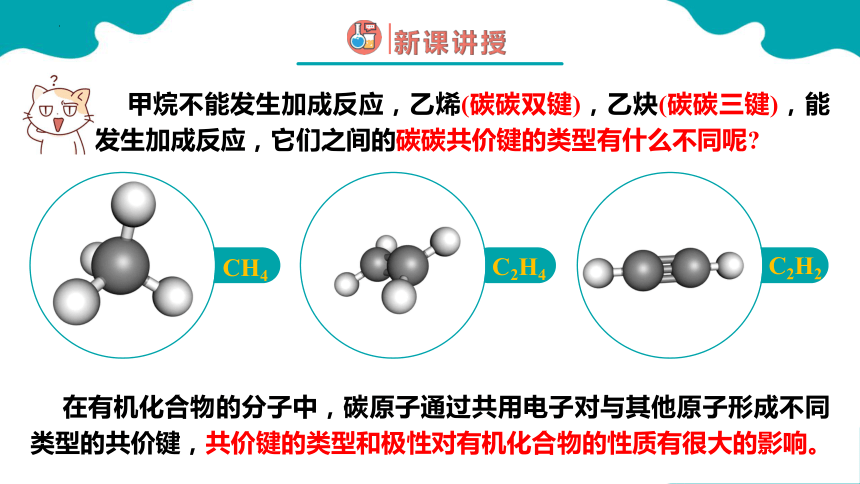
甲烷不能发生加成反应,乙烯(碳碳双键),乙炔(碳碳三键),能发生加成反应,它们之间的碳碳共价键的类型有什么不同呢
C2H2
C2H4
CH4
在有机化合物的分子中,碳原子通过共用电子对与其他原子形成不同类型的共价键,共价键的类型和极性对有机化合物的性质有很大的影响。
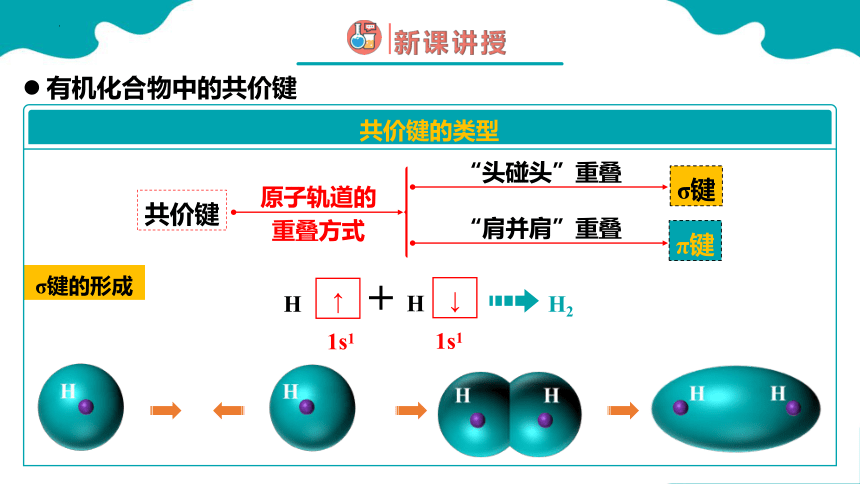
σ键的形成
有机化合物中的共价键
共价键的类型
H
↑
1s1
H
↓
1s1
H2
共价键
原子轨道的重叠方式
σ键
π键
“肩并肩”重叠
“头碰头”重叠
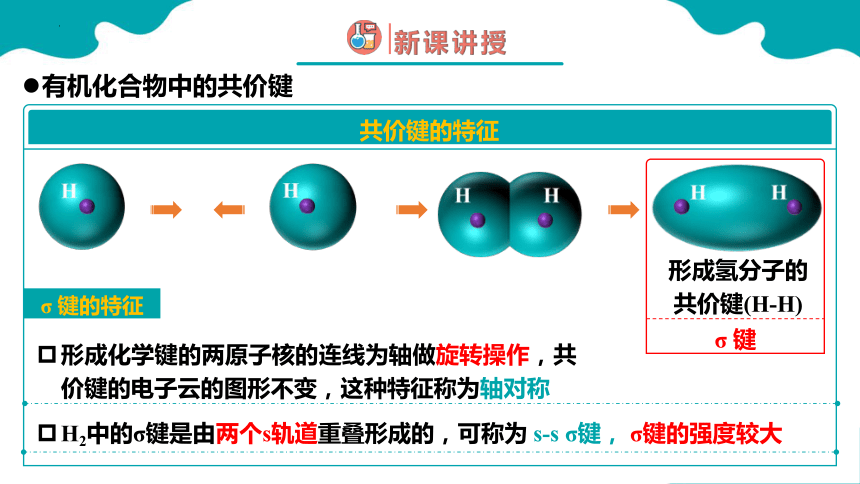
形成氢分子的共价键(H-H)
σ 键
σ 键的特征
形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云的图形不变,这种特征称为轴对称
H2中的σ键是由两个s轨道重叠形成的,可称为 s-s σ键, σ键的强度较大
共价键的特征
有机化合物中的共价键
有机化合物中的共价键
共价键的类型
HCl
H
Cl
H
Cl
H
↑
1s1
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
HCl
s-p σ键的形成
p-p σ键的形成
有机化合物中的共价键
共价键的类型
Cl
Cl
Cl2
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
Cl
3p5
↑↓
↑↓
↑
↑↓
3s2
Cl2
根据所学内容,思考:甲烷中碳原子的杂化方式?
CH4
2px
↑
↑
↑↓
2s
2py
2pz
C(1s22s22p2)
原子基态
激发
2px
↑
↑
↑
2s
↑
C原子激发态
2py
2pz
杂化
sp3杂化态
轨道
重叠
↑
↑
↑
↑
sp3
sp3
sp3
sp3
H
↑
1s1
H
↑
1s1
H
↑
1s1
H
↑
1s1
↑↓
↑↓
↑↓
↑↓
四个相同的C-H σ键
sp3-1s 成键
sp3杂化轨道是由 ns轨道和 np轨道杂化而成,每个sp3杂化轨道都含有___和______的成分,sp3杂化轨道间的夹角为 ,空间结构为正四面体形
1个
3个
109°28′
s
sp3杂化
109°28′
s
p
p
p
sp3
1/4s
3/4 p
有机化合物中的共价键
sp3杂化轨道——正四面体形
p轨道和p轨道除能形成σ键外,还能形成π键——由两个原子的p轨道“肩并肩”重叠形成
有机化合物中的共价键
共价键的类型
共价键
原子轨道的重叠方式
σ键
π键
“头碰头”重叠
“肩并肩”重叠
π键的形成
π键的电子云具有__________性,即每个π键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为_____;π键______旋转;不如σ键____________,较易____________。
镜面对称
镜像
不能
牢固
断裂
π键的特征
共价键的特征
有机化合物中的共价键
根据所学内容,思考:乙烯中碳原子的杂化方式?
C2H4
激发
2px
↑
↑
↑
2s
↑
C原子激发态
2py
2pz
杂化
轨道
重叠
↑↓
↑↓
↑↓
↑
sp2-1s 成键
2pz
2pz
↑
↑
↑
↑
sp2杂化态
sp2
sp2
sp2
H
↑
1s1
H
↑
1s1
两个相同的C-H σ键
C(1s22s22p2)
原子基态
2px
↑
↑
↑↓
2s
2py
2pz
C(1s22s22p2)
2px
↑
↑
↑↓
2s
2py
原子基态
2pz
根据所学内容,思考:乙烯中碳原子的杂化方式?
C2H4
激发
2px
↑
↑
↑
2s
↑
C原子激发态
2py
2pz
杂化
↑
↑
↑
↑
sp2杂化态
轨道
重叠
↑↓
↑↓
↑↓
↑
2pz
2pz
sp2
sp2
sp2
H
↑
1s1
H
↑
1s1
sp2-sp2成键
一个C-C σ键
↑
C
sp2
两个碳原子未参与杂化的p轨道以“肩并肩”的形式从侧面重叠,形成了π键
↑
↑
↑
↑
sp2杂化态
2pz
sp2
sp2
sp2
↑
↑
↑
↑
sp2杂化态
2pz
sp2
sp2
sp2
π键与σ键的轨道重叠程度不同,所以强度不同。通过π键连接的原子或原子团不能绕键轴旋转。
有机化合物中的共价键
sp2杂化轨道——平面三角形
sp2杂化轨道是由 ns轨道和 np轨道杂化而成的,每个sp2杂化轨道含有____和____成分,sp2杂化轨道间的夹角都是120°,呈平面三角形
1个
2个
1/3s
2/3p
s
sp2杂化
120°
120°
120°
s
p
p
p
p
sp2
根据所学内容,思考:乙炔中碳原子的杂化方式?
C2H2
C(1s22s22p2)
2px
↑
↑
↑↓
2s
2py
原子基态
激发
2px
↑
↑
↑
2s
↑
C原子激发态
2py
2pz
杂化
轨道
重叠
H
↑
1s1
↑↓
↑
↑↓
↑
sp-1s
成键
2pz
2py
↑
↑
↑
↑
sp 杂化态
2pz
2py
sp
sp
一个C-Hσ键
两个C原子均剩下两个p轨道分别两两平行“肩并肩”形成两个互相垂直的π键
↑
↑
↑
↑
2pz
2py
sp
sp
↑
↑
↑
↑
2pz
2py
sp
sp
sp-sp
成键
一个C-C σ键
有机化合物中的共价键
sp杂化——直线形
sp杂化轨道是由 ns轨道和 np轨道杂化而成的,每个sp杂化轨道含有____和____的成分,sp杂化轨道间的夹角为180°,呈直线形
1个
1个
1/2s
1/2p
sp杂化
s
p
p
p
sp
p
p
180℃
有机化合物中的共价键
归纳总结:共价键的类型
一般情况下,有机化合物中的单键是_____键,双键中含有_____个_____键和_____个_____键,三键中含有一个σ键和_____个π键。
σ
一
σ
一
π
两
单键
双键
三键
σ
σ
σ
σ
σ
σ
σ
σ
σ
σ
σ
σ
π
σ
σ
σ
π
有机化合物中的共价键
共价键对有机化合物性质的影响
共价键的类型对有机化合物性质的影响
___键的轨道重叠程度比__键的小,键能低,比较容易_____而发生化学反应
例如:乙烯和乙炔分子的双键和三键中含有_____键,都可以发生_____反应,而甲烷分子中含有C—H_____键,可发生_____反应。
π
σ
断裂
加成
π
σ
取代
取代反应
加成反应
有机化合物中的共价键
共价键对有机化合物性质的影响
共价键的极性对有机化合物性质的影响
共价键的极性越强,在反应中越容易________,因此有机化合物的________及其邻近的________往往是发生化学反应的活性部位
发生断裂
官能团
化学键
如何验证呢?
有机化合物中的共价键
实验探究:共价键的极性对有机化合物性质的影响
实验步骤
向两只分别盛有蒸馏水和无水乙醇的烧杯中各加入同样大小的钠(约绿豆大),观察现象
蒸馏水
无水乙醇
钠
本课件由大鹿化学工作室制作,侵权必究
有机化合物中的共价键
实验探究:共价键的极性对有机化合物性质的影响
实验现象
两只烧杯中均有气泡产生,乙醇与钠反应缓慢,蒸馏水与钠反应剧烈
乙醇与钠反应
蒸馏水与钠反应
有机化合物中的共价键
实验探究:共价键的极性对有机化合物性质的影响
实验分析
乙醇与钠反应产生氢气的原因
乙醇分子中的氢氧键极性较强,能够发生断裂
化学方程式
C
H
O
H
C
H
2H
H
H
2Na
C
H
O
Na
C
H
2H
H
H
H2↑
有机化合物中的共价键
实验探究:共价键的极性对有机化合物性质的影响
实验分析
相同条件下,乙醇与钠反应没有水与钠反应的剧烈,是由于
_____________________________________________________________
乙醇分子中氢氧键的极性比水分子中氢氧键的极性弱
实验结论
___________________使得官能团中化学键的______发生变化,从而影响官能团和物质的性质
基团之间的相互影响
极性
有机化合物中的共价键
实验探究:共价键的极性对有机化合物性质的影响
另外,由于羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,也可断裂,如:乙醇与氢溴酸的反应:
化学方程式
H Br
C
H
O
H
C
H
H
H
H
C
H
Br
C
H
H
H
H
H2O↑
根据共价键的类型和极性可推测该物质可发生_____反应和_____反应,与钠反应的剧烈程度比水与钠反应的_________ 。原因是
_______________________________________________________________
____________________________________
【例1】大鹿老师发现某有机物分子的结构简式为 ,该分子中有____个σ键,_____个π键,_____(填“有”或“无”)非极性键
CH
O
H
CH2
C
O
8
2
有
加成
取代
大
CH2==CHCOOH中 中的氢氧键受酮羰基影响,极性更强,更易断裂
O
H
C
O
人工合成的第一个有机物——尿素
1824年,维勒从氰经水解制得草酸;1828年他无意中用加热的方法又使氰酸铵转化为尿素。氰和氰酸铵都是无机化合物,而草酸和尿素都是有机化合物。
弗里德里希·维勒
德国化学家
维勒的实验结果给予“生命力”学说第一次冲击。此后,乙酸等有机化合物相继由碳、氢等元素合成,渐渐地“生命力”学说被抛弃了,“有机化学”这一名词却沿用至今。
1.目前已发现的有机物大约有三千万种,下列有关其种类繁多的原因的说法错误的是
A.碳原子间能以单键、双键或三键等多种方式结合
B.多个碳原子可以形成长短不一的碳链,碳链也可以含有支链
C.每个碳原子都能与氢原子形成四个共价键
D.多个碳原子间可以形成碳链、碳环,碳链或碳环也能相互结合
【答案】C
【详解】A.碳原子间能以单键、双键或三键等多种方式结合,是碳的化合物种类多的原因之一,故A正确;
B.多个碳原子可以形成长短不一的碳链,碳链也可以含有支链,是碳的化合物种类多的原因之一,故B正确;
C.每个碳原子都能与氢原子形成四个共价键,不是碳的化合物种类多的原因之一,故C错误;
D.多个碳原子间可以形成碳链、碳环,碳链或碳环也能相互结合,是碳的化合物种类多的原因之一,故D正确;
2.在大多数有机物分子里,碳原子和碳原子、碳原子和其他原子间相结合的化学键是
A.都是极性键
B.都是非极性键
C.既有极性键,又有非极性键
D.都是离子键
【答案】C
【详解】在大多数有机物分子里,碳原子和碳原子之间形成非极性共价键、碳原子和其它原子间形成极性共价键,如C-O、C-N等原子之间存在极性共价键。答案选C。
3.下列说法错误的是
A.有机化合物都含有极性键和非极性键
B.有机化合物一定含有σ键,不一定含有π键
C.1个碳原子可以与其他原子形成4个共价键
D.乙烯和乙炔都含有π键,都能发生加成反应
【答案】A
【详解】A.甲烷、甲醇、甲醛、甲酸均只含有极性键,不含有非极性键,A选项错误;
B.有机化合物原子间一定含有σ键,但不一定含有π键,B选项正确;
C.1个碳原子最多有4个单电子,可以与其他原子形成4个共价键,C选项正确;
D.乙烯中含有C=C,乙炔中含有C≡C,其中都含有π键,且都能发生加成反应,D选项正确;
4.在CH2=CHCl分子中,C—C1键采用的成键轨道是
A.sp-p
B.sp2-s
C.sp2-p
D.sp3-p
【答案】C
【详解】氯乙烯分子中不饱和碳原子的杂化方式为sp2杂化,则C—C1键采用的成键轨道是sp2—p,故选C。
5.多位化学家用简单的偶联反应合成了如下这个有趣的“纳米小人”分子。有关该分子的结构说法不正确的是
A.该分子中的C原子采取的杂化方式有:sp、sp2、sp3
B.该分子中的O原子采取sp3杂化
C.“纳米小人”头部的所有原子不能在同一平面内
D.“纳米小人”手、脚部位的碳原子不杂化
【答案】D
【详解】A.该分子中碳碳三键上的C原子采取sp杂化,苯环上的C原子采取sp2杂化,其他碳原子采取sp3杂化,A正确;
B.该分子中的O原子有2对σ键电子对,有2对孤电子对,故其采取sp3杂化,B正确;
C.“纳米小人”头部的C原子均为sp3杂化,C原子与周围的H原子形成四面体,不在同一平面上,C正确;
D.“纳米小人”手、脚部位的碳原子都属于饱和碳原子,均采取sp3杂化,D错误;
有机化合物中的共价键的类型
共价键的极性与有机反应
“头碰头”重叠-σ键
“肩并肩”重叠-π键
有机化合物中碳原子的成键特点
元素周期表中的位置
碳原子结构示意图
碳原子间的成键种类
碳原子间连接方式
共价键的特征
第一节
有机化合物的结构特点
第2课时
第一节
有机化合物的结构特点
第2课时
第一章
有机化合物的结构特点与研究方法
共价键的极性与有机反应
2
有机化合物中的共价键的类型
1
本节重点
本节难点
仅由氧元素和氢元素组成的稳定的化合物只有两种
而仅由碳元素和氢元素组成的烃类物质,目前结构已知的有上千种
C2H2
C2H4
CH4
H2O2
H2O
有机化合物分子结构的复杂多变与碳原子的成键特点、碳原子间的结合方式,以及分子中各原子在空间的排布有着密切关系。
碳原子的成键有哪些特点呢?
有机化合物中碳原子的成键特点
元素周期表中的位置
碳元素位于元素周期表中:第二周期 ⅣA族
碳原子的最外电子层有4个电子,不易得到电子,也不易失去电子而形成阳离子或阴离子
有机化合物中碳原子的成键特点
碳原子得失电子情况
碳原子结构示意图
碳原子通过共价键(共用电子对)与其他原子(H、O、N等)形成共价化合物,每个碳原子形成4个共价键
有机化合物中碳原子的成键特点
碳原子间的成键种类
有机化合物中的每个碳原子不仅能与其他原子形成4个共价键,而且碳原子与碳原子之间也能形成共价键,可以形成:
特点一
单键
双键
三键
特点二
多个碳原子之间可以结合成碳链,碳链可带有支链,也可以结合成碳环,碳环和碳链还可以相互结合,构成有机物链状或环状的碳骨架
有机化合物中碳原子的成键特点
碳原子间连接方式
环状结构
链状结构
支链
大鹿化学工作室制作,侵权必究
直链
有机化合物中碳原子的成键特点
碳原子间的成键方式
碳原子不但可以和碳形成共价键,而且可以和H、O、N、S等原子成键
甲烷不能发生加成反应,乙烯(碳碳双键),乙炔(碳碳三键),能发生加成反应,它们之间的碳碳共价键的类型有什么不同呢
C2H2
C2H4
CH4
在有机化合物的分子中,碳原子通过共用电子对与其他原子形成不同类型的共价键,共价键的类型和极性对有机化合物的性质有很大的影响。
σ键的形成
有机化合物中的共价键
共价键的类型
H
↑
1s1
H
↓
1s1
H2
共价键
原子轨道的重叠方式
σ键
π键
“肩并肩”重叠
“头碰头”重叠
形成氢分子的共价键(H-H)
σ 键
σ 键的特征
形成化学键的两原子核的连线为轴做旋转操作,共价键的电子云的图形不变,这种特征称为轴对称
H2中的σ键是由两个s轨道重叠形成的,可称为 s-s σ键, σ键的强度较大
共价键的特征
有机化合物中的共价键
有机化合物中的共价键
共价键的类型
HCl
H
Cl
H
Cl
H
↑
1s1
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
HCl
s-p σ键的形成
p-p σ键的形成
有机化合物中的共价键
共价键的类型
Cl
Cl
Cl2
Cl
3p5
↑↓
↑↓
↓
↑↓
3s2
Cl
3p5
↑↓
↑↓
↑
↑↓
3s2
Cl2
根据所学内容,思考:甲烷中碳原子的杂化方式?
CH4
2px
↑
↑
↑↓
2s
2py
2pz
C(1s22s22p2)
原子基态
激发
2px
↑
↑
↑
2s
↑
C原子激发态
2py
2pz
杂化
sp3杂化态
轨道
重叠
↑
↑
↑
↑
sp3
sp3
sp3
sp3
H
↑
1s1
H
↑
1s1
H
↑
1s1
H
↑
1s1
↑↓
↑↓
↑↓
↑↓
四个相同的C-H σ键
sp3-1s 成键
sp3杂化轨道是由 ns轨道和 np轨道杂化而成,每个sp3杂化轨道都含有___和______的成分,sp3杂化轨道间的夹角为 ,空间结构为正四面体形
1个
3个
109°28′
s
sp3杂化
109°28′
s
p
p
p
sp3
1/4s
3/4 p
有机化合物中的共价键
sp3杂化轨道——正四面体形
p轨道和p轨道除能形成σ键外,还能形成π键——由两个原子的p轨道“肩并肩”重叠形成
有机化合物中的共价键
共价键的类型
共价键
原子轨道的重叠方式
σ键
π键
“头碰头”重叠
“肩并肩”重叠
π键的形成
π键的电子云具有__________性,即每个π键的电子云由两块组成,分别位于由两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为_____;π键______旋转;不如σ键____________,较易____________。
镜面对称
镜像
不能
牢固
断裂
π键的特征
共价键的特征
有机化合物中的共价键
根据所学内容,思考:乙烯中碳原子的杂化方式?
C2H4
激发
2px
↑
↑
↑
2s
↑
C原子激发态
2py
2pz
杂化
轨道
重叠
↑↓
↑↓
↑↓
↑
sp2-1s 成键
2pz
2pz
↑
↑
↑
↑
sp2杂化态
sp2
sp2
sp2
H
↑
1s1
H
↑
1s1
两个相同的C-H σ键
C(1s22s22p2)
原子基态
2px
↑
↑
↑↓
2s
2py
2pz
C(1s22s22p2)
2px
↑
↑
↑↓
2s
2py
原子基态
2pz
根据所学内容,思考:乙烯中碳原子的杂化方式?
C2H4
激发
2px
↑
↑
↑
2s
↑
C原子激发态
2py
2pz
杂化
↑
↑
↑
↑
sp2杂化态
轨道
重叠
↑↓
↑↓
↑↓
↑
2pz
2pz
sp2
sp2
sp2
H
↑
1s1
H
↑
1s1
sp2-sp2成键
一个C-C σ键
↑
C
sp2
两个碳原子未参与杂化的p轨道以“肩并肩”的形式从侧面重叠,形成了π键
↑
↑
↑
↑
sp2杂化态
2pz
sp2
sp2
sp2
↑
↑
↑
↑
sp2杂化态
2pz
sp2
sp2
sp2
π键与σ键的轨道重叠程度不同,所以强度不同。通过π键连接的原子或原子团不能绕键轴旋转。
有机化合物中的共价键
sp2杂化轨道——平面三角形
sp2杂化轨道是由 ns轨道和 np轨道杂化而成的,每个sp2杂化轨道含有____和____成分,sp2杂化轨道间的夹角都是120°,呈平面三角形
1个
2个
1/3s
2/3p
s
sp2杂化
120°
120°
120°
s
p
p
p
p
sp2
根据所学内容,思考:乙炔中碳原子的杂化方式?
C2H2
C(1s22s22p2)
2px
↑
↑
↑↓
2s
2py
原子基态
激发
2px
↑
↑
↑
2s
↑
C原子激发态
2py
2pz
杂化
轨道
重叠
H
↑
1s1
↑↓
↑
↑↓
↑
sp-1s
成键
2pz
2py
↑
↑
↑
↑
sp 杂化态
2pz
2py
sp
sp
一个C-Hσ键
两个C原子均剩下两个p轨道分别两两平行“肩并肩”形成两个互相垂直的π键
↑
↑
↑
↑
2pz
2py
sp
sp
↑
↑
↑
↑
2pz
2py
sp
sp
sp-sp
成键
一个C-C σ键
有机化合物中的共价键
sp杂化——直线形
sp杂化轨道是由 ns轨道和 np轨道杂化而成的,每个sp杂化轨道含有____和____的成分,sp杂化轨道间的夹角为180°,呈直线形
1个
1个
1/2s
1/2p
sp杂化
s
p
p
p
sp
p
p
180℃
有机化合物中的共价键
归纳总结:共价键的类型
一般情况下,有机化合物中的单键是_____键,双键中含有_____个_____键和_____个_____键,三键中含有一个σ键和_____个π键。
σ
一
σ
一
π
两
单键
双键
三键
σ
σ
σ
σ
σ
σ
σ
σ
σ
σ
σ
σ
π
σ
σ
σ
π
有机化合物中的共价键
共价键对有机化合物性质的影响
共价键的类型对有机化合物性质的影响
___键的轨道重叠程度比__键的小,键能低,比较容易_____而发生化学反应
例如:乙烯和乙炔分子的双键和三键中含有_____键,都可以发生_____反应,而甲烷分子中含有C—H_____键,可发生_____反应。
π
σ
断裂
加成
π
σ
取代
取代反应
加成反应
有机化合物中的共价键
共价键对有机化合物性质的影响
共价键的极性对有机化合物性质的影响
共价键的极性越强,在反应中越容易________,因此有机化合物的________及其邻近的________往往是发生化学反应的活性部位
发生断裂
官能团
化学键
如何验证呢?
有机化合物中的共价键
实验探究:共价键的极性对有机化合物性质的影响
实验步骤
向两只分别盛有蒸馏水和无水乙醇的烧杯中各加入同样大小的钠(约绿豆大),观察现象
蒸馏水
无水乙醇
钠
本课件由大鹿化学工作室制作,侵权必究
有机化合物中的共价键
实验探究:共价键的极性对有机化合物性质的影响
实验现象
两只烧杯中均有气泡产生,乙醇与钠反应缓慢,蒸馏水与钠反应剧烈
乙醇与钠反应
蒸馏水与钠反应
有机化合物中的共价键
实验探究:共价键的极性对有机化合物性质的影响
实验分析
乙醇与钠反应产生氢气的原因
乙醇分子中的氢氧键极性较强,能够发生断裂
化学方程式
C
H
O
H
C
H
2H
H
H
2Na
C
H
O
Na
C
H
2H
H
H
H2↑
有机化合物中的共价键
实验探究:共价键的极性对有机化合物性质的影响
实验分析
相同条件下,乙醇与钠反应没有水与钠反应的剧烈,是由于
_____________________________________________________________
乙醇分子中氢氧键的极性比水分子中氢氧键的极性弱
实验结论
___________________使得官能团中化学键的______发生变化,从而影响官能团和物质的性质
基团之间的相互影响
极性
有机化合物中的共价键
实验探究:共价键的极性对有机化合物性质的影响
另外,由于羟基中氧原子的电负性较大,乙醇分子中的碳氧键极性也较强,也可断裂,如:乙醇与氢溴酸的反应:
化学方程式
H Br
C
H
O
H
C
H
H
H
H
C
H
Br
C
H
H
H
H
H2O↑
根据共价键的类型和极性可推测该物质可发生_____反应和_____反应,与钠反应的剧烈程度比水与钠反应的_________ 。原因是
_______________________________________________________________
____________________________________
【例1】大鹿老师发现某有机物分子的结构简式为 ,该分子中有____个σ键,_____个π键,_____(填“有”或“无”)非极性键
CH
O
H
CH2
C
O
8
2
有
加成
取代
大
CH2==CHCOOH中 中的氢氧键受酮羰基影响,极性更强,更易断裂
O
H
C
O
人工合成的第一个有机物——尿素
1824年,维勒从氰经水解制得草酸;1828年他无意中用加热的方法又使氰酸铵转化为尿素。氰和氰酸铵都是无机化合物,而草酸和尿素都是有机化合物。
弗里德里希·维勒
德国化学家
维勒的实验结果给予“生命力”学说第一次冲击。此后,乙酸等有机化合物相继由碳、氢等元素合成,渐渐地“生命力”学说被抛弃了,“有机化学”这一名词却沿用至今。
1.目前已发现的有机物大约有三千万种,下列有关其种类繁多的原因的说法错误的是
A.碳原子间能以单键、双键或三键等多种方式结合
B.多个碳原子可以形成长短不一的碳链,碳链也可以含有支链
C.每个碳原子都能与氢原子形成四个共价键
D.多个碳原子间可以形成碳链、碳环,碳链或碳环也能相互结合
【答案】C
【详解】A.碳原子间能以单键、双键或三键等多种方式结合,是碳的化合物种类多的原因之一,故A正确;
B.多个碳原子可以形成长短不一的碳链,碳链也可以含有支链,是碳的化合物种类多的原因之一,故B正确;
C.每个碳原子都能与氢原子形成四个共价键,不是碳的化合物种类多的原因之一,故C错误;
D.多个碳原子间可以形成碳链、碳环,碳链或碳环也能相互结合,是碳的化合物种类多的原因之一,故D正确;
2.在大多数有机物分子里,碳原子和碳原子、碳原子和其他原子间相结合的化学键是
A.都是极性键
B.都是非极性键
C.既有极性键,又有非极性键
D.都是离子键
【答案】C
【详解】在大多数有机物分子里,碳原子和碳原子之间形成非极性共价键、碳原子和其它原子间形成极性共价键,如C-O、C-N等原子之间存在极性共价键。答案选C。
3.下列说法错误的是
A.有机化合物都含有极性键和非极性键
B.有机化合物一定含有σ键,不一定含有π键
C.1个碳原子可以与其他原子形成4个共价键
D.乙烯和乙炔都含有π键,都能发生加成反应
【答案】A
【详解】A.甲烷、甲醇、甲醛、甲酸均只含有极性键,不含有非极性键,A选项错误;
B.有机化合物原子间一定含有σ键,但不一定含有π键,B选项正确;
C.1个碳原子最多有4个单电子,可以与其他原子形成4个共价键,C选项正确;
D.乙烯中含有C=C,乙炔中含有C≡C,其中都含有π键,且都能发生加成反应,D选项正确;
4.在CH2=CHCl分子中,C—C1键采用的成键轨道是
A.sp-p
B.sp2-s
C.sp2-p
D.sp3-p
【答案】C
【详解】氯乙烯分子中不饱和碳原子的杂化方式为sp2杂化,则C—C1键采用的成键轨道是sp2—p,故选C。
5.多位化学家用简单的偶联反应合成了如下这个有趣的“纳米小人”分子。有关该分子的结构说法不正确的是
A.该分子中的C原子采取的杂化方式有:sp、sp2、sp3
B.该分子中的O原子采取sp3杂化
C.“纳米小人”头部的所有原子不能在同一平面内
D.“纳米小人”手、脚部位的碳原子不杂化
【答案】D
【详解】A.该分子中碳碳三键上的C原子采取sp杂化,苯环上的C原子采取sp2杂化,其他碳原子采取sp3杂化,A正确;
B.该分子中的O原子有2对σ键电子对,有2对孤电子对,故其采取sp3杂化,B正确;
C.“纳米小人”头部的C原子均为sp3杂化,C原子与周围的H原子形成四面体,不在同一平面上,C正确;
D.“纳米小人”手、脚部位的碳原子都属于饱和碳原子,均采取sp3杂化,D错误;
有机化合物中的共价键的类型
共价键的极性与有机反应
“头碰头”重叠-σ键
“肩并肩”重叠-π键
有机化合物中碳原子的成键特点
元素周期表中的位置
碳原子结构示意图
碳原子间的成键种类
碳原子间连接方式
共价键的特征
第一节
有机化合物的结构特点
第2课时
