专题1《化学反应与能量变化》(含解析)单元检测题2023--2024学年上学期高二苏教版(2019)高中化学选择性必修1
文档属性
| 名称 | 专题1《化学反应与能量变化》(含解析)单元检测题2023--2024学年上学期高二苏教版(2019)高中化学选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-17 17:19:08 | ||
图片预览


文档简介
专题1《化学反应与能量变化》
一、单选题(共12题)
1.铁粉是冶金的主要原料。下列有关铁的化学反应的叙述正确的是
A.高温下,铁粉与水蒸气反应生成磁性氧化铁
B.高温下,铁粉与氧化铝粉末反应置换出铝
C.制备溴苯时,铁粉与液溴反应生成FeBr2
D.铁粉和炭粉混合用食盐水湿润后发生析氢腐蚀
2.如图是某同学用Cu在Fe片上镀铜的实验装置,下列说法正确的是
A.在A极被还原
B.溶液蓝色逐渐变浅
C.A极和B极直接相连,铜片被氧化
D.铜片连接A极,铁制品连接B极
3.我国科学家采用单原子Ni和纳米Cu作串联催化剂,通过电解法将转化为乙烯。装置示意图如下。已知:电解效率
下列说法不正确的是
A.电极a连接电源的负极
B.电极a上有CO产生
C.纳米Cu催化剂上发生反应:2CO+ 6H2O+8e—=C2H4+8OH—
D.若乙烯的电解效率为60%,电路中通过1mol电子时,产生0.075mol乙烯
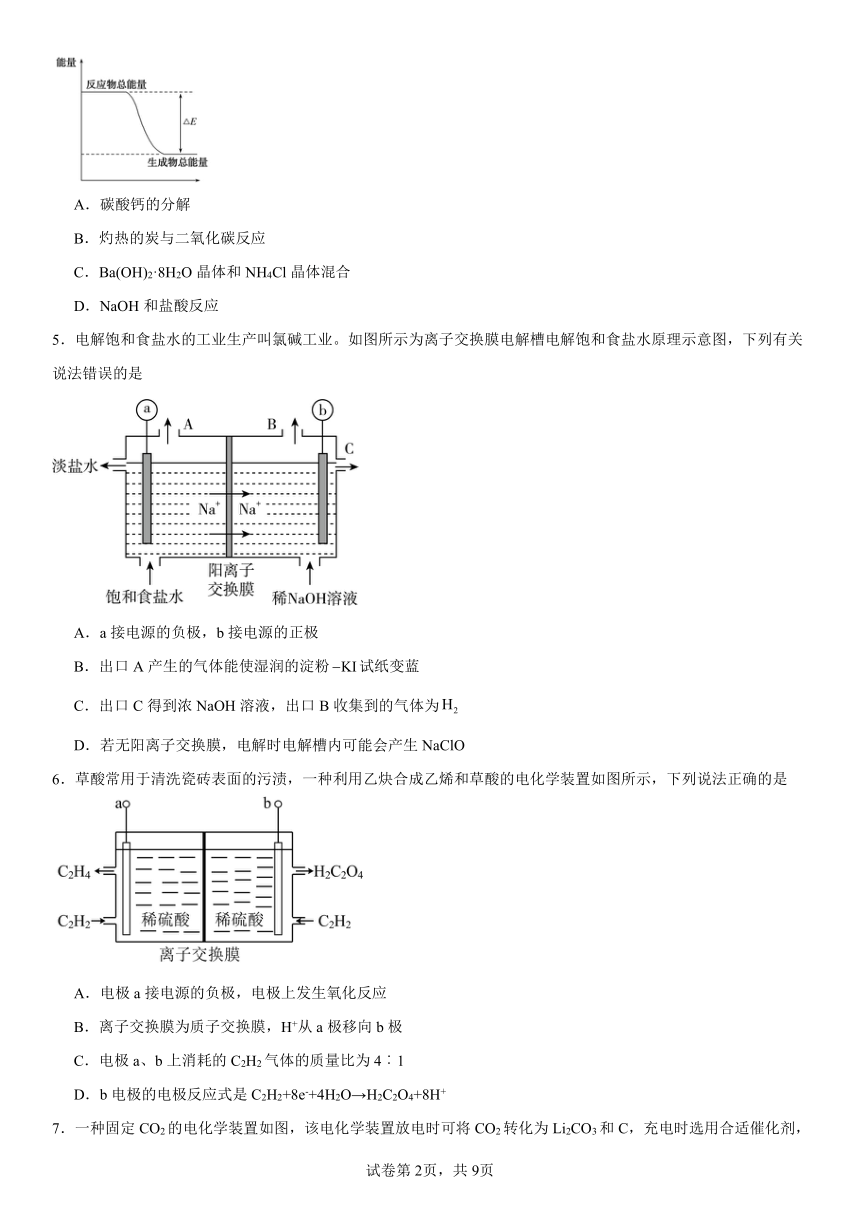
4.下列物质间反应,其能量变化符合如图所示的是
A.碳酸钙的分解
B.灼热的炭与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.NaOH和盐酸反应
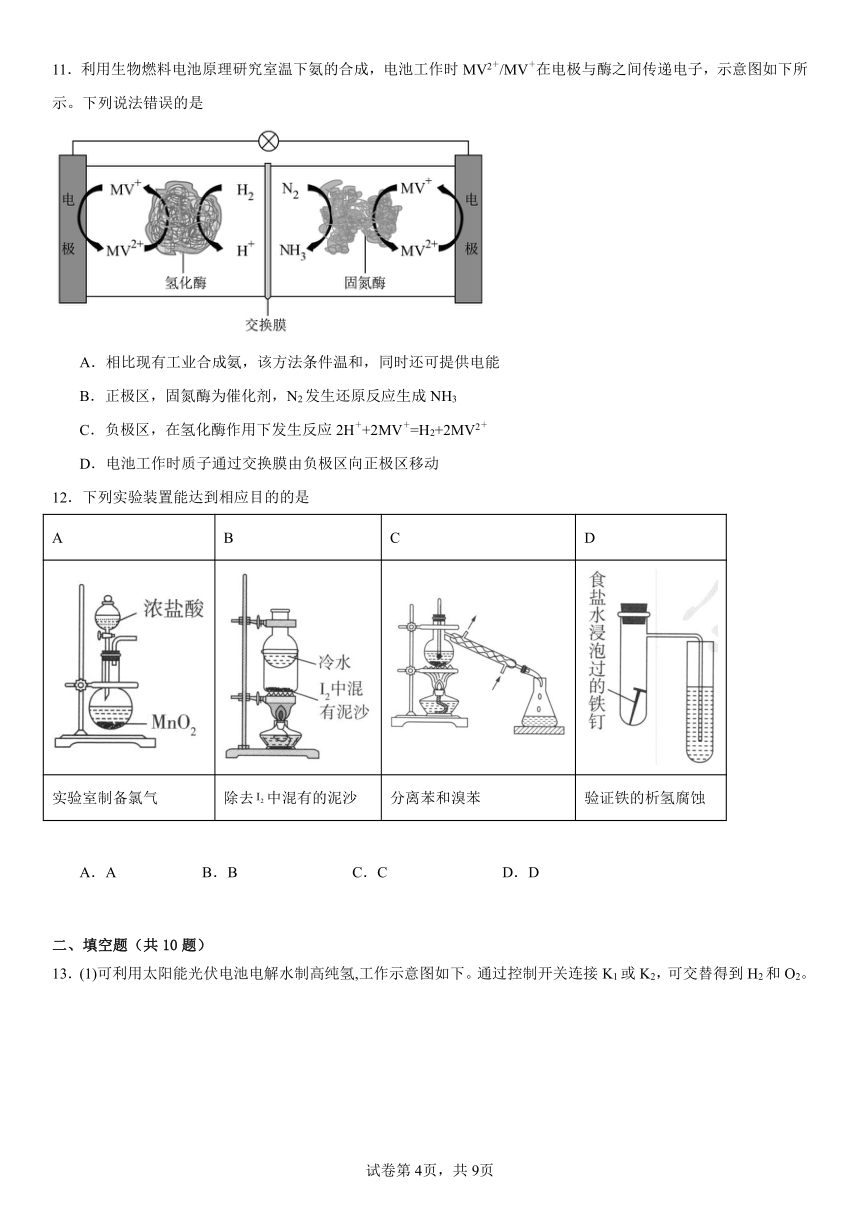
5.电解饱和食盐水的工业生产叫氯碱工业。如图所示为离子交换膜电解槽电解饱和食盐水原理示意图,下列有关说法错误的是
A.a接电源的负极,b接电源的正极
B.出口A产生的气体能使湿润的淀粉试纸变蓝
C.出口C得到浓NaOH溶液,出口B收集到的气体为
D.若无阳离子交换膜,电解时电解槽内可能会产生NaClO
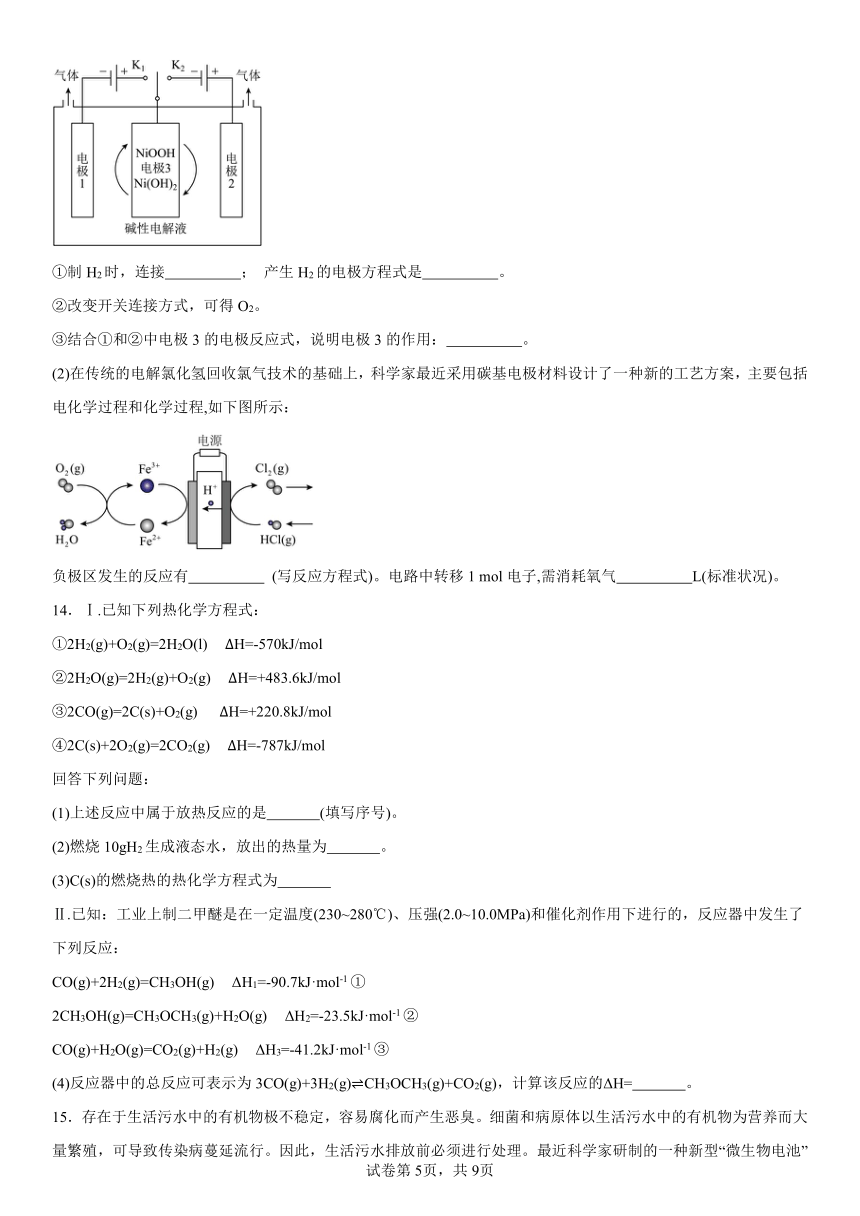
6.草酸常用于清洗瓷砖表面的污渍,一种利用乙炔合成乙烯和草酸的电化学装置如图所示,下列说法正确的是
A.电极a接电源的负极,电极上发生氧化反应
B.离子交换膜为质子交换膜,H+从a极移向b极
C.电极a、b上消耗的C2H2气体的质量比为4︰1
D.b电极的电极反应式是C2H2+8e-+4H2O→H2C2O4+8H+
7.一种固定CO2的电化学装置如图,该电化学装置放电时可将CO2转化为Li2CO3和C,充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法不正确的是
A.放电时,电极X的电极反应式:Li-e =Li+
B.充电时,电极Y应与外接电源的正极相连
C.充电时阳极的电极反应式为2Li2CO3-4e =2CO2↑+O2↑+4Li+
D.经过充、放电,该电池可以完全恢复组成,从而能够无限次使用
8.下列叙述正确的有
①CO2、SiO2、P2O5 均为酸性氧化物
②NaHCO3、Fe(OH)3、FeCl2 均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为溶液、胶体
④灼热的炭与 CO2 的反应、Ba(OH)2·8H2O 与 NH4Cl 的反应均既是氧化还原反应,又是吸热反应
⑤需要通电才可进行的有:电离、电解、电镀、电化学腐蚀
⑥氯化铝溶液与氢氧化铝胶体具有的共同性质是:能透过滤纸
⑦苛性钾、次氯酸、氯气按顺序分类依次为强电解质、弱电解质和非电解质
⑧碱石灰、生石灰、玻璃、漂白粉、光导纤维都是混合物
A.3 个 B.4 个 C.5 个 D.6 个
9.宏观辨识与微观探析是化学核心素养之一,下列有关离子方程式的书写正确的是
A.向溶液中通入过量:
B.用惰性电极电解NaCl溶液:
C.将铜丝插入稀硝酸溶液中:
D.向中通入过量HI溶液:
10.下列说法正确的是
A.化学键的断裂与形成与反应放热和吸热无关
B.放热反应的发生无需任何条件
C.所有化学变化一定遵循质量守恒和能量守恒
D.化学变化一定有化学键的断裂和生成,有化学键断裂或生成一定发生了化学变化
11.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
C.负极区,在氢化酶作用下发生反应2H++2MV+=H2+2MV2+
D.电池工作时质子通过交换膜由负极区向正极区移动
12.下列实验装置能达到相应目的的是
A B C D
实验室制备氯气 除去中混有的泥沙 分离苯和溴苯 验证铁的析氢腐蚀
A.A B.B C.C D.D
二、填空题(共10题)
13.(1)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
①制H2时,连接 ; 产生H2的电极方程式是 。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用: 。
(2)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
负极区发生的反应有 (写反应方程式)。电路中转移1 mol电子,需消耗氧气 L(标准状况)。
14.Ⅰ.已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) H=+483.6kJ/mol
③2CO(g)=2C(s)+O2(g) H=+220.8kJ/mol
④2C(s)+2O2(g)=2CO2(g) H=-787kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是 (填写序号)。
(2)燃烧10gH2生成液态水,放出的热量为 。
(3)C(s)的燃烧热的热化学方程式为
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1 ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
(4)反应器中的总反应可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),计算该反应的ΔH= 。
15.存在于生活污水中的有机物极不稳定,容易腐化而产生恶臭。细菌和病原体以生活污水中的有机物为营养而大量繁殖,可导致传染病蔓延流行。因此,生活污水排放前必须进行处理。最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图。回答下列问题:
(1)氧化银电极上的反应为 。
(2)石墨电极上的反应为 。
(3)每转移4mol电子,氧化银电极产生 LCO2气体(标准状况)。
(4)每30gC6H12O6参与反应,有 molH+经质子交换膜进入正极区。
16.有六种短周期元素,已知A的单质是最清洁的能源物质,其他元素的原子半径及主要化合价如下表:
元素代号 B C D E F
原子半径/nm 0.186 0.143 0.102 0.099 0.074
主要化合价 +1 +3 +6、-2 +7、-1 -2
根据上述信息回答以下问题。
(1)D在元素周期表中的位置 ;E的离子结构示意图 。
(2)关于A元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,试分析其理由 。
(3)用电子式表示B的单质与D的单质形成化合物的过程 。
(4)下列各项比较,正确的是 。
①氢化物的沸点:D低于F ②A~F元素的简单离子半径:C的最大
③气态氢化物稳定性:D比E稳定 ④最高价氧化物对应的水化物碱性:B小于C
(5)E单质常用于自来水消毒。用必要的文字和离子方程式解释原因 。
(6)写出C的单质与B的最高价氧化物的水化物反应的离子方程式 。
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,该反应的化学方程式为 。
(8)已知单质M的燃烧热为375kJ/mol,写出表示其燃烧热的热化学方程式 。
(9)已知NH3结合质子的能力强于F的氢化物,请用最恰当的离子方程式证明这个结论 。
17.金属铁是现代社会使用量最大的金属,其化合物也被应用在各个领域。
Ⅰ.利用烧结的铁碳混合材料可除去废水中的污染物,在有、无溶解氧的情况下均可在溶液中生成絮凝剂,某种环境下其作用原理图示如下:
请回答:
(1)图中C电极上的电极反应式 。
(2)下列叙述正确的是_______。
A.铁电极为正极,碳电极为负极
B.经过加热烧结的铁碳混合物表面空隙发达,吸附能力大幅提高,有利除污
C.如图所示,碳电极上的反应环境为无溶解氧环境
D.铁碳混合材料工作过程中电子从铁电极流出,被絮凝剂运输至碳电极表面
(3)利用该材料可处理含铬废水(),最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为,若每处理污水,电极上共转移1.2mol电子,假设废水中的Cr元素被完全处理,则该污水中的Cr在处理前的浓度为 (以铬元素的质量计算,已知Cr的相对原子质量为52)。
Ⅱ.以高铁酸钾()为原料的高铁电池的研制也在进行中。如图是高铁电池的模拟装置:
(4)写出电势较高的一极的电极反应式 。
ⅡI.工业上用溶液刻蚀液晶显示器银电路板,某研究性学习小组为探究与Ag反应,进行如下实验:按下图连接装置并加入药品(盐桥中的物质不参与反应)。
(5)K闭合时,指针向左偏转,一段时间后指针归零,向左侧U形管中滴加几滴浓溶液,发现指针向右偏转,写出此时银电极的反应式: 。结合上述实验分析,写出和Ag反应的离子方程式 。
18.“电化学”与人类生产、生活密不可分,下图Ⅰ甲池可实现在铁表面镀锌:下图Ⅱ可通过电解废旧锂电池中的获得锂盐和。
回答下列问题:
(1)上图Ⅰ中A电极的电极材料为 ;乙池电解开始时发生反应的化学方程式为 。
(2)上图Ⅰ,工作一段时间后,若甲池阴极增重26g,则乙池中产生气体的体积为 L(标准状况)。
(3)上图Ⅱ中滤布的作用为 。X电极为 极,其电极反应式为 。
(4)上图Ⅱ电解过程中将 (填“增大”“减小”或“不变”,忽略电解过程中溶液体积的变化)。
19.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
①2H2(g)+CO(g) CH3OH(g) △H=﹣90.8kJ mol﹣1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=﹣23.5kJ mol﹣1
③CO(g)+H2O(g) CO2(g)+H2(g) △H=﹣41.3kJ mol﹣1
总合成反应的热化学方程式为 。
20.氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
(1)二氧化硫是一种污染性气体,工业上常利用Fe2+的催化作用,常温下使SO2转化为SO42-,其总反应为2SO2+O2+2H2O=2H2SO4。上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: 。
(2)ClO2是一种高效的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:
①氯化钠电解槽内的阳极产物为: 。
②二氧化氯发生器所产生的气体中二氧化氯的体积分数为: 。
③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,自身被还原成Cl-。写出该反应的离子方程式 。
21.某甲烷燃料电池工作时的装置如图所示,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少。请回答下列问题:
(1)铁电极为乙池中 电极(填“M”或“N”);N极的电极反应式为 ;通入甲烷的铂电极的电极反应式为 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气 L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的c(H+)为 mol·L-1。
22.FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为2Fe3++Cu=2Fe2++Cu2+,若要将此反应设计成原电池。
(1)请写出电极反应式:
①负极: 。
②正极: 。
(2)在框中画出装置图,指出电极材料和电解质溶液:
①不含盐桥 ②含盐桥
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.高温下,铁粉与水蒸气反应生成Fe3O4和氢气,Fe3O4即磁性氧化铁,A正确;
B.Fe的还原性不如Al,无法与氧化铝粉末反应置换出铝,B错误;
C.溴氧化性较强,铁粉与液溴反应生成FeBr3,C错误;
D.食盐水显中性,铁粉发生吸氧腐蚀,D错误;
综上所述答案为A。
2.D
【分析】用Cu在Fe片上镀铜应该是,铁作阴极,连接B电极,铜作阳极,连接A电极,以此解题。
【详解】A.铜离子应该在阴极上得到电子,即在B电极上得到电子,A错误;
B.铜离子在B电极得到电子,同时单质铜在A电极失去电子,形成铜离子,铜离子浓度不变,B错误;
C.A极和B极直接相连,金属铜和金属铁构成原电池的两个电极,金属Cu为正极,该极上是铜离子发生得电子的还原反应,C错误;
D.由分析可知,铜片连接A极,铁制品连接B极,D正确;
故选D。
3.D
【分析】由图可知,与直流电源负极相连的电极a为电解池的阴极,单原子镍做催化剂条件下二氧化碳在阴极得电子生成一氧化碳、纳米铜做催化剂条件下,一氧化碳在阴极得电子生成乙烯,电极b为阳极,氢氧根离子在阳极失去电子发生氧化反应生成氧气和水。
【详解】A.由分析可知,与直流电源负极相连的电极a为电解池的阴极,故A正确;
B.由分析可知,电极a为电解池的阴极,单原子镍做催化剂条件下二氧化碳在阴极得电子生成一氧化碳,故B正确;
C.由分析可知,电极a为电解池的阴极,纳米铜做催化剂条件下,一氧化碳在阴极得电子生成乙烯,电极反应式为2CO+ 6H2O+8e—=C2H4+8OH—,故C正确;
D.若乙烯的电解效率为60%,电路中通过1mol电子时,根据公式可得生成乙烯所用的电子的物质的量n=0.6mol,二氧化碳转化为乙烯的总电极反应为2CO2+8H2O+12e—=C2H4+12OH—,则当生成乙烯所用的电子物质的量n=0.6mol,产生的乙烯为0.05mol,故D错误;
故选D。
4.D
【详解】根据图象分析得到反应为放热反应。
A.碳酸钙的分解生成氧化钙和二氧化碳,反应是吸热反应,选项A不符合题意;
B.灼热的炭与二氧化碳反应生成一氧化碳,反应是吸热反应,选项B不符合题意;
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合生成氯化钡、氨气和水,反应是吸热反应,选项C不符合题意;
D.NaOH和盐酸反应是酸碱中和反应,是放热反应,选项D符合题意。
答案选D。
5.A
【详解】A.电解池中,阳离子移向阴极,根据Na+移动方向可知左室为阳极室、右室为阴极室,则a接电源的正极,b接电源的负极,故A项错误;
B.阳极的电极反应式为,出口A产生的气体为,能使湿润的淀粉试纸变蓝,故B项正确;
C.阴极的电极反应式为,出口B收集到,出口C得到浓NaOH溶液,故C项正确;
D.若无阳离子交换膜,与NaOH反应会生成NaCl与NaClO,故D项正确;
故答案选:A。
6.C
【分析】C2H2中C元素显-1价,C2H4中C元素显-2价,H2C2O4中C元素显+3价,则a极得电子作阴极,b极失电子作阳极。
【详解】A.由C2H2制C2H4,电极a上得电子,作阴极,则接电源的负极,电极上发生还原反应,A不正确;
B.在阳极,C2H2-8e-+4H2O→H2C2O4+8H+,在阴极,4C2H2+8e-+8H+→4C2H4,离子交换膜为质子交换膜,阳离子向阴极移动,则H+从b极移向a极,B不正确;
C.b极:C2H2-8e-+4H2O→H2C2O4+8H+,a极:4C2H2+8e-+8H+=4C2H4,则电极a、b上消耗的C2H2气体的质量比为4︰1,C正确;
D.b电极为阳极,失电子,则电极反应式是C2H2-8e-+4H2O→H2C2O4+8H+,D不正确;
故选C。
7.D
【分析】分析题给信息,放电时,X极上Li失去电子,则X为负极,Y为正极,正极上CO2得电子生成C和Li2CO3,电极Y上的反应式为:3CO2+4Li++4e-=C+2Li2CO3;充电时,阴极上Li+得电子生成Li,阳极上只有Li2CO3发生氧化反应,释放出CO2和O2,电极反应式为:2Li2CO3-4e =2CO2↑+O2↑+4Li+,据此分析。
【详解】A.放电时,X极为负极,发生氧化反应,Li失电子,电极X的电极反应式:Li-e =Li+,A项正确;
B.充电时,只有Li2CO3发生氧化反应,说明Y极为阳极,与电源的正极相连,B项正确;
C.该电池充电时,阳极上只有Li2CO3发生氧化反应,释放出CO2和O2,反应式为:2Li2CO3-4e =2CO2↑+O2↑+4Li+,C项正确;
D.充电电池不可能无限次充放电,会有损耗,因此也不能无限次使用,D项错误;
答案选D。
8.B
【详解】①二氧化碳、二氧化硅、五氧化二磷都是能与碱反应生成盐和水的酸性氧化物,故正确;
②碳酸钠溶液与二氧化碳和水发生化合反应生成碳酸氢钠,氢氧化亚铁与氧气和水发生化合反应生成氢氧化铁,氯化铁溶液与铁发生化合反应生成氯化亚铁,则碳酸氢钠、氢氧化铁、氯化亚铁均可由化合反应制得,故正确;
③碘易溶于酒精,则碘晶体分散到酒精中得到碘的酒精溶液,饱和氯化铁溶液滴入沸水中煮沸得到红褐色的氢氧化铁胶体,故正确;
④八水氢氧化钡与氯化铵固体反应中没有元素发生化合价变化,属于非氧化还原反应,故错误;
⑤电离、电化学腐蚀不需要通电就可进行,故错误;
⑥氯化铝溶液与氢氧化铝胶体具有的共同性质是分散质都能透过滤纸,故正确;
⑦氯气是非金属单质,单质既不是电解质也不是非电解质,故错误;
⑧生石灰是氧化钙的俗称,光导纤维的主要成分是二氧化硅,都是纯净物,不是混合物,故错误;
则①②③⑥正确,故选B。
9.B
【详解】A.过量的CO2能与CO反应生成HCO,因此向硅酸钠溶液中通入过量的CO2发生SiO+2CO2+2H2O=H2SiO3↓+2HCO,故A错误;
B.用惰性电极电解饱和食盐水,得到NaOH、氢气和氯气,其离子方程式为2Cl-+2H2O2OH-+H2↑+Cl2↑,故B正确;
C.铜与稀硝酸反应生成NO,离子方程式为3Cu+8H++2NO=3Cu2++2NO↑+4H2O,故C错误;
D.Fe3+具有强氧化性,能将I-氧化成I2,氢氧化铁中通入过量HI溶液反应2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故D错误;
答案为B。
10.C
【详解】A.旧键断裂吸收能量,新键生成放出能量,当吸收的能量大于放出的能量时反应吸热,反之则放热,所以化学键的断裂与形成与反应放热和吸热有关,故A错误;
B.某些放热反应需要一定条件引发,如燃烧需要温度达到可燃物的着火点,故B错误;
C.所有化学变化一定遵循质量守恒和能量守恒,C正确;
D.有化学键的断裂或生成不一定发生了化学变化,如HCl溶于水时共价键断裂,但并没有发生化学变化,故D错误;
综上所述答案为C。
11.C
【分析】利用原电池工作原理进行分析,负极上化合价升高,发生氧化反应,根据装置图可知,左边电极为负极,右边电极为正极,据此分析;
【详解】A.该反应中存在化合价的变化,能产生电流,工业上合成氨,需要高温、高压,本装置不需要,题中所给方法比较温和,故A说法正确;
B.根据上述分析,右边电极为正极,依据装置图可知,正极区,固氮酶作催化剂,N2→NH3,N元素化合价降低,被还原,故B说法正确;
C.左边电极为负极,根据装置图可知,在氢化酶作用下发生2MV2++H2=2MV++2H+,故C说法错误;
D.根据原电池工作原理,内电路中H+通过交换膜由负极区移向正极区,故D说法错误;
答案为C。
12.B
【详解】A.实验室用浓盐酸和二氧化锰制备氯气时需要加热,则该实验装置不能达到相应目的,A项错误;
B.单质碘易升华,除去中混有的泥沙,可用升华的方法,则该实验装置能达到相应目的,B项正确;
C.温度计水银球应在略低于支管口处,则该实验装置不能达到相应目的,C项错误;
D.这是验证铁的吸氧腐蚀实验装置,析氢腐蚀应在酸性条件下进行,则该实验装置不能达到相应目的,D项错误;
答案选B。
13. K1 2H2O+2e-=H2↑+2OH- 制H2时,电极3发生反应:Ni(OH)2+OH--e-=NiOOH+H2O。制O2时,上述电极反应逆向进行,使电极3得以循环使用 Fe3++e-=Fe2+,4Fe2++O2+4H+=4Fe3++2H2O 5.6
【详解】(1)①根据题图示中电极3的转化关系可知,制H2时,连接K1;碱性条件下,生成H2的电极反应式为2H2O+2e-==H2↑+2OH-。
③①中电极3反应式为Ni(OH)2+OH--e-==NiOOH+H2O,消耗生成H2时产生的OH-;而②中电极3的电极反应式为NiOOH+H2O+e-==Ni(OH)2+OH-,补充生成O2所需的OH-,同时保证电极3得以循环使用。
(2)根据图示可知,负极区(指电解池的阴极区)发生的电极反应(还原反应)为Fe3++e-==Fe2+,随之发生4Fe2++O2+4H+==4Fe3++2H2O;根据电子守恒可知,电路中每转移1 mol电子消耗0.25 mol O2,在标准状况下的体积为5.6 L。
14. ①、④ 1425kJ C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol -246.1kJ·mol-1
【详解】Ⅰ. (1)<0表示放热反应,故上述反应中属于放热反应的是①、④,故答案为:①、④;
(2)根据反应①可知,燃烧10gH2生成液态水,放出的热量为1425kJ,故答案为:1425 kJ;
(3)燃烧热是指1mol燃料完全燃烧生成稳定的氧化物时的热效应,有反应④可推知,C(s)的燃烧热的热化学方程式为C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol ,故答案为:C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol;
Ⅱ.(4)根据该斯定律可知,反应器中的总反应可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)可由2①+②+③,故该反应的ΔH=2ΔH1+ΔH2+ΔH3=2×(-90.7kJ·mol-1)+(-23.5kJ·mol-1)+(-41.2kJ·mol-1)=-246.1kJ·mol-1,故答案为:-246.1kJ·mol-1。
15. Ag2O+2H++2e-=2Ag+H2O C6H12O6+6H2O-24e-=6CO2↑+24H+ 22.4 4
【分析】据图可知C6H12O6在微生物作用下转化为CO2和H2O,C6H12O6被氧化,即石墨电极为负极,氧化银电极为正极。
【详解】(1)C6H12O6在微生物作用下转化为CO2和H2O,C6H12O6被氧化,即石墨电极为负极,氧化银电极为正极,Ag2O发生得电子的还原反应,电极反应式为Ag2O+2H++2e-=2Ag+H2O;
(2)石墨电极为负极,C6H12O6在负极发生失电子的氧化反应:C6H12O6+6H2O-24e-=6CO2↑+24H+;
(3)根据负极的电极反应式可知,每转移4 mol电子,石墨电极产生1molCO2,即22.4LCO2(标准状况);
(4)30 g C6H12O6的物质的量为,根据负极的电极反应式可知,有4 mol H+经质子交换膜进入正极区。
16.(1) 第三周期,第ⅥA族
(2)氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构)
(3)
(4)①
(5)Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒
(6)2Al+2OH-+2H2O=2AlO +3H2↑
(7)2Al+Fe2O3Al2O3+2Fe
(8)Fe(s)+2/3 O2(g)=1/3 Fe3O4(s)ΔH=-375kJ/mol
(9)NH3 + H3O+=NH+ H2O
【分析】已知A的单质是最清洁的能源物质,A是H;根据元素的原子半径及主要化合价可知D一定是S,E一定是Cl,F一定是O,则B一定是Na,C一定是Al。
【详解】(1)S在元素周期表中的位置是第三周期第ⅥA族;Cl-离子结构示意图为。故答案为:第三周期,第ⅥA族;;
(2)由于氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构),因此有人主张把它放在第ⅦA族。故答案为:氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构);
(3)B的单质与D的单质形成的化合物是离子化合物硫化钠,其形成过程可表示为。故答案为:;
(4)①水分子间存在氢键,则氢化物的沸点:D低于F,正确;②离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则A~F元素的简单离子半径:S的最大,错误;③氯元素非金属性强于硫,气态氢化物稳定性:E比D稳定,错误;④钠的金属性强于铝,最高价氧化物对应的水化物碱性:B大于C,错误,答案选①;故答案为:①;
(5)Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒。故答案为:Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒;
(6)铝单质与B的最高价氧化物的水化物氢氧化钠反应的离子方程式为2Al+2OH-+2H2O=2AlO+3H2↑。故答案为:2Al+2OH-+2H2O=2AlO +3H2↑;
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,即铝与氧化铁发生的铝热反应,该反应的化学方程式为2Al+Fe2O3Al2O3+2Fe。故答案为:2Al+Fe2O3Al2O3+2Fe;
(8)已知铁的燃烧热为375kJ/mol,则表示其燃烧热的热化学方程式为Fe(s)+2/3O2(g)=1/3Fe3O4(s)ΔH=-375kJ/mol。故答案为:Fe(s)+2/3 O2(g)=1/3 Fe3O4(s)ΔH=-375kJ/mol;
(9)根据反应NH3+H3O+=NH+H2O可说明NH3结合质子的能力强于水。故答案为:NH3 + H3O+=NH+ H2O;
17.(1)
(2)BC
(3)1.04mg/L
(4)
(5)
【分析】Ⅰ中属于原电池,C电极上水变成氢气,为正极,Fe为负极;Ⅱ中M电极由Fe变为Fe(OH)2,为负极,则N为正极;ⅡI中 K闭合时,指针向左偏转,说明电流由左向右,一段时间后指针向右偏转,说明电流由右向左。
【详解】(1)由分析可知,C电极为正极,电极反应式为:;
(2)A.C电极为正极,Fe为负极,A错误;
B.经过加热烧结的铁碳混合物表面空隙发达,有利于原电池反应,生成更多的Fen+,吸附能力大幅提高,有利除污,B正确;
C.如图所示,若C电极上有溶解氧,则发生吸氧腐蚀,所以碳电极上的反应环境为无溶解氧环境,C正确;
D.铁碳混合材料工作过程中电子从铁电极流出,经其他导电介质运输至碳电极表面,不是被絮凝剂运输至碳电极表面,D错误;
故选BC;
(3)假设电池反应中Fe生成的是Fe2+,则处理含铬废水是的方程式为: ,电池反应中每生成一个Fe2+,转移2个电子,则有关系式:
解得x=0.2mol,则该污水中的Cr在处理前的浓度为;
(4)由分析可知,电势较高的一极为N极,电极反应式为:;
(5)K闭合时,指针向左偏转,说明电流由左向右,Fe3+与Ag发生反应,一段时间后指针归零,向左侧U形管中滴加几滴FeCl2浓溶液,指针向右偏转,说明电流由右向左,此时Ag+与Fe2+反应,此时银电极的反应式为:;结合上述实验分析, Fe3+和Ag反应的离子方程式。
18.(1) 铁
(2)8.96
(3) 阻挡固体颗粒,防止与混合导致产物不纯 阴
(4)增大
【分析】根据图Ⅰ甲池可实现在铁表面镀锌,可知A为铁,B为铜;下图Ⅱ可通过电解废旧锂电池中的获得锂盐和,则电极Y发生失电子的氧化反应,为阳极,电极X为阴极。
【详解】(1)根据图Ⅰ甲池可实现在铁表面镀锌,可知A为铁;乙池电解硫酸铜溶液生成铜、氧气和硫酸,故反应的化学方程式为。
(2)甲池阴极发生反应Zn2++2e-=Zn,26gZn的物质的量为=0.4mol,转移电子为0.8mol,乙池中开始发生反应,反应0.5L×0.4mol/L=0.2molCuSO4时转移0.4mol电子,生成氧气0.1mol,故又电解水转移0.4mol电子,生成氢气0.2mol、氧气0.1mol,共生成气体0.4mol,标准状况下体积为0.4mol×22.4L/mol=8.96L。
(3)图Ⅱ中滤布的作用为阻挡固体颗粒,防止与混合导致产物不纯。根据电极Y发生失电子的氧化反应,为阳极,电极X为阴极,发生的电极反应式为。
(4)电极X为阴极,发生的电极反应式为,电极Y发生反应,转移相同电子时生成Mn2+比消耗的多,故电解过程中将增大。
19.3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) △H=﹣246.4kJ mol﹣1
【详解】①2H2(g)+CO(g) CH3OH(g) △H=﹣90.8kJ mol﹣1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=﹣23.5kJ mol﹣1
③CO(g)+H2O(g) CO2(g)+H2(g) △H=﹣41.3kJ mol﹣1
利用盖斯定律,将①×2+②+③得:总合成反应的热化学方程式为3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) △H=﹣246.4kJ mol﹣1。答案为:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) △H=﹣246.4kJ mol﹣1。
20. 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ ClO3- 或 NaClO3 2/3或66.7% 2ClO2+2CN-=2CO2↑+2Cl-+N2↑
【详解】(1)根据题中反应原理,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,第二步是铁离子将二氧化硫氧化成硫酸根离子,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;(2)①电解食盐水得到氯酸钠和氢气,阳极发生失去电子的氧化反应,则阳极反应产物是ClO3-;②NaClO3和HCl反应生成ClO2,根据电子得失守恒和原子守恒可知反应的化学方程式为2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,因此二氧化氯发生器所产生的气体中二氧化氯的体积分数为2/3×100%=66.7%;③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,应为二氧化碳和氮气,自身被还原成Cl-,根据电子得失守恒、电荷守恒和原子守恒可知反应的离子方程式为 2ClO2+2CN-=2CO2↑+2Cl-+N2↑。
21. M 4OH--4e-===2H2O+O2↑ CH4-8e-+10OH-=CO32—+7H2O 0.224 0.1
【详解】试题分析:本题考查甲烷燃料电池电极反应式的书写,电解池电极材料的判断和电化学的有关计算。
(1)甲池的甲烷燃料电池中通入甲烷的Pt电极为负极,通入O2的Pt电极为正极;乙池中M与甲池中的负极相连,M为阴极,N为阳极;工作时M、N两个电极的质量都不减少,铁为活性电极,若铁为阳极,铁的质量应减少,铁只能为阴极,铁电极为乙池中的M;N为石墨电极,为阳极,电极反应式为4OH--4e-=O2↑+2H2O 。甲烷燃料电池中的电解质溶液为KOH溶液,在碱性条件下CH4被氧化成CO32-,通入甲烷的Pt电极的电极反应式为CH4-8e-+10OH-=CO32—+7H2O。
(2)n(Ag)==0.04mol,乙池中析出金属Ag的是阴极,电极反应式为Ag++e-=Ag,则电路中通过的电子物质的量为0.04mol,根据电子守恒,甲池中消耗氧气物质的量为0.04mol4=0.01mol,消耗氧气在标准状况下的体积为0.01mol22.4L/mol=0.224L。乙池中反应的离子方程式为4Ag++2H2O4Ag+4H++O2↑,则生成的H+物质的量为0.04mol,c(H+)=0.04mol0.4L=0.1mol/L。
【点睛】电化学的计算一般用电子守恒建立关系式。
22. Cu-2e-=Cu2+ 2Fe3++2e-=2Fe2+
【详解】(1)在 2Fe3++Cu=2Fe2++Cu2+反应中,铁元素的化合价降低被还原,铜元素的化合价升高被氧化,
①负极失去电子发生氧化反应,电极反应式是:Cu-2e-=Cu2+;
②正极得到电子发生还原反应,电极反应式是:2Fe3++2e-=2Fe2+;
(2)把2Fe3++Cu=2Fe2++Cu2+反应设计成原电池,铜棒做负极,碳棒做正极,电解质溶液是氯化铁溶液,
①不含盐桥时,装置图是;
②含盐桥,铜棒插入氯化铜溶液中,碳棒插入氯化铁溶液中,两个烧杯用盐桥连接,装置图是。
答案第1页,共2页
答案第1页,共2页
一、单选题(共12题)
1.铁粉是冶金的主要原料。下列有关铁的化学反应的叙述正确的是
A.高温下,铁粉与水蒸气反应生成磁性氧化铁
B.高温下,铁粉与氧化铝粉末反应置换出铝
C.制备溴苯时,铁粉与液溴反应生成FeBr2
D.铁粉和炭粉混合用食盐水湿润后发生析氢腐蚀
2.如图是某同学用Cu在Fe片上镀铜的实验装置,下列说法正确的是
A.在A极被还原
B.溶液蓝色逐渐变浅
C.A极和B极直接相连,铜片被氧化
D.铜片连接A极,铁制品连接B极
3.我国科学家采用单原子Ni和纳米Cu作串联催化剂,通过电解法将转化为乙烯。装置示意图如下。已知:电解效率
下列说法不正确的是
A.电极a连接电源的负极
B.电极a上有CO产生
C.纳米Cu催化剂上发生反应:2CO+ 6H2O+8e—=C2H4+8OH—
D.若乙烯的电解效率为60%,电路中通过1mol电子时,产生0.075mol乙烯
4.下列物质间反应,其能量变化符合如图所示的是
A.碳酸钙的分解
B.灼热的炭与二氧化碳反应
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合
D.NaOH和盐酸反应
5.电解饱和食盐水的工业生产叫氯碱工业。如图所示为离子交换膜电解槽电解饱和食盐水原理示意图,下列有关说法错误的是
A.a接电源的负极,b接电源的正极
B.出口A产生的气体能使湿润的淀粉试纸变蓝
C.出口C得到浓NaOH溶液,出口B收集到的气体为
D.若无阳离子交换膜,电解时电解槽内可能会产生NaClO
6.草酸常用于清洗瓷砖表面的污渍,一种利用乙炔合成乙烯和草酸的电化学装置如图所示,下列说法正确的是
A.电极a接电源的负极,电极上发生氧化反应
B.离子交换膜为质子交换膜,H+从a极移向b极
C.电极a、b上消耗的C2H2气体的质量比为4︰1
D.b电极的电极反应式是C2H2+8e-+4H2O→H2C2O4+8H+
7.一种固定CO2的电化学装置如图,该电化学装置放电时可将CO2转化为Li2CO3和C,充电时选用合适催化剂,只有Li2CO3发生氧化反应,释放出CO2和O2。下列说法不正确的是
A.放电时,电极X的电极反应式:Li-e =Li+
B.充电时,电极Y应与外接电源的正极相连
C.充电时阳极的电极反应式为2Li2CO3-4e =2CO2↑+O2↑+4Li+
D.经过充、放电,该电池可以完全恢复组成,从而能够无限次使用
8.下列叙述正确的有
①CO2、SiO2、P2O5 均为酸性氧化物
②NaHCO3、Fe(OH)3、FeCl2 均可由化合反应制得
③碘晶体分散到酒精中、饱和氯化铁溶液滴入沸水中所形成的分散系分别为溶液、胶体
④灼热的炭与 CO2 的反应、Ba(OH)2·8H2O 与 NH4Cl 的反应均既是氧化还原反应,又是吸热反应
⑤需要通电才可进行的有:电离、电解、电镀、电化学腐蚀
⑥氯化铝溶液与氢氧化铝胶体具有的共同性质是:能透过滤纸
⑦苛性钾、次氯酸、氯气按顺序分类依次为强电解质、弱电解质和非电解质
⑧碱石灰、生石灰、玻璃、漂白粉、光导纤维都是混合物
A.3 个 B.4 个 C.5 个 D.6 个
9.宏观辨识与微观探析是化学核心素养之一,下列有关离子方程式的书写正确的是
A.向溶液中通入过量:
B.用惰性电极电解NaCl溶液:
C.将铜丝插入稀硝酸溶液中:
D.向中通入过量HI溶液:
10.下列说法正确的是
A.化学键的断裂与形成与反应放热和吸热无关
B.放热反应的发生无需任何条件
C.所有化学变化一定遵循质量守恒和能量守恒
D.化学变化一定有化学键的断裂和生成,有化学键断裂或生成一定发生了化学变化
11.利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
C.负极区,在氢化酶作用下发生反应2H++2MV+=H2+2MV2+
D.电池工作时质子通过交换膜由负极区向正极区移动
12.下列实验装置能达到相应目的的是
A B C D
实验室制备氯气 除去中混有的泥沙 分离苯和溴苯 验证铁的析氢腐蚀
A.A B.B C.C D.D
二、填空题(共10题)
13.(1)可利用太阳能光伏电池电解水制高纯氢,工作示意图如下。通过控制开关连接K1或K2,可交替得到H2和O2。
①制H2时,连接 ; 产生H2的电极方程式是 。
②改变开关连接方式,可得O2。
③结合①和②中电极3的电极反应式,说明电极3的作用: 。
(2)在传统的电解氯化氢回收氯气技术的基础上,科学家最近采用碳基电极材料设计了一种新的工艺方案,主要包括电化学过程和化学过程,如下图所示:
负极区发生的反应有 (写反应方程式)。电路中转移1 mol电子,需消耗氧气 L(标准状况)。
14.Ⅰ.已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) H=+483.6kJ/mol
③2CO(g)=2C(s)+O2(g) H=+220.8kJ/mol
④2C(s)+2O2(g)=2CO2(g) H=-787kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是 (填写序号)。
(2)燃烧10gH2生成液态水,放出的热量为 。
(3)C(s)的燃烧热的热化学方程式为
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1 ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
(4)反应器中的总反应可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),计算该反应的ΔH= 。
15.存在于生活污水中的有机物极不稳定,容易腐化而产生恶臭。细菌和病原体以生活污水中的有机物为营养而大量繁殖,可导致传染病蔓延流行。因此,生活污水排放前必须进行处理。最近科学家研制的一种新型“微生物电池”可以将污水中的有机物转化为H2O和CO2,同时产生电能,其原理示意如图。回答下列问题:
(1)氧化银电极上的反应为 。
(2)石墨电极上的反应为 。
(3)每转移4mol电子,氧化银电极产生 LCO2气体(标准状况)。
(4)每30gC6H12O6参与反应,有 molH+经质子交换膜进入正极区。
16.有六种短周期元素,已知A的单质是最清洁的能源物质,其他元素的原子半径及主要化合价如下表:
元素代号 B C D E F
原子半径/nm 0.186 0.143 0.102 0.099 0.074
主要化合价 +1 +3 +6、-2 +7、-1 -2
根据上述信息回答以下问题。
(1)D在元素周期表中的位置 ;E的离子结构示意图 。
(2)关于A元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,试分析其理由 。
(3)用电子式表示B的单质与D的单质形成化合物的过程 。
(4)下列各项比较,正确的是 。
①氢化物的沸点:D低于F ②A~F元素的简单离子半径:C的最大
③气态氢化物稳定性:D比E稳定 ④最高价氧化物对应的水化物碱性:B小于C
(5)E单质常用于自来水消毒。用必要的文字和离子方程式解释原因 。
(6)写出C的单质与B的最高价氧化物的水化物反应的离子方程式 。
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,该反应的化学方程式为 。
(8)已知单质M的燃烧热为375kJ/mol,写出表示其燃烧热的热化学方程式 。
(9)已知NH3结合质子的能力强于F的氢化物,请用最恰当的离子方程式证明这个结论 。
17.金属铁是现代社会使用量最大的金属,其化合物也被应用在各个领域。
Ⅰ.利用烧结的铁碳混合材料可除去废水中的污染物,在有、无溶解氧的情况下均可在溶液中生成絮凝剂,某种环境下其作用原理图示如下:
请回答:
(1)图中C电极上的电极反应式 。
(2)下列叙述正确的是_______。
A.铁电极为正极,碳电极为负极
B.经过加热烧结的铁碳混合物表面空隙发达,吸附能力大幅提高,有利除污
C.如图所示,碳电极上的反应环境为无溶解氧环境
D.铁碳混合材料工作过程中电子从铁电极流出,被絮凝剂运输至碳电极表面
(3)利用该材料可处理含铬废水(),最终溶液中的金属离子均生成氢氧化物沉淀。已知国家标准中污染物排放浓度的单位为,若每处理污水,电极上共转移1.2mol电子,假设废水中的Cr元素被完全处理,则该污水中的Cr在处理前的浓度为 (以铬元素的质量计算,已知Cr的相对原子质量为52)。
Ⅱ.以高铁酸钾()为原料的高铁电池的研制也在进行中。如图是高铁电池的模拟装置:
(4)写出电势较高的一极的电极反应式 。
ⅡI.工业上用溶液刻蚀液晶显示器银电路板,某研究性学习小组为探究与Ag反应,进行如下实验:按下图连接装置并加入药品(盐桥中的物质不参与反应)。
(5)K闭合时,指针向左偏转,一段时间后指针归零,向左侧U形管中滴加几滴浓溶液,发现指针向右偏转,写出此时银电极的反应式: 。结合上述实验分析,写出和Ag反应的离子方程式 。
18.“电化学”与人类生产、生活密不可分,下图Ⅰ甲池可实现在铁表面镀锌:下图Ⅱ可通过电解废旧锂电池中的获得锂盐和。
回答下列问题:
(1)上图Ⅰ中A电极的电极材料为 ;乙池电解开始时发生反应的化学方程式为 。
(2)上图Ⅰ,工作一段时间后,若甲池阴极增重26g,则乙池中产生气体的体积为 L(标准状况)。
(3)上图Ⅱ中滤布的作用为 。X电极为 极,其电极反应式为 。
(4)上图Ⅱ电解过程中将 (填“增大”“减小”或“不变”,忽略电解过程中溶液体积的变化)。
19.工业上可利用煤的气化产物(CO和H2)合成二甲醚(CH3OCH3)同时生成二氧化碳,其三步反应如下:
①2H2(g)+CO(g) CH3OH(g) △H=﹣90.8kJ mol﹣1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=﹣23.5kJ mol﹣1
③CO(g)+H2O(g) CO2(g)+H2(g) △H=﹣41.3kJ mol﹣1
总合成反应的热化学方程式为 。
20.氧化还原反应在生产生活中有着重要的应用。请按要求写出相应的方程式。
(1)二氧化硫是一种污染性气体,工业上常利用Fe2+的催化作用,常温下使SO2转化为SO42-,其总反应为2SO2+O2+2H2O=2H2SO4。上述总反应分两步进行,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,写出第二步反应的离子方程式: 。
(2)ClO2是一种高效的杀菌消毒剂。氯化钠电解法生产ClO2工艺原理示意图如下:
①氯化钠电解槽内的阳极产物为: 。
②二氧化氯发生器所产生的气体中二氧化氯的体积分数为: 。
③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,自身被还原成Cl-。写出该反应的离子方程式 。
21.某甲烷燃料电池工作时的装置如图所示,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少。请回答下列问题:
(1)铁电极为乙池中 电极(填“M”或“N”);N极的电极反应式为 ;通入甲烷的铂电极的电极反应式为 。
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气 L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的c(H+)为 mol·L-1。
22.FeCl3常用于腐蚀印刷电路铜板,反应过程的离子方程式为2Fe3++Cu=2Fe2++Cu2+,若要将此反应设计成原电池。
(1)请写出电极反应式:
①负极: 。
②正极: 。
(2)在框中画出装置图,指出电极材料和电解质溶液:
①不含盐桥 ②含盐桥
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A.高温下,铁粉与水蒸气反应生成Fe3O4和氢气,Fe3O4即磁性氧化铁,A正确;
B.Fe的还原性不如Al,无法与氧化铝粉末反应置换出铝,B错误;
C.溴氧化性较强,铁粉与液溴反应生成FeBr3,C错误;
D.食盐水显中性,铁粉发生吸氧腐蚀,D错误;
综上所述答案为A。
2.D
【分析】用Cu在Fe片上镀铜应该是,铁作阴极,连接B电极,铜作阳极,连接A电极,以此解题。
【详解】A.铜离子应该在阴极上得到电子,即在B电极上得到电子,A错误;
B.铜离子在B电极得到电子,同时单质铜在A电极失去电子,形成铜离子,铜离子浓度不变,B错误;
C.A极和B极直接相连,金属铜和金属铁构成原电池的两个电极,金属Cu为正极,该极上是铜离子发生得电子的还原反应,C错误;
D.由分析可知,铜片连接A极,铁制品连接B极,D正确;
故选D。
3.D
【分析】由图可知,与直流电源负极相连的电极a为电解池的阴极,单原子镍做催化剂条件下二氧化碳在阴极得电子生成一氧化碳、纳米铜做催化剂条件下,一氧化碳在阴极得电子生成乙烯,电极b为阳极,氢氧根离子在阳极失去电子发生氧化反应生成氧气和水。
【详解】A.由分析可知,与直流电源负极相连的电极a为电解池的阴极,故A正确;
B.由分析可知,电极a为电解池的阴极,单原子镍做催化剂条件下二氧化碳在阴极得电子生成一氧化碳,故B正确;
C.由分析可知,电极a为电解池的阴极,纳米铜做催化剂条件下,一氧化碳在阴极得电子生成乙烯,电极反应式为2CO+ 6H2O+8e—=C2H4+8OH—,故C正确;
D.若乙烯的电解效率为60%,电路中通过1mol电子时,根据公式可得生成乙烯所用的电子的物质的量n=0.6mol,二氧化碳转化为乙烯的总电极反应为2CO2+8H2O+12e—=C2H4+12OH—,则当生成乙烯所用的电子物质的量n=0.6mol,产生的乙烯为0.05mol,故D错误;
故选D。
4.D
【详解】根据图象分析得到反应为放热反应。
A.碳酸钙的分解生成氧化钙和二氧化碳,反应是吸热反应,选项A不符合题意;
B.灼热的炭与二氧化碳反应生成一氧化碳,反应是吸热反应,选项B不符合题意;
C.Ba(OH)2·8H2O晶体和NH4Cl晶体混合生成氯化钡、氨气和水,反应是吸热反应,选项C不符合题意;
D.NaOH和盐酸反应是酸碱中和反应,是放热反应,选项D符合题意。
答案选D。
5.A
【详解】A.电解池中,阳离子移向阴极,根据Na+移动方向可知左室为阳极室、右室为阴极室,则a接电源的正极,b接电源的负极,故A项错误;
B.阳极的电极反应式为,出口A产生的气体为,能使湿润的淀粉试纸变蓝,故B项正确;
C.阴极的电极反应式为,出口B收集到,出口C得到浓NaOH溶液,故C项正确;
D.若无阳离子交换膜,与NaOH反应会生成NaCl与NaClO,故D项正确;
故答案选:A。
6.C
【分析】C2H2中C元素显-1价,C2H4中C元素显-2价,H2C2O4中C元素显+3价,则a极得电子作阴极,b极失电子作阳极。
【详解】A.由C2H2制C2H4,电极a上得电子,作阴极,则接电源的负极,电极上发生还原反应,A不正确;
B.在阳极,C2H2-8e-+4H2O→H2C2O4+8H+,在阴极,4C2H2+8e-+8H+→4C2H4,离子交换膜为质子交换膜,阳离子向阴极移动,则H+从b极移向a极,B不正确;
C.b极:C2H2-8e-+4H2O→H2C2O4+8H+,a极:4C2H2+8e-+8H+=4C2H4,则电极a、b上消耗的C2H2气体的质量比为4︰1,C正确;
D.b电极为阳极,失电子,则电极反应式是C2H2-8e-+4H2O→H2C2O4+8H+,D不正确;
故选C。
7.D
【分析】分析题给信息,放电时,X极上Li失去电子,则X为负极,Y为正极,正极上CO2得电子生成C和Li2CO3,电极Y上的反应式为:3CO2+4Li++4e-=C+2Li2CO3;充电时,阴极上Li+得电子生成Li,阳极上只有Li2CO3发生氧化反应,释放出CO2和O2,电极反应式为:2Li2CO3-4e =2CO2↑+O2↑+4Li+,据此分析。
【详解】A.放电时,X极为负极,发生氧化反应,Li失电子,电极X的电极反应式:Li-e =Li+,A项正确;
B.充电时,只有Li2CO3发生氧化反应,说明Y极为阳极,与电源的正极相连,B项正确;
C.该电池充电时,阳极上只有Li2CO3发生氧化反应,释放出CO2和O2,反应式为:2Li2CO3-4e =2CO2↑+O2↑+4Li+,C项正确;
D.充电电池不可能无限次充放电,会有损耗,因此也不能无限次使用,D项错误;
答案选D。
8.B
【详解】①二氧化碳、二氧化硅、五氧化二磷都是能与碱反应生成盐和水的酸性氧化物,故正确;
②碳酸钠溶液与二氧化碳和水发生化合反应生成碳酸氢钠,氢氧化亚铁与氧气和水发生化合反应生成氢氧化铁,氯化铁溶液与铁发生化合反应生成氯化亚铁,则碳酸氢钠、氢氧化铁、氯化亚铁均可由化合反应制得,故正确;
③碘易溶于酒精,则碘晶体分散到酒精中得到碘的酒精溶液,饱和氯化铁溶液滴入沸水中煮沸得到红褐色的氢氧化铁胶体,故正确;
④八水氢氧化钡与氯化铵固体反应中没有元素发生化合价变化,属于非氧化还原反应,故错误;
⑤电离、电化学腐蚀不需要通电就可进行,故错误;
⑥氯化铝溶液与氢氧化铝胶体具有的共同性质是分散质都能透过滤纸,故正确;
⑦氯气是非金属单质,单质既不是电解质也不是非电解质,故错误;
⑧生石灰是氧化钙的俗称,光导纤维的主要成分是二氧化硅,都是纯净物,不是混合物,故错误;
则①②③⑥正确,故选B。
9.B
【详解】A.过量的CO2能与CO反应生成HCO,因此向硅酸钠溶液中通入过量的CO2发生SiO+2CO2+2H2O=H2SiO3↓+2HCO,故A错误;
B.用惰性电极电解饱和食盐水,得到NaOH、氢气和氯气,其离子方程式为2Cl-+2H2O2OH-+H2↑+Cl2↑,故B正确;
C.铜与稀硝酸反应生成NO,离子方程式为3Cu+8H++2NO=3Cu2++2NO↑+4H2O,故C错误;
D.Fe3+具有强氧化性,能将I-氧化成I2,氢氧化铁中通入过量HI溶液反应2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O,故D错误;
答案为B。
10.C
【详解】A.旧键断裂吸收能量,新键生成放出能量,当吸收的能量大于放出的能量时反应吸热,反之则放热,所以化学键的断裂与形成与反应放热和吸热有关,故A错误;
B.某些放热反应需要一定条件引发,如燃烧需要温度达到可燃物的着火点,故B错误;
C.所有化学变化一定遵循质量守恒和能量守恒,C正确;
D.有化学键的断裂或生成不一定发生了化学变化,如HCl溶于水时共价键断裂,但并没有发生化学变化,故D错误;
综上所述答案为C。
11.C
【分析】利用原电池工作原理进行分析,负极上化合价升高,发生氧化反应,根据装置图可知,左边电极为负极,右边电极为正极,据此分析;
【详解】A.该反应中存在化合价的变化,能产生电流,工业上合成氨,需要高温、高压,本装置不需要,题中所给方法比较温和,故A说法正确;
B.根据上述分析,右边电极为正极,依据装置图可知,正极区,固氮酶作催化剂,N2→NH3,N元素化合价降低,被还原,故B说法正确;
C.左边电极为负极,根据装置图可知,在氢化酶作用下发生2MV2++H2=2MV++2H+,故C说法错误;
D.根据原电池工作原理,内电路中H+通过交换膜由负极区移向正极区,故D说法错误;
答案为C。
12.B
【详解】A.实验室用浓盐酸和二氧化锰制备氯气时需要加热,则该实验装置不能达到相应目的,A项错误;
B.单质碘易升华,除去中混有的泥沙,可用升华的方法,则该实验装置能达到相应目的,B项正确;
C.温度计水银球应在略低于支管口处,则该实验装置不能达到相应目的,C项错误;
D.这是验证铁的吸氧腐蚀实验装置,析氢腐蚀应在酸性条件下进行,则该实验装置不能达到相应目的,D项错误;
答案选B。
13. K1 2H2O+2e-=H2↑+2OH- 制H2时,电极3发生反应:Ni(OH)2+OH--e-=NiOOH+H2O。制O2时,上述电极反应逆向进行,使电极3得以循环使用 Fe3++e-=Fe2+,4Fe2++O2+4H+=4Fe3++2H2O 5.6
【详解】(1)①根据题图示中电极3的转化关系可知,制H2时,连接K1;碱性条件下,生成H2的电极反应式为2H2O+2e-==H2↑+2OH-。
③①中电极3反应式为Ni(OH)2+OH--e-==NiOOH+H2O,消耗生成H2时产生的OH-;而②中电极3的电极反应式为NiOOH+H2O+e-==Ni(OH)2+OH-,补充生成O2所需的OH-,同时保证电极3得以循环使用。
(2)根据图示可知,负极区(指电解池的阴极区)发生的电极反应(还原反应)为Fe3++e-==Fe2+,随之发生4Fe2++O2+4H+==4Fe3++2H2O;根据电子守恒可知,电路中每转移1 mol电子消耗0.25 mol O2,在标准状况下的体积为5.6 L。
14. ①、④ 1425kJ C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol -246.1kJ·mol-1
【详解】Ⅰ. (1)<0表示放热反应,故上述反应中属于放热反应的是①、④,故答案为:①、④;
(2)根据反应①可知,燃烧10gH2生成液态水,放出的热量为1425kJ,故答案为:1425 kJ;
(3)燃烧热是指1mol燃料完全燃烧生成稳定的氧化物时的热效应,有反应④可推知,C(s)的燃烧热的热化学方程式为C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol ,故答案为:C(s)+O2(g)=CO2(g)ΔH=-393.5kJ/mol;
Ⅱ.(4)根据该斯定律可知,反应器中的总反应可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g)可由2①+②+③,故该反应的ΔH=2ΔH1+ΔH2+ΔH3=2×(-90.7kJ·mol-1)+(-23.5kJ·mol-1)+(-41.2kJ·mol-1)=-246.1kJ·mol-1,故答案为:-246.1kJ·mol-1。
15. Ag2O+2H++2e-=2Ag+H2O C6H12O6+6H2O-24e-=6CO2↑+24H+ 22.4 4
【分析】据图可知C6H12O6在微生物作用下转化为CO2和H2O,C6H12O6被氧化,即石墨电极为负极,氧化银电极为正极。
【详解】(1)C6H12O6在微生物作用下转化为CO2和H2O,C6H12O6被氧化,即石墨电极为负极,氧化银电极为正极,Ag2O发生得电子的还原反应,电极反应式为Ag2O+2H++2e-=2Ag+H2O;
(2)石墨电极为负极,C6H12O6在负极发生失电子的氧化反应:C6H12O6+6H2O-24e-=6CO2↑+24H+;
(3)根据负极的电极反应式可知,每转移4 mol电子,石墨电极产生1molCO2,即22.4LCO2(标准状况);
(4)30 g C6H12O6的物质的量为,根据负极的电极反应式可知,有4 mol H+经质子交换膜进入正极区。
16.(1) 第三周期,第ⅥA族
(2)氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构)
(3)
(4)①
(5)Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒
(6)2Al+2OH-+2H2O=2AlO +3H2↑
(7)2Al+Fe2O3Al2O3+2Fe
(8)Fe(s)+2/3 O2(g)=1/3 Fe3O4(s)ΔH=-375kJ/mol
(9)NH3 + H3O+=NH+ H2O
【分析】已知A的单质是最清洁的能源物质,A是H;根据元素的原子半径及主要化合价可知D一定是S,E一定是Cl,F一定是O,则B一定是Na,C一定是Al。
【详解】(1)S在元素周期表中的位置是第三周期第ⅥA族;Cl-离子结构示意图为。故答案为:第三周期,第ⅥA族;;
(2)由于氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构),因此有人主张把它放在第ⅦA族。故答案为:氢元素的负化合价是-1价(或氢的最外层得到一个电子达到饱和结构);
(3)B的单质与D的单质形成的化合物是离子化合物硫化钠,其形成过程可表示为。故答案为:;
(4)①水分子间存在氢键,则氢化物的沸点:D低于F,正确;②离子的核外电子层数越多,离子半径越大,核外电子排布相同时离子半径随原子序数的增大而减小,则A~F元素的简单离子半径:S的最大,错误;③氯元素非金属性强于硫,气态氢化物稳定性:E比D稳定,错误;④钠的金属性强于铝,最高价氧化物对应的水化物碱性:B大于C,错误,答案选①;故答案为:①;
(5)Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒。故答案为:Cl2通入水中发生反应Cl2+H2O=H++Cl-+HClO,生成的HClO具有强氧化性,能杀菌消毒;
(6)铝单质与B的最高价氧化物的水化物氢氧化钠反应的离子方程式为2Al+2OH-+2H2O=2AlO+3H2↑。故答案为:2Al+2OH-+2H2O=2AlO +3H2↑;
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,即铝与氧化铁发生的铝热反应,该反应的化学方程式为2Al+Fe2O3Al2O3+2Fe。故答案为:2Al+Fe2O3Al2O3+2Fe;
(8)已知铁的燃烧热为375kJ/mol,则表示其燃烧热的热化学方程式为Fe(s)+2/3O2(g)=1/3Fe3O4(s)ΔH=-375kJ/mol。故答案为:Fe(s)+2/3 O2(g)=1/3 Fe3O4(s)ΔH=-375kJ/mol;
(9)根据反应NH3+H3O+=NH+H2O可说明NH3结合质子的能力强于水。故答案为:NH3 + H3O+=NH+ H2O;
17.(1)
(2)BC
(3)1.04mg/L
(4)
(5)
【分析】Ⅰ中属于原电池,C电极上水变成氢气,为正极,Fe为负极;Ⅱ中M电极由Fe变为Fe(OH)2,为负极,则N为正极;ⅡI中 K闭合时,指针向左偏转,说明电流由左向右,一段时间后指针向右偏转,说明电流由右向左。
【详解】(1)由分析可知,C电极为正极,电极反应式为:;
(2)A.C电极为正极,Fe为负极,A错误;
B.经过加热烧结的铁碳混合物表面空隙发达,有利于原电池反应,生成更多的Fen+,吸附能力大幅提高,有利除污,B正确;
C.如图所示,若C电极上有溶解氧,则发生吸氧腐蚀,所以碳电极上的反应环境为无溶解氧环境,C正确;
D.铁碳混合材料工作过程中电子从铁电极流出,经其他导电介质运输至碳电极表面,不是被絮凝剂运输至碳电极表面,D错误;
故选BC;
(3)假设电池反应中Fe生成的是Fe2+,则处理含铬废水是的方程式为: ,电池反应中每生成一个Fe2+,转移2个电子,则有关系式:
解得x=0.2mol,则该污水中的Cr在处理前的浓度为;
(4)由分析可知,电势较高的一极为N极,电极反应式为:;
(5)K闭合时,指针向左偏转,说明电流由左向右,Fe3+与Ag发生反应,一段时间后指针归零,向左侧U形管中滴加几滴FeCl2浓溶液,指针向右偏转,说明电流由右向左,此时Ag+与Fe2+反应,此时银电极的反应式为:;结合上述实验分析, Fe3+和Ag反应的离子方程式。
18.(1) 铁
(2)8.96
(3) 阻挡固体颗粒,防止与混合导致产物不纯 阴
(4)增大
【分析】根据图Ⅰ甲池可实现在铁表面镀锌,可知A为铁,B为铜;下图Ⅱ可通过电解废旧锂电池中的获得锂盐和,则电极Y发生失电子的氧化反应,为阳极,电极X为阴极。
【详解】(1)根据图Ⅰ甲池可实现在铁表面镀锌,可知A为铁;乙池电解硫酸铜溶液生成铜、氧气和硫酸,故反应的化学方程式为。
(2)甲池阴极发生反应Zn2++2e-=Zn,26gZn的物质的量为=0.4mol,转移电子为0.8mol,乙池中开始发生反应,反应0.5L×0.4mol/L=0.2molCuSO4时转移0.4mol电子,生成氧气0.1mol,故又电解水转移0.4mol电子,生成氢气0.2mol、氧气0.1mol,共生成气体0.4mol,标准状况下体积为0.4mol×22.4L/mol=8.96L。
(3)图Ⅱ中滤布的作用为阻挡固体颗粒,防止与混合导致产物不纯。根据电极Y发生失电子的氧化反应,为阳极,电极X为阴极,发生的电极反应式为。
(4)电极X为阴极,发生的电极反应式为,电极Y发生反应,转移相同电子时生成Mn2+比消耗的多,故电解过程中将增大。
19.3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) △H=﹣246.4kJ mol﹣1
【详解】①2H2(g)+CO(g) CH3OH(g) △H=﹣90.8kJ mol﹣1
②2CH3OH(g) CH3OCH3(g)+H2O(g) △H=﹣23.5kJ mol﹣1
③CO(g)+H2O(g) CO2(g)+H2(g) △H=﹣41.3kJ mol﹣1
利用盖斯定律,将①×2+②+③得:总合成反应的热化学方程式为3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) △H=﹣246.4kJ mol﹣1。答案为:3H2(g)+3CO(g) CH3OCH3(g)+CO2(g) △H=﹣246.4kJ mol﹣1。
20. 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ ClO3- 或 NaClO3 2/3或66.7% 2ClO2+2CN-=2CO2↑+2Cl-+N2↑
【详解】(1)根据题中反应原理,第一步反应的离子方程式为4Fe2++O2+4H+=4Fe3++2H2O,第二步是铁离子将二氧化硫氧化成硫酸根离子,反应的离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+;(2)①电解食盐水得到氯酸钠和氢气,阳极发生失去电子的氧化反应,则阳极反应产物是ClO3-;②NaClO3和HCl反应生成ClO2,根据电子得失守恒和原子守恒可知反应的化学方程式为2NaClO3+4HCl=2NaCl+2ClO2↑+Cl2↑+2H2O,因此二氧化氯发生器所产生的气体中二氧化氯的体积分数为2/3×100%=66.7%;③ClO2能将电镀废水中的CN-离子氧化成两种无毒气体,应为二氧化碳和氮气,自身被还原成Cl-,根据电子得失守恒、电荷守恒和原子守恒可知反应的离子方程式为 2ClO2+2CN-=2CO2↑+2Cl-+N2↑。
21. M 4OH--4e-===2H2O+O2↑ CH4-8e-+10OH-=CO32—+7H2O 0.224 0.1
【详解】试题分析:本题考查甲烷燃料电池电极反应式的书写,电解池电极材料的判断和电化学的有关计算。
(1)甲池的甲烷燃料电池中通入甲烷的Pt电极为负极,通入O2的Pt电极为正极;乙池中M与甲池中的负极相连,M为阴极,N为阳极;工作时M、N两个电极的质量都不减少,铁为活性电极,若铁为阳极,铁的质量应减少,铁只能为阴极,铁电极为乙池中的M;N为石墨电极,为阳极,电极反应式为4OH--4e-=O2↑+2H2O 。甲烷燃料电池中的电解质溶液为KOH溶液,在碱性条件下CH4被氧化成CO32-,通入甲烷的Pt电极的电极反应式为CH4-8e-+10OH-=CO32—+7H2O。
(2)n(Ag)==0.04mol,乙池中析出金属Ag的是阴极,电极反应式为Ag++e-=Ag,则电路中通过的电子物质的量为0.04mol,根据电子守恒,甲池中消耗氧气物质的量为0.04mol4=0.01mol,消耗氧气在标准状况下的体积为0.01mol22.4L/mol=0.224L。乙池中反应的离子方程式为4Ag++2H2O4Ag+4H++O2↑,则生成的H+物质的量为0.04mol,c(H+)=0.04mol0.4L=0.1mol/L。
【点睛】电化学的计算一般用电子守恒建立关系式。
22. Cu-2e-=Cu2+ 2Fe3++2e-=2Fe2+
【详解】(1)在 2Fe3++Cu=2Fe2++Cu2+反应中,铁元素的化合价降低被还原,铜元素的化合价升高被氧化,
①负极失去电子发生氧化反应,电极反应式是:Cu-2e-=Cu2+;
②正极得到电子发生还原反应,电极反应式是:2Fe3++2e-=2Fe2+;
(2)把2Fe3++Cu=2Fe2++Cu2+反应设计成原电池,铜棒做负极,碳棒做正极,电解质溶液是氯化铁溶液,
①不含盐桥时,装置图是;
②含盐桥,铜棒插入氯化铜溶液中,碳棒插入氯化铁溶液中,两个烧杯用盐桥连接,装置图是。
答案第1页,共2页
答案第1页,共2页
