第一章《有机化合物的结构特点与研究方法》练习题 (含解析)2023-2024学年下学期高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 第一章《有机化合物的结构特点与研究方法》练习题 (含解析)2023-2024学年下学期高二化学人教版(2019)选择性必修3 |  | |
| 格式 | docx | ||
| 文件大小 | 784.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-17 18:51:15 | ||
图片预览



文档简介
第一章《有机化合物的结构特点与研究方法》练习题
一、单选题
1.下列各组物质中,互为同分异构体的是
A.水与冰
B.红磷与白磷
C.与
D.与
2.维生素B5的结构如图所示,下列有关维生素B5的说法正确的是
A.分子内不存在手性碳原子
B.一定条件下能发生缩聚反应
C.不能使酸性KMnO4溶液褪色
D.分子内有5种官能团
3.某芳香烃的相对分子质量为106,分子的核磁共振氢谱有4组峰,其峰面积比为6∶2∶1∶1。该芳香烃是
A. B. C. D.
4.光刻胶树脂是芯片生产中必不可少的材料,如图所示的两种物质是用于生成某种光刻胶树脂X的两种单体,下列说法错误的是
A.单体①和单体②在碱性条件下均易水解
B.单体①饱和环上一氯代物有5种(不考虑立体异构)
C.可用溴的溶液鉴别单体①和单体②
D.树脂X是加聚产物
5.下列关于有机化合物的叙述正确的是
A.氟利昂-12的结构式为,该分子是平面型分子
B.苯与液溴混合后撤入铁粉发生了加成反应
C.分子式为C4H9Cl的同分异构体共有4种
D.1mol苹果酸(HOOCCHOHCH2COOH)可与3molNaHCO3发生反应
6.下列实验中,所采取方法错误的是
A.提纯苯甲酸:重结晶
B.分离正己烷(沸点69℃)和正庚烷(沸点98℃):蒸馏
C.鉴别乙醇和1-丁醇():质谱法
D.除去乙炔中的:溴水,洗气
7.下列说法错误的是( )
A.分子中没有手性碳原子
B.分子中σ键和π键的数目比为7:1
C.某元素气态基态原子的逐级电离能(kJ mol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+
D.反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(l) 中若有4 mol N﹣H键断裂,则形成的π键数目为3NA
8.已知:两种有机物A和B可以互溶,有关性质如下表:
相对密度(20 ℃) 熔点 沸点 溶解性
A 0.789 3 -117.3 ℃ 78.5 ℃ 与水以任意比混溶
B 0.713 7 -116.6 ℃ 34.5 ℃ 不溶于水
若要除去A中混有的少量B,应采用的方法是
A.蒸馏 B.萃取 C.重结晶 D.加水充分振荡,分液
9.下列实验中,所采取的分离方法与对应原理都正确的是
选项 目的 分离方法 原理
A 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 除去乙烷中的乙烯 洗气 乙烯能与酸性高锰酸钾反应
C 除去KNO3固体中混有的NaCl 重结晶 NaCl在水中的溶解度很大
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
A.A B.B C.C D.D
10.现有一物质的核磁共振氢谱如图所示,则可能是下列物质中的
A. B. C. D.
11.1861年德国人基尔霍夫(G.R Kirchhoff)和本生(R W Bunsen)研究锂云母的某谱时,发现在深红区有一新线,从而发现了铷元素,他们研究的某谱是
A.原子光谱 B.质谱 C.红外光谱 D.核磁共振谱
12.目前,人们在自然界中发现的物质和人工合成的物质已超过1亿种,其中绝大多数都是有机化合物,而且新的有机物仍在源源不断地被发现或被合成出来。下列有关碳元素形成的有机化合物种类繁多的原因叙述不正确的是
A.常温下碳原子的性质活泼,容易跟多种原子形成共价键
B.碳原子之间既可以形成稳定的单键,又可以形成双键和三键
C.碳原子可以跟碳原子或其他原子形成4根共价键
D.多个碳原子之间可以结合成碳链,也可以结合成碳环
13.下列各组中两个变化所发生的反应,属于同一类型的是
A.由乙烷制溴乙烷、由乙烯制溴乙烷
B.乙烯使溴水褪色、乙炔使酸性高锰酸钾溶液褪色
C.乙醛转化为乙酸、乙醛转化为乙醇
D.由乙醇制乙烯、由溴乙烷制乙烯
二、填空题
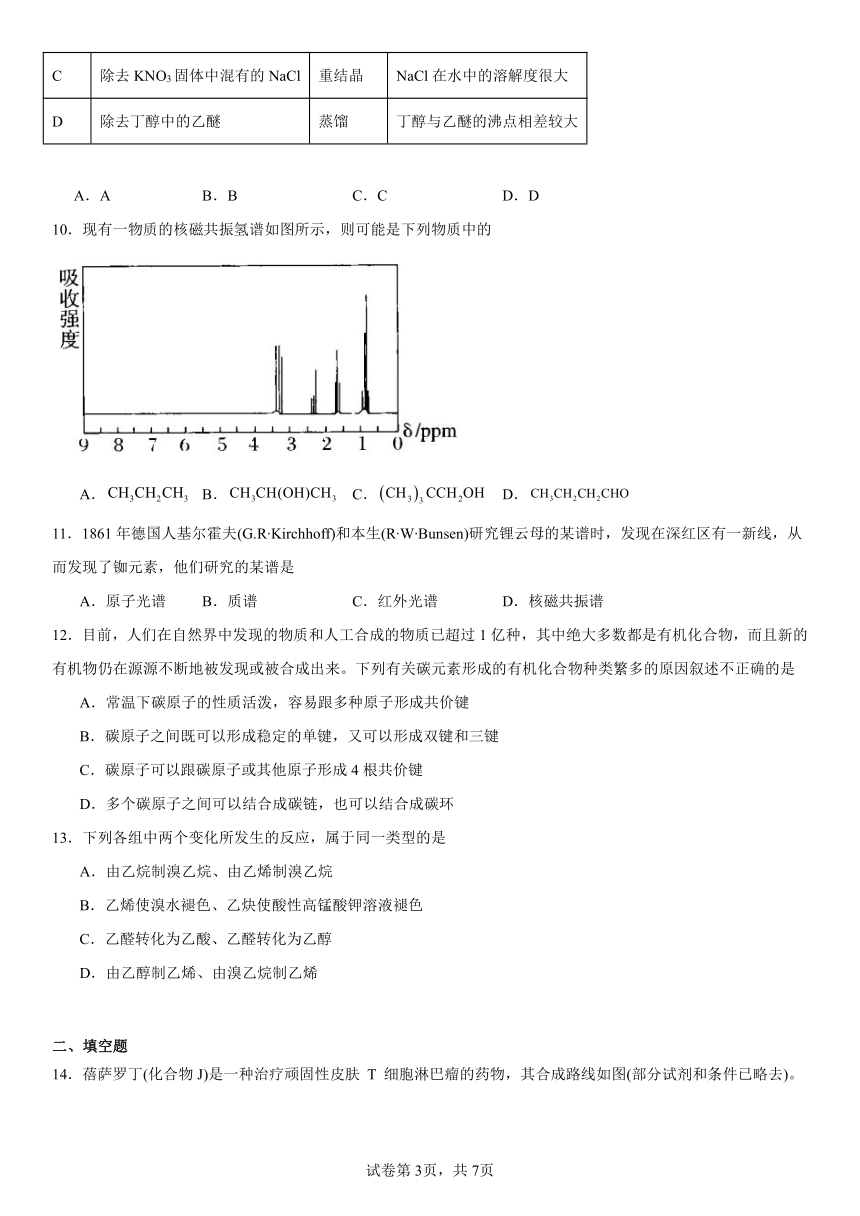
14.蓓萨罗丁(化合物J)是一种治疗顽固性皮肤 T 细胞淋巴瘤的药物,其合成路线如图(部分试剂和条件已略去)。
已知: RCOOH
试回答下列问题:
化合物 G 有多种同分异构体,符合下列条件的有 种,写出其中一种的 结构简式 。
①苯环三取代且氯原子与苯环直接相连 ②能发生银镜反应 ③能与 NaHCO3溶液反应
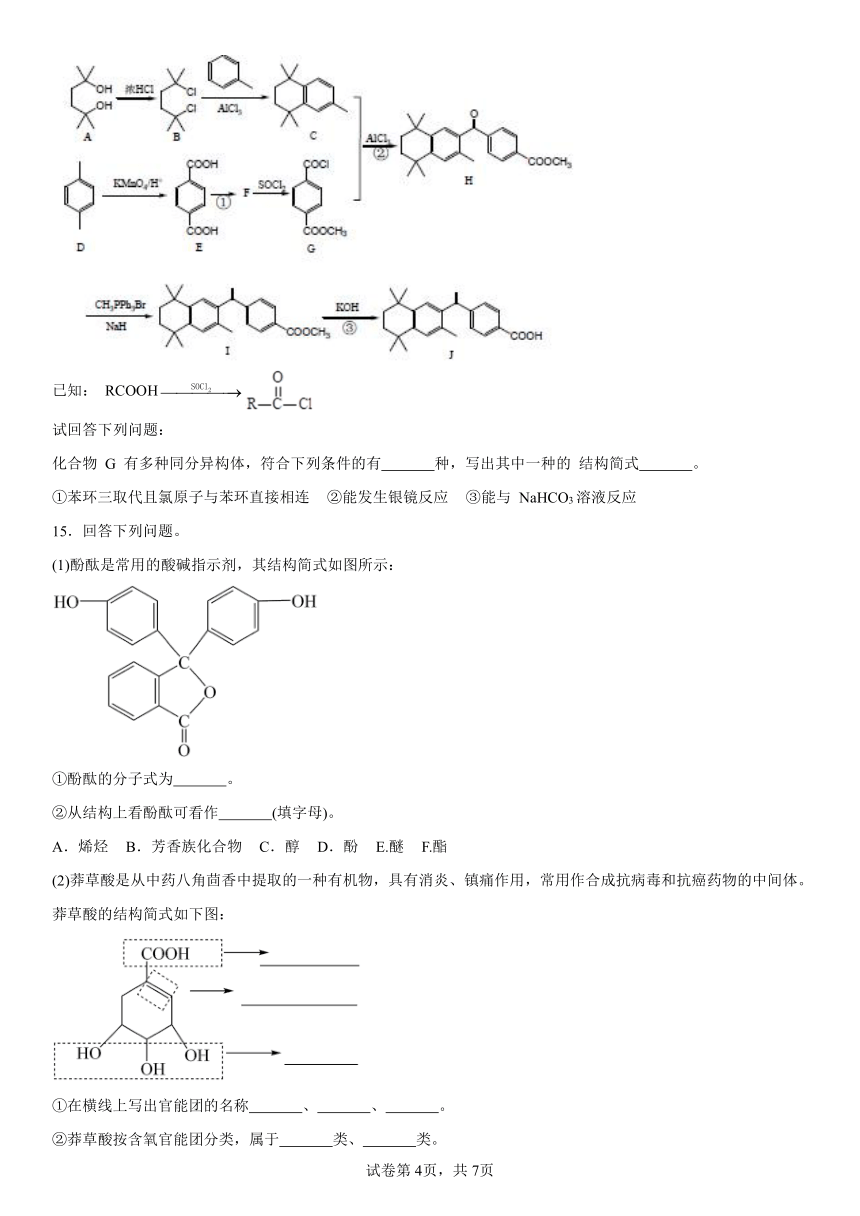
15.回答下列问题。
(1)酚酞是常用的酸碱指示剂,其结构简式如图所示:
①酚酞的分子式为 。
②从结构上看酚酞可看作 (填字母)。
A.烯烃 B.芳香族化合物 C.醇 D.酚 E.醚 F.酯
(2)莽草酸是从中药八角茴香中提取的一种有机物,具有消炎、镇痛作用,常用作合成抗病毒和抗癌药物的中间体。莽草酸的结构简式如下图:
①在横线上写出官能团的名称 、 、 。
②莽草酸按含氧官能团分类,属于 类、 类。
16.肉桂醛是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。工业上通过下列反应制备:
(1)肉桂醛所含官能团的名称是 。
(2)请写出两分子的乙醛在上述条件下反应的化学方程式: 。
(3)B有多种同分异构体,同时满足下列条件的同分异构体有 种。
①分子中不含羰基和羟基;②是苯的对二取代物;③除苯环外,不含其他环状结构。
(4)肉桂醛与新制Cu(OH)2反应的化学方程式是 。
17.将下列物质进行分类(填序号)。
①与②与③金刚石与石墨④冰与水⑤C(CH3)4与(CH3)2CHCH2CH3⑥与
(1)互为同位素的是 。
(2)互为同素异形体的是 。
(3)互为同分异构体的是 。
(4)属于同一化合物的是 。
18.质谱仪:
现代化学常利用质谱仪测定分子的 。
19.按要求回答下列问题:
(1)有机物X的分子式为,其红外光谱如图所示:
则该有机物可能的结构为_______(填字母)。
A. B.
C. D.
(2)有机物Y的结构可能有和两种,要用物理方法对其结构进行鉴定,可用 。
①有机物Y若为,则红外光谱能检测出有 (填官能团名称);核磁共振氢谱中应有 组峰。
②有机物Y若为,则红外光谱能检测出有 (填官能团名称);核磁共振氢谱中应有 组峰。
20.Ⅰ.有机物A由碳、氢、氧三种元素组成,现取3 g A与4.48 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸质量增加3.6 g,碱石灰质量增加4.4 g,则该有机物的分子式为 。
Ⅱ.有机物A的相对分子质量为74,其红外光谱图(示意图)如图,则该分子的结构简式为 ,按照官能团分类,该物质属于 。
Ⅲ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
实验 编号 HA的物质的量浓度(mol·L-1) NaOH的物质的量浓度(mol·L-1) 混合后溶液的pH
甲 0.1 0.1 pH=a
乙 0.12 0.1 pH=7
丙 0.2 0.1 pH>7
丁 0.1 0.1 pH=10
(1)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(2)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
(3)某二元酸(分子式用H2B表示)在水中的电离方程式是:
H2B===H++HB- HB-H++B2-
在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1 mol/L B.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(OH-)=c(H+)+c(HB-)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.水与冰属于同种物质,A项错误;
B.红磷与白磷是由磷元素组成的不同单质,二者互为同素异形体,B项错误;
C.与的分子结构和组成完全相同,属于同种物质,C项错误;
D.与的分子式相同,但结构不同,二者互为同分异构体,D项正确;
答案选D。
2.B
【详解】A.由结构简式可知,维生素B5分子中含有如图*所示的1个连有不同原子或原子团的手性碳原子:,A项错误;
B.由结构简式可知,维生素B5分子中含有羧基和羟基,一定条件下能发生缩聚反应生成高聚酯,B项正确;
C.由结构简式可知,维生素B5分子中与羟基相连的碳原子上连有氢原子,能与酸性高锰酸钾溶液发生氧化反应,使溶液褪色,C项错误;
D.由结构简式可知,维生素B5分子中含有羧基、亚氨基、羰基和羟基4种官能团,D项错误;
答案选B。
3.C
【分析】选项中的四种含苯环的有机物均只由碳和氢两种元素组成,属于芳香烃,相对分子质量均为106,核磁共振氢谱有4组峰,说明分子中有四种等效氢。同一个碳原子上的H等效,对称位置上的H等效。
【详解】A.乙苯有5种等效氢,故A不选;
B.邻二甲苯有3种等效氢,故B不选;
C.间二甲苯有4种等效氢,且等效氢的数目分别为6、2、1、1,即核磁共振氢谱图上4组峰的面积之比为6∶2∶1∶1,故C选;
D.对二甲苯有2种等效氢,故D不选;
故选C。
4.C
【详解】A.单体①和单体②均含有酯基,在碱性条件下易水解,A正确;
B.单体①饱和环上的等效氢为5种,可推知一氯代物有5种,B正确;
C.单体①和单体②均含有碳碳双键,都能使溴的溶液褪色,不能鉴别,C错误;
D.两种单体生成树脂X,即为加聚反应,可知树脂X为加聚产物,D正确;
故选C。
5.C
【详解】A.氟利昂-12中碳原子为饱和碳原子,该分子是四面体型分子,A项错误;
B.苯与液溴混合后撤入铁粉发生取代反应生成溴苯和溴化氢,B项错误;
C.C4H9—有CH3CH2CH2CH2—、CH3CH2CH(CH3)—、(CH3)2CHCH2—、(CH3)3C—,共4种结构,故分子式为C4H9Cl的同分异构体共有4种,C项正确;
D.1mol羧基能与1mol碳酸氢钠反应,醇羟基与碳酸氢钠不反应,故1mol苹果酸(HOOCCHOHCH2COOH)可与2molNaHCO3发生反应,D项错误;
答案选C。
6.D
【详解】A.提纯苯甲酸应用重结晶法,故A正确;
B.分离两种互溶液体应根据沸点差异采用蒸馏法分离,故B正确;
C.乙醇和1-丁醇摩尔质量不同,可通过质谱图鉴别,故C正确;
D.除去乙炔中的应用硫酸铜溶液洗气,乙炔也能被溴水吸收,故D错误;
故选:D。
7.B
【详解】A.手性碳原子应连接4个不同的原子或原子团,不存在手性碳原子,故A正确;
B.分子中σ键数目为18,π键的数目为2,分子中σ键和π键的数目比为9:1,故B错误;
C.该元素的第三电离能剧增,说明最外层有2个电子,为第ⅡA族元素,与氯气反应时易失去最外层2个电子,形成X2+离子,故C正确;
D.若该反应中有4 mol N-H键断裂,则生成1.5mol氮气,形成π键的数目是3NA,故D正确。
答案选B。
【点睛】注意分子中与N相连的两个C原子上连有H原子。
8.A
【详解】根据表格信息,互溶的两者有机物A和B沸点差异较大,且B的沸点低,可以采用蒸馏的方法除去A中混有的少量B,故答案选A。
9.D
【详解】A.乙醇易溶于水,溶液不分层,不能用乙醇萃取,一般用苯或四氯化碳进行萃取,故A错误;
B.乙烯会被酸性高锰酸钾氧化成二氧化碳,则引入杂质气体,不能分离,故B错误;
C.二者的溶解度随温度的变化不同,可用重结晶的方法分离,氯化钠的溶解度随温度的变化较小,故C错误;
D.二者沸点不同,且相差较大,则可用蒸馏的方法分离,故D正确。
故选:D。
10.D
【详解】通过核磁共振氢谱可以看出,该物质含有四种氢;
A.该物质含有两种H,A错误;
B.该物质含有三种H,B错误;
C.该物质含有三种H,C错误;
D.该物质含有四种H,D正确;
答案选D。
11.A
【详解】1861年德国人基尔霍夫(G.R Kirchhoff)和本生(R W Bunsen)研究锂云母的原子光谱时,发现在深红区有一新线,从而发现了铷元素,铷的发现,是用光谱分析法研究分析物质元素成分取得的第一个胜利,综上所述,答案选A。
12.A
【详解】A.碳原子最外层4个电子,常温下碳原子的性质不活泼,通常很难形成离子键,只有在一定条件下跟多种原子形成共价键,A错误;
B.碳原子最外层4个电子,碳原子之间既可以形成稳定的单键,又可以形成双键和三键,B正确;
C.碳原子最外层4个电子,碳原子可以跟碳原子或其他原子形成4根共价键而达到稳定结构,C正确;
D.碳原子可以形成4根共价键,多个碳原子之间可以结合成碳链,也可以结合成碳环,D正确;
答案选A。
13.D
【详解】A.由乙烷制溴乙烷属于取代反应、由乙烯制溴乙烷属于加成反应,故不选A;
B.乙烯使溴水褪色属于加成反应、乙炔使酸性高锰酸钾溶液褪色属于氧化反应,故不选B;
C.乙醛转化为乙酸属于氧化反应、乙醛转化为乙醇属于还原反应,故不选C;
D.由乙醇制乙烯、由溴乙烷制乙烯都属于消去反应,故选D;
选D。
14. 20 (或,取代基直接与苯环相连,位置多种)
【详解】由G的结构简式知,G的化学式为C9H7O3Cl,其同分异构体满足能发生银镜反应,说明含有-CHO,能与 NaHCO3溶液反应,说明含有-COOH,苯环三取代且氯原子与苯环直接相连,则当苯环上的取代基为-Cl、-COOH和-CH2CHO时,先把前二个取代基处于苯环的邻间对位,具体有:结构为、和,再把第三个取代基引入到苯环上:苯环上有4种氢原子,故-CH2CHO有4种不同位置,苯环上有4种氢原子,故-CH2CHO有4种不同位置,苯环上有2种氢原子,故-CH2CHO有2种不同位置,合计有10种同分异构体;同理,当苯环上的取代基为-Cl、- CH2COOH和-CHO时,又有10种同分异构体;故满足条件的有20种同分异构体;可任写1种,例如:、等等。
15.(1) BDF
(2) 羧基 碳碳双键 羟基 羧酸 醇
【详解】(1)①根据酚酞的结构简式可知,其分子式为:;
②从结构上看酚酞中含有苯环,故属于芳香族化合物,其中含有酚羟基,故属于酚类物质,其中含有酯基,故属于酯类物质,故选BDF;
(2)①根据莽草酸的结构简式可知其中含有的官能团分别为:羧基、碳碳双键、羟基;
②莽草酸中含有羧基,故属于羧酸;其中含有羟基,故属于醇。
16.(1)碳碳双键、醛基
(2)
(3)2
(4)
【分析】肉桂醛中含有碳碳双键和醛基,由苯甲醛和乙醛反应制得,两个醛基进行反应得到双键。
B的分子式为C8H8O,同分异构体中,是苯的二取代物则含有一个苯环,还剩下C3H4O;不含羰基与羟基,则可能含有醚键、碳碳三键。
【详解】(1)肉桂醛的结构简式 ,所含官能团的名称是碳碳双键和醛基。
(2)两分子的乙醛在上述条件下发生反应,可以看作先加成后消去,化学方程式为
(3)B为 其同分异构体同时满足下列条件:
①分子中不含羰基和羟基;②是苯的对二取代物;③除苯环外,不含其他环状结构,则其侧链含醚键、碳碳三键,同分异构体的结构简式为 、
(4)肉桂醛与新制Cu(OH)2反应生成 、Cu2O和水,化学方程式为
【点睛】同分异构体书写时,先摘出较为大的基团,如苯环等,再分析剩余基团的不饱和度确定剩余基团可能含有的官能团结构。不饱和度计算方法:假设有CxHy的有机物,则不饱和度为,双键的不饱和度为1、三键为2、环为1、苯环为4。
17.(1)①
(2)②;③
(3)⑤;⑥
(4)④
【详解】(1)质子数相同中子数不同的同一种元素的不同核素互为同位素,则互为同位素的是与,答案选①;
(2)由同一种元素形成的不同单质互为同素异形体,与是氧元素形成的不同单质,二者互为同素异形体,金刚石与石墨是碳元素形成的不同单质,二者互为同素异形体,答案选②③;
(3)分子式相同,结构不同的化合物互为同分异构体,C(CH3)4与(CH3)2CHCH2CH3分别是新戊烷和异戊烷,互为同分异构体,与的分子式也相同,结构不同,也互为同分异构体,答案选⑤⑥;
(4)结构和性质完全相同的是同一种物质,冰与水属于同一化合物,答案选④。
18.相对分子质量
【详解】现代化学常利用质谱仪测定分子的相对分子质量。
19.(1)AB
(2) 红外光谱法 羧基 2 酯基 2
【详解】(1)A、B项都有两个-CH3,且不对称,都含有C=O、C-O-C,所以A、B项符合图示;C项只有一个-CH3,不会出现不对称的现象;D项中没有C-O-C键,且-CH3为对称结构。
(2)常用的鉴定有机物结构式物理方法为红外光谱法;①中,红外光谱能检测出有羧基,化学键有O-H、C=O、C-O、C-C、C-H,所以共有5个振动吸收;分子中含有2种氢(-CH3、-OH),所以核磁共振氢谱中应有2个峰;②|中,红外光谱能检测出有酯基,化学键有C=O、C-O-C、C-H,所以共有3个振动吸收;分子中含有2种氢(-CH3、H-C=O ),所以核磁共振氢谱中应有2个峰。
20. C3H8O CH3CH2—O—CH2CH3 醚 c(Na+)>c(A-)>c(OH-)>c(H+) 10-4-10-10 A、C
【分析】Ⅰ.氧气的质量 = ×32 g/mol = 6.4 g,根据质量守恒确定一氧化碳的物质的量,再结合原子守恒确定C、H、O三种原子的物质的量之比;根据有机物中分子中C、H、O原子个数比确定该有机物中碳原子是否达到饱和状态来判断其分子式;
Ⅱ.该有机物的相对原子质量为74,红外光谱图显示存在对称的甲基、对称的亚甲基和醚键可得分子结构;
Ⅲ. (1)混合溶液的溶质为等物质的量的HA和NaA,pH>7则说明A-的水解大于HA的电离,结合电荷守恒判断;
(2)由电荷守恒关系式变形得c(Na+)-c(A-)=c(OH-)-c(H+);
(3)根据二元酸的电离方程式H2B═H++HB-,HB- H++B2-可知,B2-只发生第一步水解,结合电荷守恒和物料守恒分析解答。
【详解】Ⅰ. 氧气的质量= ×32 g/mol = 6.4 g,浓硫酸吸收的是水,水的物质的量= = 0.2 mol,碱石灰吸收的是二氧化碳,二氧化碳的物质的量 = = 0.1 mol,根据质量守恒知,一氧化碳的物质的量 = = 0.05 mol,
根据原子守恒得n(H) = 2n(H2O) = 0.4 mol,n(C) = n(CO2) + n(CO) = (0.1+0.05) mol = 0.15 mol,
则3 g A中,n(H) = 0.4 mol,n(C) = 0.15 mol,
n(O) = 2n(CO2) + n(CO) + n(H2O) 2n(O2) = 2×0.1 mol + 0.05 mol + 0.2 mol 2×0.2 mol = 0.05mol
则该有机物的分子中,C、H、O原子的物质的量之比n(C):n(H):n(O) = 0.15 mol :0.4 mol :0.05mol = 3:8:1,
又氢原子已使碳达饱和,所以该有机物的分子式为C3H8O,
故答案为C3H8O;
Ⅱ. 该有机物的相对原子质量为74,红外光谱图显示存在对称的甲基、对称的亚甲基和醚键,可得该分子的结构简式为:CH3CH2OCH2CH3,按照官能团分类,该物质属于醚,
故答案为CH3CH2OCH2CH3;醚;
Ⅲ. (1)混合溶液的溶质为等物质的量的HA和NaA,混合溶液的pH>7,说明A 的水解大于HA的电离,所以其离子浓度由大到小的顺序为c(Na+)>c(A-)>c(OH-)>c(H+),
故答案为c(Na+)>c(A-)>c(OH-)>c(H+);
(2)由电荷守恒关系式可知,c(Na+) + c(H+) = c(OH ) + c(A ),变形得c(Na+) c(A ) = c(OH ) c(H+) = (10 4 10 10) mol L 1,
故答案为10 4 10 10·;
(3)在Na2B中存在水解平衡:B2 +H2O HB +OH ,HB 不会进一步水解,
A. 由物料守恒得:c(B2 )+c(HB ) = 0.1 mol L 1,故A项正确;
B. HB 不会进一步水解,所以溶液中没有H2B分子,故B项错误;
C. 根据溶液中质子守恒得:c(OH )=c(H+)+c(HB ),故C项正确;
D. 溶液中电荷守恒为:c(Na+)+c(H+)=c(OH )+c(HB )+2c(B2 ),故D项错误;
故答案为A、C。
【点睛】Ⅲ.(3)是本题的难点,学生准确读取题设信息是解题的关键,根据溶液的三大守恒进行解题是基础。其中C选项的质子守恒规律可借助电荷守恒与物料守恒关系式间接求出。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列各组物质中,互为同分异构体的是
A.水与冰
B.红磷与白磷
C.与
D.与
2.维生素B5的结构如图所示,下列有关维生素B5的说法正确的是
A.分子内不存在手性碳原子
B.一定条件下能发生缩聚反应
C.不能使酸性KMnO4溶液褪色
D.分子内有5种官能团
3.某芳香烃的相对分子质量为106,分子的核磁共振氢谱有4组峰,其峰面积比为6∶2∶1∶1。该芳香烃是
A. B. C. D.
4.光刻胶树脂是芯片生产中必不可少的材料,如图所示的两种物质是用于生成某种光刻胶树脂X的两种单体,下列说法错误的是
A.单体①和单体②在碱性条件下均易水解
B.单体①饱和环上一氯代物有5种(不考虑立体异构)
C.可用溴的溶液鉴别单体①和单体②
D.树脂X是加聚产物
5.下列关于有机化合物的叙述正确的是
A.氟利昂-12的结构式为,该分子是平面型分子
B.苯与液溴混合后撤入铁粉发生了加成反应
C.分子式为C4H9Cl的同分异构体共有4种
D.1mol苹果酸(HOOCCHOHCH2COOH)可与3molNaHCO3发生反应
6.下列实验中,所采取方法错误的是
A.提纯苯甲酸:重结晶
B.分离正己烷(沸点69℃)和正庚烷(沸点98℃):蒸馏
C.鉴别乙醇和1-丁醇():质谱法
D.除去乙炔中的:溴水,洗气
7.下列说法错误的是( )
A.分子中没有手性碳原子
B.分子中σ键和π键的数目比为7:1
C.某元素气态基态原子的逐级电离能(kJ mol﹣1)分别为738、1451、7733、10540、13630、17995、21703,当它与氯气反应时可能生成的阳离子是X2+
D.反应N2O4(l)+2N2H4(l)═3N2(g)+4H2O(l) 中若有4 mol N﹣H键断裂,则形成的π键数目为3NA
8.已知:两种有机物A和B可以互溶,有关性质如下表:
相对密度(20 ℃) 熔点 沸点 溶解性
A 0.789 3 -117.3 ℃ 78.5 ℃ 与水以任意比混溶
B 0.713 7 -116.6 ℃ 34.5 ℃ 不溶于水
若要除去A中混有的少量B,应采用的方法是
A.蒸馏 B.萃取 C.重结晶 D.加水充分振荡,分液
9.下列实验中,所采取的分离方法与对应原理都正确的是
选项 目的 分离方法 原理
A 分离溶于水中的碘 乙醇萃取 碘在乙醇中的溶解度较大
B 除去乙烷中的乙烯 洗气 乙烯能与酸性高锰酸钾反应
C 除去KNO3固体中混有的NaCl 重结晶 NaCl在水中的溶解度很大
D 除去丁醇中的乙醚 蒸馏 丁醇与乙醚的沸点相差较大
A.A B.B C.C D.D
10.现有一物质的核磁共振氢谱如图所示,则可能是下列物质中的
A. B. C. D.
11.1861年德国人基尔霍夫(G.R Kirchhoff)和本生(R W Bunsen)研究锂云母的某谱时,发现在深红区有一新线,从而发现了铷元素,他们研究的某谱是
A.原子光谱 B.质谱 C.红外光谱 D.核磁共振谱
12.目前,人们在自然界中发现的物质和人工合成的物质已超过1亿种,其中绝大多数都是有机化合物,而且新的有机物仍在源源不断地被发现或被合成出来。下列有关碳元素形成的有机化合物种类繁多的原因叙述不正确的是
A.常温下碳原子的性质活泼,容易跟多种原子形成共价键
B.碳原子之间既可以形成稳定的单键,又可以形成双键和三键
C.碳原子可以跟碳原子或其他原子形成4根共价键
D.多个碳原子之间可以结合成碳链,也可以结合成碳环
13.下列各组中两个变化所发生的反应,属于同一类型的是
A.由乙烷制溴乙烷、由乙烯制溴乙烷
B.乙烯使溴水褪色、乙炔使酸性高锰酸钾溶液褪色
C.乙醛转化为乙酸、乙醛转化为乙醇
D.由乙醇制乙烯、由溴乙烷制乙烯
二、填空题
14.蓓萨罗丁(化合物J)是一种治疗顽固性皮肤 T 细胞淋巴瘤的药物,其合成路线如图(部分试剂和条件已略去)。
已知: RCOOH
试回答下列问题:
化合物 G 有多种同分异构体,符合下列条件的有 种,写出其中一种的 结构简式 。
①苯环三取代且氯原子与苯环直接相连 ②能发生银镜反应 ③能与 NaHCO3溶液反应
15.回答下列问题。
(1)酚酞是常用的酸碱指示剂,其结构简式如图所示:
①酚酞的分子式为 。
②从结构上看酚酞可看作 (填字母)。
A.烯烃 B.芳香族化合物 C.醇 D.酚 E.醚 F.酯
(2)莽草酸是从中药八角茴香中提取的一种有机物,具有消炎、镇痛作用,常用作合成抗病毒和抗癌药物的中间体。莽草酸的结构简式如下图:
①在横线上写出官能团的名称 、 、 。
②莽草酸按含氧官能团分类,属于 类、 类。
16.肉桂醛是一种食用香精,它广泛用于牙膏、洗涤剂、糖果以及调味品中。工业上通过下列反应制备:
(1)肉桂醛所含官能团的名称是 。
(2)请写出两分子的乙醛在上述条件下反应的化学方程式: 。
(3)B有多种同分异构体,同时满足下列条件的同分异构体有 种。
①分子中不含羰基和羟基;②是苯的对二取代物;③除苯环外,不含其他环状结构。
(4)肉桂醛与新制Cu(OH)2反应的化学方程式是 。
17.将下列物质进行分类(填序号)。
①与②与③金刚石与石墨④冰与水⑤C(CH3)4与(CH3)2CHCH2CH3⑥与
(1)互为同位素的是 。
(2)互为同素异形体的是 。
(3)互为同分异构体的是 。
(4)属于同一化合物的是 。
18.质谱仪:
现代化学常利用质谱仪测定分子的 。
19.按要求回答下列问题:
(1)有机物X的分子式为,其红外光谱如图所示:
则该有机物可能的结构为_______(填字母)。
A. B.
C. D.
(2)有机物Y的结构可能有和两种,要用物理方法对其结构进行鉴定,可用 。
①有机物Y若为,则红外光谱能检测出有 (填官能团名称);核磁共振氢谱中应有 组峰。
②有机物Y若为,则红外光谱能检测出有 (填官能团名称);核磁共振氢谱中应有 组峰。
20.Ⅰ.有机物A由碳、氢、氧三种元素组成,现取3 g A与4.48 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸质量增加3.6 g,碱石灰质量增加4.4 g,则该有机物的分子式为 。
Ⅱ.有机物A的相对分子质量为74,其红外光谱图(示意图)如图,则该分子的结构简式为 ,按照官能团分类,该物质属于 。
Ⅲ.常温下,将某一元酸HA(甲、乙、丙、丁代表不同的一元酸)和NaOH溶液等体积混合,两种溶液的物质的量浓度和混合溶液的pH如下表所示:
实验 编号 HA的物质的量浓度(mol·L-1) NaOH的物质的量浓度(mol·L-1) 混合后溶液的pH
甲 0.1 0.1 pH=a
乙 0.12 0.1 pH=7
丙 0.2 0.1 pH>7
丁 0.1 0.1 pH=10
(1)从丙组实验结果分析,该混合溶液中离子浓度由大到小的顺序是 。
(2)分析丁组实验数据,写出该混合溶液中下列算式的精确结果(列式):c(Na+)-c(A-)= mol/L。
(3)某二元酸(分子式用H2B表示)在水中的电离方程式是:
H2B===H++HB- HB-H++B2-
在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是 。
A.c(B2-)+c(HB-)=0.1 mol/L B.c(B2-)+c(HB-)+c(H2B)=0.1 mol/L
C.c(OH-)=c(H+)+c(HB-) D.c(Na+)+c(OH-)=c(H+)+c(HB-)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.D
【详解】A.水与冰属于同种物质,A项错误;
B.红磷与白磷是由磷元素组成的不同单质,二者互为同素异形体,B项错误;
C.与的分子结构和组成完全相同,属于同种物质,C项错误;
D.与的分子式相同,但结构不同,二者互为同分异构体,D项正确;
答案选D。
2.B
【详解】A.由结构简式可知,维生素B5分子中含有如图*所示的1个连有不同原子或原子团的手性碳原子:,A项错误;
B.由结构简式可知,维生素B5分子中含有羧基和羟基,一定条件下能发生缩聚反应生成高聚酯,B项正确;
C.由结构简式可知,维生素B5分子中与羟基相连的碳原子上连有氢原子,能与酸性高锰酸钾溶液发生氧化反应,使溶液褪色,C项错误;
D.由结构简式可知,维生素B5分子中含有羧基、亚氨基、羰基和羟基4种官能团,D项错误;
答案选B。
3.C
【分析】选项中的四种含苯环的有机物均只由碳和氢两种元素组成,属于芳香烃,相对分子质量均为106,核磁共振氢谱有4组峰,说明分子中有四种等效氢。同一个碳原子上的H等效,对称位置上的H等效。
【详解】A.乙苯有5种等效氢,故A不选;
B.邻二甲苯有3种等效氢,故B不选;
C.间二甲苯有4种等效氢,且等效氢的数目分别为6、2、1、1,即核磁共振氢谱图上4组峰的面积之比为6∶2∶1∶1,故C选;
D.对二甲苯有2种等效氢,故D不选;
故选C。
4.C
【详解】A.单体①和单体②均含有酯基,在碱性条件下易水解,A正确;
B.单体①饱和环上的等效氢为5种,可推知一氯代物有5种,B正确;
C.单体①和单体②均含有碳碳双键,都能使溴的溶液褪色,不能鉴别,C错误;
D.两种单体生成树脂X,即为加聚反应,可知树脂X为加聚产物,D正确;
故选C。
5.C
【详解】A.氟利昂-12中碳原子为饱和碳原子,该分子是四面体型分子,A项错误;
B.苯与液溴混合后撤入铁粉发生取代反应生成溴苯和溴化氢,B项错误;
C.C4H9—有CH3CH2CH2CH2—、CH3CH2CH(CH3)—、(CH3)2CHCH2—、(CH3)3C—,共4种结构,故分子式为C4H9Cl的同分异构体共有4种,C项正确;
D.1mol羧基能与1mol碳酸氢钠反应,醇羟基与碳酸氢钠不反应,故1mol苹果酸(HOOCCHOHCH2COOH)可与2molNaHCO3发生反应,D项错误;
答案选C。
6.D
【详解】A.提纯苯甲酸应用重结晶法,故A正确;
B.分离两种互溶液体应根据沸点差异采用蒸馏法分离,故B正确;
C.乙醇和1-丁醇摩尔质量不同,可通过质谱图鉴别,故C正确;
D.除去乙炔中的应用硫酸铜溶液洗气,乙炔也能被溴水吸收,故D错误;
故选:D。
7.B
【详解】A.手性碳原子应连接4个不同的原子或原子团,不存在手性碳原子,故A正确;
B.分子中σ键数目为18,π键的数目为2,分子中σ键和π键的数目比为9:1,故B错误;
C.该元素的第三电离能剧增,说明最外层有2个电子,为第ⅡA族元素,与氯气反应时易失去最外层2个电子,形成X2+离子,故C正确;
D.若该反应中有4 mol N-H键断裂,则生成1.5mol氮气,形成π键的数目是3NA,故D正确。
答案选B。
【点睛】注意分子中与N相连的两个C原子上连有H原子。
8.A
【详解】根据表格信息,互溶的两者有机物A和B沸点差异较大,且B的沸点低,可以采用蒸馏的方法除去A中混有的少量B,故答案选A。
9.D
【详解】A.乙醇易溶于水,溶液不分层,不能用乙醇萃取,一般用苯或四氯化碳进行萃取,故A错误;
B.乙烯会被酸性高锰酸钾氧化成二氧化碳,则引入杂质气体,不能分离,故B错误;
C.二者的溶解度随温度的变化不同,可用重结晶的方法分离,氯化钠的溶解度随温度的变化较小,故C错误;
D.二者沸点不同,且相差较大,则可用蒸馏的方法分离,故D正确。
故选:D。
10.D
【详解】通过核磁共振氢谱可以看出,该物质含有四种氢;
A.该物质含有两种H,A错误;
B.该物质含有三种H,B错误;
C.该物质含有三种H,C错误;
D.该物质含有四种H,D正确;
答案选D。
11.A
【详解】1861年德国人基尔霍夫(G.R Kirchhoff)和本生(R W Bunsen)研究锂云母的原子光谱时,发现在深红区有一新线,从而发现了铷元素,铷的发现,是用光谱分析法研究分析物质元素成分取得的第一个胜利,综上所述,答案选A。
12.A
【详解】A.碳原子最外层4个电子,常温下碳原子的性质不活泼,通常很难形成离子键,只有在一定条件下跟多种原子形成共价键,A错误;
B.碳原子最外层4个电子,碳原子之间既可以形成稳定的单键,又可以形成双键和三键,B正确;
C.碳原子最外层4个电子,碳原子可以跟碳原子或其他原子形成4根共价键而达到稳定结构,C正确;
D.碳原子可以形成4根共价键,多个碳原子之间可以结合成碳链,也可以结合成碳环,D正确;
答案选A。
13.D
【详解】A.由乙烷制溴乙烷属于取代反应、由乙烯制溴乙烷属于加成反应,故不选A;
B.乙烯使溴水褪色属于加成反应、乙炔使酸性高锰酸钾溶液褪色属于氧化反应,故不选B;
C.乙醛转化为乙酸属于氧化反应、乙醛转化为乙醇属于还原反应,故不选C;
D.由乙醇制乙烯、由溴乙烷制乙烯都属于消去反应,故选D;
选D。
14. 20 (或,取代基直接与苯环相连,位置多种)
【详解】由G的结构简式知,G的化学式为C9H7O3Cl,其同分异构体满足能发生银镜反应,说明含有-CHO,能与 NaHCO3溶液反应,说明含有-COOH,苯环三取代且氯原子与苯环直接相连,则当苯环上的取代基为-Cl、-COOH和-CH2CHO时,先把前二个取代基处于苯环的邻间对位,具体有:结构为、和,再把第三个取代基引入到苯环上:苯环上有4种氢原子,故-CH2CHO有4种不同位置,苯环上有4种氢原子,故-CH2CHO有4种不同位置,苯环上有2种氢原子,故-CH2CHO有2种不同位置,合计有10种同分异构体;同理,当苯环上的取代基为-Cl、- CH2COOH和-CHO时,又有10种同分异构体;故满足条件的有20种同分异构体;可任写1种,例如:、等等。
15.(1) BDF
(2) 羧基 碳碳双键 羟基 羧酸 醇
【详解】(1)①根据酚酞的结构简式可知,其分子式为:;
②从结构上看酚酞中含有苯环,故属于芳香族化合物,其中含有酚羟基,故属于酚类物质,其中含有酯基,故属于酯类物质,故选BDF;
(2)①根据莽草酸的结构简式可知其中含有的官能团分别为:羧基、碳碳双键、羟基;
②莽草酸中含有羧基,故属于羧酸;其中含有羟基,故属于醇。
16.(1)碳碳双键、醛基
(2)
(3)2
(4)
【分析】肉桂醛中含有碳碳双键和醛基,由苯甲醛和乙醛反应制得,两个醛基进行反应得到双键。
B的分子式为C8H8O,同分异构体中,是苯的二取代物则含有一个苯环,还剩下C3H4O;不含羰基与羟基,则可能含有醚键、碳碳三键。
【详解】(1)肉桂醛的结构简式 ,所含官能团的名称是碳碳双键和醛基。
(2)两分子的乙醛在上述条件下发生反应,可以看作先加成后消去,化学方程式为
(3)B为 其同分异构体同时满足下列条件:
①分子中不含羰基和羟基;②是苯的对二取代物;③除苯环外,不含其他环状结构,则其侧链含醚键、碳碳三键,同分异构体的结构简式为 、
(4)肉桂醛与新制Cu(OH)2反应生成 、Cu2O和水,化学方程式为
【点睛】同分异构体书写时,先摘出较为大的基团,如苯环等,再分析剩余基团的不饱和度确定剩余基团可能含有的官能团结构。不饱和度计算方法:假设有CxHy的有机物,则不饱和度为,双键的不饱和度为1、三键为2、环为1、苯环为4。
17.(1)①
(2)②;③
(3)⑤;⑥
(4)④
【详解】(1)质子数相同中子数不同的同一种元素的不同核素互为同位素,则互为同位素的是与,答案选①;
(2)由同一种元素形成的不同单质互为同素异形体,与是氧元素形成的不同单质,二者互为同素异形体,金刚石与石墨是碳元素形成的不同单质,二者互为同素异形体,答案选②③;
(3)分子式相同,结构不同的化合物互为同分异构体,C(CH3)4与(CH3)2CHCH2CH3分别是新戊烷和异戊烷,互为同分异构体,与的分子式也相同,结构不同,也互为同分异构体,答案选⑤⑥;
(4)结构和性质完全相同的是同一种物质,冰与水属于同一化合物,答案选④。
18.相对分子质量
【详解】现代化学常利用质谱仪测定分子的相对分子质量。
19.(1)AB
(2) 红外光谱法 羧基 2 酯基 2
【详解】(1)A、B项都有两个-CH3,且不对称,都含有C=O、C-O-C,所以A、B项符合图示;C项只有一个-CH3,不会出现不对称的现象;D项中没有C-O-C键,且-CH3为对称结构。
(2)常用的鉴定有机物结构式物理方法为红外光谱法;①中,红外光谱能检测出有羧基,化学键有O-H、C=O、C-O、C-C、C-H,所以共有5个振动吸收;分子中含有2种氢(-CH3、-OH),所以核磁共振氢谱中应有2个峰;②|中,红外光谱能检测出有酯基,化学键有C=O、C-O-C、C-H,所以共有3个振动吸收;分子中含有2种氢(-CH3、H-C=O ),所以核磁共振氢谱中应有2个峰。
20. C3H8O CH3CH2—O—CH2CH3 醚 c(Na+)>c(A-)>c(OH-)>c(H+) 10-4-10-10 A、C
【分析】Ⅰ.氧气的质量 = ×32 g/mol = 6.4 g,根据质量守恒确定一氧化碳的物质的量,再结合原子守恒确定C、H、O三种原子的物质的量之比;根据有机物中分子中C、H、O原子个数比确定该有机物中碳原子是否达到饱和状态来判断其分子式;
Ⅱ.该有机物的相对原子质量为74,红外光谱图显示存在对称的甲基、对称的亚甲基和醚键可得分子结构;
Ⅲ. (1)混合溶液的溶质为等物质的量的HA和NaA,pH>7则说明A-的水解大于HA的电离,结合电荷守恒判断;
(2)由电荷守恒关系式变形得c(Na+)-c(A-)=c(OH-)-c(H+);
(3)根据二元酸的电离方程式H2B═H++HB-,HB- H++B2-可知,B2-只发生第一步水解,结合电荷守恒和物料守恒分析解答。
【详解】Ⅰ. 氧气的质量= ×32 g/mol = 6.4 g,浓硫酸吸收的是水,水的物质的量= = 0.2 mol,碱石灰吸收的是二氧化碳,二氧化碳的物质的量 = = 0.1 mol,根据质量守恒知,一氧化碳的物质的量 = = 0.05 mol,
根据原子守恒得n(H) = 2n(H2O) = 0.4 mol,n(C) = n(CO2) + n(CO) = (0.1+0.05) mol = 0.15 mol,
则3 g A中,n(H) = 0.4 mol,n(C) = 0.15 mol,
n(O) = 2n(CO2) + n(CO) + n(H2O) 2n(O2) = 2×0.1 mol + 0.05 mol + 0.2 mol 2×0.2 mol = 0.05mol
则该有机物的分子中,C、H、O原子的物质的量之比n(C):n(H):n(O) = 0.15 mol :0.4 mol :0.05mol = 3:8:1,
又氢原子已使碳达饱和,所以该有机物的分子式为C3H8O,
故答案为C3H8O;
Ⅱ. 该有机物的相对原子质量为74,红外光谱图显示存在对称的甲基、对称的亚甲基和醚键,可得该分子的结构简式为:CH3CH2OCH2CH3,按照官能团分类,该物质属于醚,
故答案为CH3CH2OCH2CH3;醚;
Ⅲ. (1)混合溶液的溶质为等物质的量的HA和NaA,混合溶液的pH>7,说明A 的水解大于HA的电离,所以其离子浓度由大到小的顺序为c(Na+)>c(A-)>c(OH-)>c(H+),
故答案为c(Na+)>c(A-)>c(OH-)>c(H+);
(2)由电荷守恒关系式可知,c(Na+) + c(H+) = c(OH ) + c(A ),变形得c(Na+) c(A ) = c(OH ) c(H+) = (10 4 10 10) mol L 1,
故答案为10 4 10 10·;
(3)在Na2B中存在水解平衡:B2 +H2O HB +OH ,HB 不会进一步水解,
A. 由物料守恒得:c(B2 )+c(HB ) = 0.1 mol L 1,故A项正确;
B. HB 不会进一步水解,所以溶液中没有H2B分子,故B项错误;
C. 根据溶液中质子守恒得:c(OH )=c(H+)+c(HB ),故C项正确;
D. 溶液中电荷守恒为:c(Na+)+c(H+)=c(OH )+c(HB )+2c(B2 ),故D项错误;
故答案为A、C。
【点睛】Ⅲ.(3)是本题的难点,学生准确读取题设信息是解题的关键,根据溶液的三大守恒进行解题是基础。其中C选项的质子守恒规律可借助电荷守恒与物料守恒关系式间接求出。
答案第1页,共2页
答案第1页,共2页
