第一章:化学反应与能量转化(含解析)同步习题2023---2024学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第一章:化学反应与能量转化(含解析)同步习题2023---2024学年上学期高二化学鲁科版(2019)选择性必修1 | 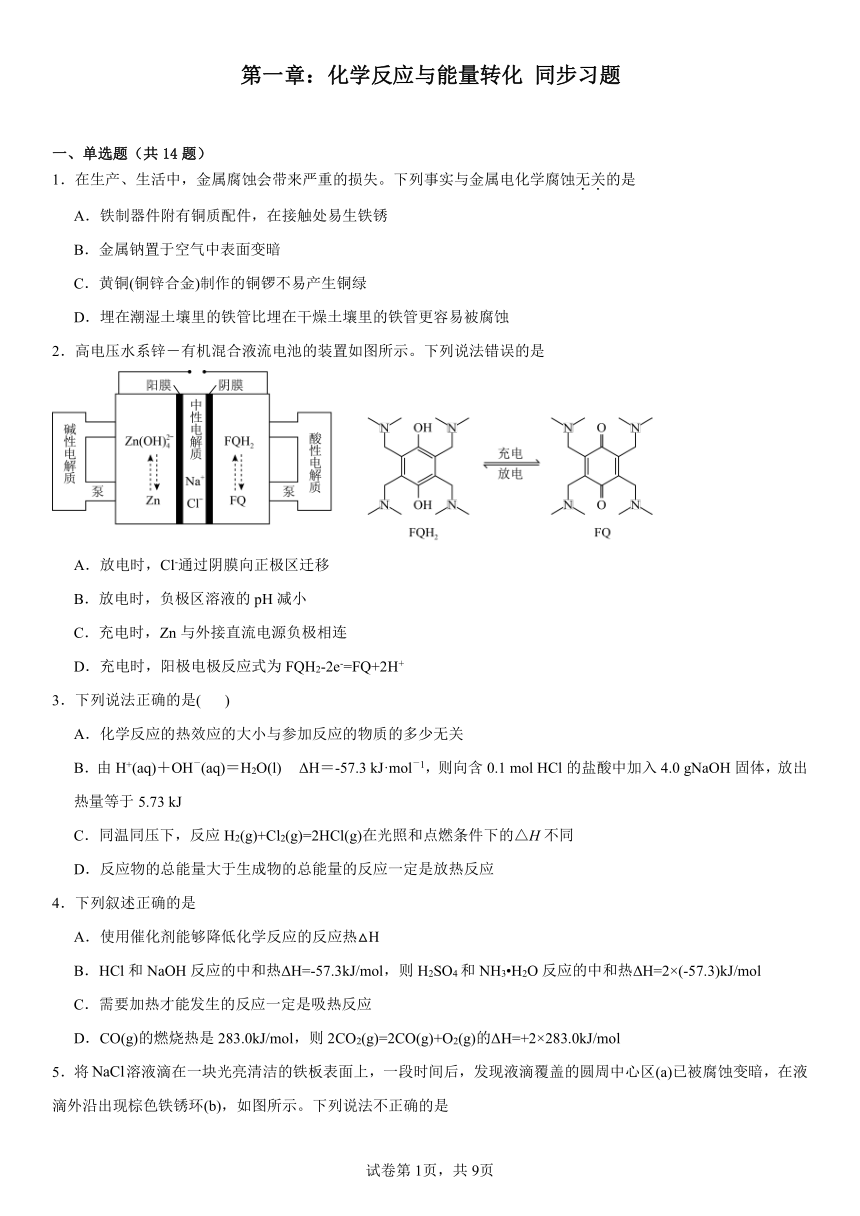 | |
| 格式 | docx | ||
| 文件大小 | 889.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-17 19:08:57 | ||
图片预览




文档简介
第一章:化学反应与能量转化 同步习题
一、单选题(共14题)
1.在生产、生活中,金属腐蚀会带来严重的损失。下列事实与金属电化学腐蚀无关的是
A.铁制器件附有铜质配件,在接触处易生铁锈
B.金属钠置于空气中表面变暗
C.黄铜(铜锌合金)制作的铜锣不易产生铜绿
D.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更容易被腐蚀
2.高电压水系锌-有机混合液流电池的装置如图所示。下列说法错误的是
A.放电时,Cl-通过阴膜向正极区迁移
B.放电时,负极区溶液的pH减小
C.充电时,Zn与外接直流电源负极相连
D.充电时,阳极电极反应式为FQH2-2e-=FQ+2H+
3.下列说法正确的是( )
A.化学反应的热效应的大小与参加反应的物质的多少无关
B.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D.反应物的总能量大于生成物的总能量的反应一定是放热反应
4.下列叙述正确的是
A.使用催化剂能够降低化学反应的反应热△H
B.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和NH3 H2O反应的中和热ΔH=2×(-57.3)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的ΔH=+2×283.0kJ/mol
5.将溶液滴在一块光亮清洁的铁板表面上,一段时间后,发现液滴覆盖的圆周中心区(a)已被腐蚀变暗,在液滴外沿出现棕色铁锈环(b),如图所示。下列说法不正确的是
A.铁锈环的主要成分是,铁片腐蚀过程发生的总反应为
B.液滴之下氧气含量少,铁片作负极,发生的还原反应为
C.液滴边缘是正极区,发生的电极反应为
D.铁片腐蚀最严重的区域不是生锈最多的区域
6.高氯酸铵(NH4ClO4)可用作火箭推进剂,某种制备NH4ClO4的工艺流程如图(相关物质的溶解度如图)。下列说法错误的是
A.电解I中发生反应的离子方程式:Cl-+3H2OClO+3H2↑
B.操作是加热蒸发、趁热过滤
C.洗涤粗产品宜使用冷水
D.流程中可循环利用的物质是NaCl
7.以为催化材料,利用电化学原理实现消除酸性废水中的,其反应过程如图所示。已知中Fe元素化合价为+2、+3价,分别表示为Fe(I)、Fe(Ⅲ)。下列说法错误的是
A.Pd上发生的电极反应为
B.Fe(II)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C.处理的电极反应为
D.反应过程中与的物质的量比为2:3
8.偏钨酸铵是制备金属钨、合金钢以及陶瓷工业的重要原料。采用如下电化学装置可制备偏钨酸铵,双极膜中间层中的水解离为H+和OH-,并在直流电场作用下分别向两极迁移,下列说法正确的是
A.a膜为阴离子交换膜
B.阳极电极反应为
C.双极膜中间层中的OH-向右侧迁移进入产品室
D.当电路中通过时,双极膜中解离水的质量为2.0g
9.研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。质子交换膜只允许H+自由通过,下列说法错误的是
A.电子由Pt电极流向C电极
B.电池工作时正极区溶液的降低
C.常温常压下,被还原同时有被氧化
D.负极反应为
10.铜—锌原电池装置如图所示,电解质溶液为硫酸铜溶液,电池工作一段时间后,下列说法错误的是
A.锌电极上的反应为Zn-2e-=Zn2+
B.溶液中的SO向锌电极移动
C.电子从锌电极经过硫酸铜溶液流向铜电极
D.铜电极质量增加
11.我国航天近年来成就斐然,卫星发射任务不断增多。下列有关说法正确的是
A.某运载火箭利用液氧和煤油为燃料,煤油为纯净物
B.火箭中的燃料燃烧时将化学能转化为热能
C.火箭箭体采用铝合金是为了美观耐用
D.卫星计算机芯片使用高纯度的二氧化硅
12.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应为
B.酸性氢氧燃料电池的正极电极反应为
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为
D.钢铁发生吸氧腐蚀时,铁作负极被氧化:
13.利用反应 ,可回收处理石油化工行业废气中的硫化氢。T℃时,该反应在密闭容器中进行,下列说法正确的是
A.平衡后,通入,减小
B.上述条件下,可实现100%分解
C.平衡态是该条件下分解的最大程度
D.生成的质量不变时,反应停止
14.一种双阴极微生物燃料电池装置如图所示,电解质溶液呈酸性,该装置可以同时进行硝化和反硝化脱氮,下列叙述错误的是
A.电池工作时,的迁移方向为“厌氧阳极”→“缺氧阴极”和“厌氧阳极”→“好氧阴极”
B.电池工作时,“缺氧阴极”电极附近的溶液pH增大
C.“好氧阴极”存在反应:
D.“厌氧阳极”区质量减少28.8g时,该电极输出电子2.4mol
二、填空题(共9题)
15.某课外活动小组进行电解饱和食盐水的实验(如图)。请回答下列问题。
(1)通电一段时间后,可观察到 电极(填“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为 。
(2)该溶液电解反应的化学方程式为 。
(3)若开始时改用银棒做阳极,阳极的电极反应式为 。
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电。则a极的电极反应式为 。
16.如图是一套电化学实验装置,图中C、D均为铂电极,G是灵敏电流计,其指针总是偏向电源正极。回答下列问题:
(1)向烧杯B中加入适量较浓的硫酸,发现G的指针向右偏移。则电极C是原电池的 (填“正极”或“负极”),电极C上的电极反应式为 ,烧杯A中的主要实验现象是 。
(2)一段时间后,再向烧杯B中加入适量质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移。此时整套实验装置总反应的离子方程式为,此时电极D为 (填“正极”或“负极”),其电极反应方程式为 。
(3)再过一段时间后,实验装置中的化学反应已经达到化学平衡状态,则此时G的指针指向 (填“右边”“左边”或“0刻度”),理由是 。
17.Ⅰ.如下图为相互串联的甲、乙两个电解池(电极都是惰性电极),
请回答:
(1)写出甲电解池中的电解反应方程式:甲 。
(2)若甲槽阴极增重12.8 g,则乙槽阳极放出气体在标准状况下的体积为 。
(3)若乙槽剩余液体为400 mL,则电解后得到碱液的物质的量浓度为 。
Ⅱ.将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
金属 电流方向 电压/V
A Cu→A +0.78
B B→Cu -0.15
C Cu→C +1.35
D Cu→D +0.30
已知:构成两电极的金属其活动性相差越大,电压表读数越大。请依据表中数据判断:
(1) 金属可能是最强的还原剂。(填字母)
(2) 金属一定不能从硫酸铜溶液中置换出铜。(填字母)
(3)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是 (填字母)。金属对应的原电池的正极电极反应式为 。
18.Ⅰ.已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) △H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) △H=+483.6kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是 (填写序号)。
(2)燃烧10gH2生成液态水,放出的热量为 。
(3)已知:1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应,写出该中和热的热化学方程式为 。
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1 ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
(4)反应器中的总反应可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),计算该反应的ΔH= 。
19.金属由于其优良的物理化学性能,在工农业生产以及国防中被大量使用。钢铁是应用最广的金属材料,但是钢铁材料的腐蚀也使我们损失惨重,因此对其进行防护是十分必要的。防止或减少钢铁的腐蚀有多种方法,如制成耐腐蚀合金,表面“烤蓝”,电镀另一种金属以及电化学保护等方法。
(1)钢铁的腐蚀主要是吸氧腐蚀,请写出钢铁吸氧腐蚀的电极反应:负极的电极反应式为 ,正极的电极反应式为 。
(2)合金的性能多种多样,人们根据需要生产出种类繁多的合金材料。请回答
①作为建筑材料的铝合金的特性有 (至少回答两点)。
②由于摄入较多的Al对人的健康有害,所以现在不主张使用铝制炊具。你认为生产炊具的材料最好是 ,理由是 。
(3)钢铁表面常电镀一层Cr达到防腐蚀的目的,这是由于Cr具有优良的抗腐蚀性能。请回答:
电镀过程中,阴极是 ,电解质中一定含有 ,阳极材料是 ;电镀Cr时,不能使用或作为镀液,请说明原因: 。
20.已知H—H键、N≡N键、N—H键键能如下表所示:
化学键 H—H N≡N N—H
键能/kJ·mol-1 436 946 391
则在一定条件下进行反应N2(g)+3H2(g)=2NH3(g),生成1 mol NH3时的反应热Q= 。
21.现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式 。
(2)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为: 。
(3)用电子式表示化合物D2C的形成过程 。
(4)某原电池中,电解质为KOH溶液,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应: ;负极反应: ;
22.一个完整的氧化还原反应方程式可以拆分,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu=2Fe2++Cu2+,可以写成:氧化反应 Cu-2e-=Cu2+;还原反应 2Fe3++2e—=2Fe2+(或Fe3++e-=Fe2+)。
(1)根据以上信息将反应3NO2+H2O=2H++2+NO拆分成两个“半反应式”:氧化反应式 ;还原反应式 。
(2)已知某一反应的“半反应式”为CH4+10OH--8e-=+7H2O;O2+2H2O+4e-=4OH-,则总反应式为 。
23.如图所示,U形管内盛有100 mL 的溶液,按要求回答下列问题:
(1)打开K2,闭合K1,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液,则B极的电极反应式为 。
(2)打开K1,闭合K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是 ,Na+移向 极(填A、B);总反应化学方程式是 。
(3)如果要用电解的方法精炼粗铜,打开K1,闭合K2,电解液选用CuSO4溶液,则A电极的材料应换成是 (填“粗铜”或“纯铜”),反应一段时间后电解质溶液中Cu2+的浓度将会 (填“增大”、“减小”、“不变”)。
24.(1)已知某反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,回答问题。
该反应是 (填“吸热”或“放热”)反应,该反应的ΔH= kJ· mol-1(用含E1、E2的代数式表示)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l) =H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式 。
(3)已知:H2(g)+Cl2(g)==2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为 kJ。
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.铁和铜接触处和电解质溶液会形成原电池反应,铁做负极发生氧化反应被腐蚀,A不符合;
B.金属钠暴露在空气中表面变暗是因为钠被氧化生成了氧化钠,属于化学变化,与金属电化学腐蚀无关,B符合题意;
C.铜锌合金在电解质溶液中形成原电池反应,锌做负极被腐蚀.正极被保护,所以不易形成铜绿,和电化学有关,C不符合;
D.埋在潮湿土壤里的铁管由于潮湿土壤中的电解质更容易导电,发生电化学反应,故比埋在干燥土壤里的铁管更容易被腐蚀,D不符合;
故选B。
2.A
【详解】A.原电池中阴离子向负极移动,故放电时,Cl-不会向正极区迁移,A错误;
B.放电时,负极区锌失去电子发生氧化反应,,溶液氢氧根离子浓度减小,pH减小,B正确;
C.充电时,Zn做阴极,与外接直流电源负极相连,C正确;
D.充电时,阳极的FQH2失去电子反应氧化反应,电极反应式为FQH2-2e-=FQ+2H+,D正确;
故选A。
3.D
【详解】A.化学反应的热效应的大小与物质的量有关,不同量的物质,反应热量变化不同,A错误;
B.NaOH固体溶解也会放热,因此向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量大于5.73 kJ,B错误;
C.△H=生成物的总能量-反应物的总能量,与反应条件无关,同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同,C错误;
D.△H=生成物的总能量-反应物的总能量,反应物的总能量大于生成物的总能量的反应,△H<0,是放热反应,D正确;
答案选D。
4.D
【详解】A. 使用催化剂只能降低反应的活化能,不能改变反应的△H,A错误;
B.中和热是指强酸强碱稀溶液反应生成1mol水释放的能量,故其数值不会发生变化,B错误;
C.有些放热反应也需要加热,C错误;
D. CO的燃烧热是指1molCO完全燃烧生成二氧化碳时放出的能量,该反应的逆反应该好就是CO完全燃烧的反应,故该反应为吸热反应,吸收的热量数值为CO燃烧热的两倍,D正确;
故选D。
5.B
【详解】A.两极生成的和相互吸引,发生迁移接触后生成,继而发生反应和,则铁锈环的主要成分是;铁片腐蚀过程发生的总反应为,A正确;
B.铁片作负极,发生氧化反应,电极反应为,B错误;
C.溶液覆盖的铁片主要发生吸氧腐蚀,正极区在液滴边缘得到电子被还原:,C正确;
D.铁片腐蚀最严重的区域不是生锈最多的区域,而是液滴覆盖的圆周中心区,D正确;
故选B。
6.B
【分析】制备NH4ClO4的工艺流程为:电解饱和食盐水得到NaClO3,然后通过电解NaClO3溶液,阳极附近失电子发生氧化反应生成,阴极附近H+得到电子发生还原反应生成氢气;除杂时发生的反应为2NaClO3+2HCl+H2O2═2ClO2↑+2NaCl+2H2O+O2↑,“除杂”的目的是除去少量未被电解的NaClO3;“反应”时用NaClO4和NH4Cl在90℃制备NH4ClO4粗品,据此分析解题。
【详解】A.由分析可知,电解I中发生反应的离子方程式:Cl-+3H2OClO+3H2↑,A正确;
B.由分析可知,操作是分离NH4ClO4和NaCl,结合题干溶解度曲线图可知,NH4ClO4的溶解度随温度变化明显,而NaCl的溶解度随温度变化不明显,则操作是加热蒸发,冷却结晶,过滤洗涤、干燥,B错误;
C.题干溶解度曲线图可知,NH4ClO4的溶解度随温度变化明显,为减少NH4ClO4因溶解损失,则洗涤粗产品宜使用冷水,C正确;
D.由分析可知,流程中经操作分离出来的滤液中含有NaCl,可循环利用,D正确;
故答案为:B。
7.C
【解析】根据图示可知,Fe3O4/Pd为催化材料,H2消除酸性废水中的致癌物NO的总反应为:2H++2NO+3H2 N2+4H2O,该反应中N元素化合价降低被还原,H元素化合价升高被氧化,氢气为还原剂,NO为氧化剂,据此解答。
【详解】A.由图可知Pd上氢气得电子生成氢离子,所以电极反应为:,故A正确;
B.H2消除酸性废水中的致癌物NO的总反应为:2H++2NO+3H2 N2+4H2O
,Fe(II)与Fe(III)的相互转化起到了传递电子的作用,故B正确;
C.过程①中NO的+3价N元素变为0价,化合价降低被还原,电极反应为2NO+8H++6e ═N2↑+4H2O,故C错误;
D.由总反应方程式可知,反应过程中与的物质的量比等于化学计量数之比,为2:3,故D正确;
故选:C。
8.B
【分析】由图可知,左侧石墨电极为电解池的阳极,一水合氨在阳极失去电子发生氧化反应生成铵根离子、氧气和水,碱室中碳酸氢根离子通过阴膜加入阳极室,双极膜中间层中的氢氧根离子进入碱室、氢离子加入产品室,产品室中氢离子与溶液中铵根离子、钨酸根离子反应生成偏钨酸铵,过量的铵根离子通过阳膜进入阴极室,右侧电极为阴极,水在阴极得到电子发生还原反应生成氢气和氢氧根离子,铵根离子与氢氧根离子反应生成一水合氨。
【详解】A.由分析可知,a膜为阳离子交换膜,故A错误;
B.由分析可知,左侧石墨电极为电解池的阳极,一水合氨在阳极失去电子发生氧化反应生成铵根离子、氧气和水,电极反应式为,故B正确;
C.由分析可知,双极膜中间层中的氢氧根离子进入碱室、氢离子加入产品室,故C错误;
D.当电路中通过0.1mol电子时,双极膜中有0.1mol氢氧根离子进入碱室,则双极膜中解离水的质量为0.1mol×18g/mol=1.8g,故D错误;
故选B。
9.B
【详解】A.Pt电极甲醇发生氧化反应生成二氧化碳,Pt电极是负极、C电极是正极,外电路中电子由Pt电极流向C电极,故A正确;
B.电池工作时,正极区总反应为氧气得电子生成水,酸溶液浓度减小,溶液的升高,故B错误;
C.电池工作时,总反应为CH3CH2OH+3O2=2CO2+3H2O,常温常压下,3mol氧气被还原同时有1mol乙醇被氧化,故C正确;
D.负极乙醇失电子发生氧化反应生成二氧化碳和氢离子,负极反应式为,故D正确;
选B。
10.C
【详解】A.锌的活动性强于铜,锌作负极,则锌电极上的反应为Zn-2e-=Zn2+,A正确;
B.原电池工作时,电解质溶液中的阴离子向负极移动,故SO向锌电极移动,B正确;
C.电子从锌电极经过导线流向铜电极,溶液不能传导电子,C错误;
D.铜电极是正极,溶液中的铜离子在正极放电析出铜,因此铜电极质量增加,D正确;
故选C。
11.B
【详解】A.煤油为多种烷烃和环烷烃的混合物,故A错误;
B.燃料燃烧时将化学能转化为热能,B正确;
C.铝合金的密度较小,硬度较大,火箭箭体采用铝合金的主要目的是减轻火箭的质量,故C错误;
D.卫星计算机芯片使用高纯度的硅,而不是二氧化硅,故D错误;
故选B。
12.A
【详解】A.电解饱和食盐水时,阳极氯离子失电子发生氧化反应,其电极反应为,A正确;
B.酸性氢氧燃料电池的正极电极反应为:,B错误;
C.粗铜精炼时,与电源正极相连的是纯铜,作阴极,其电极反应为,C错误;
D.钢铁发生吸氧腐蚀时,铁作负极被氧化,生成的是亚铁离子,所以其电极反应式为:,D错误;
故选A。
13.C
【详解】A.平衡后,通入,对平衡无影响,且在一定温度和压强下为定值,此时不发生改变,故A错误;
B.该反应为可逆反应,反应不能进行完全,则不可能100%分解,故B错误;
C.可逆反应达到平衡状态时,各物质的浓度保持不变,即平衡态是该条件下分解达到的最大程度,故C正确;
D.化学平衡是动态平衡,达到平衡状态时,生成的质量不变,但反应没有停止,此时正逆反应速率相等,故D错误;
答案选C。
14.C
【分析】“厌氧阳极”上,失去电子生成和,电极反应式为;“缺氧阴极”上,得到电子生成,再转化为,电极反应式分别为、。“好氧阴极”上,得到电子生成,电极反应式为,同时还能氧化生成,还可以被氧化为,离子方程式分别为、;
【详解】A.在该电池中,“阳极”代表负极,“阴极”代表正极,阳离子由负极移向正极,电池工作时,“厌氧阳极”产生的通过质子交换膜向“缺氧阴极”和“好氧阴极”迁移,A正确;
B.由分析可知,电池工作时,“缺氧阴极”上消耗多于从“厌氧阳极”迁移过来的,且反应生成水,其附近的溶液pH增大,B正确;
C.由题干可知,电解质溶液呈酸性,C错误;
D.“厌氧阳极”的电极反应式为,1mol参与反应消耗6mol,输出24mol电子,“厌氧阳极”区质量减少288g,故“厌氧阳极”区质量减少28.8g时,该电极输出电子2.4mol,D正确;
故答案为:C。
15.(1) 阴极 2H2O+2e-=H2↑+2OH-
(2)2NaCl+2H2O Cl2↑+H2↑+2NaOH
(3)Ag-e-═Ag+
(4)H2-2e-+2OH-=2H2O
【分析】该装置为电解池,在阳极溶液中的Cl-失去电子生成氯气,在阴极水电离出来的氢离子得到电子生成氢气。
【详解】(1)阴极氢离子放电产生氢氧根离子使附近溶液颜色先变红,电极反应方程式为:2H2O+2e-=H2↑+2OH-,故答案为:阴极;2H2O+2e-=H2↑+2OH-;
(2)阳极是还原性强的氯离子放电生成氯气,阴极是水电离的氢离子放电生成氢气,所以电解反应的化学方程式为2NaCl+2H2O Cl2↑+H2↑+2NaOH;
(3)金属银作阳极,阳极是金属银本身放电,电极反应方程式为:Ag-e-═Ag+;
(4)通氢气的一极发生氧化反应是负极;b极氧气发生还原反应是正极,在碱性溶液中负极的电极反应式为:H2-2e-+2OH-=2H2O。
16.(1) 负极 溶液变蓝
(2) 负极
(3) 0刻度 化学反应达到化学平衡后,电路中的电子不再定向移动
【详解】(1)向B烧杯中加入适量较浓的硫酸,发现G的指针向右偏移,根据“G是灵敏电流计,其指针总是偏向电源正极”,则电极C为负极,电极D为正极,电子从C经过G流向D,即碘离子发生氧化反应,失去电子,生成碘单质,电极C上的电极反应式为2I--2e-=I2,I2遇到淀粉变蓝。
(2)再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移,说明此时C是正极,D是负极,结合总反应为:+H2O知,A中发生碘单质得电子的还原反应,B中发生亚砷酸失电子的氧化反应,电极反应方程式为。
(3)再过一段时间后,G的指针逐渐指向0刻度,此时实验装置中的化学反应已经达到化学平衡状态,化学反应达到化学平衡后,电路中的电子不再定向移动。
17. 2CuSO4+2H2O2Cu+O2↑+2H2SO4 4.48 L 1 mol·L-1 C B B O2+2H2O+4e-=4OH-
【详解】Ⅰ.(1)甲电解池中电解硫酸铜溶液,则电解反应方程式为2CuSO4+2H2O2Cu+O2↑+2H2SO4。
(2)若甲槽阴极增重12.8 g,即析出单质铜是12.8g,物质的量是0.2mol,转移0.4mol电子,乙槽阳极氯离子放电生成氯气,根据电子转移守恒可知生成氯气是0.2mol,在标准状况下的体积为4.48 L。
(3)若乙槽剩余液体为400 mL,根据(2)中分析可知生成氢氧化钠是0.4mol,则电解后得到碱液的物质的量浓度为0.4mol÷0.4L=1 mol·L-1。
Ⅱ.(1)根据电流方向可知B的金属性弱于铜,又因为构成两电极的金属其活动性相差越大,电压表读数越大,所以根据表中数据可知C金属可能是最强的还原剂。
(2)B的金属性弱于铜,因此B金属一定不能从硫酸铜溶液中置换出铜。
(3)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,在滤纸上能看到有蓝色沉淀析出,说明铜是负极,失去电子,被氧化为铜离子,金属作正极,则该金属是B。溶液显碱性,正极氧气放电,则金属对应的原电池的正极电极反应式为O2+2H2O+4e-=4OH-。
18. ① 1425kJ NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+H2O(l) ΔH= 57.3kJ/mol -246.1kJ·mol-1
【详解】(1)氢气燃烧为放热反应,所以属于放热反应的是①;
(2)燃烧10gH2即5mol氢气,生成液态水,根据①分析,放出的热量为570×2.5=1425 kJ;
(3)已知:1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应生成2mol水,放出114.6kJ的热量,即可知生成1mol水放出的热量为57.3 kJ,中和热的热化学方程式为NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+H2O(l) ΔH= 57.3kJ/mol;
(4)根据盖斯定律分析,由①×2+②+③得热化学方程式为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) ΔH=(-90.7×2-23.5-41.2)kJ·mol-1=-246.1kJ·mol-1。
19. 强度较高、密度小、耐腐蚀 不锈钢 强度高、耐腐蚀,无有害健康的物质进入食物 镀件 铬 、均带有负电荷,电镀过程中向阳极移动,不能在阴极上放电析出Cr
【详解】(1)钢铁是铁和碳的合金,吸氧腐蚀中,铁作负极失去电子,负极电极反应式为:,碳作正极,溶解于水中的O2得到电子,正极的电极反应式为:;
(2)①铝合金是生活中最常见的金属材料,其特性有:强度较高、密度小、耐腐蚀;
②生产炊具的材料最好是不锈钢。因为不锈钢强度高、耐腐蚀,无有害健康的物质进入食物;
(3)钢铁表面镀铬,钢铁作镀件,电镀时镀件作阴极,铬作阳极,失去电子生成Cr3+,进入溶液,溶液中的Cr3+在阴极得到电子生成Cr单质,覆盖在钢铁上,因而电解液中必须含有Cr3+。、均带有负电荷,电镀过程中向阳极移动,不能在阴极上放电析出Cr。
20.-46 kJ
【详解】断开反应物的化学键吸收能量为946 kJ+436 kJ×3 = 2254 kJ,形成生成物的化学键放出能量为391 kJ×6 = 2346 kJ,生成2 mol NH3时放出的热量=2346 kJ -2254 kJ = 92 kJ,所以1 mol NH3时的放出的热量为46 kJ,即反应热Q=-46kJ,故答案为:-46kJ;
21.(1)
(2)4NH3 + 6NO5N2 +6 H2O
(3)
(4) O2+4e-+2H2O=4OH-
【分析】现有A、B、C、D、E五种常见短周期元素,已知:①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;②A、D同主族,A是所有元素中原子半径最小的元素,则A是H,所以D是Na;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍,原子序数小于钠,则C是O,所以B是N;③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和,因此E是铝元素,甲、乙、丙分别是硝酸、氢氧化钠和氢氧化铝。
【详解】(1)根据以上分析可知乙+丙在溶液中反应的离子方程式。
(2)化合物NH3与NO在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,应该是氮气和CO2,所以反应的化学方程式为4NH3 + 6NO5N2 +6 H2O。
(3)氧化钠是离子化合物,则用电子式表示化合物D2C的形成过程可表示为
。
(4)某原电池中,电解质为KOH溶液,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,该化合物是CO。向正极通入元素C最常见的单质,即为氧气。原电池中正极得到电子,即氧气在正极放电,则正极反应为O2+4e-+2H2O=4OH-;负极失去电子,因此CO在负极通入,发生氧化反应,则负极反应为。
22. 2NO2+2H2O-2e-=2+4H+(或写成 NO2+H2O-e-=+2H+) NO2+2H++2e-=NO ↑+H2O CH4+2O2+2OH-=+3H2O
【分析】(2)原电池中正负极电极方程式相加即可得到总反应.
【详解】(1)3NO2+H2O=2H++2+NO反应中,NO2失电子发生氧化反应生成,NO2得电子发生还原反应生成NO,
①氧化反应:2NO2+2H2O-2e-=2+4H+;
②还原反应:NO2+2H++2e-=NO ↑+H2O;
(2)已知甲烷燃料电池的半反应式分别为:CH4+10OH--8e-=+7H2O;O2+2H2O+4e-=4OH-,原电池中正负极电极方程式相加即可得到总反应,则总反应式:CH4+2O2+2OH-=+3H2O.
23. 负 Zn-2e-=Zn2+ 2H2O+O2+4e-=4OH- A极上有气泡,电极附近溶液变红 A 2NaCl+2H2O2NaOH+H2↑+Cl2↑ 纯铜 减小
【分析】(1)根据所盛溶液为CuSO4溶液,打开K2,合并K1,该装置是原电池,较活泼的金属作负极,负极上发生氧化反应,较不活泼的金属或导电的非金属作正极,正极上发生氧化反应,所盛溶液为KCl溶液,则B极上氧气得到电子发生还原反应进行分析;
(2)根据打开K1,合并K2,该装置是电解池,阳极上失去电子发生氧化反应,阴极上得到电子发生还原反应进行分析;
(3)根据用电解的方法精炼粗铜,粗铜作阳极,精铜作阴极,阳极上发生氧化反应,阴极上发生还原反应进行分析.
【详解】(1)若所盛溶液为CuSO4溶液,打开K2,合并K1,该装置是原电池,锌作负极,碳作正极,负极上锌失去电子发生氧化反应,电极反应式为: Zn-2e-=Zn2+,若所盛溶液为KCl溶液,则B极上氧气得到电子发生还原反应,电极反应式为: 2H2O+O2+4e-=4OH-;答案:负、Zn-2e-=Zn2+、 2H2O+O2+4e-=4OH-。
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,该装置是电解池,碳作阳极,锌作阴极,A电极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,溶液显碱性,酚酞遇碱变红色,所以A电极附近可观察到的现象是:产生无色气泡,电极附近溶液变红色。阳离子向阴极移动,所以Na+移向A极,B极上氯离子放电生成氯气 ,总反应化学方程式是: 2NaCl+2H2O2NaOH+H2↑+Cl2↑;答案:A极上有气泡,电极附近溶液变红、 A 、 2NaCl+2H2O2NaOH+H2↑+Cl2↑。
(3)用电解的方法精炼粗铜,粗铜作阳极,精铜作阴极,阳极上发生氧化反应,阴极上发生还原反应,所以A电极的材料应换成是纯铜,阳极上不仅铜,还有其他金属失去电子进入溶液,阴极上只有铜离子得到电子,所以反应一段时间后电解质溶液中Cu2+的浓度将会减小。答案是:纯铜、减小。
24. 吸热 E1-E2 CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-725.8 kJ·mol-1 434 kJ SO3(g)+H2O(l)===H2SO4(l) ΔH=-130 kJ·mol-1
【详解】(1)由图象可知,反应物的能量低于生成物的能量,所以该反应是吸热反应;ΔH= E1—E2 kJ· mol-1;
(2) 燃烧热是1mol燃烧物完全燃烧生成稳定的化合物所释放的热量,所以①×1/2-②×2即得CH3OH(l)+3/2O2(g)==CO2(g)+2 H2O(l) ΔH=—725.8 kJ·mol-1;
(3) ΔH=反应物键能总和—生成物键能总和,所以ΔH=-185 kJ/mol=436 kJ/mol+247 kJ/mol-2E(H—Cl),所以E(H—Cl)==434 kJ/mol,即形成1 mol H—Cl键放出的能量为434 kJ;
(4)根据盖斯定律可推知,[③—①—②×2],即得SO3(g)+H2O(l)==H2SO4(l) ΔH=[H3—ΔH1—ΔH2×2]= —130 kJ·mol-1。
答案第1页,共2页
答案第1页,共2页
一、单选题(共14题)
1.在生产、生活中,金属腐蚀会带来严重的损失。下列事实与金属电化学腐蚀无关的是
A.铁制器件附有铜质配件,在接触处易生铁锈
B.金属钠置于空气中表面变暗
C.黄铜(铜锌合金)制作的铜锣不易产生铜绿
D.埋在潮湿土壤里的铁管比埋在干燥土壤里的铁管更容易被腐蚀
2.高电压水系锌-有机混合液流电池的装置如图所示。下列说法错误的是
A.放电时,Cl-通过阴膜向正极区迁移
B.放电时,负极区溶液的pH减小
C.充电时,Zn与外接直流电源负极相连
D.充电时,阳极电极反应式为FQH2-2e-=FQ+2H+
3.下列说法正确的是( )
A.化学反应的热效应的大小与参加反应的物质的多少无关
B.由H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1,则向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量等于5.73 kJ
C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同
D.反应物的总能量大于生成物的总能量的反应一定是放热反应
4.下列叙述正确的是
A.使用催化剂能够降低化学反应的反应热△H
B.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和NH3 H2O反应的中和热ΔH=2×(-57.3)kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的ΔH=+2×283.0kJ/mol
5.将溶液滴在一块光亮清洁的铁板表面上,一段时间后,发现液滴覆盖的圆周中心区(a)已被腐蚀变暗,在液滴外沿出现棕色铁锈环(b),如图所示。下列说法不正确的是
A.铁锈环的主要成分是,铁片腐蚀过程发生的总反应为
B.液滴之下氧气含量少,铁片作负极,发生的还原反应为
C.液滴边缘是正极区,发生的电极反应为
D.铁片腐蚀最严重的区域不是生锈最多的区域
6.高氯酸铵(NH4ClO4)可用作火箭推进剂,某种制备NH4ClO4的工艺流程如图(相关物质的溶解度如图)。下列说法错误的是
A.电解I中发生反应的离子方程式:Cl-+3H2OClO+3H2↑
B.操作是加热蒸发、趁热过滤
C.洗涤粗产品宜使用冷水
D.流程中可循环利用的物质是NaCl
7.以为催化材料,利用电化学原理实现消除酸性废水中的,其反应过程如图所示。已知中Fe元素化合价为+2、+3价,分别表示为Fe(I)、Fe(Ⅲ)。下列说法错误的是
A.Pd上发生的电极反应为
B.Fe(II)与Fe(Ⅲ)的相互转化起到了传递电子的作用
C.处理的电极反应为
D.反应过程中与的物质的量比为2:3
8.偏钨酸铵是制备金属钨、合金钢以及陶瓷工业的重要原料。采用如下电化学装置可制备偏钨酸铵,双极膜中间层中的水解离为H+和OH-,并在直流电场作用下分别向两极迁移,下列说法正确的是
A.a膜为阴离子交换膜
B.阳极电极反应为
C.双极膜中间层中的OH-向右侧迁移进入产品室
D.当电路中通过时,双极膜中解离水的质量为2.0g
9.研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。质子交换膜只允许H+自由通过,下列说法错误的是
A.电子由Pt电极流向C电极
B.电池工作时正极区溶液的降低
C.常温常压下,被还原同时有被氧化
D.负极反应为
10.铜—锌原电池装置如图所示,电解质溶液为硫酸铜溶液,电池工作一段时间后,下列说法错误的是
A.锌电极上的反应为Zn-2e-=Zn2+
B.溶液中的SO向锌电极移动
C.电子从锌电极经过硫酸铜溶液流向铜电极
D.铜电极质量增加
11.我国航天近年来成就斐然,卫星发射任务不断增多。下列有关说法正确的是
A.某运载火箭利用液氧和煤油为燃料,煤油为纯净物
B.火箭中的燃料燃烧时将化学能转化为热能
C.火箭箭体采用铝合金是为了美观耐用
D.卫星计算机芯片使用高纯度的二氧化硅
12.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是
A.电解饱和食盐水时,阳极的电极反应为
B.酸性氢氧燃料电池的正极电极反应为
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应为
D.钢铁发生吸氧腐蚀时,铁作负极被氧化:
13.利用反应 ,可回收处理石油化工行业废气中的硫化氢。T℃时,该反应在密闭容器中进行,下列说法正确的是
A.平衡后,通入,减小
B.上述条件下,可实现100%分解
C.平衡态是该条件下分解的最大程度
D.生成的质量不变时,反应停止
14.一种双阴极微生物燃料电池装置如图所示,电解质溶液呈酸性,该装置可以同时进行硝化和反硝化脱氮,下列叙述错误的是
A.电池工作时,的迁移方向为“厌氧阳极”→“缺氧阴极”和“厌氧阳极”→“好氧阴极”
B.电池工作时,“缺氧阴极”电极附近的溶液pH增大
C.“好氧阴极”存在反应:
D.“厌氧阳极”区质量减少28.8g时,该电极输出电子2.4mol
二、填空题(共9题)
15.某课外活动小组进行电解饱和食盐水的实验(如图)。请回答下列问题。
(1)通电一段时间后,可观察到 电极(填“阴极”或“阳极”)附近溶液颜色先变红,该电极上的电极反应式为 。
(2)该溶液电解反应的化学方程式为 。
(3)若开始时改用银棒做阳极,阳极的电极反应式为 。
(4)若用H2和O2为反应物,以KOH为电解质溶液,可构成新型燃料电池(如图),两个电极均由多孔性炭制成,通入的气体由孔隙中逸出,并在电极表面放电。则a极的电极反应式为 。
16.如图是一套电化学实验装置,图中C、D均为铂电极,G是灵敏电流计,其指针总是偏向电源正极。回答下列问题:
(1)向烧杯B中加入适量较浓的硫酸,发现G的指针向右偏移。则电极C是原电池的 (填“正极”或“负极”),电极C上的电极反应式为 ,烧杯A中的主要实验现象是 。
(2)一段时间后,再向烧杯B中加入适量质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移。此时整套实验装置总反应的离子方程式为,此时电极D为 (填“正极”或“负极”),其电极反应方程式为 。
(3)再过一段时间后,实验装置中的化学反应已经达到化学平衡状态,则此时G的指针指向 (填“右边”“左边”或“0刻度”),理由是 。
17.Ⅰ.如下图为相互串联的甲、乙两个电解池(电极都是惰性电极),
请回答:
(1)写出甲电解池中的电解反应方程式:甲 。
(2)若甲槽阴极增重12.8 g,则乙槽阳极放出气体在标准状况下的体积为 。
(3)若乙槽剩余液体为400 mL,则电解后得到碱液的物质的量浓度为 。
Ⅱ.将洁净的金属片A、B、C、D分别放置在浸有食盐溶液的滤纸上面并压紧(如图所示),在每次实验时,记录电压表指针的移动方向和电压表的读数如下:
金属 电流方向 电压/V
A Cu→A +0.78
B B→Cu -0.15
C Cu→C +1.35
D Cu→D +0.30
已知:构成两电极的金属其活动性相差越大,电压表读数越大。请依据表中数据判断:
(1) 金属可能是最强的还原剂。(填字母)
(2) 金属一定不能从硫酸铜溶液中置换出铜。(填字母)
(3)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,则在滤纸上能看到有蓝色沉淀析出的是 (填字母)。金属对应的原电池的正极电极反应式为 。
18.Ⅰ.已知下列热化学方程式:
①2H2(g)+O2(g)=2H2O(l) △H=-570kJ/mol
②2H2O(g)=2H2(g)+O2(g) △H=+483.6kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是 (填写序号)。
(2)燃烧10gH2生成液态水,放出的热量为 。
(3)已知:1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应,放出114.6kJ的热量,由此推知H2SO4与NaOH发生中和反应,写出该中和热的热化学方程式为 。
Ⅱ.已知:工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用下进行的,反应器中发生了下列反应:
CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.7kJ·mol-1 ①
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5kJ·mol-1 ②
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.2kJ·mol-1 ③
(4)反应器中的总反应可表示为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g),计算该反应的ΔH= 。
19.金属由于其优良的物理化学性能,在工农业生产以及国防中被大量使用。钢铁是应用最广的金属材料,但是钢铁材料的腐蚀也使我们损失惨重,因此对其进行防护是十分必要的。防止或减少钢铁的腐蚀有多种方法,如制成耐腐蚀合金,表面“烤蓝”,电镀另一种金属以及电化学保护等方法。
(1)钢铁的腐蚀主要是吸氧腐蚀,请写出钢铁吸氧腐蚀的电极反应:负极的电极反应式为 ,正极的电极反应式为 。
(2)合金的性能多种多样,人们根据需要生产出种类繁多的合金材料。请回答
①作为建筑材料的铝合金的特性有 (至少回答两点)。
②由于摄入较多的Al对人的健康有害,所以现在不主张使用铝制炊具。你认为生产炊具的材料最好是 ,理由是 。
(3)钢铁表面常电镀一层Cr达到防腐蚀的目的,这是由于Cr具有优良的抗腐蚀性能。请回答:
电镀过程中,阴极是 ,电解质中一定含有 ,阳极材料是 ;电镀Cr时,不能使用或作为镀液,请说明原因: 。
20.已知H—H键、N≡N键、N—H键键能如下表所示:
化学键 H—H N≡N N—H
键能/kJ·mol-1 436 946 391
则在一定条件下进行反应N2(g)+3H2(g)=2NH3(g),生成1 mol NH3时的反应热Q= 。
21.现有A、B、C、D、E五种常见短周期元素,已知:
①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;
②A、D同主族,A是所有元素中原子半径最小的元素;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍;
③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;
④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和。
请填写下列空白:
(1)写出乙+丙在溶液中反应的离子方程式 。
(2)化合物BA3与BC在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,其反应的化学方程式为: 。
(3)用电子式表示化合物D2C的形成过程 。
(4)某原电池中,电解质为KOH溶液,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,向正极通入元素C最常见的单质,试完成下列问题:
正极反应: ;负极反应: ;
22.一个完整的氧化还原反应方程式可以拆分,写成两个“半反应式”,一个是“氧化反应”式,一个是“还原反应”式。如2Fe3++Cu=2Fe2++Cu2+,可以写成:氧化反应 Cu-2e-=Cu2+;还原反应 2Fe3++2e—=2Fe2+(或Fe3++e-=Fe2+)。
(1)根据以上信息将反应3NO2+H2O=2H++2+NO拆分成两个“半反应式”:氧化反应式 ;还原反应式 。
(2)已知某一反应的“半反应式”为CH4+10OH--8e-=+7H2O;O2+2H2O+4e-=4OH-,则总反应式为 。
23.如图所示,U形管内盛有100 mL 的溶液,按要求回答下列问题:
(1)打开K2,闭合K1,若所盛溶液为CuSO4溶液:则A为 极,A极的电极反应式为 。若所盛溶液为KCl溶液,则B极的电极反应式为 。
(2)打开K1,闭合K2,若所盛溶液为滴有酚酞的NaCl溶液,则A电极附近可观察到的现象是 ,Na+移向 极(填A、B);总反应化学方程式是 。
(3)如果要用电解的方法精炼粗铜,打开K1,闭合K2,电解液选用CuSO4溶液,则A电极的材料应换成是 (填“粗铜”或“纯铜”),反应一段时间后电解质溶液中Cu2+的浓度将会 (填“增大”、“减小”、“不变”)。
24.(1)已知某反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,回答问题。
该反应是 (填“吸热”或“放热”)反应,该反应的ΔH= kJ· mol-1(用含E1、E2的代数式表示)。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)==2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l) =H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式 。
(3)已知:H2(g)+Cl2(g)==2HCl(g) ΔH=-185 kJ/mol,断裂1 mol H—H键吸收的能量为436 kJ,断裂1 mol Cl—Cl键吸收的能量为247 kJ,则形成1 mol H—Cl键放出的能量为 kJ。
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.铁和铜接触处和电解质溶液会形成原电池反应,铁做负极发生氧化反应被腐蚀,A不符合;
B.金属钠暴露在空气中表面变暗是因为钠被氧化生成了氧化钠,属于化学变化,与金属电化学腐蚀无关,B符合题意;
C.铜锌合金在电解质溶液中形成原电池反应,锌做负极被腐蚀.正极被保护,所以不易形成铜绿,和电化学有关,C不符合;
D.埋在潮湿土壤里的铁管由于潮湿土壤中的电解质更容易导电,发生电化学反应,故比埋在干燥土壤里的铁管更容易被腐蚀,D不符合;
故选B。
2.A
【详解】A.原电池中阴离子向负极移动,故放电时,Cl-不会向正极区迁移,A错误;
B.放电时,负极区锌失去电子发生氧化反应,,溶液氢氧根离子浓度减小,pH减小,B正确;
C.充电时,Zn做阴极,与外接直流电源负极相连,C正确;
D.充电时,阳极的FQH2失去电子反应氧化反应,电极反应式为FQH2-2e-=FQ+2H+,D正确;
故选A。
3.D
【详解】A.化学反应的热效应的大小与物质的量有关,不同量的物质,反应热量变化不同,A错误;
B.NaOH固体溶解也会放热,因此向含0.1 mol HCl的盐酸中加入4.0 gNaOH固体,放出热量大于5.73 kJ,B错误;
C.△H=生成物的总能量-反应物的总能量,与反应条件无关,同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同,C错误;
D.△H=生成物的总能量-反应物的总能量,反应物的总能量大于生成物的总能量的反应,△H<0,是放热反应,D正确;
答案选D。
4.D
【详解】A. 使用催化剂只能降低反应的活化能,不能改变反应的△H,A错误;
B.中和热是指强酸强碱稀溶液反应生成1mol水释放的能量,故其数值不会发生变化,B错误;
C.有些放热反应也需要加热,C错误;
D. CO的燃烧热是指1molCO完全燃烧生成二氧化碳时放出的能量,该反应的逆反应该好就是CO完全燃烧的反应,故该反应为吸热反应,吸收的热量数值为CO燃烧热的两倍,D正确;
故选D。
5.B
【详解】A.两极生成的和相互吸引,发生迁移接触后生成,继而发生反应和,则铁锈环的主要成分是;铁片腐蚀过程发生的总反应为,A正确;
B.铁片作负极,发生氧化反应,电极反应为,B错误;
C.溶液覆盖的铁片主要发生吸氧腐蚀,正极区在液滴边缘得到电子被还原:,C正确;
D.铁片腐蚀最严重的区域不是生锈最多的区域,而是液滴覆盖的圆周中心区,D正确;
故选B。
6.B
【分析】制备NH4ClO4的工艺流程为:电解饱和食盐水得到NaClO3,然后通过电解NaClO3溶液,阳极附近失电子发生氧化反应生成,阴极附近H+得到电子发生还原反应生成氢气;除杂时发生的反应为2NaClO3+2HCl+H2O2═2ClO2↑+2NaCl+2H2O+O2↑,“除杂”的目的是除去少量未被电解的NaClO3;“反应”时用NaClO4和NH4Cl在90℃制备NH4ClO4粗品,据此分析解题。
【详解】A.由分析可知,电解I中发生反应的离子方程式:Cl-+3H2OClO+3H2↑,A正确;
B.由分析可知,操作是分离NH4ClO4和NaCl,结合题干溶解度曲线图可知,NH4ClO4的溶解度随温度变化明显,而NaCl的溶解度随温度变化不明显,则操作是加热蒸发,冷却结晶,过滤洗涤、干燥,B错误;
C.题干溶解度曲线图可知,NH4ClO4的溶解度随温度变化明显,为减少NH4ClO4因溶解损失,则洗涤粗产品宜使用冷水,C正确;
D.由分析可知,流程中经操作分离出来的滤液中含有NaCl,可循环利用,D正确;
故答案为:B。
7.C
【解析】根据图示可知,Fe3O4/Pd为催化材料,H2消除酸性废水中的致癌物NO的总反应为:2H++2NO+3H2 N2+4H2O,该反应中N元素化合价降低被还原,H元素化合价升高被氧化,氢气为还原剂,NO为氧化剂,据此解答。
【详解】A.由图可知Pd上氢气得电子生成氢离子,所以电极反应为:,故A正确;
B.H2消除酸性废水中的致癌物NO的总反应为:2H++2NO+3H2 N2+4H2O
,Fe(II)与Fe(III)的相互转化起到了传递电子的作用,故B正确;
C.过程①中NO的+3价N元素变为0价,化合价降低被还原,电极反应为2NO+8H++6e ═N2↑+4H2O,故C错误;
D.由总反应方程式可知,反应过程中与的物质的量比等于化学计量数之比,为2:3,故D正确;
故选:C。
8.B
【分析】由图可知,左侧石墨电极为电解池的阳极,一水合氨在阳极失去电子发生氧化反应生成铵根离子、氧气和水,碱室中碳酸氢根离子通过阴膜加入阳极室,双极膜中间层中的氢氧根离子进入碱室、氢离子加入产品室,产品室中氢离子与溶液中铵根离子、钨酸根离子反应生成偏钨酸铵,过量的铵根离子通过阳膜进入阴极室,右侧电极为阴极,水在阴极得到电子发生还原反应生成氢气和氢氧根离子,铵根离子与氢氧根离子反应生成一水合氨。
【详解】A.由分析可知,a膜为阳离子交换膜,故A错误;
B.由分析可知,左侧石墨电极为电解池的阳极,一水合氨在阳极失去电子发生氧化反应生成铵根离子、氧气和水,电极反应式为,故B正确;
C.由分析可知,双极膜中间层中的氢氧根离子进入碱室、氢离子加入产品室,故C错误;
D.当电路中通过0.1mol电子时,双极膜中有0.1mol氢氧根离子进入碱室,则双极膜中解离水的质量为0.1mol×18g/mol=1.8g,故D错误;
故选B。
9.B
【详解】A.Pt电极甲醇发生氧化反应生成二氧化碳,Pt电极是负极、C电极是正极,外电路中电子由Pt电极流向C电极,故A正确;
B.电池工作时,正极区总反应为氧气得电子生成水,酸溶液浓度减小,溶液的升高,故B错误;
C.电池工作时,总反应为CH3CH2OH+3O2=2CO2+3H2O,常温常压下,3mol氧气被还原同时有1mol乙醇被氧化,故C正确;
D.负极乙醇失电子发生氧化反应生成二氧化碳和氢离子,负极反应式为,故D正确;
选B。
10.C
【详解】A.锌的活动性强于铜,锌作负极,则锌电极上的反应为Zn-2e-=Zn2+,A正确;
B.原电池工作时,电解质溶液中的阴离子向负极移动,故SO向锌电极移动,B正确;
C.电子从锌电极经过导线流向铜电极,溶液不能传导电子,C错误;
D.铜电极是正极,溶液中的铜离子在正极放电析出铜,因此铜电极质量增加,D正确;
故选C。
11.B
【详解】A.煤油为多种烷烃和环烷烃的混合物,故A错误;
B.燃料燃烧时将化学能转化为热能,B正确;
C.铝合金的密度较小,硬度较大,火箭箭体采用铝合金的主要目的是减轻火箭的质量,故C错误;
D.卫星计算机芯片使用高纯度的硅,而不是二氧化硅,故D错误;
故选B。
12.A
【详解】A.电解饱和食盐水时,阳极氯离子失电子发生氧化反应,其电极反应为,A正确;
B.酸性氢氧燃料电池的正极电极反应为:,B错误;
C.粗铜精炼时,与电源正极相连的是纯铜,作阴极,其电极反应为,C错误;
D.钢铁发生吸氧腐蚀时,铁作负极被氧化,生成的是亚铁离子,所以其电极反应式为:,D错误;
故选A。
13.C
【详解】A.平衡后,通入,对平衡无影响,且在一定温度和压强下为定值,此时不发生改变,故A错误;
B.该反应为可逆反应,反应不能进行完全,则不可能100%分解,故B错误;
C.可逆反应达到平衡状态时,各物质的浓度保持不变,即平衡态是该条件下分解达到的最大程度,故C正确;
D.化学平衡是动态平衡,达到平衡状态时,生成的质量不变,但反应没有停止,此时正逆反应速率相等,故D错误;
答案选C。
14.C
【分析】“厌氧阳极”上,失去电子生成和,电极反应式为;“缺氧阴极”上,得到电子生成,再转化为,电极反应式分别为、。“好氧阴极”上,得到电子生成,电极反应式为,同时还能氧化生成,还可以被氧化为,离子方程式分别为、;
【详解】A.在该电池中,“阳极”代表负极,“阴极”代表正极,阳离子由负极移向正极,电池工作时,“厌氧阳极”产生的通过质子交换膜向“缺氧阴极”和“好氧阴极”迁移,A正确;
B.由分析可知,电池工作时,“缺氧阴极”上消耗多于从“厌氧阳极”迁移过来的,且反应生成水,其附近的溶液pH增大,B正确;
C.由题干可知,电解质溶液呈酸性,C错误;
D.“厌氧阳极”的电极反应式为,1mol参与反应消耗6mol,输出24mol电子,“厌氧阳极”区质量减少288g,故“厌氧阳极”区质量减少28.8g时,该电极输出电子2.4mol,D正确;
故答案为:C。
15.(1) 阴极 2H2O+2e-=H2↑+2OH-
(2)2NaCl+2H2O Cl2↑+H2↑+2NaOH
(3)Ag-e-═Ag+
(4)H2-2e-+2OH-=2H2O
【分析】该装置为电解池,在阳极溶液中的Cl-失去电子生成氯气,在阴极水电离出来的氢离子得到电子生成氢气。
【详解】(1)阴极氢离子放电产生氢氧根离子使附近溶液颜色先变红,电极反应方程式为:2H2O+2e-=H2↑+2OH-,故答案为:阴极;2H2O+2e-=H2↑+2OH-;
(2)阳极是还原性强的氯离子放电生成氯气,阴极是水电离的氢离子放电生成氢气,所以电解反应的化学方程式为2NaCl+2H2O Cl2↑+H2↑+2NaOH;
(3)金属银作阳极,阳极是金属银本身放电,电极反应方程式为:Ag-e-═Ag+;
(4)通氢气的一极发生氧化反应是负极;b极氧气发生还原反应是正极,在碱性溶液中负极的电极反应式为:H2-2e-+2OH-=2H2O。
16.(1) 负极 溶液变蓝
(2) 负极
(3) 0刻度 化学反应达到化学平衡后,电路中的电子不再定向移动
【详解】(1)向B烧杯中加入适量较浓的硫酸,发现G的指针向右偏移,根据“G是灵敏电流计,其指针总是偏向电源正极”,则电极C为负极,电极D为正极,电子从C经过G流向D,即碘离子发生氧化反应,失去电子,生成碘单质,电极C上的电极反应式为2I--2e-=I2,I2遇到淀粉变蓝。
(2)再向B杯中加入适量的质量分数为40%的氢氧化钠溶液,发现G的指针向左偏移,说明此时C是正极,D是负极,结合总反应为:+H2O知,A中发生碘单质得电子的还原反应,B中发生亚砷酸失电子的氧化反应,电极反应方程式为。
(3)再过一段时间后,G的指针逐渐指向0刻度,此时实验装置中的化学反应已经达到化学平衡状态,化学反应达到化学平衡后,电路中的电子不再定向移动。
17. 2CuSO4+2H2O2Cu+O2↑+2H2SO4 4.48 L 1 mol·L-1 C B B O2+2H2O+4e-=4OH-
【详解】Ⅰ.(1)甲电解池中电解硫酸铜溶液,则电解反应方程式为2CuSO4+2H2O2Cu+O2↑+2H2SO4。
(2)若甲槽阴极增重12.8 g,即析出单质铜是12.8g,物质的量是0.2mol,转移0.4mol电子,乙槽阳极氯离子放电生成氯气,根据电子转移守恒可知生成氯气是0.2mol,在标准状况下的体积为4.48 L。
(3)若乙槽剩余液体为400 mL,根据(2)中分析可知生成氢氧化钠是0.4mol,则电解后得到碱液的物质的量浓度为0.4mol÷0.4L=1 mol·L-1。
Ⅱ.(1)根据电流方向可知B的金属性弱于铜,又因为构成两电极的金属其活动性相差越大,电压表读数越大,所以根据表中数据可知C金属可能是最强的还原剂。
(2)B的金属性弱于铜,因此B金属一定不能从硫酸铜溶液中置换出铜。
(3)若滤纸不用盐溶液浸润而改用NaOH溶液浸润,在滤纸上能看到有蓝色沉淀析出,说明铜是负极,失去电子,被氧化为铜离子,金属作正极,则该金属是B。溶液显碱性,正极氧气放电,则金属对应的原电池的正极电极反应式为O2+2H2O+4e-=4OH-。
18. ① 1425kJ NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+H2O(l) ΔH= 57.3kJ/mol -246.1kJ·mol-1
【详解】(1)氢气燃烧为放热反应,所以属于放热反应的是①;
(2)燃烧10gH2即5mol氢气,生成液态水,根据①分析,放出的热量为570×2.5=1425 kJ;
(3)已知:1L1mol/LH2SO4溶液与2L1mol/LNaOH溶液完全反应生成2mol水,放出114.6kJ的热量,即可知生成1mol水放出的热量为57.3 kJ,中和热的热化学方程式为NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+H2O(l) ΔH= 57.3kJ/mol;
(4)根据盖斯定律分析,由①×2+②+③得热化学方程式为3CO(g)+3H2(g) CH3OCH3(g)+CO2(g) ΔH=(-90.7×2-23.5-41.2)kJ·mol-1=-246.1kJ·mol-1。
19. 强度较高、密度小、耐腐蚀 不锈钢 强度高、耐腐蚀,无有害健康的物质进入食物 镀件 铬 、均带有负电荷,电镀过程中向阳极移动,不能在阴极上放电析出Cr
【详解】(1)钢铁是铁和碳的合金,吸氧腐蚀中,铁作负极失去电子,负极电极反应式为:,碳作正极,溶解于水中的O2得到电子,正极的电极反应式为:;
(2)①铝合金是生活中最常见的金属材料,其特性有:强度较高、密度小、耐腐蚀;
②生产炊具的材料最好是不锈钢。因为不锈钢强度高、耐腐蚀,无有害健康的物质进入食物;
(3)钢铁表面镀铬,钢铁作镀件,电镀时镀件作阴极,铬作阳极,失去电子生成Cr3+,进入溶液,溶液中的Cr3+在阴极得到电子生成Cr单质,覆盖在钢铁上,因而电解液中必须含有Cr3+。、均带有负电荷,电镀过程中向阳极移动,不能在阴极上放电析出Cr。
20.-46 kJ
【详解】断开反应物的化学键吸收能量为946 kJ+436 kJ×3 = 2254 kJ,形成生成物的化学键放出能量为391 kJ×6 = 2346 kJ,生成2 mol NH3时放出的热量=2346 kJ -2254 kJ = 92 kJ,所以1 mol NH3时的放出的热量为46 kJ,即反应热Q=-46kJ,故答案为:-46kJ;
21.(1)
(2)4NH3 + 6NO5N2 +6 H2O
(3)
(4) O2+4e-+2H2O=4OH-
【分析】现有A、B、C、D、E五种常见短周期元素,已知:①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;②A、D同主族,A是所有元素中原子半径最小的元素,则A是H,所以D是Na;B与C的位置相邻;C元素原子最外层电子数是次外层电子数的3倍,原子序数小于钠,则C是O,所以B是N;③B、D、E三者的最高价氧化物有水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素;④B、E两种元素原子最外层电子数之和等于A、C、D三种元素原子最外层电子数之和,因此E是铝元素,甲、乙、丙分别是硝酸、氢氧化钠和氢氧化铝。
【详解】(1)根据以上分析可知乙+丙在溶液中反应的离子方程式。
(2)化合物NH3与NO在加热和有催化剂存在的条件下能发生反应,生成两种无毒物质,应该是氮气和CO2,所以反应的化学方程式为4NH3 + 6NO5N2 +6 H2O。
(3)氧化钠是离子化合物,则用电子式表示化合物D2C的形成过程可表示为
。
(4)某原电池中,电解质为KOH溶液,分别向负极通入碳元素与元素C(原子物质的量之比1:1)形成的化合物,该化合物是CO。向正极通入元素C最常见的单质,即为氧气。原电池中正极得到电子,即氧气在正极放电,则正极反应为O2+4e-+2H2O=4OH-;负极失去电子,因此CO在负极通入,发生氧化反应,则负极反应为。
22. 2NO2+2H2O-2e-=2+4H+(或写成 NO2+H2O-e-=+2H+) NO2+2H++2e-=NO ↑+H2O CH4+2O2+2OH-=+3H2O
【分析】(2)原电池中正负极电极方程式相加即可得到总反应.
【详解】(1)3NO2+H2O=2H++2+NO反应中,NO2失电子发生氧化反应生成,NO2得电子发生还原反应生成NO,
①氧化反应:2NO2+2H2O-2e-=2+4H+;
②还原反应:NO2+2H++2e-=NO ↑+H2O;
(2)已知甲烷燃料电池的半反应式分别为:CH4+10OH--8e-=+7H2O;O2+2H2O+4e-=4OH-,原电池中正负极电极方程式相加即可得到总反应,则总反应式:CH4+2O2+2OH-=+3H2O.
23. 负 Zn-2e-=Zn2+ 2H2O+O2+4e-=4OH- A极上有气泡,电极附近溶液变红 A 2NaCl+2H2O2NaOH+H2↑+Cl2↑ 纯铜 减小
【分析】(1)根据所盛溶液为CuSO4溶液,打开K2,合并K1,该装置是原电池,较活泼的金属作负极,负极上发生氧化反应,较不活泼的金属或导电的非金属作正极,正极上发生氧化反应,所盛溶液为KCl溶液,则B极上氧气得到电子发生还原反应进行分析;
(2)根据打开K1,合并K2,该装置是电解池,阳极上失去电子发生氧化反应,阴极上得到电子发生还原反应进行分析;
(3)根据用电解的方法精炼粗铜,粗铜作阳极,精铜作阴极,阳极上发生氧化反应,阴极上发生还原反应进行分析.
【详解】(1)若所盛溶液为CuSO4溶液,打开K2,合并K1,该装置是原电池,锌作负极,碳作正极,负极上锌失去电子发生氧化反应,电极反应式为: Zn-2e-=Zn2+,若所盛溶液为KCl溶液,则B极上氧气得到电子发生还原反应,电极反应式为: 2H2O+O2+4e-=4OH-;答案:负、Zn-2e-=Zn2+、 2H2O+O2+4e-=4OH-。
(2)打开K1,合并K2,若所盛溶液为滴有酚酞的NaCl溶液,该装置是电解池,碳作阳极,锌作阴极,A电极上氢离子放电生成氢气,同时溶液中生成氢氧化钠,溶液显碱性,酚酞遇碱变红色,所以A电极附近可观察到的现象是:产生无色气泡,电极附近溶液变红色。阳离子向阴极移动,所以Na+移向A极,B极上氯离子放电生成氯气 ,总反应化学方程式是: 2NaCl+2H2O2NaOH+H2↑+Cl2↑;答案:A极上有气泡,电极附近溶液变红、 A 、 2NaCl+2H2O2NaOH+H2↑+Cl2↑。
(3)用电解的方法精炼粗铜,粗铜作阳极,精铜作阴极,阳极上发生氧化反应,阴极上发生还原反应,所以A电极的材料应换成是纯铜,阳极上不仅铜,还有其他金属失去电子进入溶液,阴极上只有铜离子得到电子,所以反应一段时间后电解质溶液中Cu2+的浓度将会减小。答案是:纯铜、减小。
24. 吸热 E1-E2 CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(l) ΔH=-725.8 kJ·mol-1 434 kJ SO3(g)+H2O(l)===H2SO4(l) ΔH=-130 kJ·mol-1
【详解】(1)由图象可知,反应物的能量低于生成物的能量,所以该反应是吸热反应;ΔH= E1—E2 kJ· mol-1;
(2) 燃烧热是1mol燃烧物完全燃烧生成稳定的化合物所释放的热量,所以①×1/2-②×2即得CH3OH(l)+3/2O2(g)==CO2(g)+2 H2O(l) ΔH=—725.8 kJ·mol-1;
(3) ΔH=反应物键能总和—生成物键能总和,所以ΔH=-185 kJ/mol=436 kJ/mol+247 kJ/mol-2E(H—Cl),所以E(H—Cl)==434 kJ/mol,即形成1 mol H—Cl键放出的能量为434 kJ;
(4)根据盖斯定律可推知,[③—①—②×2],即得SO3(g)+H2O(l)==H2SO4(l) ΔH=[H3—ΔH1—ΔH2×2]= —130 kJ·mol-1。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
