第一单元物质及其转化测试卷(含解析)
文档属性
| 名称 | 第一单元物质及其转化测试卷(含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 233.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-17 22:49:36 | ||
图片预览




文档简介
第一单元物质及其转化测试卷
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是
纯净物 混合物 强电解质 弱电解质 非电解质
A 盐酸 水煤气 硫酸 醋酸 HD
B 胆矾 石灰水 硫酸钡 NH3·H2O NH3
C 火碱 蔗糖溶液 氯化钠 氨水 三氧化硫
D 冰醋酸 氢氧化铁胶体 苛性钾 氯化氢 乙醇
A.A B.B C.C D.D
2.下列离子方程式书写不正确的是( )
A.氯气通入氯化亚铁溶液Fe2++Cl2=Cl-+Fe3+
B.澄清的石灰水跟盐酸反应H++OH-=H2O
C.碳酸钡溶于盐酸BaCO3+2H+=Ba2++H2O+CO2↑
D.金属钠跟水反应2Na+2H2O=2Na++2OH-+H2↑
3.下列各组离子在指定溶液中一定能大量共存的是
A.能使紫色石蕊溶液变红的溶液:Na+、Mg2+、Cl-、CH3COO-
B.无色溶液:K+、H+、SO、MnO
C.含大量SO的澄清溶液:Mg2+、Cu2+、Cl-、NO
D.强碱溶液:K+、Al3+、Cl-、NO
4.对某酸性溶液(可能含有、、、)分别进行如下实验:①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入溶液,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在原溶液中是否存在的是
A. B. C. D.
5.下列实验装置或操作正确的是
A.图1取用药品 B.图2处理废弃硫酸
C.图3检查气密性 D.图4滴加液体
6.下列有关说法正确的是( )
A.溶液和胶体的本质区别是能否发生丁达尔效应
B.含0.1 mol FeCl3溶质的溶液形成胶体后,胶体粒子为0.1 mol
C.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
D.可通过观察液体是否澄清透明来区别溶液和胶体
7.下列变化属于化学变化的是
A.金属腐蚀 B.碘的升华
C.氯气液化 D.矿石粉碎
8.下列各反应的离子方程式中,错误的是
A.硫酸铝溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH
B.铁片放入过量的稀硝酸中:3Fe+8H++2NO=3Fe2++2NO2↑+4H2O
C.将铝片放入过量NaOH溶液中:2Al+2OH-+6H2O=2Al(OH)+3H2↑
D.四羟基合铝酸盐与过量盐酸反应:Al(OH)+4H+=Al3++4H2O
9.下列气体的制备或检验过程中,发生的反应不是离子反应的是
A.实验室制取二氧化碳 B.实验室制取氢气
C.实验室用高锰酸钾制取氧气 D.用澄清石灰水检验二氧化碳气体
10.下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是( )
A.氯气:K+ Ba2+ SiO32— NO3— B.二氧化硫:Na+ NH4+ SO32— Cl—
C.氨气:K+ Na+ AlO2— CO32— D.硫化氢:Ca2+ Mg2+ MnO4— NO3—
11.已知在酸性条件下,下列物质氧化KI时,自身发生如下变化:Cl2→2Cl﹣ ; MnO→Mn2+ ; Cr2O→Cr3+ ; HNO3→NO ;如果分别用等物质的量的这些物质氧化足量的KI,得到I2的物质的量最多的是
A.Cl2 B.MnO C.Cr2O D.HNO3
12.当光束通过下列分散系时,能观察到丁达尔效应的是
A.蔗糖溶液 B.氢氧化钠溶液 C.氯化钾溶液 D.氢氧化铁胶体
13.下列离子方程式正确的是
A.溶液中加入过量稀NaOH溶液:
B.溶液中通入足量的氯气:
C.硫酸亚铁溶液中加入用硫酸酸化的双氧水:
D.足量溶液与小苏打溶液混合:
14.下列各组离子在指定的条件下一定能大量共存的是
A.弱碱性溶液:HCO、Na+、K+、Cl-
B.通入NO2溶液:Cu2+、Al3+、Fe2+、I-
C.加入Na2O2的溶液:AlO、Cl-、S2-、NH
D.能使甲基橙变为红色的溶液:NH、Na+、K+、S2O
15.下列分散系能产生“丁达尔效应”的是
A.氯化钠溶液 B.硫酸铜溶液 C.氢氧化铁胶体 D.蔗糖溶液
二、填空题
16.(1)在VL Al2(SO4)3溶液中,含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为
(2)有以下物质:①AgCl;②CCl4;③医用酒精;④液氧;⑤二氧化碳;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧食醋;⑨氧化钠固体;⑩氯化氢气体。其中属于电解质的是 (填序号,下同);属于非电解质的是
(3)实验室简单模拟从海水中提取溴单质的部分流程如图
实验操作②的名称 ,操作①中要用到的玻璃仪器 、
17.正确书写以下物质在水溶液中的电离方程式
(1)HNO3:
(2)Ba(OH)2:
(3)Na3PO4:
(4)(NH4)2Fe(SO4)2:
18.(1)向NaHSO4溶液中滴加NaHSO3溶液的离子反应方程式为: ,若是改加氢氧化钡溶液至中性,离子反应方程式为: 。
(2)向1L 1mol/L的NH4Al(SO4)2溶液中滴加2.25L 等浓度的Ba(OH)2溶液,离子反应方程式为: 。
(3)向含FeI2和FeBr2各1mol 的混合液中通入氯气2.5 mol,离子反应方程式为: 。
(4)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO3-还原为N2。上述反应的离子方程式为 。
(5)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为 。
(6) Fe的一种含氧酸根FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是 。
19.完成下列反应的化学方程式,并指明其中的氧化剂和还原剂。
(1) 、氧化剂 、还原剂 。
(2) 、氧化剂 、还原剂 。
(3) 、氧化剂 、还原剂 。
(4) 、氧化剂 、还原剂 。
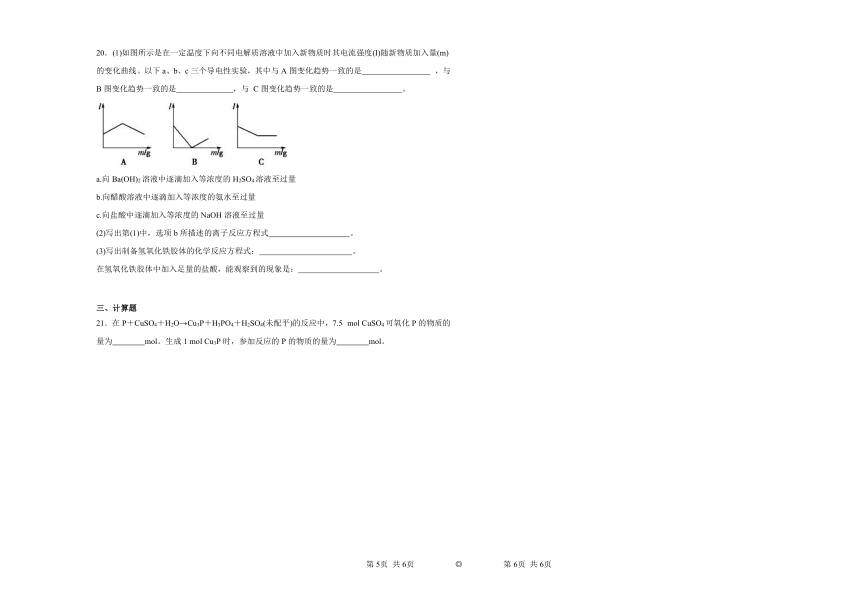
20.(1)如图所示是在一定温度下向不同电解质溶液中加入新物质时其电流强度(I)随新物质加入量(m)的变化曲线。以下a、b、c三个导电性实验,其中与A图变化趋势一致的是 ,与B图变化趋势一致的是 ,与 C图变化趋势一致的是 。
a.向Ba(OH)2溶液中逐滴加入等浓度的H2SO4溶液至过量
b.向醋酸溶液中逐滴加入等浓度的氨水至过量
c.向盐酸中逐滴加入等浓度的NaOH溶液至过量
(2)写出第(1)中,选项b所描述的离子反应方程式 。
(3)写出制备氢氧化铁胶体的化学反应方程式: 。
在氢氧化铁胶体中加入足量的盐酸,能观察到的现象是: 。
三、计算题
21.在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为 mol。生成1 mol Cu3P时,参加反应的P的物质的量为 mol。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【分析】依据由同种物质组成的为纯净物,包括单质和化合物;由不同物质组成的为混合物;在水溶液或熔融状态下能导电的化合物为电解质;在水溶液和熔融状态下都不能导电的化合物为非电解质,电解质和非电解质都是混合物来分析。
【详解】A.盐酸是氯化氢的水溶液,是混合物,故A错误;
B.胆矾、石灰水、硫酸钡、NH3·H2O、NH3分别属于化合物、混合物、强电解质、弱电解质,非电解质,故B正确;
C.氨水是混合物,不是弱电解质,故C错误;
D.氯化氢溶于水完全电离出离子,氯化氢是强电解质,故D错误;
故选:B。
2.A
【详解】A.得失电子不守恒,原子不守恒,正确的离子方程式2Fe2++Cl2=2Cl-+2Fe3+,A符合题意;
B.Ca(OH)2是微溶物,微溶物若是在澄清溶液中,并且作为反应物,书写离子方程式时,拆成离子的形式,若作为生成物,或者是在浑浊液中则写成化学式,B离子方程式书写正确,不符合题意;
C.碳酸钡溶于盐酸,C离子方程式书写正确,不符合题意;
D.金属钠跟水反应生成氢氧化钠和氢气,D离子方程式书写正确,不符合题意;
答案选A。
3.C
【详解】A.使紫色石蕊溶液变红的溶液呈酸性,则CH3COO-不能大量存在,A不符合题意;
B.含MnO的溶液呈紫色,B不符合题意;
C.SO与Mg2+、Cu2+、Cl-、NO均不反应,可以大量存在,C符合题意;
D.在强碱溶液中Al3+不能大量存在,D不符合题意;
故选C。
4.B
【详解】加热时放出的气体可以使品红溶液褪色,则原溶液中一定含有 H2SO3,因 H2SO3不稳定,分解产生的 SO2可使品红溶液褪色;加碱加热后,产生使湿润的红色石蕊试纸变蓝的气体,即有 NH3 产生,说明原溶液中一定含有;加入氯水时,溶液显黄色,说明原溶液中含有 Br-;再加 BaCl2 溶液有不溶于稀 HNO3 的白色沉淀生成,说明此时溶液中含,但可能是原溶液含有的,也可能是氯水氧化 H2SO3 产生的,故不能确定在原溶液中是否存在 ;
答案选B。
5.A
【详解】A.氯化钠为粉末状,取用时应用药匙,瓶塞应倒放,故A正确;
B.废弃硫酸不能倒入下水道,应倒入专用指定容器中,故B错误;
C.不应选用长颈漏斗,故C错误;
D.向试管中滴加液体,胶头滴管不能伸入到试管中,应在试管口竖直上方,故D错误;
答案为A。
6.C
【详解】A. 丁达尔现象是胶体的性质,是区分胶体和溶液的一种常用物理方法,并不是本质区别,溶液和胶体的本质区别是分散质粒子直径的大小不同,故A错误;
B. 胶体粒子是大量氢氧化铁的聚集体,所以含0.1molFeCl3溶质的溶液形成胶体后,胶体粒子小于0.1mol,故B错误;
C. 胶体区别于其它分散系的本质特征是胶体粒子直径在10 9 10 7m之间,溶液的粒子直径小于10 9m,浊液的粒子直径大于10 7m,分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液,故C正确;
D. 有的胶体也是澄清透明的,可以根据能否发生丁达尔效应来区别溶液和胶体,故D错误;
答案选C。
【点睛】胶体的性质中发生丁达尔效应是因为分散质粒子直径的大小10 9 10 7m。
7.A
【详解】A.金属腐蚀即金属被氧化的过程,有新物质生成,属于化学变化,故A符合题意;
B.碘的升华只是碘分子间距发生变化,没有新物质生成,不属于化学变化,故B不符合题意;
C.氯气液化只是氯气分子间距发生变化,没有新物质生成,不属于化学变化,故C不符合题意;
D.矿石粉碎过程中没有新物质生成,不属于化学变化,故D不符合题意;
综上所述答案为A,
8.B
【详解】A. 硫酸铝溶液中加入过量的氨水生成氢氧化铝和硫酸铵:Al3++3NH3·H2O=Al(OH)3↓+3NH,故A正确;
B. 铁片放入过量的稀硝酸中生成硝酸铁、一氧化氮和水:Fe+4H++NO=Fe3++NO↑+2H2O,故B错误;
C. 将铝片放入过量NaOH溶液中生成偏铝酸钠和氢气:2Al+2OH-+6H2O=2Al(OH)+3H2↑,故C正确;
D. 四羟基合铝酸盐与过量盐酸反应生成氯化铝和水:Al(OH)+4H+=Al3++4H2O,故D正确;
故选B。
9.C
【详解】A.实验室制取二氧化碳的反应为碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,该反应是在水溶液中进行的离子反应,故A不符合题意;
B.实验室制取氢气的反应为锌和稀盐酸反应生成氯化锌和氢气,该反应是在水溶液中进行的离子反应,故B不符合题意;
C.实验室用高锰酸钾制取氧气的反应为高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,该反应不是在水溶液中进行的离子反应,故C符合题意;
D.用澄清石灰水检验二氧化碳气体的反应为二氧化碳和澄清石灰水反应生成碳酸钙和水,该反应是在水溶液中进行的离子反应,故D不符合题意;
故选C。
10.C
【详解】A.Ba2+、SiO32-结合生成沉淀,不能大量共存,故A错误;
B.该组离子之间不反应,可大量共存,但通入二氧化硫气体可与SO32-反应,不能大量共存,故B错误;
C.该组离子之间不反应,可大量共存,且通入氨气仍不反应,可大量共存,故C正确;
D.该组离子之间不反应,可大量共存,但通入H2S能被MnO4-、NO3-氧化,不能大量共存,故D错误;
故答案为C。
【点睛】明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等。
11.C
【分析】由氧化还原反应中得失电子守恒,1mol氧化剂得电子越多,生成的I2就多。
【详解】A.1molCl2→2Cl-得2mole-;
B.1molMnO→Mn2+得5mole-;
C.1molCr2O→Cr3+得6mole-;
D.1molHNO3→NO得3mole-;
显然C中1mol氧化剂得电子最多,生成的I2就最多;
故答案为:C。
12.D
【分析】胶体分散系可以产生丁达尔效应,据此解答。
【详解】A.蔗糖溶液不属于胶体,不能产生丁达尔效应,A不选;
B.氢氧化钠溶液不属于胶体,不能产生丁达尔效应,B不选;
C.氯化钾溶液不属于胶体,不能产生丁达尔效应,C不选;
D.氢氧化铁胶体属于胶体分散系,当光束通过氢氧化铁胶体分散系时,能观察到丁达尔效应,D选;
答案选D。
13.D
【详解】A.溶液中加入过量稀NaOH溶液生成碳酸钠和一水合氨,离子方程式:,故A错误;
B.溶液中通入足量的氯气反应生成氯化铁和溴单质,离子方程式为:,故B错误;
C.硫酸亚铁溶液中加入用硫酸酸化的双氧水反应生成硫酸铁和水,离子方程式:,故C错误;
D.足量溶液与小苏打溶液混合,离子方程式:,故D正确;
答案选D。
14.A
【分析】电解法制备高纯铬和硫酸,结合图可知,甲池反应为铬离子得到电子发生还原反应生成铬单质,为阴极区;石墨电极上水中氢氧根离子发生氧化反应生成氧气,为阳极;
【详解】A.HCO存在的溶液为弱碱性,故弱碱性溶液中HCO、Na+、K+、Cl-相互不反应,能共存,A正确;
B.二氧化氮和水生成氧化性物质硝酸,硝酸和亚铁离子、碘离子均会发生氧化还原反应,不共存,B错误;
C.过氧化钠和水生成氢氧化钠,氢氧化钠和铵根离子生成氨气,不共存,C错误;
D.能使甲基橙变为红色的溶液为酸性溶液,酸性溶液中氢离子和S2O反应生成硫单质、二氧化硫,不共存,D错误;
故选A。
15.C
【分析】胶体能产生“丁达尔效应”,溶液不能产生“丁达尔效应”。
【详解】A.氯化钠溶液属于溶液,不能产生“丁达尔效应”,故不选A;
B.硫酸铜溶液属于溶液,不能产生“丁达尔效应”,故不选B;
C.氢氧化铁胶体属于胶体,能产生“丁达尔效应”,故选C;
D.蔗糖溶液属于溶液,不能产生“丁达尔效应”,故不选D;
选C。
16. moL/L ①⑥⑨⑩ ②⑤ 蒸馏 分液漏斗 烧杯
【详解】(1)在VL Al2(SO4)3溶液中,含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为×=moL/L,故答案为:moL/L;
(2)①AgCl为电解质;②CCl4为非电解质;③医用酒精为混合物,既不是电解质也不是非电解质;④液氧为单质,既不是电解质也不是非电解质;
⑤二氧化碳本身不能电离,为非电解质;⑥碳酸氢钠固体在熔化或溶于水完全电离,为电解质;⑦氢氧化钡溶液为混合物,既不是电解质也不是非电解质;
⑧食醋为混合物,既不是电解质也不是非电解质;⑨氧化钠固体,熔化状态下可导电,为电解质;⑩氯化氢气体溶于水完全电离,为电解质;
其中属于电解质的是①⑥⑨⑩;属于非电解质的是②⑤,故答案为:①⑥⑨⑩;②⑤;
(3)实验操作②的名称为蒸馏,操作①为萃取,要用到的玻璃仪器为分液漏斗、烧杯,故答案为:蒸馏;分液漏斗;烧杯。
17.(1)HNO3=H++NO
(2)Ba(OH)2=Ba2++2OH-
(3)Na3PO4=3Na++PO
(4)(NH4)2Fe(SO4)2=2NH+Fe2++2SO
【解析】(1)
HNO3为强酸,在水溶液中发生完全电离,生成氢离子和硝酸根离子,其电离方程式为:HNO3=H++NO;
(2)
Ba(OH)2为强碱,在水溶液中发生完全电离,生成钡离子和氢氧根离子,其电离方程式为:Ba(OH)2=Ba2++2OH-;
(3)
Na3PO4为盐,在水溶液中发生完全电离,生成钠离子和磷酸根离子,其电离方程式为:Na3PO4=3Na++PO;
(4)
(NH4)2Fe(SO4)2为盐,在水溶液中发生完全电离,生成铵根离子、亚铁离子和硫酸根离子,其电离方程式为:(NH4)2Fe(SO4)2=2NH+Fe2++2SO。
18. H++HSO3-=H2O+SO2↑ Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O 2NH4++9OH-+2Al3++4SO42-+4Ba2+=4BaSO4↓+2NH3·H2O+Al(OH)3↓+AlO2-+2H2O 4I-+4Fe2++2Br-+5Cl2=2I2+4Fe3++Br2+10Cl- 2 NO3-+5H2 N2+2OH-+4H2O H2SO3+I2+H2O=4H++SO42-+2I- 4FeO42-+20H+ =4Fe3++3O2↑+10H2O
【分析】(1)向NaHSO4溶液中滴加NaHSO3溶液生成SO2气体;若是改加氢氧化钡溶液至中性,氢离子与氢氧根离子恰好完全反应。
(2)1L 1mol/L的NH4Al(SO4)2溶液中含有1molNH4+、1molAl3+和2molSO42-,滴加2.25L 等浓度的Ba(OH)2溶液,即向溶液中加入2.25molBa2+和4.5molOH-,其中4.5molOH-先生成1molAl(OH)3、1mol/LNH3·H2O、并继续溶解0.5molAl(OH)3生成0.5molAlO2-;
(3)由2Fe3++2I-=2Fe2++I2;2Fe2++Br2=2Br-+2Fe3+可知,还原性强弱顺序是:I->Fe2+>Br-,向溶液中通入氯气,氯气先和碘离子反应,然后再和亚铁离子反应,最后再和溴离子反应;
(4)根据信息:用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,即生成氢氧根离子,据此书写方程式;
(5)碘单质将亚硫酸氧化成硫酸,据此写出反应的离子方程式;
(6) FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,说明有Fe3+生成,并有无色气体产生,根据电子转移守恒,只能为O元素被氧化,故还生成O2,配平书写离子方程式。
【详解】(1)向NaHSO4溶液中滴加NaHSO3溶液的离子反应方程式为H++HSO3-=H2O+SO2↑;将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式为:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O;
(2)1L 1mol/L的NH4Al(SO4)2溶液中含有1molNH4+、1molAl3+和2molSO42-,滴加2.25L 等浓度的Ba(OH)2溶液,即向溶液中加入2.25molBa2+和4.5molOH-,其中4.5molOH-先生成1molAl(OH)3、1mol/LNH3·H2O、并继续溶解0.5molAl(OH)3生成0.5molAlO2-,则发生反应的离子反应方程式为2NH4++9OH-+2Al3++4SO42-+4Ba2+=4BaSO4↓+2NH3·H2O+Al(OH)3↓+AlO2-+2H2O;
(3)含FeI2和FeBr2各1mol 的混合液中含有2molI-、2molFe2+,2molBr-,通入2.5mol Cl2,应依次氧化2molI-、2molFe2+和1molBr-,则发生反应的离子方程式为4I-+4Fe2++2Br-+5Cl2=2I2+4Fe3++Br2+10Cl-;
(4)根据信息:用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,即生成氢氧根离子,发生的反应为:2NO3-+5H2N2+2OH-+4H2O;
(5)碘单质与亚硫酸发生氧化还原反应,反应的离子方程式为:H2SO3+I2+H2O=4H++SO42-+2I-;
(6) FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,说明有Fe3+生成,并有无色气体产生,根据电子转移守恒,只能为O元素被氧化,故还生成O2,反应离子方程式为:4FeO42-+20H+=4Fe3++3O2↑+10H2O。
19.(1) SnO2 C
(2) WO3 H2
(3) O2 PbS
(4) UF4 Mg
【详解】(1)在反应中,SnO2Sn中Sn元素的化合价由+4价降低到0价,所以SnO2为氧化剂;CCO中C元素的化合价由0价升高到+2价,所以C为还原剂,故答案:;SnO2;C。
(2)在反应中,WO3中W元素化合价由+6价降低到0价,所以WO3为氧化剂;H2H2O中H元素的化合价由0价升高到+1价,所以H2为还原剂,故答案:;WO3;H2。
(3)在反应中,PbS中S元素的化合价由-2价升高到+4价,所以PbS为还原剂,O2H2O中O元素的化合价由0价升降低到-2价,所以O2为氧化剂;故答案:;O2;PbS。
(4)在反应中,UF4中U元素化合价由+4价降低到0价,所以UF4为氧化剂;MgMgF2中Mg元素的化合价由0价升高到+2价,所以Mg为还原剂,故答案:;UF4;Mg。
20. b a c CH3COOH+NH3 H2O=CH3COO-++H2O FeCl3+3H2OFe(OH)3(胶体)+3HCl 先逐渐产生红褐色沉淀,而后沉淀逐渐溶解,溶液呈棕黄色
【详解】(1)电解质溶液导电性与离子浓度和离子所带电荷呈正比,
a.氢氧化钡溶液中加入等浓度的硫酸至过量,二者发生反应生成硫酸钡沉淀和水,硫酸钡为难溶物,溶液离子浓度先减小,当二者恰好完全反应时,溶液不导电,继续加入稀硫酸,离子浓度增大,溶液导电性增强,所以B符合;
b.醋酸是弱电解质,离子浓度较小,导电性较弱,加入等浓度的氨水,二者反应生成强电解质醋酸铵,离子浓度增大,溶液导电性增强,二者恰好反应后继续滴加氨水,离子浓度变小,导电性变小,所以A符合;
c.向稀盐酸溶液中加入等浓度的NaOH溶液,二者反应生成强电解质氯化钠和弱电解质水,溶液体积增大导致离子浓度减小,溶液导电性减小,当二者完全反应后继续滴加NaOH溶液,当NaOH溶液体积无限增大时溶液浓度相当于NaOH溶液,导电性不变,所以C符合,
故答案为:b;a;c;
(2)b为向醋酸溶液中逐滴加入等浓度的氨水,二者反应生成醋酸铵和水,反应离子方程式为CH3COOH+NH3 H2O=CH3COO-++H2O;
(3)实验室通过向沸水中滴加几滴饱和FeCl3溶液并加热至溶液呈红褐色制备Fe(OH)3胶体,反应化学方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl;盐酸为HCl的水溶液,HCl为强电解质,因此在氢氧化铁胶体中加入足量的盐酸,胶体会先发生聚沉生成红褐色Fe(OH)3沉淀,而后再滴加盐酸,盐酸与Fe(OH)3沉淀反应生成FeCl3,沉淀逐渐溶解,溶液变为棕黄色,故答案为:FeCl3+3H2OFe(OH)3(胶体)+3HCl;先逐渐产生红褐色沉淀,而后沉淀逐渐溶解,溶液呈棕黄色。
答案第1页,共2页
答案第1页,共2页
学校:___________姓名:___________班级:___________考号:___________
一、单选题
1.下列物质按纯净物、混合物、强电解质、弱电解质、非电解质的组合正确的是
纯净物 混合物 强电解质 弱电解质 非电解质
A 盐酸 水煤气 硫酸 醋酸 HD
B 胆矾 石灰水 硫酸钡 NH3·H2O NH3
C 火碱 蔗糖溶液 氯化钠 氨水 三氧化硫
D 冰醋酸 氢氧化铁胶体 苛性钾 氯化氢 乙醇
A.A B.B C.C D.D
2.下列离子方程式书写不正确的是( )
A.氯气通入氯化亚铁溶液Fe2++Cl2=Cl-+Fe3+
B.澄清的石灰水跟盐酸反应H++OH-=H2O
C.碳酸钡溶于盐酸BaCO3+2H+=Ba2++H2O+CO2↑
D.金属钠跟水反应2Na+2H2O=2Na++2OH-+H2↑
3.下列各组离子在指定溶液中一定能大量共存的是
A.能使紫色石蕊溶液变红的溶液:Na+、Mg2+、Cl-、CH3COO-
B.无色溶液:K+、H+、SO、MnO
C.含大量SO的澄清溶液:Mg2+、Cu2+、Cl-、NO
D.强碱溶液:K+、Al3+、Cl-、NO
4.对某酸性溶液(可能含有、、、)分别进行如下实验:①加热时放出的气体可以使品红溶液褪色;②加碱调至碱性后,加热时放出的气体可以使润湿的红色石蕊试纸变蓝;③加入氯水时,溶液略显黄色,再加入溶液,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在原溶液中是否存在的是
A. B. C. D.
5.下列实验装置或操作正确的是
A.图1取用药品 B.图2处理废弃硫酸
C.图3检查气密性 D.图4滴加液体
6.下列有关说法正确的是( )
A.溶液和胶体的本质区别是能否发生丁达尔效应
B.含0.1 mol FeCl3溶质的溶液形成胶体后,胶体粒子为0.1 mol
C.分散系中分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液
D.可通过观察液体是否澄清透明来区别溶液和胶体
7.下列变化属于化学变化的是
A.金属腐蚀 B.碘的升华
C.氯气液化 D.矿石粉碎
8.下列各反应的离子方程式中,错误的是
A.硫酸铝溶液中加入过量的氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH
B.铁片放入过量的稀硝酸中:3Fe+8H++2NO=3Fe2++2NO2↑+4H2O
C.将铝片放入过量NaOH溶液中:2Al+2OH-+6H2O=2Al(OH)+3H2↑
D.四羟基合铝酸盐与过量盐酸反应:Al(OH)+4H+=Al3++4H2O
9.下列气体的制备或检验过程中,发生的反应不是离子反应的是
A.实验室制取二氧化碳 B.实验室制取氢气
C.实验室用高锰酸钾制取氧气 D.用澄清石灰水检验二氧化碳气体
10.下列各组离子能大量共存,向溶液中通入足量相应气体后,各离子还能大量存在的是( )
A.氯气:K+ Ba2+ SiO32— NO3— B.二氧化硫:Na+ NH4+ SO32— Cl—
C.氨气:K+ Na+ AlO2— CO32— D.硫化氢:Ca2+ Mg2+ MnO4— NO3—
11.已知在酸性条件下,下列物质氧化KI时,自身发生如下变化:Cl2→2Cl﹣ ; MnO→Mn2+ ; Cr2O→Cr3+ ; HNO3→NO ;如果分别用等物质的量的这些物质氧化足量的KI,得到I2的物质的量最多的是
A.Cl2 B.MnO C.Cr2O D.HNO3
12.当光束通过下列分散系时,能观察到丁达尔效应的是
A.蔗糖溶液 B.氢氧化钠溶液 C.氯化钾溶液 D.氢氧化铁胶体
13.下列离子方程式正确的是
A.溶液中加入过量稀NaOH溶液:
B.溶液中通入足量的氯气:
C.硫酸亚铁溶液中加入用硫酸酸化的双氧水:
D.足量溶液与小苏打溶液混合:
14.下列各组离子在指定的条件下一定能大量共存的是
A.弱碱性溶液:HCO、Na+、K+、Cl-
B.通入NO2溶液:Cu2+、Al3+、Fe2+、I-
C.加入Na2O2的溶液:AlO、Cl-、S2-、NH
D.能使甲基橙变为红色的溶液:NH、Na+、K+、S2O
15.下列分散系能产生“丁达尔效应”的是
A.氯化钠溶液 B.硫酸铜溶液 C.氢氧化铁胶体 D.蔗糖溶液
二、填空题
16.(1)在VL Al2(SO4)3溶液中,含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为
(2)有以下物质:①AgCl;②CCl4;③医用酒精;④液氧;⑤二氧化碳;⑥碳酸氢钠固体;⑦氢氧化钡溶液;⑧食醋;⑨氧化钠固体;⑩氯化氢气体。其中属于电解质的是 (填序号,下同);属于非电解质的是
(3)实验室简单模拟从海水中提取溴单质的部分流程如图
实验操作②的名称 ,操作①中要用到的玻璃仪器 、
17.正确书写以下物质在水溶液中的电离方程式
(1)HNO3:
(2)Ba(OH)2:
(3)Na3PO4:
(4)(NH4)2Fe(SO4)2:
18.(1)向NaHSO4溶液中滴加NaHSO3溶液的离子反应方程式为: ,若是改加氢氧化钡溶液至中性,离子反应方程式为: 。
(2)向1L 1mol/L的NH4Al(SO4)2溶液中滴加2.25L 等浓度的Ba(OH)2溶液,离子反应方程式为: 。
(3)向含FeI2和FeBr2各1mol 的混合液中通入氯气2.5 mol,离子反应方程式为: 。
(4)化学在环境保护中起着十分重要的作用,催化反硝化法可用于治理水中硝酸盐的污染,催化反硝化法中H2能将NO3-还原为N2。上述反应的离子方程式为 。
(5)利用I2的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化成H2SO3,然后用一定浓度的I2溶液进行滴定,滴定反应的离子方程式为 。
(6) Fe的一种含氧酸根FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,并有无色气体产生。该反应的离子方程式是 。
19.完成下列反应的化学方程式,并指明其中的氧化剂和还原剂。
(1) 、氧化剂 、还原剂 。
(2) 、氧化剂 、还原剂 。
(3) 、氧化剂 、还原剂 。
(4) 、氧化剂 、还原剂 。
20.(1)如图所示是在一定温度下向不同电解质溶液中加入新物质时其电流强度(I)随新物质加入量(m)的变化曲线。以下a、b、c三个导电性实验,其中与A图变化趋势一致的是 ,与B图变化趋势一致的是 ,与 C图变化趋势一致的是 。
a.向Ba(OH)2溶液中逐滴加入等浓度的H2SO4溶液至过量
b.向醋酸溶液中逐滴加入等浓度的氨水至过量
c.向盐酸中逐滴加入等浓度的NaOH溶液至过量
(2)写出第(1)中,选项b所描述的离子反应方程式 。
(3)写出制备氢氧化铁胶体的化学反应方程式: 。
在氢氧化铁胶体中加入足量的盐酸,能观察到的现象是: 。
三、计算题
21.在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为 mol。生成1 mol Cu3P时,参加反应的P的物质的量为 mol。
第1页 共4页 ◎ 第2页 共4页
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.B
【分析】依据由同种物质组成的为纯净物,包括单质和化合物;由不同物质组成的为混合物;在水溶液或熔融状态下能导电的化合物为电解质;在水溶液和熔融状态下都不能导电的化合物为非电解质,电解质和非电解质都是混合物来分析。
【详解】A.盐酸是氯化氢的水溶液,是混合物,故A错误;
B.胆矾、石灰水、硫酸钡、NH3·H2O、NH3分别属于化合物、混合物、强电解质、弱电解质,非电解质,故B正确;
C.氨水是混合物,不是弱电解质,故C错误;
D.氯化氢溶于水完全电离出离子,氯化氢是强电解质,故D错误;
故选:B。
2.A
【详解】A.得失电子不守恒,原子不守恒,正确的离子方程式2Fe2++Cl2=2Cl-+2Fe3+,A符合题意;
B.Ca(OH)2是微溶物,微溶物若是在澄清溶液中,并且作为反应物,书写离子方程式时,拆成离子的形式,若作为生成物,或者是在浑浊液中则写成化学式,B离子方程式书写正确,不符合题意;
C.碳酸钡溶于盐酸,C离子方程式书写正确,不符合题意;
D.金属钠跟水反应生成氢氧化钠和氢气,D离子方程式书写正确,不符合题意;
答案选A。
3.C
【详解】A.使紫色石蕊溶液变红的溶液呈酸性,则CH3COO-不能大量存在,A不符合题意;
B.含MnO的溶液呈紫色,B不符合题意;
C.SO与Mg2+、Cu2+、Cl-、NO均不反应,可以大量存在,C符合题意;
D.在强碱溶液中Al3+不能大量存在,D不符合题意;
故选C。
4.B
【详解】加热时放出的气体可以使品红溶液褪色,则原溶液中一定含有 H2SO3,因 H2SO3不稳定,分解产生的 SO2可使品红溶液褪色;加碱加热后,产生使湿润的红色石蕊试纸变蓝的气体,即有 NH3 产生,说明原溶液中一定含有;加入氯水时,溶液显黄色,说明原溶液中含有 Br-;再加 BaCl2 溶液有不溶于稀 HNO3 的白色沉淀生成,说明此时溶液中含,但可能是原溶液含有的,也可能是氯水氧化 H2SO3 产生的,故不能确定在原溶液中是否存在 ;
答案选B。
5.A
【详解】A.氯化钠为粉末状,取用时应用药匙,瓶塞应倒放,故A正确;
B.废弃硫酸不能倒入下水道,应倒入专用指定容器中,故B错误;
C.不应选用长颈漏斗,故C错误;
D.向试管中滴加液体,胶头滴管不能伸入到试管中,应在试管口竖直上方,故D错误;
答案为A。
6.C
【详解】A. 丁达尔现象是胶体的性质,是区分胶体和溶液的一种常用物理方法,并不是本质区别,溶液和胶体的本质区别是分散质粒子直径的大小不同,故A错误;
B. 胶体粒子是大量氢氧化铁的聚集体,所以含0.1molFeCl3溶质的溶液形成胶体后,胶体粒子小于0.1mol,故B错误;
C. 胶体区别于其它分散系的本质特征是胶体粒子直径在10 9 10 7m之间,溶液的粒子直径小于10 9m,浊液的粒子直径大于10 7m,分散质粒子的直径:Fe(OH)3悬浊液>Fe(OH)3胶体>FeCl3溶液,故C正确;
D. 有的胶体也是澄清透明的,可以根据能否发生丁达尔效应来区别溶液和胶体,故D错误;
答案选C。
【点睛】胶体的性质中发生丁达尔效应是因为分散质粒子直径的大小10 9 10 7m。
7.A
【详解】A.金属腐蚀即金属被氧化的过程,有新物质生成,属于化学变化,故A符合题意;
B.碘的升华只是碘分子间距发生变化,没有新物质生成,不属于化学变化,故B不符合题意;
C.氯气液化只是氯气分子间距发生变化,没有新物质生成,不属于化学变化,故C不符合题意;
D.矿石粉碎过程中没有新物质生成,不属于化学变化,故D不符合题意;
综上所述答案为A,
8.B
【详解】A. 硫酸铝溶液中加入过量的氨水生成氢氧化铝和硫酸铵:Al3++3NH3·H2O=Al(OH)3↓+3NH,故A正确;
B. 铁片放入过量的稀硝酸中生成硝酸铁、一氧化氮和水:Fe+4H++NO=Fe3++NO↑+2H2O,故B错误;
C. 将铝片放入过量NaOH溶液中生成偏铝酸钠和氢气:2Al+2OH-+6H2O=2Al(OH)+3H2↑,故C正确;
D. 四羟基合铝酸盐与过量盐酸反应生成氯化铝和水:Al(OH)+4H+=Al3++4H2O,故D正确;
故选B。
9.C
【详解】A.实验室制取二氧化碳的反应为碳酸钙和稀盐酸反应生成氯化钙、二氧化碳和水,该反应是在水溶液中进行的离子反应,故A不符合题意;
B.实验室制取氢气的反应为锌和稀盐酸反应生成氯化锌和氢气,该反应是在水溶液中进行的离子反应,故B不符合题意;
C.实验室用高锰酸钾制取氧气的反应为高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气,该反应不是在水溶液中进行的离子反应,故C符合题意;
D.用澄清石灰水检验二氧化碳气体的反应为二氧化碳和澄清石灰水反应生成碳酸钙和水,该反应是在水溶液中进行的离子反应,故D不符合题意;
故选C。
10.C
【详解】A.Ba2+、SiO32-结合生成沉淀,不能大量共存,故A错误;
B.该组离子之间不反应,可大量共存,但通入二氧化硫气体可与SO32-反应,不能大量共存,故B错误;
C.该组离子之间不反应,可大量共存,且通入氨气仍不反应,可大量共存,故C正确;
D.该组离子之间不反应,可大量共存,但通入H2S能被MnO4-、NO3-氧化,不能大量共存,故D错误;
故答案为C。
【点睛】明确离子不能大量共存的一般情况:能发生复分解反应的离子之间; 能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;解决离子共存问题时还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等。
11.C
【分析】由氧化还原反应中得失电子守恒,1mol氧化剂得电子越多,生成的I2就多。
【详解】A.1molCl2→2Cl-得2mole-;
B.1molMnO→Mn2+得5mole-;
C.1molCr2O→Cr3+得6mole-;
D.1molHNO3→NO得3mole-;
显然C中1mol氧化剂得电子最多,生成的I2就最多;
故答案为:C。
12.D
【分析】胶体分散系可以产生丁达尔效应,据此解答。
【详解】A.蔗糖溶液不属于胶体,不能产生丁达尔效应,A不选;
B.氢氧化钠溶液不属于胶体,不能产生丁达尔效应,B不选;
C.氯化钾溶液不属于胶体,不能产生丁达尔效应,C不选;
D.氢氧化铁胶体属于胶体分散系,当光束通过氢氧化铁胶体分散系时,能观察到丁达尔效应,D选;
答案选D。
13.D
【详解】A.溶液中加入过量稀NaOH溶液生成碳酸钠和一水合氨,离子方程式:,故A错误;
B.溶液中通入足量的氯气反应生成氯化铁和溴单质,离子方程式为:,故B错误;
C.硫酸亚铁溶液中加入用硫酸酸化的双氧水反应生成硫酸铁和水,离子方程式:,故C错误;
D.足量溶液与小苏打溶液混合,离子方程式:,故D正确;
答案选D。
14.A
【分析】电解法制备高纯铬和硫酸,结合图可知,甲池反应为铬离子得到电子发生还原反应生成铬单质,为阴极区;石墨电极上水中氢氧根离子发生氧化反应生成氧气,为阳极;
【详解】A.HCO存在的溶液为弱碱性,故弱碱性溶液中HCO、Na+、K+、Cl-相互不反应,能共存,A正确;
B.二氧化氮和水生成氧化性物质硝酸,硝酸和亚铁离子、碘离子均会发生氧化还原反应,不共存,B错误;
C.过氧化钠和水生成氢氧化钠,氢氧化钠和铵根离子生成氨气,不共存,C错误;
D.能使甲基橙变为红色的溶液为酸性溶液,酸性溶液中氢离子和S2O反应生成硫单质、二氧化硫,不共存,D错误;
故选A。
15.C
【分析】胶体能产生“丁达尔效应”,溶液不能产生“丁达尔效应”。
【详解】A.氯化钠溶液属于溶液,不能产生“丁达尔效应”,故不选A;
B.硫酸铜溶液属于溶液,不能产生“丁达尔效应”,故不选B;
C.氢氧化铁胶体属于胶体,能产生“丁达尔效应”,故选C;
D.蔗糖溶液属于溶液,不能产生“丁达尔效应”,故不选D;
选C。
16. moL/L ①⑥⑨⑩ ②⑤ 蒸馏 分液漏斗 烧杯
【详解】(1)在VL Al2(SO4)3溶液中,含Al3+的质量为a g,则Al2(SO4)3溶液的物质的量浓度为×=moL/L,故答案为:moL/L;
(2)①AgCl为电解质;②CCl4为非电解质;③医用酒精为混合物,既不是电解质也不是非电解质;④液氧为单质,既不是电解质也不是非电解质;
⑤二氧化碳本身不能电离,为非电解质;⑥碳酸氢钠固体在熔化或溶于水完全电离,为电解质;⑦氢氧化钡溶液为混合物,既不是电解质也不是非电解质;
⑧食醋为混合物,既不是电解质也不是非电解质;⑨氧化钠固体,熔化状态下可导电,为电解质;⑩氯化氢气体溶于水完全电离,为电解质;
其中属于电解质的是①⑥⑨⑩;属于非电解质的是②⑤,故答案为:①⑥⑨⑩;②⑤;
(3)实验操作②的名称为蒸馏,操作①为萃取,要用到的玻璃仪器为分液漏斗、烧杯,故答案为:蒸馏;分液漏斗;烧杯。
17.(1)HNO3=H++NO
(2)Ba(OH)2=Ba2++2OH-
(3)Na3PO4=3Na++PO
(4)(NH4)2Fe(SO4)2=2NH+Fe2++2SO
【解析】(1)
HNO3为强酸,在水溶液中发生完全电离,生成氢离子和硝酸根离子,其电离方程式为:HNO3=H++NO;
(2)
Ba(OH)2为强碱,在水溶液中发生完全电离,生成钡离子和氢氧根离子,其电离方程式为:Ba(OH)2=Ba2++2OH-;
(3)
Na3PO4为盐,在水溶液中发生完全电离,生成钠离子和磷酸根离子,其电离方程式为:Na3PO4=3Na++PO;
(4)
(NH4)2Fe(SO4)2为盐,在水溶液中发生完全电离,生成铵根离子、亚铁离子和硫酸根离子,其电离方程式为:(NH4)2Fe(SO4)2=2NH+Fe2++2SO。
18. H++HSO3-=H2O+SO2↑ Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O 2NH4++9OH-+2Al3++4SO42-+4Ba2+=4BaSO4↓+2NH3·H2O+Al(OH)3↓+AlO2-+2H2O 4I-+4Fe2++2Br-+5Cl2=2I2+4Fe3++Br2+10Cl- 2 NO3-+5H2 N2+2OH-+4H2O H2SO3+I2+H2O=4H++SO42-+2I- 4FeO42-+20H+ =4Fe3++3O2↑+10H2O
【分析】(1)向NaHSO4溶液中滴加NaHSO3溶液生成SO2气体;若是改加氢氧化钡溶液至中性,氢离子与氢氧根离子恰好完全反应。
(2)1L 1mol/L的NH4Al(SO4)2溶液中含有1molNH4+、1molAl3+和2molSO42-,滴加2.25L 等浓度的Ba(OH)2溶液,即向溶液中加入2.25molBa2+和4.5molOH-,其中4.5molOH-先生成1molAl(OH)3、1mol/LNH3·H2O、并继续溶解0.5molAl(OH)3生成0.5molAlO2-;
(3)由2Fe3++2I-=2Fe2++I2;2Fe2++Br2=2Br-+2Fe3+可知,还原性强弱顺序是:I->Fe2+>Br-,向溶液中通入氯气,氯气先和碘离子反应,然后再和亚铁离子反应,最后再和溴离子反应;
(4)根据信息:用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,即生成氢氧根离子,据此书写方程式;
(5)碘单质将亚硫酸氧化成硫酸,据此写出反应的离子方程式;
(6) FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,说明有Fe3+生成,并有无色气体产生,根据电子转移守恒,只能为O元素被氧化,故还生成O2,配平书写离子方程式。
【详解】(1)向NaHSO4溶液中滴加NaHSO3溶液的离子反应方程式为H++HSO3-=H2O+SO2↑;将NaHSO4溶液滴入氢氧化钡溶液中至中性的离子反应方程式为:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O;
(2)1L 1mol/L的NH4Al(SO4)2溶液中含有1molNH4+、1molAl3+和2molSO42-,滴加2.25L 等浓度的Ba(OH)2溶液,即向溶液中加入2.25molBa2+和4.5molOH-,其中4.5molOH-先生成1molAl(OH)3、1mol/LNH3·H2O、并继续溶解0.5molAl(OH)3生成0.5molAlO2-,则发生反应的离子反应方程式为2NH4++9OH-+2Al3++4SO42-+4Ba2+=4BaSO4↓+2NH3·H2O+Al(OH)3↓+AlO2-+2H2O;
(3)含FeI2和FeBr2各1mol 的混合液中含有2molI-、2molFe2+,2molBr-,通入2.5mol Cl2,应依次氧化2molI-、2molFe2+和1molBr-,则发生反应的离子方程式为4I-+4Fe2++2Br-+5Cl2=2I2+4Fe3++Br2+10Cl-;
(4)根据信息:用H2将NO3-还原为N2,一段时间后,溶液的碱性明显增强,即生成氢氧根离子,发生的反应为:2NO3-+5H2N2+2OH-+4H2O;
(5)碘单质与亚硫酸发生氧化还原反应,反应的离子方程式为:H2SO3+I2+H2O=4H++SO42-+2I-;
(6) FeO42-具有强氧化性,在其钠盐溶液中加入稀硫酸,溶液变为黄色,说明有Fe3+生成,并有无色气体产生,根据电子转移守恒,只能为O元素被氧化,故还生成O2,反应离子方程式为:4FeO42-+20H+=4Fe3++3O2↑+10H2O。
19.(1) SnO2 C
(2) WO3 H2
(3) O2 PbS
(4) UF4 Mg
【详解】(1)在反应中,SnO2Sn中Sn元素的化合价由+4价降低到0价,所以SnO2为氧化剂;CCO中C元素的化合价由0价升高到+2价,所以C为还原剂,故答案:;SnO2;C。
(2)在反应中,WO3中W元素化合价由+6价降低到0价,所以WO3为氧化剂;H2H2O中H元素的化合价由0价升高到+1价,所以H2为还原剂,故答案:;WO3;H2。
(3)在反应中,PbS中S元素的化合价由-2价升高到+4价,所以PbS为还原剂,O2H2O中O元素的化合价由0价升降低到-2价,所以O2为氧化剂;故答案:;O2;PbS。
(4)在反应中,UF4中U元素化合价由+4价降低到0价,所以UF4为氧化剂;MgMgF2中Mg元素的化合价由0价升高到+2价,所以Mg为还原剂,故答案:;UF4;Mg。
20. b a c CH3COOH+NH3 H2O=CH3COO-++H2O FeCl3+3H2OFe(OH)3(胶体)+3HCl 先逐渐产生红褐色沉淀,而后沉淀逐渐溶解,溶液呈棕黄色
【详解】(1)电解质溶液导电性与离子浓度和离子所带电荷呈正比,
a.氢氧化钡溶液中加入等浓度的硫酸至过量,二者发生反应生成硫酸钡沉淀和水,硫酸钡为难溶物,溶液离子浓度先减小,当二者恰好完全反应时,溶液不导电,继续加入稀硫酸,离子浓度增大,溶液导电性增强,所以B符合;
b.醋酸是弱电解质,离子浓度较小,导电性较弱,加入等浓度的氨水,二者反应生成强电解质醋酸铵,离子浓度增大,溶液导电性增强,二者恰好反应后继续滴加氨水,离子浓度变小,导电性变小,所以A符合;
c.向稀盐酸溶液中加入等浓度的NaOH溶液,二者反应生成强电解质氯化钠和弱电解质水,溶液体积增大导致离子浓度减小,溶液导电性减小,当二者完全反应后继续滴加NaOH溶液,当NaOH溶液体积无限增大时溶液浓度相当于NaOH溶液,导电性不变,所以C符合,
故答案为:b;a;c;
(2)b为向醋酸溶液中逐滴加入等浓度的氨水,二者反应生成醋酸铵和水,反应离子方程式为CH3COOH+NH3 H2O=CH3COO-++H2O;
(3)实验室通过向沸水中滴加几滴饱和FeCl3溶液并加热至溶液呈红褐色制备Fe(OH)3胶体,反应化学方程式为FeCl3+3H2OFe(OH)3(胶体)+3HCl;盐酸为HCl的水溶液,HCl为强电解质,因此在氢氧化铁胶体中加入足量的盐酸,胶体会先发生聚沉生成红褐色Fe(OH)3沉淀,而后再滴加盐酸,盐酸与Fe(OH)3沉淀反应生成FeCl3,沉淀逐渐溶解,溶液变为棕黄色,故答案为:FeCl3+3H2OFe(OH)3(胶体)+3HCl;先逐渐产生红褐色沉淀,而后沉淀逐渐溶解,溶液呈棕黄色。
答案第1页,共2页
答案第1页,共2页
