1.1 课时3 反应焓变的计算 课件 (共20张PPT)2023-2024学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.1 课时3 反应焓变的计算 课件 (共20张PPT)2023-2024学年高二化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 741.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 15:30:57 | ||
图片预览








文档简介
(共20张PPT)
第1节 化学反应的热效应 课时3
第1章 物质的性质与转化
1.能根据盖斯定律求算反应焓变,认识热力学状态函数的变化与变化途径无关;
2.能从综合能量变化、物质变化角度解决燃料选择、利用等实际问题;
3.了解摩尔燃烧焓的概念。
联想·质疑
联想·质疑
在生产中,对燃料的燃烧、反应条件的控制以及废热的利用,都需要知道物质在发生化学反应时所放出或吸收的热量。
C(s)+(g)=CO (g)
例如,对于化学反应:
这个反应的反应热是冶金工业中非常有用的数据,应该如何获得呢?
C燃烧时不可能全部生成CO,总有一部分CO2生成,因此该反应的反应热无法直接测定。
怎么计算该反应的反应热呢?
N2(g) + 2O2 (g)
2 NO2(g)
ΔH1
ΔH2
ΔH3
2NO (g) + O2 (g)
ΔH3= ΔH1 + ΔH2
①N2 (g) + O2 (g) === 2NO (g) ΔH1 =+180.5 kJ/mol
②2NO (g) + O2 (g) === 2NO2 (g) ΔH2 =-112.8 kJ/mol
③N2 (g) + 2O2 (g) === 2NO2 (g) ΔH3 =+ 67.7 kJ/mol
思考与交流
方法一
方法二
请判断哪种方法生成2molNO2(g)的反应热最少?
一、反应焓变的计算
1.盖斯定律
(1)定义:一个化学反应无论是一步完成还是分几步完成,反应热是相同的。
盖斯定律表明,在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应进行的途径无关。
A
B
C
ΔH
ΔH1
ΔH2
ΔH = ΔH1 + ΔH2
登山时上升的高度与登山路径无关
始态
终态
体系吸收热量
H2>0
体系放出热量
H1 <0
经过一个循环,物质没有发生变化,就不能引发能量变化,即 H1+ H2=0
推论:同一个热化学反应方程式,正向反应 H1与逆向反应 H2大小相等,符号相反,即: H1= – H2
①反应进行得很慢
②反应不容易直接发生
③反应的产品不纯
间接计算
ΔH
如C(s)+(g)=CO (g)
的反应热无法直接测定,但下列两个反应的反应热却可以直接测定:
C(s)+O2(g)=CO2(g) H1= -393.5 kJ/mol
CO(g)+ O2 (g)=CO2(g) H2= -283.0 kJ/mol
(2)在科学研究中的重要意义:
热化学之父
盖斯定律
根据盖斯定律,则有:
= -393.5kJ/mol-(-283.0kJ/mol)
= -110.5kJ/mol
H1= H2+ H3
H3= H1- H2
H1
H3
H2
C(s)+O2(g)
CO2(g)
CO(g)+ O2 (g)
C(s)+ O2(g)=CO (g) H3 = -110.5kJ/mol
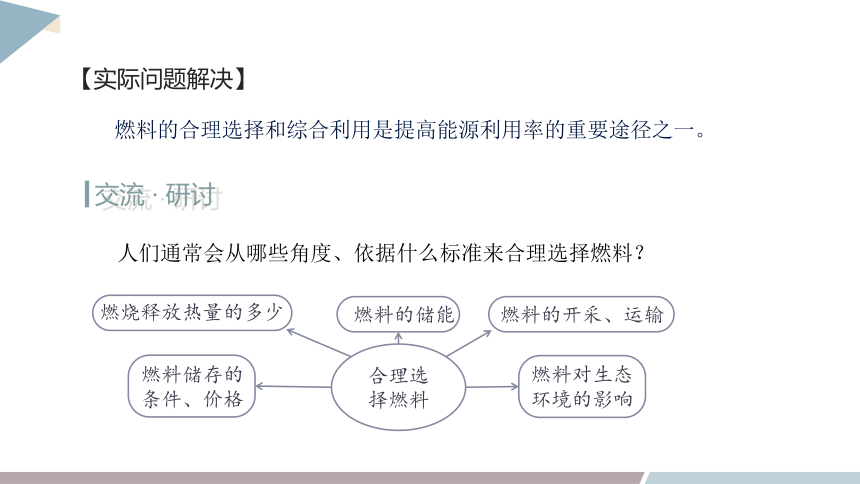
【实际问题解决】
燃料的合理选择和综合利用是提高能源利用率的重要途径之一。
交流 · 研讨
交流 · 研讨
人们通常会从哪些角度、依据什么标准来合理选择燃料?
燃烧释放热量的多少
燃料的储能
燃料的开采、运输
燃料储存的
条件、价格
燃料对生态
环境的影响
合理选
择燃料
交流 · 研讨
交流 · 研讨
请同学们结合下表中的数据,评价煤、天然气、氢气、一氧化碳作为燃料的优缺点。
(注:煤的燃烧焓可用石墨的燃烧焓数据粗略估算)
物质 化学式 ΔH/(kJ/mol)
石墨 C(s) -393.5
氢气 H2(g) -285.8
一氧化碳 CO(g) -283.0
甲烷 CH4(g) -890.3
表1 几种物质的摩尔燃烧焓(298 K,101 kPa)
某物质的摩尔燃烧焓指在一定反应温度和压强条件下,1 mol纯物质完全氧化为同温下的指定产物时的焓变。
①N → N2(g) ② C→CO2(g)
③ S →SO2(g) ④H→H2O(l)
目前,煤在我国仍然是第一能源。但是,将煤直接用作燃料,不仅利用率低,而且会产生大量固体垃圾和多种有害气体。为了解决这一问题,工业上通过煤的干馏、气化和液化等方法来实现煤的综合利用。煤的气化是将煤转化为可燃性气体的过程,主要反应为:
C(s) + H2O(g)===CO(g)+ H2(g)
高温
(1)你认为煤的气化对于提高能源利用效率有哪些价值?
a.煤气化后增大接触面积,燃烧更充分,节约资源,减少成本;
b.减少燃料中N和S的含量,减少其氧化物对环境的污染;
c.更有利于运输,气体可通过管道运输,减少损耗,降低成本。
(2)已知298 K、101 kPa时, 1 mol H2O(l) 变为H2O(g)需要吸收44.0 kJ的热量。则上述煤的气化反应的焓变是多少 ?
待求反应:
C(s) + H2O(g)===CO(g)+ H2(g)
高温
ΔH=?
已知反应:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
④H2O(l)===H2O(g) ΔH4=+44.0 kJ·mol-1
②CO(g)+ O2(g)===CO2(g) ΔH2=-283.0 kJ·mol-1
③H2(g)+ O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
①找出待求热化学方程式中反应物与反应产物在已知热化学方程式中的位置。
×(-1)
×(-1)
×(-1)
②调整已知热化学方程式方向、计量数和ΔH。
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②CO2(g)===CO(g)+ O2(g) ΔH2`=+283.0 kJ·mol-1
③H2O(l)===H2(g)+ O2(g) ΔH3`=+285.8 kJ·mol-1
④H2O(g)===H2O(l) ΔH4`=-44.0 kJ·mol-1
③加和已调整的热化学方程式中的ΔH,确定待求反应的ΔH。
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②CO2(g)===CO(g)+ O2(g) ΔH2`=+283.0 kJ·mol-1
③H2O(l)===H2(g)+ O2(g) ΔH3`=+285.8 kJ·mol-1
④H2O(g)===H2O(l) ΔH4`=-44.0 kJ·mol-1
ΔH=ΔH1 +ΔH2`+ ΔH3` +ΔH4`
ΔH=+131.3 kJ/mol
①热化学方程式中物质的化学计量数同乘以某一数时,反应热数值也必须乘以该数;
②热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减;
③将一个热化学方程式颠倒时, H的数值不变,但“+”、“-”号必须随之改变;
④若热化学方程式相减,最好能先把被减方程式进行颠倒,然后相加,更不易出错。
应用盖斯定律计算反应热应注意:
【总结】若一个化学方程式可由另外几个化学方程式相加减而得到,则该化学反应的焓变即为这几个化学反应焓变的代数和。
【练一练】
1.判断正误
(1)对一个化学反应,在一定条件下,如果反应的途径不同,其焓变一定不同( )
(2)使用催化剂能够降低化学反应的反应热( )
(3)化学反应的焓变与方程式的书写方式无关( )
(4)同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同( )
(5)在 中,存在关系式:ΔH1=ΔH2+ΔH3。( )
2.按照盖斯定律,结合下述反应方程式回答问题,已知:
①NH3(g)+HCl(g)=NH4Cl(s) △H1=-176kJ/mol
②NH3(g)+H2O(l)=NH3(aq) △H2=-35.1kJ/mol
③HCl(g) +H2O(l)=HCl(aq) △H3=-72.3kJ/mol
④NH3(aq)+ HCl(aq)=NH4Cl(aq) △H4=-52.3kJ/mol
⑤NH4Cl(s)+2H2O(l)= NH4Cl(aq) △H5=?
则第⑤个方程式中的反应热△H是 。
根据盖斯定律和上述反应方程式得:⑤=④+③+②-①,
即△H5 = +16.3kJ/mol
+16.3kJ/mol
3.化学反应N2(g)+3H2(g)=2NH3(l)的能量变化如图所示,该反应的ΔH为( )
A.+2(a-b-c) kJ·mol-1 B.+2(b-a) kJ·mol-1
C.+(b+c-a) kJ·mol-1 D.+(a+b) kJ·mol-1
A
4.盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )
A.A→F,ΔH=-ΔH6
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C.C→F,|ΔH|=|ΔH1+ΔH2+ΔH6|
D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
B
反应焓变的计算
盖斯定律
能源
摩尔燃烧焓
定义
意义
计算
第1节 化学反应的热效应 课时3
第1章 物质的性质与转化
1.能根据盖斯定律求算反应焓变,认识热力学状态函数的变化与变化途径无关;
2.能从综合能量变化、物质变化角度解决燃料选择、利用等实际问题;
3.了解摩尔燃烧焓的概念。
联想·质疑
联想·质疑
在生产中,对燃料的燃烧、反应条件的控制以及废热的利用,都需要知道物质在发生化学反应时所放出或吸收的热量。
C(s)+(g)=CO (g)
例如,对于化学反应:
这个反应的反应热是冶金工业中非常有用的数据,应该如何获得呢?
C燃烧时不可能全部生成CO,总有一部分CO2生成,因此该反应的反应热无法直接测定。
怎么计算该反应的反应热呢?
N2(g) + 2O2 (g)
2 NO2(g)
ΔH1
ΔH2
ΔH3
2NO (g) + O2 (g)
ΔH3= ΔH1 + ΔH2
①N2 (g) + O2 (g) === 2NO (g) ΔH1 =+180.5 kJ/mol
②2NO (g) + O2 (g) === 2NO2 (g) ΔH2 =-112.8 kJ/mol
③N2 (g) + 2O2 (g) === 2NO2 (g) ΔH3 =+ 67.7 kJ/mol
思考与交流
方法一
方法二
请判断哪种方法生成2molNO2(g)的反应热最少?
一、反应焓变的计算
1.盖斯定律
(1)定义:一个化学反应无论是一步完成还是分几步完成,反应热是相同的。
盖斯定律表明,在一定条件下,化学反应的反应热只与反应体系的始态和终态有关,而与反应进行的途径无关。
A
B
C
ΔH
ΔH1
ΔH2
ΔH = ΔH1 + ΔH2
登山时上升的高度与登山路径无关
始态
终态
体系吸收热量
H2>0
体系放出热量
H1 <0
经过一个循环,物质没有发生变化,就不能引发能量变化,即 H1+ H2=0
推论:同一个热化学反应方程式,正向反应 H1与逆向反应 H2大小相等,符号相反,即: H1= – H2
①反应进行得很慢
②反应不容易直接发生
③反应的产品不纯
间接计算
ΔH
如C(s)+(g)=CO (g)
的反应热无法直接测定,但下列两个反应的反应热却可以直接测定:
C(s)+O2(g)=CO2(g) H1= -393.5 kJ/mol
CO(g)+ O2 (g)=CO2(g) H2= -283.0 kJ/mol
(2)在科学研究中的重要意义:
热化学之父
盖斯定律
根据盖斯定律,则有:
= -393.5kJ/mol-(-283.0kJ/mol)
= -110.5kJ/mol
H1= H2+ H3
H3= H1- H2
H1
H3
H2
C(s)+O2(g)
CO2(g)
CO(g)+ O2 (g)
C(s)+ O2(g)=CO (g) H3 = -110.5kJ/mol
【实际问题解决】
燃料的合理选择和综合利用是提高能源利用率的重要途径之一。
交流 · 研讨
交流 · 研讨
人们通常会从哪些角度、依据什么标准来合理选择燃料?
燃烧释放热量的多少
燃料的储能
燃料的开采、运输
燃料储存的
条件、价格
燃料对生态
环境的影响
合理选
择燃料
交流 · 研讨
交流 · 研讨
请同学们结合下表中的数据,评价煤、天然气、氢气、一氧化碳作为燃料的优缺点。
(注:煤的燃烧焓可用石墨的燃烧焓数据粗略估算)
物质 化学式 ΔH/(kJ/mol)
石墨 C(s) -393.5
氢气 H2(g) -285.8
一氧化碳 CO(g) -283.0
甲烷 CH4(g) -890.3
表1 几种物质的摩尔燃烧焓(298 K,101 kPa)
某物质的摩尔燃烧焓指在一定反应温度和压强条件下,1 mol纯物质完全氧化为同温下的指定产物时的焓变。
①N → N2(g) ② C→CO2(g)
③ S →SO2(g) ④H→H2O(l)
目前,煤在我国仍然是第一能源。但是,将煤直接用作燃料,不仅利用率低,而且会产生大量固体垃圾和多种有害气体。为了解决这一问题,工业上通过煤的干馏、气化和液化等方法来实现煤的综合利用。煤的气化是将煤转化为可燃性气体的过程,主要反应为:
C(s) + H2O(g)===CO(g)+ H2(g)
高温
(1)你认为煤的气化对于提高能源利用效率有哪些价值?
a.煤气化后增大接触面积,燃烧更充分,节约资源,减少成本;
b.减少燃料中N和S的含量,减少其氧化物对环境的污染;
c.更有利于运输,气体可通过管道运输,减少损耗,降低成本。
(2)已知298 K、101 kPa时, 1 mol H2O(l) 变为H2O(g)需要吸收44.0 kJ的热量。则上述煤的气化反应的焓变是多少 ?
待求反应:
C(s) + H2O(g)===CO(g)+ H2(g)
高温
ΔH=?
已知反应:
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
④H2O(l)===H2O(g) ΔH4=+44.0 kJ·mol-1
②CO(g)+ O2(g)===CO2(g) ΔH2=-283.0 kJ·mol-1
③H2(g)+ O2(g)===H2O(l) ΔH3=-285.8 kJ·mol-1
①找出待求热化学方程式中反应物与反应产物在已知热化学方程式中的位置。
×(-1)
×(-1)
×(-1)
②调整已知热化学方程式方向、计量数和ΔH。
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②CO2(g)===CO(g)+ O2(g) ΔH2`=+283.0 kJ·mol-1
③H2O(l)===H2(g)+ O2(g) ΔH3`=+285.8 kJ·mol-1
④H2O(g)===H2O(l) ΔH4`=-44.0 kJ·mol-1
③加和已调整的热化学方程式中的ΔH,确定待求反应的ΔH。
①C(s)+O2(g)===CO2(g) ΔH1=-393.5 kJ·mol-1
②CO2(g)===CO(g)+ O2(g) ΔH2`=+283.0 kJ·mol-1
③H2O(l)===H2(g)+ O2(g) ΔH3`=+285.8 kJ·mol-1
④H2O(g)===H2O(l) ΔH4`=-44.0 kJ·mol-1
ΔH=ΔH1 +ΔH2`+ ΔH3` +ΔH4`
ΔH=+131.3 kJ/mol
①热化学方程式中物质的化学计量数同乘以某一数时,反应热数值也必须乘以该数;
②热化学方程式相加减时,同种物质之间可相加减,反应热也随之相加减;
③将一个热化学方程式颠倒时, H的数值不变,但“+”、“-”号必须随之改变;
④若热化学方程式相减,最好能先把被减方程式进行颠倒,然后相加,更不易出错。
应用盖斯定律计算反应热应注意:
【总结】若一个化学方程式可由另外几个化学方程式相加减而得到,则该化学反应的焓变即为这几个化学反应焓变的代数和。
【练一练】
1.判断正误
(1)对一个化学反应,在一定条件下,如果反应的途径不同,其焓变一定不同( )
(2)使用催化剂能够降低化学反应的反应热( )
(3)化学反应的焓变与方程式的书写方式无关( )
(4)同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同( )
(5)在 中,存在关系式:ΔH1=ΔH2+ΔH3。( )
2.按照盖斯定律,结合下述反应方程式回答问题,已知:
①NH3(g)+HCl(g)=NH4Cl(s) △H1=-176kJ/mol
②NH3(g)+H2O(l)=NH3(aq) △H2=-35.1kJ/mol
③HCl(g) +H2O(l)=HCl(aq) △H3=-72.3kJ/mol
④NH3(aq)+ HCl(aq)=NH4Cl(aq) △H4=-52.3kJ/mol
⑤NH4Cl(s)+2H2O(l)= NH4Cl(aq) △H5=?
则第⑤个方程式中的反应热△H是 。
根据盖斯定律和上述反应方程式得:⑤=④+③+②-①,
即△H5 = +16.3kJ/mol
+16.3kJ/mol
3.化学反应N2(g)+3H2(g)=2NH3(l)的能量变化如图所示,该反应的ΔH为( )
A.+2(a-b-c) kJ·mol-1 B.+2(b-a) kJ·mol-1
C.+(b+c-a) kJ·mol-1 D.+(a+b) kJ·mol-1
A
4.盖斯定律指出:化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。物质A在一定条件下可发生一系列转化,由图判断下列关系错误的是( )
A.A→F,ΔH=-ΔH6
B.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=1
C.C→F,|ΔH|=|ΔH1+ΔH2+ΔH6|
D.|ΔH1+ΔH2+ΔH3|=|ΔH4+ΔH5+ΔH6|
B
反应焓变的计算
盖斯定律
能源
摩尔燃烧焓
定义
意义
计算
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
