1.2 课时2 化学电源 课件 (共21张PPT)2023-2024学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 1.2 课时2 化学电源 课件 (共21张PPT)2023-2024学年高二化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 15:36:53 | ||
图片预览








文档简介
(共21张PPT)
第2节 化学能转化为电能——电池 课时2
第1章 物质的性质与转化
1.了解三种重要的化学电源,能列举常见的电源,并能利用相关信息分析化学电源的工作原理;
2.进一步理解原电池工作原理对人类生产、生活的重要应用。
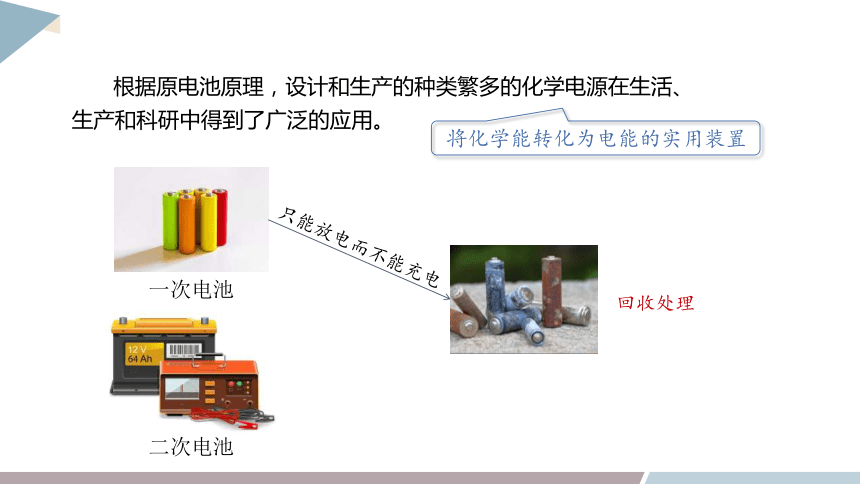
根据原电池原理,设计和生产的种类繁多的化学电源在生活、生产和科研中得到了广泛的应用。
将化学能转化为电能的实用装置
一次电池
二次电池
只能放电而不能充电
回收处理
一、化学电源
1.锌锰干电池
(1)酸性锌锰干电池
锌筒
二氧化锰和炭黑
氯化铵和氯化锌
石墨电极
请分析酸性锌锰干电池各部分的作用。
负极材料、负极反应物
正极材料
离子导体
正极反应物
负极: Zn-2e-===Zn2+
正极:
2MnO2+2 +2e-===Mn2O3+2NH3+H2O
一、化学电源
1.锌锰干电池
(1)酸性锌锰干电池
锌筒
二氧化锰和炭黑
氯化铵和氯化锌
石墨电极
分析酸性锌锰干电池的工作原理,写出负极的电极反应。
已知氯化铵溶液显酸性,为什么酸性锌锰干电池即使不用也会很快没电甚至漏液?
思考与交流
锌很容易跟与之直接接触的、显酸性的氯化铵溶液发生反应,所以即使不用,锌筒也会逐渐变薄,时间久了就会出现漏液的现象。
酸性锌锰干电池的缺点:
容易自放电导致存放时间短
放电后电压下降较快
碱性锌锰干电池
碱性锌锰电池的
构造示意图
组成:
正极: ;负极: ;电解质: 。
工作原理:
负极反应: ;
正极反应: ;
总反应 : Zn+2MnO2+H2O=2MnOOH+ZnO。
MnO2
Zn
KOH
Zn+2OH--2e-==ZnO+H2O
2MnO2+2e-+2H2O==2MnOOH+2OH-
(2)碱性锌锰干电池
代替氯化铵
复杂电极反应=总反应-较简单一极的电极反应
2.铅蓄电池
——用于电动自行车、汽车、发电站等。
组成: 正极: ;负极: ;电解质: 。
PbO2
Pb
H2SO4
工作机制
化学能
电能
放电
充电电池中能量的转化关系:
优点:性能优良、造价低、可多次充放电。
缺点:单位质量电池释放的电能少。
充电
工作原理:
铅酸蓄电池是最常见的二次电池,其电极反应分为放电和充电两个过程。
①放电过程的电极反应、总反应:
负极: ;
正极: ;
总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
②充电过程的电极反应、总反应:
阴极: (还原反应);
阳极: (氧化反应);
总反应:2PbSO4+2H2O=Pb+PbO2+2H2SO4。
[思考] 铅酸蓄电池在放电一段时间后,正极、负极的质量将如何变化
铅酸蓄电池放电时,正极部分PbO2变为PbSO4,质量变大;负极部分Pb变为PbSO4,质量也变大。
③充电时电极反应式与放电时电极反应式相反,充、放电时的电池反应为:
并非表示该反应为可逆反应
同一电极
同一电极
外接电源正极
外接电源负极
还原反应:阴极
氧化反应:阳极
充电
可充电电池
放电
负极:氧化反应
正极:还原反应
3.燃料电池
燃料电池能量利用效率高、可连续使用、污染轻。
燃料电池负极一般通入燃料(如H2、CH4、CH3OH、CH3CH2OH等),正极一般通入氧化剂(如O2)。实现一个相当于燃烧反应的电池反应,将化学能转化为电能。
活动 · 探究
活动 · 探究
实验目的
利用所给试剂和仪器设计装置,通过该装置将下列反应产生的化学能转化为电能。写出设计思路,绘制实验装置图。
2H2 + O2===2H2O
实验用品
KOH溶液,稀硫酸,K2SO4溶液,石墨棒;
长颈漏斗,U 形管,橡胶塞,导线,电流表,电源。
确定负极
确定正极
构成闭合回路
负极反应物
负极材料
H2
O2
石墨
石墨
导线
KOH溶液
稀硫酸
K2SO4溶液
[思考]设计电池的基本思路是什么?
正极反应物
正极材料
电子导体
离子导体
[思考]分别写出电解质溶液为KOH溶液、稀硫酸、K2SO4溶液时氢氧燃料电池的电极反应。
正极: O2 + 2H2O +4e-=4OH- ;
负极: 2H2+4OH- -4e-=4H2O
总(电池)反应:2H2 + O2=2H2O
①KOH溶液(碱性条件):
正极: O2 + 4H+ + 4e-=2H2O ;
负极: 2H2 - 4e-=4H+
总(电池)反应:2H2 + O2=2H2O
②稀硫酸(酸性条件):
③K2SO4溶液(中性条件)
负极: 2H2 - 4e-=4H+
正极: O2 + 2H2O +4e-=4OH- ;
总(电池)反应:2H2 + O2=2H2O
书写燃料电池电极反应式和总反应式
[书写步骤]
1.写出燃烧反应的化学方程式;
2.根据电解液改写燃料电池总反应;
3.写出正极的电极反应式(一般较简单);
4.由燃料电池总反应式减去正极的电极反应式得到负极的电极反应式。
[注意事项]
1.电极反应是一种离子反应,遵循书写离子反应的所有规则;
2.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以形式存在);
4.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-。
【练一练】
1.下列几种化学电池中,不属于可充电电池的是( )
A.碱性锌锰电池
B.手机用锂离子电池
C.汽车用铅酸蓄电池
D.玩具用镍氢电池
A
2.一种熔融碳酸盐燃料电池原理示意图如下。下列有关该电池的说法正确的是( )
D
3.甲醇燃料电池结构示意图如下。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应式为2CH3OH+3O2=2CO2+4H2O。下列说法不正确的是( )
A.右电极为电池正极
B.负极电极反应式为CH3OH+H2O-6e-=CO2+6H+
C.b处通入空气,a处通入甲醇
D.正极电极反应式为O2+2H2O+4e-=4OH-
D
化学电源
一次电池
二次电池
燃料电池
酸性锌锰干电池
碱性锌锰干电池
铅蓄电池
银锌电池、镍镉电池、镍氢电池
氢氧燃料电池
甲烷、甲醇、肼燃料电池等
第2节 化学能转化为电能——电池 课时2
第1章 物质的性质与转化
1.了解三种重要的化学电源,能列举常见的电源,并能利用相关信息分析化学电源的工作原理;
2.进一步理解原电池工作原理对人类生产、生活的重要应用。
根据原电池原理,设计和生产的种类繁多的化学电源在生活、生产和科研中得到了广泛的应用。
将化学能转化为电能的实用装置
一次电池
二次电池
只能放电而不能充电
回收处理
一、化学电源
1.锌锰干电池
(1)酸性锌锰干电池
锌筒
二氧化锰和炭黑
氯化铵和氯化锌
石墨电极
请分析酸性锌锰干电池各部分的作用。
负极材料、负极反应物
正极材料
离子导体
正极反应物
负极: Zn-2e-===Zn2+
正极:
2MnO2+2 +2e-===Mn2O3+2NH3+H2O
一、化学电源
1.锌锰干电池
(1)酸性锌锰干电池
锌筒
二氧化锰和炭黑
氯化铵和氯化锌
石墨电极
分析酸性锌锰干电池的工作原理,写出负极的电极反应。
已知氯化铵溶液显酸性,为什么酸性锌锰干电池即使不用也会很快没电甚至漏液?
思考与交流
锌很容易跟与之直接接触的、显酸性的氯化铵溶液发生反应,所以即使不用,锌筒也会逐渐变薄,时间久了就会出现漏液的现象。
酸性锌锰干电池的缺点:
容易自放电导致存放时间短
放电后电压下降较快
碱性锌锰干电池
碱性锌锰电池的
构造示意图
组成:
正极: ;负极: ;电解质: 。
工作原理:
负极反应: ;
正极反应: ;
总反应 : Zn+2MnO2+H2O=2MnOOH+ZnO。
MnO2
Zn
KOH
Zn+2OH--2e-==ZnO+H2O
2MnO2+2e-+2H2O==2MnOOH+2OH-
(2)碱性锌锰干电池
代替氯化铵
复杂电极反应=总反应-较简单一极的电极反应
2.铅蓄电池
——用于电动自行车、汽车、发电站等。
组成: 正极: ;负极: ;电解质: 。
PbO2
Pb
H2SO4
工作机制
化学能
电能
放电
充电电池中能量的转化关系:
优点:性能优良、造价低、可多次充放电。
缺点:单位质量电池释放的电能少。
充电
工作原理:
铅酸蓄电池是最常见的二次电池,其电极反应分为放电和充电两个过程。
①放电过程的电极反应、总反应:
负极: ;
正极: ;
总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2O。
②充电过程的电极反应、总反应:
阴极: (还原反应);
阳极: (氧化反应);
总反应:2PbSO4+2H2O=Pb+PbO2+2H2SO4。
[思考] 铅酸蓄电池在放电一段时间后,正极、负极的质量将如何变化
铅酸蓄电池放电时,正极部分PbO2变为PbSO4,质量变大;负极部分Pb变为PbSO4,质量也变大。
③充电时电极反应式与放电时电极反应式相反,充、放电时的电池反应为:
并非表示该反应为可逆反应
同一电极
同一电极
外接电源正极
外接电源负极
还原反应:阴极
氧化反应:阳极
充电
可充电电池
放电
负极:氧化反应
正极:还原反应
3.燃料电池
燃料电池能量利用效率高、可连续使用、污染轻。
燃料电池负极一般通入燃料(如H2、CH4、CH3OH、CH3CH2OH等),正极一般通入氧化剂(如O2)。实现一个相当于燃烧反应的电池反应,将化学能转化为电能。
活动 · 探究
活动 · 探究
实验目的
利用所给试剂和仪器设计装置,通过该装置将下列反应产生的化学能转化为电能。写出设计思路,绘制实验装置图。
2H2 + O2===2H2O
实验用品
KOH溶液,稀硫酸,K2SO4溶液,石墨棒;
长颈漏斗,U 形管,橡胶塞,导线,电流表,电源。
确定负极
确定正极
构成闭合回路
负极反应物
负极材料
H2
O2
石墨
石墨
导线
KOH溶液
稀硫酸
K2SO4溶液
[思考]设计电池的基本思路是什么?
正极反应物
正极材料
电子导体
离子导体
[思考]分别写出电解质溶液为KOH溶液、稀硫酸、K2SO4溶液时氢氧燃料电池的电极反应。
正极: O2 + 2H2O +4e-=4OH- ;
负极: 2H2+4OH- -4e-=4H2O
总(电池)反应:2H2 + O2=2H2O
①KOH溶液(碱性条件):
正极: O2 + 4H+ + 4e-=2H2O ;
负极: 2H2 - 4e-=4H+
总(电池)反应:2H2 + O2=2H2O
②稀硫酸(酸性条件):
③K2SO4溶液(中性条件)
负极: 2H2 - 4e-=4H+
正极: O2 + 2H2O +4e-=4OH- ;
总(电池)反应:2H2 + O2=2H2O
书写燃料电池电极反应式和总反应式
[书写步骤]
1.写出燃烧反应的化学方程式;
2.根据电解液改写燃料电池总反应;
3.写出正极的电极反应式(一般较简单);
4.由燃料电池总反应式减去正极的电极反应式得到负极的电极反应式。
[注意事项]
1.电极反应是一种离子反应,遵循书写离子反应的所有规则;
2.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;
3.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以形式存在);
4.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-。
【练一练】
1.下列几种化学电池中,不属于可充电电池的是( )
A.碱性锌锰电池
B.手机用锂离子电池
C.汽车用铅酸蓄电池
D.玩具用镍氢电池
A
2.一种熔融碳酸盐燃料电池原理示意图如下。下列有关该电池的说法正确的是( )
D
3.甲醇燃料电池结构示意图如下。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一电极后与氧气反应,电池总反应式为2CH3OH+3O2=2CO2+4H2O。下列说法不正确的是( )
A.右电极为电池正极
B.负极电极反应式为CH3OH+H2O-6e-=CO2+6H+
C.b处通入空气,a处通入甲醇
D.正极电极反应式为O2+2H2O+4e-=4OH-
D
化学电源
一次电池
二次电池
燃料电池
酸性锌锰干电池
碱性锌锰干电池
铅蓄电池
银锌电池、镍镉电池、镍氢电池
氢氧燃料电池
甲烷、甲醇、肼燃料电池等
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
