2.2 课时4 压强对化学平衡的影响 平衡移动原理 课件(共20张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 2.2 课时4 压强对化学平衡的影响 平衡移动原理 课件(共20张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 421.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 15:47:51 | ||
图片预览







文档简介
(共20张PPT)
第2节 化学反应的限度 课时4
第2章 化学反应的方向、限度与速率
1.了解压强对化学平衡的影响,并能判断平衡移动的方向;
2.理解平衡移动原理(勒·夏特列原理)
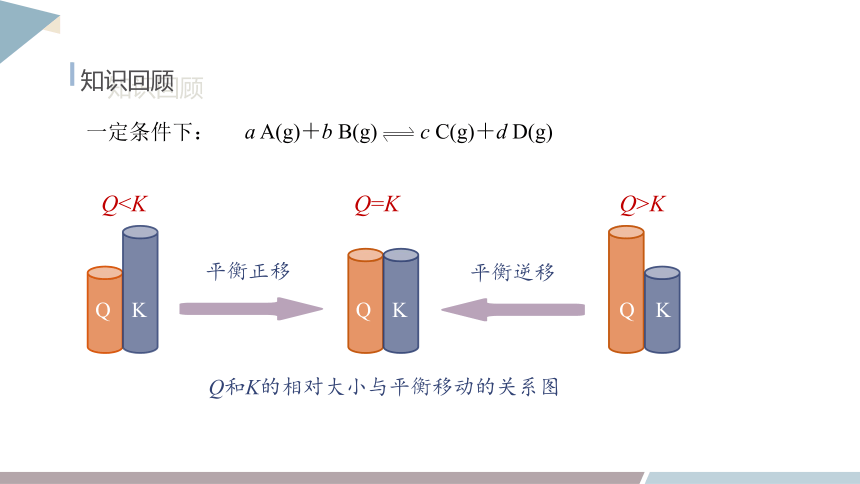
a A(g)+b B(g) c C(g)+d D(g)
一定条件下:
Q和K的相对大小与平衡移动的关系图
Q
Q
Q
K
K
K
QQ=K
Q>K
平衡正移
平衡逆移
知识回顾
知识回顾
【预测】压强对化学平衡的影响
N2(g)+3H2(g) 2NH3(g)
高温、高压
催化剂
ΔH<0
如果压缩体积增大压强,K、Q如何变化?平衡如何移动?
Q=
c2 (NH3)
c(N2) c3 (H2)
K=
c 2 (NH3)
c (N2) c 3 (H2)
平
平
平
K不变, Q变?
各物质浓度同等程度增大
压缩体积
压强增大
增大体积
压强减小
各物质浓度同等程度减小
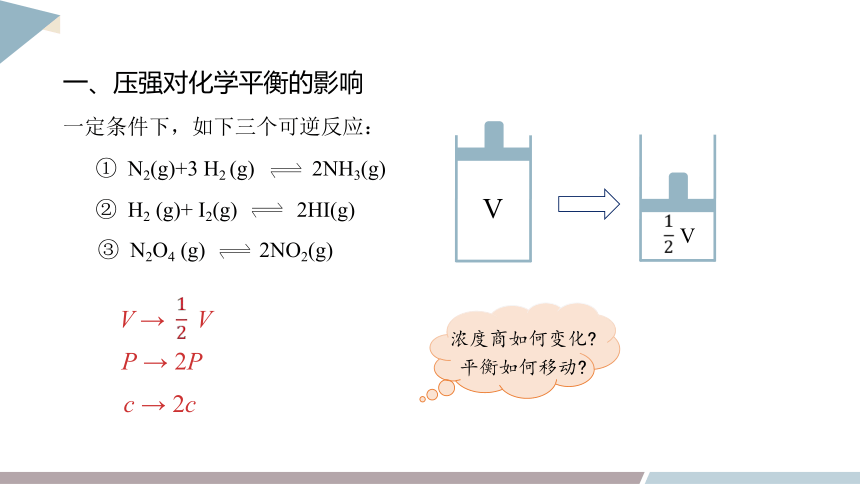
一、压强对化学平衡的影响
一定条件下,如下三个可逆反应:
V
① N2(g)+3 H2 (g) 2NH3(g)
② H2 (g)+ I2(g) 2HI(g)
③ N2O4 (g) 2NO2(g)
V
P → 2P
c → 2c
V → V
浓度商如何变化
平衡如何移动
① N2(g)+3 H2 (g) 2NH3(g)
Q1=
c2 (NH3)
c(N2) c3 (H2)
=K
P → 2P
c → 2c
Q1’=
[2c (NH3)]2
2c(N2) [2c (H2)]3
= K
< K
压强增大时,该平衡向正反应方向移动
② H2 (g)+ I2(g) 2HI(g)
Q2=
c2 (HI)
c(H2) c (I2)
=K
P → 2P
c → 2c
2c(H2) 2c (I2)
Q2’=
[2c (HI)]2
=K
压强增大,平衡不移动
③ N2O4 (g) 2NO2(g)
Q3=
c2 (NO2)
c(N2O4)
=K
P → 2P
c → 2c
2c(N2O4)
Q3’=
[2c (NO2)]2
=2K
>K
压强增大时,此反应向逆反应方向移动
对于: m A(g)+n B(g) p C(g)+q D(g)
c (A) c (B)
Qc=
p
c (C) c (D)
q
m
n
n (A) n (B)
=
p
n (C) n (D)
q
m
n
·V (m+n)-(p+q)
当 m+n > p+q
P
V
Q<K
O
t
v
t1
v(正)
v(逆)
v′(正)
v′(逆)
平衡正向移动
v(正)、v(逆)同时增大
对于: m A(g)+n B(g) p C(g)+q D(g)
c (A) c (B)
Qc=
p
c (C) c (D)
q
m
n
n (A) n (B)
=
p
n (C) n (D)
q
m
n
·V (m+n)-(p+q)
当 m+n < p+q
P
V
Q>K
O
t
v
t1
v(正)
v′(逆)
v(逆)
v′(正)
平衡逆向移动
v(正)、v(逆)同时增大
不要把v(正)增大与平衡向正反应方向移动等同起来,只有v(正)>v(逆)时,才使平衡向正反应方向移动。
对于: m A(g)+n B(g) p C(g)+q D(g)
c (A) c (B)
Qc=
p
c (C) c (D)
q
m
n
n (A) n (B)
=
p
n (C) n (D)
q
m
n
·V (m+n)-(p+q)
当 m+n < p+q
P
V
Q<K
O
t
v
t1
v(正)
v(逆)
平衡正向移动
v(正)、v(逆)同时减小
v′(正)
v′(逆)
对于: m A(g)+n B(g) p C(g)+q D(g)
c (A) c (B)
Qc=
p
c (C) c (D)
q
m
n
n (A) n (B)
=
p
n (C) n (D)
q
m
n
·V (m+n)-(p+q)
当 m+n > p+q
P
V
Q>K
平衡逆向移动
v(正)、v(逆)同时减小
O
t
v
t1
v(正)
v(逆)
v′(逆)
v′(正)
对于: m A(g)+n B(g) p C(g)+q D(g)
c (A) c (B)
Qc=
p
c (C) c (D)
q
m
n
n (A) n (B)
=
p
n (C) n (D)
q
m
n
·V (m+n)-(p+q)
当 m+n = p+q
改变压强,平衡不移动
Qc
n (A) n (B)
=
p
n (C) n (D)
q
m
n
·V (m+n)-(p+q)
n (A) n (B)
=
p
n (C) n (D)
q
m
n
归纳:压强对化学平衡的影响
1)对于Δvg≠0的反应:增大压强,化学平衡向气体分子数减小的方向移动;减小压强,化学平衡向气体分子数增大的方向移动。
2)对于Δvg=0的反应:压强改变,平衡不移动。
注:对于只涉及固体或液体的反应,压强对平衡体系的影响极其微弱,可以不予考虑。
“如果改变影响平衡的条件之一(如温度、压强、以及参加反应的化学物质的浓度),平衡向着能够减弱这种改变的方向移动。”
二、勒·夏特列原理——平衡移动原理
勒 夏特列
思考与交流
Ⅰ.可逆反应达平衡,改变条件平衡向正方向移动,反应物转化率一定增大吗
不一定。若有两种反应物,增大其中一种反应物的浓度,另一种反应物转化率增大,浓度增大的反应物的转化率减小。
Ⅱ.催化剂会影响化学平衡吗
催化剂能够同等程度地改变正、逆反应速率,因此它对化学平衡移动无影响。
【练一练】
(1)对于C(s)+CO2(g)??2CO(g),在某温度下达到平衡,缩小容器的体积,平衡不移动( )
(2)有气体参与的反应,改变压强,平衡一定发生移动( )
(3)增大压强可使2SO2(g)+O2(g) 2SO3(g)平衡向正向移动,原因是增大压强,v正增大,v逆减小( )
(4)恒容容器中充入He,可使N2(g)+3H2(g)??2NH3(g)平衡向正向移动( )
1.判断下列叙述的正误
2.在密闭容器中,反应:xA(g)+yB(g)??zC(g),在一定条件下达到平衡状态,保持温度不变,改变下列条件,分析解答下列问题:
(1)若x+y>z,缩小体积,增大压强,则平衡向________方向移动。
(2)若保持体积不变,通入He气,则平衡________移动。
(3)若保持压强不变,通入He气,平衡向正反应方向移动,则x、y、z的关系为________。
(4)若x+y=z,恒容条件下充入He气,则平衡________移动。
正反应
不
x+y<z
不
3.下列事实中,不能用勒·夏特列原理加以解释的是( )
A.夏天,打开啤酒瓶时会在瓶口逸出气体
B.浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体
C.压缩氢气与碘蒸气反应的平衡混合气体,颜色变深
D.将盛有二氧化氮和四氧化二氮混合气体的密闭容器置于冷水中,混合气体颜色变浅
C
4.反应C2H6(g) C2H4(g)+H2(g) ΔH>0 在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )。
A.增大容器容积 B.升高反应温度
C.分离出部分氢气 D.等容下通入惰性气体
D
惰性气体对化学平衡的影响
(1)恒温、恒容条件
原平衡体系
惰性气体
体系中各组
分浓度不变
Q = K
平衡不移动
(2)恒温、恒压条件
原平衡体系
平衡体系容
器容积增大
惰性气体
各组分浓度
同比例减小
减压
5.改变反应容器体积使压强变化,但不会使下列化学反应的平衡发生移动的是( )
A.Fe2O3(s)+3CO(g)??2Fe(s)+3CO2(g)
B.3H2(g)+N2(g)??2NH3(g)
C.2SO2(g)+O2(g)??2SO3(g)
D.C(s)+CO2(g)??2CO(g)
A
反应
条件
对化
学平
衡的
影响
温度
浓度
压强
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
改变浓度,若Q < K,平衡正向移动
改变浓度,若Q > K,平衡逆向移动
改变压强,若Q < K,平衡正向移动
改变压强,若Q > K,平衡逆向移动
勒·夏特列原理
第2节 化学反应的限度 课时4
第2章 化学反应的方向、限度与速率
1.了解压强对化学平衡的影响,并能判断平衡移动的方向;
2.理解平衡移动原理(勒·夏特列原理)
a A(g)+b B(g) c C(g)+d D(g)
一定条件下:
Q和K的相对大小与平衡移动的关系图
Q
Q
Q
K
K
K
Q
Q>K
平衡正移
平衡逆移
知识回顾
知识回顾
【预测】压强对化学平衡的影响
N2(g)+3H2(g) 2NH3(g)
高温、高压
催化剂
ΔH<0
如果压缩体积增大压强,K、Q如何变化?平衡如何移动?
Q=
c2 (NH3)
c(N2) c3 (H2)
K=
c 2 (NH3)
c (N2) c 3 (H2)
平
平
平
K不变, Q变?
各物质浓度同等程度增大
压缩体积
压强增大
增大体积
压强减小
各物质浓度同等程度减小
一、压强对化学平衡的影响
一定条件下,如下三个可逆反应:
V
① N2(g)+3 H2 (g) 2NH3(g)
② H2 (g)+ I2(g) 2HI(g)
③ N2O4 (g) 2NO2(g)
V
P → 2P
c → 2c
V → V
浓度商如何变化
平衡如何移动
① N2(g)+3 H2 (g) 2NH3(g)
Q1=
c2 (NH3)
c(N2) c3 (H2)
=K
P → 2P
c → 2c
Q1’=
[2c (NH3)]2
2c(N2) [2c (H2)]3
= K
< K
压强增大时,该平衡向正反应方向移动
② H2 (g)+ I2(g) 2HI(g)
Q2=
c2 (HI)
c(H2) c (I2)
=K
P → 2P
c → 2c
2c(H2) 2c (I2)
Q2’=
[2c (HI)]2
=K
压强增大,平衡不移动
③ N2O4 (g) 2NO2(g)
Q3=
c2 (NO2)
c(N2O4)
=K
P → 2P
c → 2c
2c(N2O4)
Q3’=
[2c (NO2)]2
=2K
>K
压强增大时,此反应向逆反应方向移动
对于: m A(g)+n B(g) p C(g)+q D(g)
c (A) c (B)
Qc=
p
c (C) c (D)
q
m
n
n (A) n (B)
=
p
n (C) n (D)
q
m
n
·V (m+n)-(p+q)
当 m+n > p+q
P
V
Q<K
O
t
v
t1
v(正)
v(逆)
v′(正)
v′(逆)
平衡正向移动
v(正)、v(逆)同时增大
对于: m A(g)+n B(g) p C(g)+q D(g)
c (A) c (B)
Qc=
p
c (C) c (D)
q
m
n
n (A) n (B)
=
p
n (C) n (D)
q
m
n
·V (m+n)-(p+q)
当 m+n < p+q
P
V
Q>K
O
t
v
t1
v(正)
v′(逆)
v(逆)
v′(正)
平衡逆向移动
v(正)、v(逆)同时增大
不要把v(正)增大与平衡向正反应方向移动等同起来,只有v(正)>v(逆)时,才使平衡向正反应方向移动。
对于: m A(g)+n B(g) p C(g)+q D(g)
c (A) c (B)
Qc=
p
c (C) c (D)
q
m
n
n (A) n (B)
=
p
n (C) n (D)
q
m
n
·V (m+n)-(p+q)
当 m+n < p+q
P
V
Q<K
O
t
v
t1
v(正)
v(逆)
平衡正向移动
v(正)、v(逆)同时减小
v′(正)
v′(逆)
对于: m A(g)+n B(g) p C(g)+q D(g)
c (A) c (B)
Qc=
p
c (C) c (D)
q
m
n
n (A) n (B)
=
p
n (C) n (D)
q
m
n
·V (m+n)-(p+q)
当 m+n > p+q
P
V
Q>K
平衡逆向移动
v(正)、v(逆)同时减小
O
t
v
t1
v(正)
v(逆)
v′(逆)
v′(正)
对于: m A(g)+n B(g) p C(g)+q D(g)
c (A) c (B)
Qc=
p
c (C) c (D)
q
m
n
n (A) n (B)
=
p
n (C) n (D)
q
m
n
·V (m+n)-(p+q)
当 m+n = p+q
改变压强,平衡不移动
Qc
n (A) n (B)
=
p
n (C) n (D)
q
m
n
·V (m+n)-(p+q)
n (A) n (B)
=
p
n (C) n (D)
q
m
n
归纳:压强对化学平衡的影响
1)对于Δvg≠0的反应:增大压强,化学平衡向气体分子数减小的方向移动;减小压强,化学平衡向气体分子数增大的方向移动。
2)对于Δvg=0的反应:压强改变,平衡不移动。
注:对于只涉及固体或液体的反应,压强对平衡体系的影响极其微弱,可以不予考虑。
“如果改变影响平衡的条件之一(如温度、压强、以及参加反应的化学物质的浓度),平衡向着能够减弱这种改变的方向移动。”
二、勒·夏特列原理——平衡移动原理
勒 夏特列
思考与交流
Ⅰ.可逆反应达平衡,改变条件平衡向正方向移动,反应物转化率一定增大吗
不一定。若有两种反应物,增大其中一种反应物的浓度,另一种反应物转化率增大,浓度增大的反应物的转化率减小。
Ⅱ.催化剂会影响化学平衡吗
催化剂能够同等程度地改变正、逆反应速率,因此它对化学平衡移动无影响。
【练一练】
(1)对于C(s)+CO2(g)??2CO(g),在某温度下达到平衡,缩小容器的体积,平衡不移动( )
(2)有气体参与的反应,改变压强,平衡一定发生移动( )
(3)增大压强可使2SO2(g)+O2(g) 2SO3(g)平衡向正向移动,原因是增大压强,v正增大,v逆减小( )
(4)恒容容器中充入He,可使N2(g)+3H2(g)??2NH3(g)平衡向正向移动( )
1.判断下列叙述的正误
2.在密闭容器中,反应:xA(g)+yB(g)??zC(g),在一定条件下达到平衡状态,保持温度不变,改变下列条件,分析解答下列问题:
(1)若x+y>z,缩小体积,增大压强,则平衡向________方向移动。
(2)若保持体积不变,通入He气,则平衡________移动。
(3)若保持压强不变,通入He气,平衡向正反应方向移动,则x、y、z的关系为________。
(4)若x+y=z,恒容条件下充入He气,则平衡________移动。
正反应
不
x+y<z
不
3.下列事实中,不能用勒·夏特列原理加以解释的是( )
A.夏天,打开啤酒瓶时会在瓶口逸出气体
B.浓氨水中加入氢氧化钠固体时产生较多的刺激性气味的气体
C.压缩氢气与碘蒸气反应的平衡混合气体,颜色变深
D.将盛有二氧化氮和四氧化二氮混合气体的密闭容器置于冷水中,混合气体颜色变浅
C
4.反应C2H6(g) C2H4(g)+H2(g) ΔH>0 在一定条件下于密闭容器中达到平衡。下列各项措施中,不能提高乙烷平衡转化率的是( )。
A.增大容器容积 B.升高反应温度
C.分离出部分氢气 D.等容下通入惰性气体
D
惰性气体对化学平衡的影响
(1)恒温、恒容条件
原平衡体系
惰性气体
体系中各组
分浓度不变
Q = K
平衡不移动
(2)恒温、恒压条件
原平衡体系
平衡体系容
器容积增大
惰性气体
各组分浓度
同比例减小
减压
5.改变反应容器体积使压强变化,但不会使下列化学反应的平衡发生移动的是( )
A.Fe2O3(s)+3CO(g)??2Fe(s)+3CO2(g)
B.3H2(g)+N2(g)??2NH3(g)
C.2SO2(g)+O2(g)??2SO3(g)
D.C(s)+CO2(g)??2CO(g)
A
反应
条件
对化
学平
衡的
影响
温度
浓度
压强
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
改变浓度,若Q < K,平衡正向移动
改变浓度,若Q > K,平衡逆向移动
改变压强,若Q < K,平衡正向移动
改变压强,若Q > K,平衡逆向移动
勒·夏特列原理
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
