2.2 课时3 浓度、温度对化学平衡的影响 课件(共22张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 2.2 课时3 浓度、温度对化学平衡的影响 课件(共22张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 9.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 15:46:43 | ||
图片预览






文档简介
(共22张PPT)
第2节 化学反应的限度 课时3
第2章 化学反应的方向、限度与速率
了解温度、浓度等因素对化学平衡的影响,并能判断平衡移动的方向。
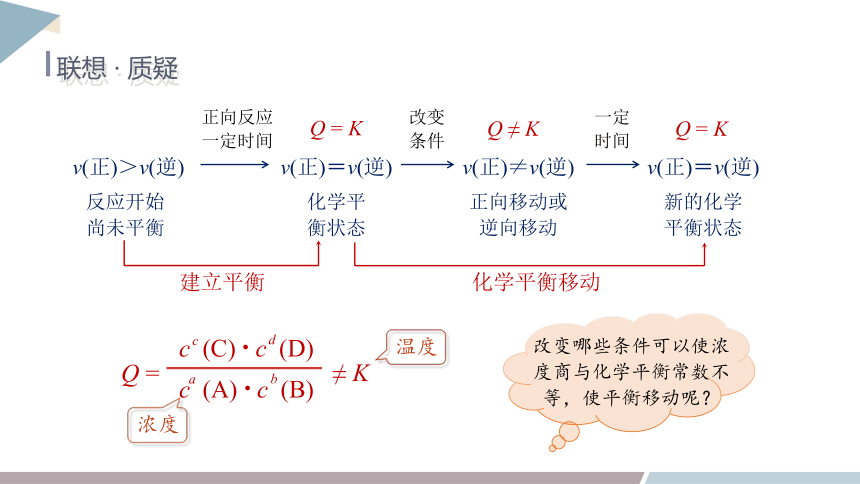
联想 · 质疑
联想 · 质疑
正向反应
一定时间
改变
条件
一定
时间
v(正)>v(逆)
v(正)=v(逆)
v(正)≠v(逆)
v(正)=v(逆)
反应开始
尚未平衡
化学平
衡状态
正向移动或
逆向移动
新的化学
平衡状态
建立平衡
化学平衡移动
Q = K
Q = K
Q ≠ K
改变哪些条件可以使浓度商与化学平衡常数不等,使平衡移动呢?
c (A) c (B)
Q =
c
c (C) c (D)
d
a
b
≠ K
温度
浓度
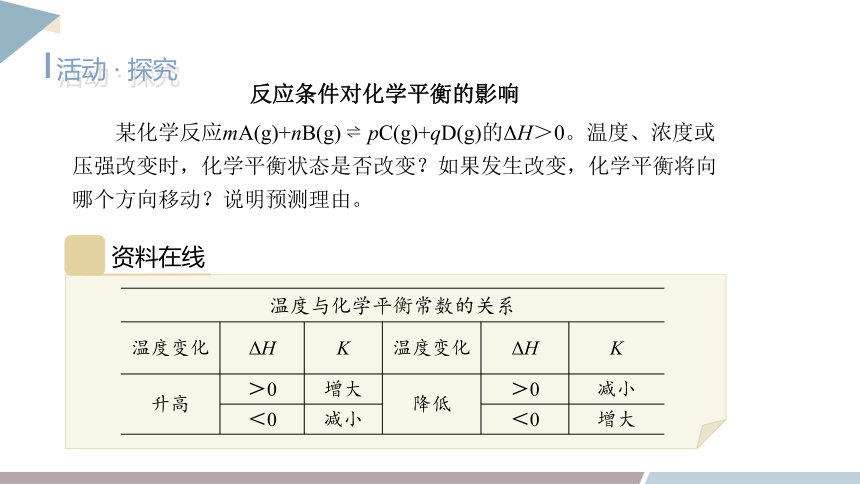
活动 · 探究
活动 · 探究
反应条件对化学平衡的影响
某化学反应mA(g)+nB(g) pC(g)+qD(g)的ΔH>0。温度、浓度或压强改变时,化学平衡状态是否改变?如果发生改变,化学平衡将向哪个方向移动?说明预测理由。
资料在线
温度与化学平衡常数的关系
温度变化 ΔH K 温度变化 ΔH K
升高 >0 增大 降低 >0 减小
<0 减小 <0 增大
探究温度对化学平衡的影响
【实验1】
【实验用品】
装有二氧化氮—四氧化二氮混合气体的装置,冰水混合物,热水;烧杯。
2NO2 (g) N2O4(g)
红棕色
无色
ΔH < 0
二氧化氮平衡球
T / K K /(mol-1·L)
333 0.601
298 6.80
根据信息,预测温度改变对化学平衡移动有怎样的影响。
2NO2 (g) N2O4(g)
红棕色
无色
ΔH < 0
T / K K /(mol-1·L)
333 0.601
298 6.80
达到平衡时:
c(N2O4 )
c2(NO2 )
Q=
= K
K ↑
Q <
K
平衡正向移动(放热方向)
降低温度
K ↓
Q >
K
平衡逆向移动(吸热方向)
升高温度
【实验现象】
浸到冰水中混合物颜色_____,
浸到热水中混合物颜色_____。
变浅
变深
平衡正向移动
平衡逆向移动
(放热反应)
(吸热反应)
降低温度
颜色变浅
升高温度
颜色变深
视频
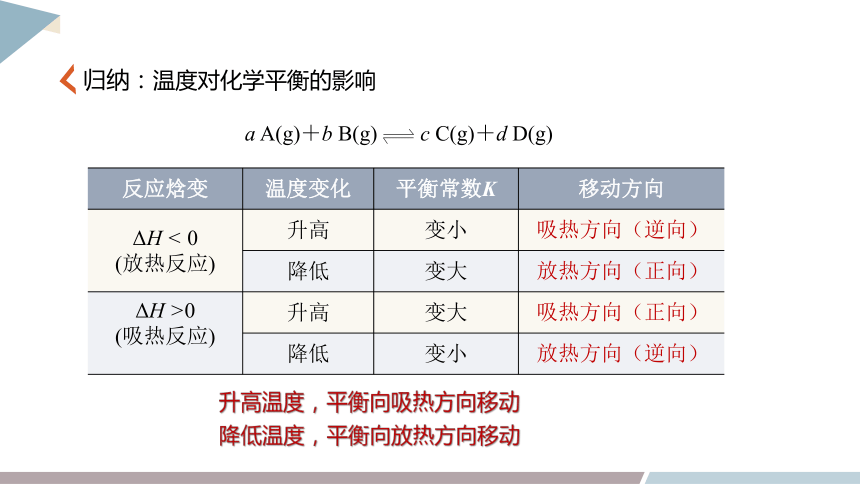
归纳:温度对化学平衡的影响
a A(g)+b B(g) c C(g)+d D(g)
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
反应焓变 温度变化 平衡常数K 移动方向
ΔH < 0 (放热反应) 升高 变小
降低 变大
ΔH >0 (吸热反应) 升高 变大
降低 变小
吸热方向(逆向)
放热方向(正向)
吸热方向(正向)
放热方向(逆向)
a A(g)+b B(g) c C(g)+d D(g)
a
c (A) c (B)
Q =
c
c (C) c (D)
d
b
= K
一定条件下,对任意可逆反应:
【预测】浓度对化学平衡的影响
增大反应物浓度,或减小反应产物浓度
减小反应物浓度,或增大反应产物浓度
Q <
K
平衡正向移动
Q >
K
平衡逆向移动
探究浓度对化学平衡的影响
【实验2】
【实验用品】
0.01 mol/L FeCl3溶液,1 mol/L FeCl3溶液,0.01 mol/L KSCN溶液,
1 mol/L KSCN溶液, 0.01 mol/L NaOH溶液,铁粉;试管,烧杯,胶头滴管
Fe3+ + 3SCN- Fe(SCN)3(红色)
【设计】利用所给试剂,验证改变某一种物质浓度对平衡的影响情况。
①先建立一个平衡体系
②改变某一物质浓度,观察实验现象,判断平衡移动方向
在小烧杯中加入等体积的 0.01 mol/L FeCl3溶液与0.01 mol/L KSCN溶液,静置一段时间,待溶液颜色不变。
将上述混合溶液平均分成四份,分别置于4 支试管中, 编号。
1234
添加1 mol/L FeCl3 溶液
添加1 mol/L
KSCN溶液
添加0.01 mol/L NaOH溶液
少量铁粉
Fe3+ + 3SCN- Fe(SCN)3(红色)
编号 实验操作 改变因素 实验现象 平衡移动方向
1
2
红色变深
红色变深
滴加1 mol/L FeCl3 溶液
滴加1 mol/L KSCN溶液
增大c(Fe3+)
增大c(SCN-)
平衡正移
平衡正移
Fe3+ + 3SCN- Fe(SCN)3(红色)
编号 实验操作 改变因素 实验现象 平衡移动方向
3
4
红色变浅
红色变浅
少量铁粉
滴加0.01mol/LNaOH 溶液
减小c(Fe3+)
平衡逆移
平衡逆移
减小c(Fe3+)
归纳:浓度对化学平衡的影响
a A(g)+b B(g) c C(g)+d D(g)
一定条件下:
Q和K的相对大小与平衡移动的关系图
Q
Q
Q
K
K
K
QQ=K
Q>K
平衡正移
平衡逆移
增大反应物浓度
减小反应产物浓度
减小反应物浓度
增大反应产物浓度
Ⅰ.在FeCl3溶液中加入KSCN溶液,发生反应如下:
FeCl3+ 3KSCN?? 3KCl+Fe(SCN)3
向上述溶液中加入KCl固体,平衡发生移动吗?请解释原因。
不移动。该可逆反应的实质为Fe3++3SCN-??Fe(SCN)3,加入KCl固体,只增加了c(K+)、c(Cl-),未改变c(Fe3+)、c(SCN-)、c[Fe(SCN)3],浓度商Q不变,平衡不移动。
思考与交流
Ⅱ.25℃时,1体积水可溶解500体积的HCl,可溶解2体积氯气,且新制的饱和氯水中存在:Cl2 + H2O HCl + HClO,利用所学平衡移动知识,解释为什么可用饱和食盐水除去氯气中混有的HCl气体。
因为1体积水可溶解500体积的HCl,说明HCl在水中的溶解度很大,可以被饱和食盐水吸收完全;而饱和食盐水中氯离子浓度大,会使
Cl2 + H2O H+ + Cl- + HClO,向逆反应方向移动,从而减少氯气与水的反应,也减少氯气在水中的溶解度。所以,可以用饱和食盐水除去氯气中的氯化氢气体。
思考与交流
【练一练】
1.在某温度下,有反应ClF(g)+F2(g) ClF3(g) ΔH=+268 kJ·mol-1,
在密闭容器中达到平衡,下列说法中正确的是( )
A.升高温度,K值不变,平衡向正反应方向移动
B.升高温度,平衡常数变小
C.升高温度,平衡向正反应方向移动,F2的转化率提高
D.降低温度,ClF3的产率提高
C
2.反应X(g)+Y(g) 2Z(g) ΔH<0,达到平衡状态时,下列说法正确的是( )
A.减小容器容积,平衡向右移动
B.加入催化剂,Z的产率增大
C.增大X的浓度,X的转化率增大
D.降低温度,Y的转化率增大
D
3.在新制的氯水中存在平衡:Cl2+H2O ??H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
A.H+浓度减小,HClO浓度减小
B.H+浓度增大,HClO浓度增大
C.H+浓度减小,HClO浓度增大
D.H+浓度增大,HClO浓度减小
C
4.在容积一定的密闭容器中,反应NH4HS(s)??NH3(g)+H2S(g)在某温度下达到平衡。
(1)温度、容积不变,通入少量SO2气体,平衡向________方向移动,原因是:_________________________________________________________。
(2)温度、容积不变,通入HCl气体,平衡向________方向移动,原因是:____________________________________________________________。
(3)加入少量NH4HS固体(不考虑占用的体积),氨气的体积________(填“增大”“减小”或“不变”,下同)。
(4)温度、容积不变,通入少量NH3,NH4HS固体的质量__________。
正反应
SO2+2H2S=3S↓+2H2O,c(H2S)减小,平衡右移
正反应
HCl+NH3=NH4Cl,c(NH3)减小,平衡右移
不变
增大
化学平衡的移动
和影响因素
温度
浓度
升高温度
降低温度
平衡向吸热反应的方向移动
平衡向放热反应的方向移动
平衡向正反应方向移动
平衡向逆反应方向移动
增大c(反应物) 或减小c(反应产物)
减小c(反应物) 或增大c(反应产物)
第2节 化学反应的限度 课时3
第2章 化学反应的方向、限度与速率
了解温度、浓度等因素对化学平衡的影响,并能判断平衡移动的方向。
联想 · 质疑
联想 · 质疑
正向反应
一定时间
改变
条件
一定
时间
v(正)>v(逆)
v(正)=v(逆)
v(正)≠v(逆)
v(正)=v(逆)
反应开始
尚未平衡
化学平
衡状态
正向移动或
逆向移动
新的化学
平衡状态
建立平衡
化学平衡移动
Q = K
Q = K
Q ≠ K
改变哪些条件可以使浓度商与化学平衡常数不等,使平衡移动呢?
c (A) c (B)
Q =
c
c (C) c (D)
d
a
b
≠ K
温度
浓度
活动 · 探究
活动 · 探究
反应条件对化学平衡的影响
某化学反应mA(g)+nB(g) pC(g)+qD(g)的ΔH>0。温度、浓度或压强改变时,化学平衡状态是否改变?如果发生改变,化学平衡将向哪个方向移动?说明预测理由。
资料在线
温度与化学平衡常数的关系
温度变化 ΔH K 温度变化 ΔH K
升高 >0 增大 降低 >0 减小
<0 减小 <0 增大
探究温度对化学平衡的影响
【实验1】
【实验用品】
装有二氧化氮—四氧化二氮混合气体的装置,冰水混合物,热水;烧杯。
2NO2 (g) N2O4(g)
红棕色
无色
ΔH < 0
二氧化氮平衡球
T / K K /(mol-1·L)
333 0.601
298 6.80
根据信息,预测温度改变对化学平衡移动有怎样的影响。
2NO2 (g) N2O4(g)
红棕色
无色
ΔH < 0
T / K K /(mol-1·L)
333 0.601
298 6.80
达到平衡时:
c(N2O4 )
c2(NO2 )
Q=
= K
K ↑
Q <
K
平衡正向移动(放热方向)
降低温度
K ↓
Q >
K
平衡逆向移动(吸热方向)
升高温度
【实验现象】
浸到冰水中混合物颜色_____,
浸到热水中混合物颜色_____。
变浅
变深
平衡正向移动
平衡逆向移动
(放热反应)
(吸热反应)
降低温度
颜色变浅
升高温度
颜色变深
视频
归纳:温度对化学平衡的影响
a A(g)+b B(g) c C(g)+d D(g)
升高温度,平衡向吸热方向移动
降低温度,平衡向放热方向移动
反应焓变 温度变化 平衡常数K 移动方向
ΔH < 0 (放热反应) 升高 变小
降低 变大
ΔH >0 (吸热反应) 升高 变大
降低 变小
吸热方向(逆向)
放热方向(正向)
吸热方向(正向)
放热方向(逆向)
a A(g)+b B(g) c C(g)+d D(g)
a
c (A) c (B)
Q =
c
c (C) c (D)
d
b
= K
一定条件下,对任意可逆反应:
【预测】浓度对化学平衡的影响
增大反应物浓度,或减小反应产物浓度
减小反应物浓度,或增大反应产物浓度
Q <
K
平衡正向移动
Q >
K
平衡逆向移动
探究浓度对化学平衡的影响
【实验2】
【实验用品】
0.01 mol/L FeCl3溶液,1 mol/L FeCl3溶液,0.01 mol/L KSCN溶液,
1 mol/L KSCN溶液, 0.01 mol/L NaOH溶液,铁粉;试管,烧杯,胶头滴管
Fe3+ + 3SCN- Fe(SCN)3(红色)
【设计】利用所给试剂,验证改变某一种物质浓度对平衡的影响情况。
①先建立一个平衡体系
②改变某一物质浓度,观察实验现象,判断平衡移动方向
在小烧杯中加入等体积的 0.01 mol/L FeCl3溶液与0.01 mol/L KSCN溶液,静置一段时间,待溶液颜色不变。
将上述混合溶液平均分成四份,分别置于4 支试管中, 编号。
1234
添加1 mol/L FeCl3 溶液
添加1 mol/L
KSCN溶液
添加0.01 mol/L NaOH溶液
少量铁粉
Fe3+ + 3SCN- Fe(SCN)3(红色)
编号 实验操作 改变因素 实验现象 平衡移动方向
1
2
红色变深
红色变深
滴加1 mol/L FeCl3 溶液
滴加1 mol/L KSCN溶液
增大c(Fe3+)
增大c(SCN-)
平衡正移
平衡正移
Fe3+ + 3SCN- Fe(SCN)3(红色)
编号 实验操作 改变因素 实验现象 平衡移动方向
3
4
红色变浅
红色变浅
少量铁粉
滴加0.01mol/LNaOH 溶液
减小c(Fe3+)
平衡逆移
平衡逆移
减小c(Fe3+)
归纳:浓度对化学平衡的影响
a A(g)+b B(g) c C(g)+d D(g)
一定条件下:
Q和K的相对大小与平衡移动的关系图
Q
Q
Q
K
K
K
Q
Q>K
平衡正移
平衡逆移
增大反应物浓度
减小反应产物浓度
减小反应物浓度
增大反应产物浓度
Ⅰ.在FeCl3溶液中加入KSCN溶液,发生反应如下:
FeCl3+ 3KSCN?? 3KCl+Fe(SCN)3
向上述溶液中加入KCl固体,平衡发生移动吗?请解释原因。
不移动。该可逆反应的实质为Fe3++3SCN-??Fe(SCN)3,加入KCl固体,只增加了c(K+)、c(Cl-),未改变c(Fe3+)、c(SCN-)、c[Fe(SCN)3],浓度商Q不变,平衡不移动。
思考与交流
Ⅱ.25℃时,1体积水可溶解500体积的HCl,可溶解2体积氯气,且新制的饱和氯水中存在:Cl2 + H2O HCl + HClO,利用所学平衡移动知识,解释为什么可用饱和食盐水除去氯气中混有的HCl气体。
因为1体积水可溶解500体积的HCl,说明HCl在水中的溶解度很大,可以被饱和食盐水吸收完全;而饱和食盐水中氯离子浓度大,会使
Cl2 + H2O H+ + Cl- + HClO,向逆反应方向移动,从而减少氯气与水的反应,也减少氯气在水中的溶解度。所以,可以用饱和食盐水除去氯气中的氯化氢气体。
思考与交流
【练一练】
1.在某温度下,有反应ClF(g)+F2(g) ClF3(g) ΔH=+268 kJ·mol-1,
在密闭容器中达到平衡,下列说法中正确的是( )
A.升高温度,K值不变,平衡向正反应方向移动
B.升高温度,平衡常数变小
C.升高温度,平衡向正反应方向移动,F2的转化率提高
D.降低温度,ClF3的产率提高
C
2.反应X(g)+Y(g) 2Z(g) ΔH<0,达到平衡状态时,下列说法正确的是( )
A.减小容器容积,平衡向右移动
B.加入催化剂,Z的产率增大
C.增大X的浓度,X的转化率增大
D.降低温度,Y的转化率增大
D
3.在新制的氯水中存在平衡:Cl2+H2O ??H++Cl-+HClO,若向氯水中投入少量碳酸钙粉末,溶液中发生的变化是( )
A.H+浓度减小,HClO浓度减小
B.H+浓度增大,HClO浓度增大
C.H+浓度减小,HClO浓度增大
D.H+浓度增大,HClO浓度减小
C
4.在容积一定的密闭容器中,反应NH4HS(s)??NH3(g)+H2S(g)在某温度下达到平衡。
(1)温度、容积不变,通入少量SO2气体,平衡向________方向移动,原因是:_________________________________________________________。
(2)温度、容积不变,通入HCl气体,平衡向________方向移动,原因是:____________________________________________________________。
(3)加入少量NH4HS固体(不考虑占用的体积),氨气的体积________(填“增大”“减小”或“不变”,下同)。
(4)温度、容积不变,通入少量NH3,NH4HS固体的质量__________。
正反应
SO2+2H2S=3S↓+2H2O,c(H2S)减小,平衡右移
正反应
HCl+NH3=NH4Cl,c(NH3)减小,平衡右移
不变
增大
化学平衡的移动
和影响因素
温度
浓度
升高温度
降低温度
平衡向吸热反应的方向移动
平衡向放热反应的方向移动
平衡向正反应方向移动
平衡向逆反应方向移动
增大c(反应物) 或减小c(反应产物)
减小c(反应物) 或增大c(反应产物)
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
