2.4 化学反应条件的优化——工业合成氨 课件(共19张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 2.4 化学反应条件的优化——工业合成氨 课件(共19张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 15:54:46 | ||
图片预览




文档简介
(共19张PPT)
第4节 化学反应条件的优化——工业合成氨
第2章 化学反应的方向、限度与速率
1.了解如何应用化学反应速率和化学平衡原理分析合成氨的适宜条件;
2.了解应用化学反应原理分析化工生产条件的思路和方法,体验实际生产条件的选择与理论分析的差异;
3.通过对合成氨适宜条件的分析,认识化学反应速率和化学平衡的调控在工业生产中的重要作用。
联想 · 质疑
联想 · 质疑
在历史上,化学曾在扩大世界粮食供应过程中起过关键作用。这就是合成氨的发明和现代农药的使用,以及它们的工业化。
但自从1784年氨被发现以来,直到1913年才实现了合成氨的工业化生产。
N2(g)+3H2(g) 2NH3(g)
要实现合成氨的工业化生产,必须从反应速率和反应限度两个方面选择合适的反应条件。
一、合成氨反应的限度
交流 · 研讨
交流 · 研讨
工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g)
298 K
ΔH=-92.2 kJ·mol-1
ΔS=-198.2 J·K-1·mol-1
1.根据反应的焓变和熵变分析在298 K时合成氨反应能否正向自发进行。
合成氨反应是在298 K时能正向自发进行的放热反应,同时也是熵减反应。
工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g)
ΔH=-92.2 kJ·mol-1
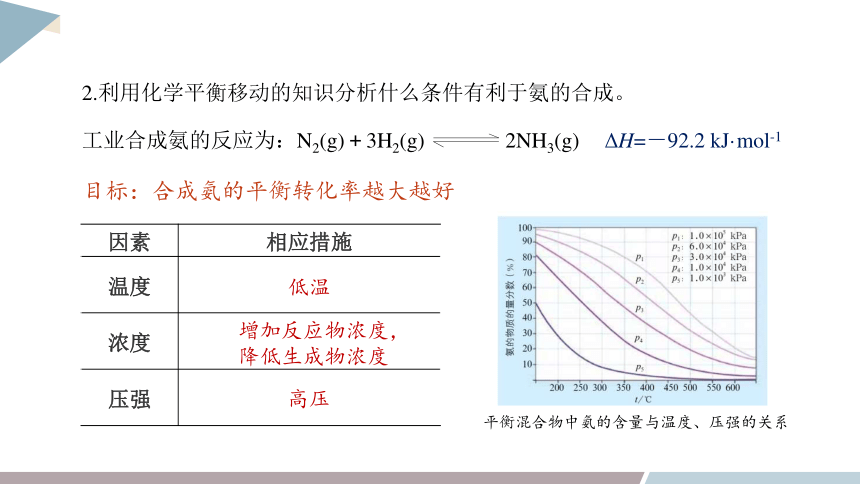
2.利用化学平衡移动的知识分析什么条件有利于氨的合成。
目标:合成氨的平衡转化率越大越好
低温
高压
增加反应物浓度,
降低生成物浓度
因素 相应措施
温度
浓度
压强
平衡混合物中氨的含量与温度、压强的关系
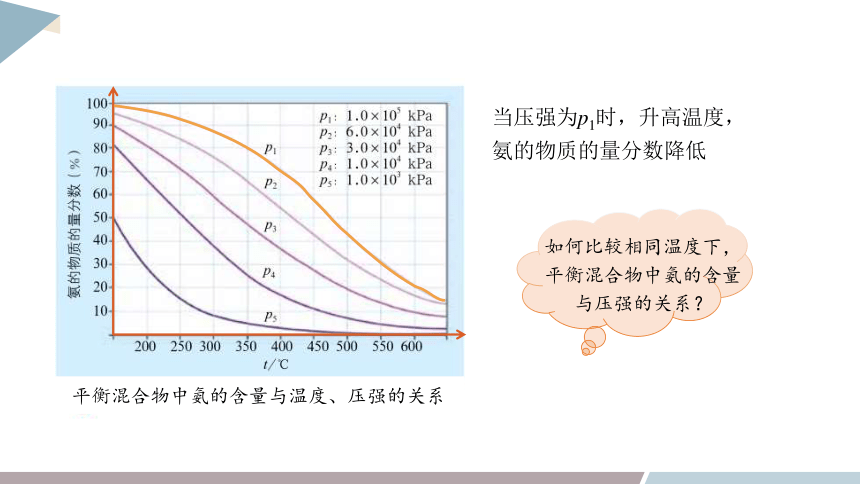
平衡混合物中氨的含量与温度、压强的关系
当压强为p1时,升高温度,
氨的物质的量分数降低
如何比较相同温度下,平衡混合物中氨的含量与压强的关系?
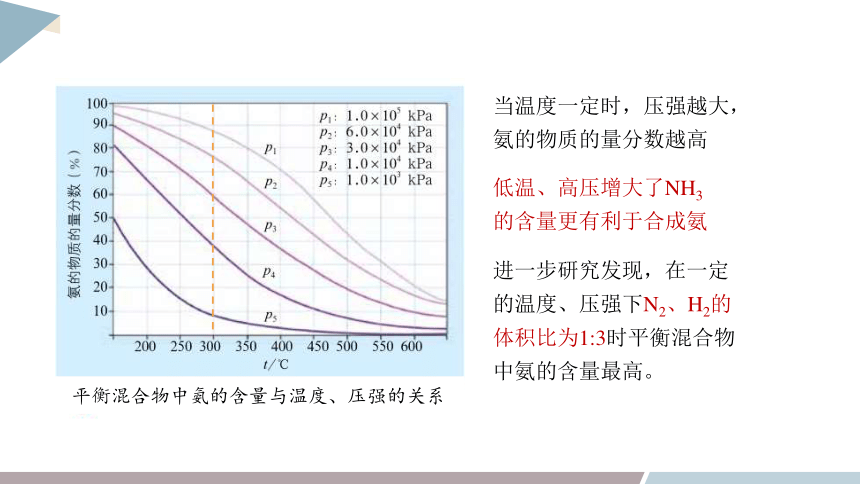
平衡混合物中氨的含量与温度、压强的关系
当温度一定时,压强越大,氨的物质的量分数越高
低温、高压增大了NH3的含量更有利于合成氨
进一步研究发现,在一定的温度、压强下N2、H2的体积比为1:3时平衡混合物中氨的含量最高。
工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g)
ΔH=-92.2 kJ·mol-1
2.利用化学平衡移动的知识分析什么条件有利于氨的合成。
目标:合成氨的平衡转化率越大越好
反应条件:
低温、
高压、
增加反应物浓度、分离氨、氮气与氢气的体积比为1:3
高要求设备
达到化学平衡的时间延长
二、合成氨反应的速率
3.可以通过控制哪些反应条件来提高合成氨反应的速率?
高温、增加反应物浓度、高压、使用催化剂
交流 · 研讨
交流 · 研讨
资料1.合成氨反应速率与参与反应的物质浓度的关系式为:υ=kc(N2) · c1.5(H2) · c-1(NH3)
增加反应物浓度,将氨从混合气中分离出去。
资料2.催化剂对合成氨反应的速率影响:
条件 Ea/(kJ·mol-1)
无催化剂 335 3.4×1012(700K)
使用铁催化剂 167
使用铁作催化剂
根据对合成氨反应的速率及催化反应历程的研究,氮的吸附分解所需活化能最高,是控制总反应速率的关键步骤。应适当提高氮气的比例,n(N2) : n(H2) = 1 : 2.8 。
合成氨反应的限度 合成氨反应的速率
低温
高压
增加反应物浓度、分离氨
n(N2) : n(H2) = 1 : 3
高温
高压
增加反应物浓度、分离氨
n(N2) : n(H2) = 1 : 2.8
铁催化剂
三、合成氨生产的适宜条件
此外,还应该考虑原料的价格、未转化的合成气(氮气和氢气)的循环使用、反应热的综合利用等问题。
反 应 条 件 压强 温度 催化剂 浓度
根据反应设备选择压强:低压(1×107Pa) 中压(2×107~3×107Pa) 高压(8.5×107~1×107Pa) 700K 左右 铁 投料比n(N2) : n(H2) = 1 : 2.8
使气态NH3变成液态NH3并及时分离出去,补充N2和H2
不足:
研究方向:
合成氨工业生产需要高温、高压的反应条件且催化剂易中毒、使用寿命不长。
仿生固氮酶催化剂
根瘤菌固氮
合成氨的生产流程
合成氨的整个工业生产包括造气、净化、合成氨三大部分。
造气 原料气中的氮气来自空气,而氢气来自天然气、煤和炼油产品。
以天然气为原料时,反应可简单表示为:
净化 消除造气过程中夹带的杂质,防止催化剂中毒。
合成氨 该部分包括终端产品氨的分离,氮气、氢气的循环使用,利
用反应产生的热预热合成气等。
CH4 + H2O CO + 3H2
CO + H2O CO2 + H2
高温
催化剂
高温
催化剂
合成氨生产过程中,要使用多种催化剂、十几个反应塔或吸收塔、上百个热交换器和循环泵以及上千米的管道,这些构成了合成氨厂错落有致的设备布局。
【练一练】
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)使用铁做催化剂,可提高合成氨反应的速率和平衡转化率。 ( )
(2)高压比常压条件更有利于合成氨的反应。( )
(3)500 ℃左右比室温更有利于合成氨的反应,提高H2的平衡转化率。( )
(4)合成氨时采用循环操作,可提高原料的利用率。( )
(5)合成氨采用2×107~5×107 Pa,因为该压强下铁触媒的活性最高。( )
(6)合成氨工业采用高压,不仅能提高转化率,还能缩短到达平衡的时间。( )
2.合成氨时采用700 K左右的温度进行,主要是因为在该温度时( )
A.合成氨的化学反应速率最大
B.N2的转化率最高
C.催化剂的活性最大
D.NH3在平衡混合气体中的体积分数最大
C
3.在合成氨时,既要使氨的产率增大,又要使化学反应速率增大,可以采取的措施有( )
①增大体积使压强减小 ②减小体积使压强增大 ③升高温度 ④降低温度 ⑤恒温恒容,再充入等量的N2和H2 ⑥恒温恒压,再充入等量的N2和H2 ⑦及时分离产生的NH3 ⑧使用正催化剂
A.①④⑤⑦ B.②③④⑦⑧ C.②⑤ D.②③⑤⑥⑧
C
4.工业合成氨的正反应是放热反应,下列关于反应N2(g)+3H2(g) 2NH3(g)的图像中,错误的是( )
C
5.有关合成氨工业的下列说法正确的是( )
A.从合成塔出来的混合气体,NH3的含量较小,所以生产氨的工厂的效率都很低
B.由于氨可液化分离出来,N2、H2在实际生产中循环使用,所以总体来说氨的产率较高
C.合成氨工业的反应温度一般控制在700 K左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107~3×107 Pa,因在该压强下铁催化剂的活性最大
B
工业合成氨
化学反应的方向
化学反应的限度
化学反应速率
实际情况
700K左右
低压、中压、高压
催化剂铁
氮气、氢气循环操作
分离氨
第4节 化学反应条件的优化——工业合成氨
第2章 化学反应的方向、限度与速率
1.了解如何应用化学反应速率和化学平衡原理分析合成氨的适宜条件;
2.了解应用化学反应原理分析化工生产条件的思路和方法,体验实际生产条件的选择与理论分析的差异;
3.通过对合成氨适宜条件的分析,认识化学反应速率和化学平衡的调控在工业生产中的重要作用。
联想 · 质疑
联想 · 质疑
在历史上,化学曾在扩大世界粮食供应过程中起过关键作用。这就是合成氨的发明和现代农药的使用,以及它们的工业化。
但自从1784年氨被发现以来,直到1913年才实现了合成氨的工业化生产。
N2(g)+3H2(g) 2NH3(g)
要实现合成氨的工业化生产,必须从反应速率和反应限度两个方面选择合适的反应条件。
一、合成氨反应的限度
交流 · 研讨
交流 · 研讨
工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g)
298 K
ΔH=-92.2 kJ·mol-1
ΔS=-198.2 J·K-1·mol-1
1.根据反应的焓变和熵变分析在298 K时合成氨反应能否正向自发进行。
合成氨反应是在298 K时能正向自发进行的放热反应,同时也是熵减反应。
工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g)
ΔH=-92.2 kJ·mol-1
2.利用化学平衡移动的知识分析什么条件有利于氨的合成。
目标:合成氨的平衡转化率越大越好
低温
高压
增加反应物浓度,
降低生成物浓度
因素 相应措施
温度
浓度
压强
平衡混合物中氨的含量与温度、压强的关系
平衡混合物中氨的含量与温度、压强的关系
当压强为p1时,升高温度,
氨的物质的量分数降低
如何比较相同温度下,平衡混合物中氨的含量与压强的关系?
平衡混合物中氨的含量与温度、压强的关系
当温度一定时,压强越大,氨的物质的量分数越高
低温、高压增大了NH3的含量更有利于合成氨
进一步研究发现,在一定的温度、压强下N2、H2的体积比为1:3时平衡混合物中氨的含量最高。
工业合成氨的反应为:N2(g)+3H2(g) 2NH3(g)
ΔH=-92.2 kJ·mol-1
2.利用化学平衡移动的知识分析什么条件有利于氨的合成。
目标:合成氨的平衡转化率越大越好
反应条件:
低温、
高压、
增加反应物浓度、分离氨、氮气与氢气的体积比为1:3
高要求设备
达到化学平衡的时间延长
二、合成氨反应的速率
3.可以通过控制哪些反应条件来提高合成氨反应的速率?
高温、增加反应物浓度、高压、使用催化剂
交流 · 研讨
交流 · 研讨
资料1.合成氨反应速率与参与反应的物质浓度的关系式为:υ=kc(N2) · c1.5(H2) · c-1(NH3)
增加反应物浓度,将氨从混合气中分离出去。
资料2.催化剂对合成氨反应的速率影响:
条件 Ea/(kJ·mol-1)
无催化剂 335 3.4×1012(700K)
使用铁催化剂 167
使用铁作催化剂
根据对合成氨反应的速率及催化反应历程的研究,氮的吸附分解所需活化能最高,是控制总反应速率的关键步骤。应适当提高氮气的比例,n(N2) : n(H2) = 1 : 2.8 。
合成氨反应的限度 合成氨反应的速率
低温
高压
增加反应物浓度、分离氨
n(N2) : n(H2) = 1 : 3
高温
高压
增加反应物浓度、分离氨
n(N2) : n(H2) = 1 : 2.8
铁催化剂
三、合成氨生产的适宜条件
此外,还应该考虑原料的价格、未转化的合成气(氮气和氢气)的循环使用、反应热的综合利用等问题。
反 应 条 件 压强 温度 催化剂 浓度
根据反应设备选择压强:低压(1×107Pa) 中压(2×107~3×107Pa) 高压(8.5×107~1×107Pa) 700K 左右 铁 投料比n(N2) : n(H2) = 1 : 2.8
使气态NH3变成液态NH3并及时分离出去,补充N2和H2
不足:
研究方向:
合成氨工业生产需要高温、高压的反应条件且催化剂易中毒、使用寿命不长。
仿生固氮酶催化剂
根瘤菌固氮
合成氨的生产流程
合成氨的整个工业生产包括造气、净化、合成氨三大部分。
造气 原料气中的氮气来自空气,而氢气来自天然气、煤和炼油产品。
以天然气为原料时,反应可简单表示为:
净化 消除造气过程中夹带的杂质,防止催化剂中毒。
合成氨 该部分包括终端产品氨的分离,氮气、氢气的循环使用,利
用反应产生的热预热合成气等。
CH4 + H2O CO + 3H2
CO + H2O CO2 + H2
高温
催化剂
高温
催化剂
合成氨生产过程中,要使用多种催化剂、十几个反应塔或吸收塔、上百个热交换器和循环泵以及上千米的管道,这些构成了合成氨厂错落有致的设备布局。
【练一练】
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)使用铁做催化剂,可提高合成氨反应的速率和平衡转化率。 ( )
(2)高压比常压条件更有利于合成氨的反应。( )
(3)500 ℃左右比室温更有利于合成氨的反应,提高H2的平衡转化率。( )
(4)合成氨时采用循环操作,可提高原料的利用率。( )
(5)合成氨采用2×107~5×107 Pa,因为该压强下铁触媒的活性最高。( )
(6)合成氨工业采用高压,不仅能提高转化率,还能缩短到达平衡的时间。( )
2.合成氨时采用700 K左右的温度进行,主要是因为在该温度时( )
A.合成氨的化学反应速率最大
B.N2的转化率最高
C.催化剂的活性最大
D.NH3在平衡混合气体中的体积分数最大
C
3.在合成氨时,既要使氨的产率增大,又要使化学反应速率增大,可以采取的措施有( )
①增大体积使压强减小 ②减小体积使压强增大 ③升高温度 ④降低温度 ⑤恒温恒容,再充入等量的N2和H2 ⑥恒温恒压,再充入等量的N2和H2 ⑦及时分离产生的NH3 ⑧使用正催化剂
A.①④⑤⑦ B.②③④⑦⑧ C.②⑤ D.②③⑤⑥⑧
C
4.工业合成氨的正反应是放热反应,下列关于反应N2(g)+3H2(g) 2NH3(g)的图像中,错误的是( )
C
5.有关合成氨工业的下列说法正确的是( )
A.从合成塔出来的混合气体,NH3的含量较小,所以生产氨的工厂的效率都很低
B.由于氨可液化分离出来,N2、H2在实际生产中循环使用,所以总体来说氨的产率较高
C.合成氨工业的反应温度一般控制在700 K左右,目的是使化学平衡向正反应方向移动
D.合成氨厂采用的压强是2×107~3×107 Pa,因在该压强下铁催化剂的活性最大
B
工业合成氨
化学反应的方向
化学反应的限度
化学反应速率
实际情况
700K左右
低压、中压、高压
催化剂铁
氮气、氢气循环操作
分离氨
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
