3.1 课时1 水的电离 强、弱电解质 课件 (共23张PPT)2023-2024学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 3.1 课时1 水的电离 强、弱电解质 课件 (共23张PPT)2023-2024学年高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 15:57:39 | ||
图片预览




文档简介
(共23张PPT)
第1节 水与水溶液 课时1
1.理解水的电离以及水的离子积常数的含义,能用水的离子积常数进行相关计算;
2.知道强、弱电解质的区别,理解弱电解质的电离特点。
联想 · 质疑
联想 · 质疑
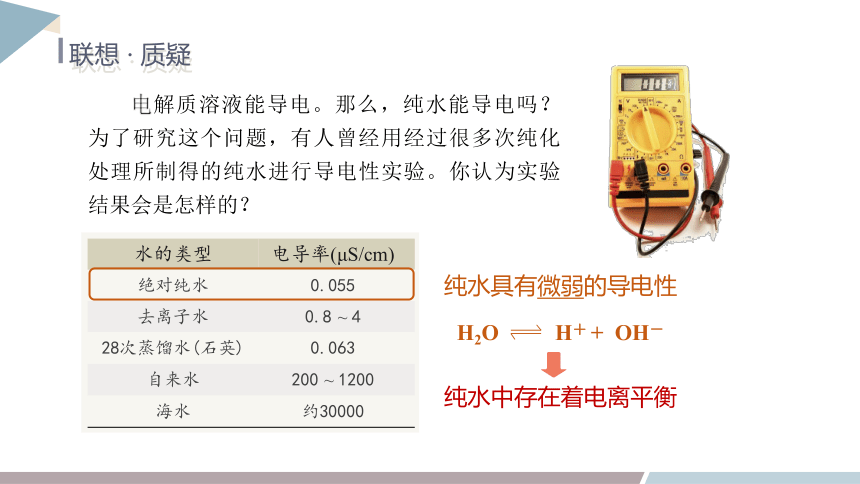
电解质溶液能导电。那么,纯水能导电吗?为了研究这个问题,有人曾经用经过很多次纯化处理所制得的纯水进行导电性实验。你认为实验结果会是怎样的?
水的类型 电导率(μS/cm)
绝对纯水 0.055
去离子水 0.8 ~ 4
28次蒸馏水(石英) 0.063
自来水 200 ~ 1200
海水 约30000
纯水具有微弱的导电性
H2O H+ + OH-
纯水中存在着电离平衡
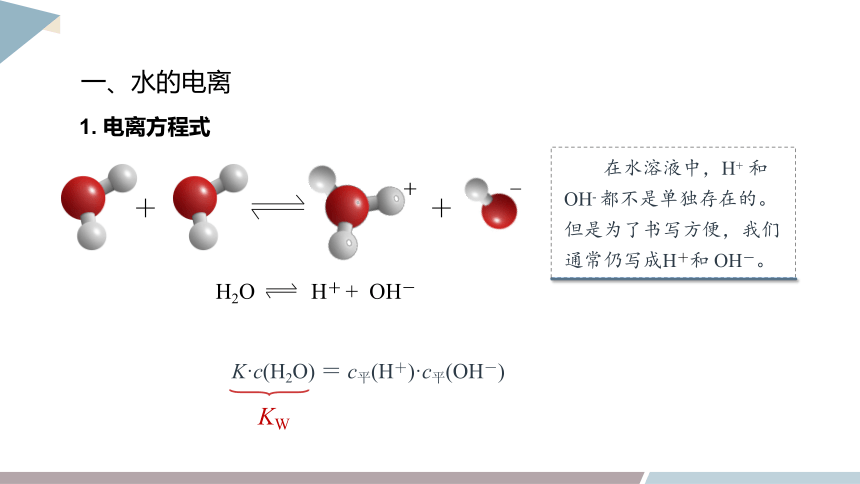
一、水的电离
H2O H+ + OH-
1. 电离方程式
在水溶液中,H+ 和 OH- 都不是单独存在的。但是为了书写方便,我们通常仍写成H+和 OH-。
电离平衡常数:K=
+
+
+
-
c平(H+)·c平(OH-)
c(H2O)
一定温度下为定值
K·c(H2O) = c平(H+)·c平(OH-)
KW
2. 水的离子积常数
Kw = c平(H+)·c平(OH-)
(1)表达式:
[思考] 25℃时,测得纯水的 pH = 7,求该温度下,水的离子积常数。
pH = -lg c(H+)
25℃时,KW = c平(H+)·c平(OH-)
= 1×10﹣14 mol2·L﹣2
由pH=7可知:
c平(H+) = c平(OH-) = 1×10﹣7 mol·L﹣1
温度变化,KW会如何变化?
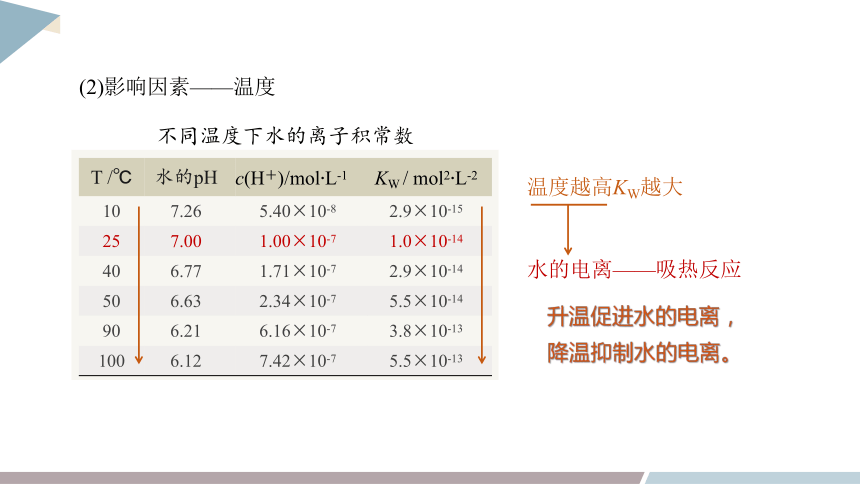
(2)影响因素——温度
T /℃ 水的pH c(H+)/mol·L-1 KW / mol2·L-2
10 7.26 5.40×10-8 2.9×10-15
25 7.00 1.00×10-7 1.0×10-14
40 6.77 1.71×10-7 2.9×10-14
50 6.63 2.34×10-7 5.5×10-14
90 6.21 6.16×10-7 3.8×10-13
100 6.12 7.42×10-7 5.5×10-13
不同温度下水的离子积常数
温度越高KW越大
水的电离——吸热反应
升温促进水的电离,
降温抑制水的电离。
(3)KW的适用范围:
不仅适用于纯水,也适用于酸、碱、盐的稀溶液。
注意:在Kw=c平(H+)·c平(OH-)中,c平(H+)、c平(OH-)均指整个溶液中的总物质的量浓度。
①中性溶液:
②稀酸溶液(25℃):若酸电离出的c平(H+)酸>10-5 mol·L-1,则忽略水的电离。
③稀碱溶液(25℃):若碱电离出的c平(H+)酸>10-5 mol·L-1,则忽略水的电离。
注意:任何水溶液中,由水电离出的OH-和H+的浓度都是相等的。
Kw=c平(H+)水·c平(OH-)水,c平(H+)=c平(OH-)
Kw=c平(H+)酸·c平(OH-)水
Kw=c平(H+)水·c平(OH-)碱
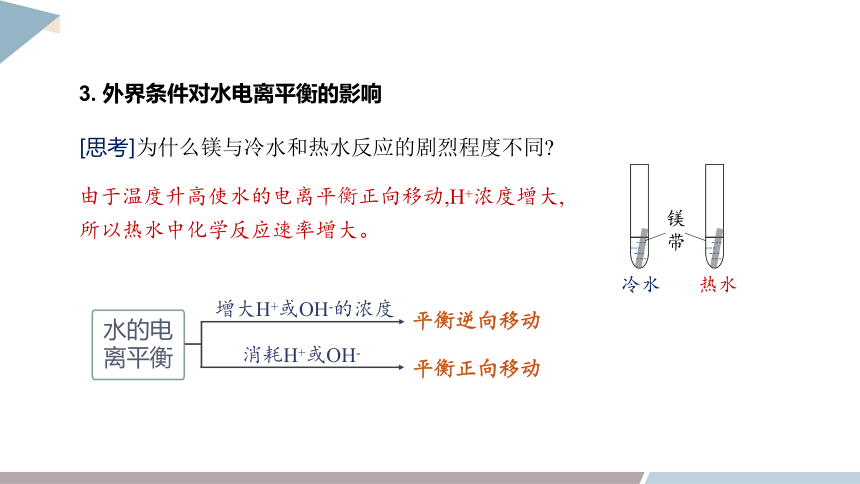
3. 外界条件对水电离平衡的影响
冷水
镁
带
热水
[思考]为什么镁与冷水和热水反应的剧烈程度不同
由于温度升高使水的电离平衡正向移动,H+浓度增大,所以热水中化学反应速率增大。
水的电
离平衡
增大H+或OH-的浓度
消耗H+或OH-
平衡逆向移动
平衡正向移动
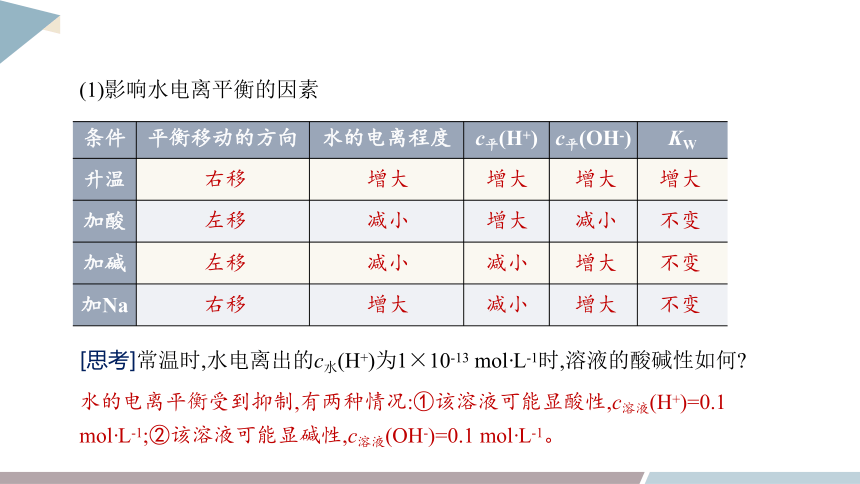
(1)影响水电离平衡的因素
条件 平衡移动的方向 水的电离程度 c平(H+) c平(OH-) KW
升温
加酸
加碱
加Na
右移
增大
增大
增大
增大
左移
减小
增大
减小
不变
左移
减小
减小
增大
不变
右移
增大
减小
增大
不变
[思考]常温时,水电离出的c水(H+)为1×10-13 mol·L-1时,溶液的酸碱性如何
水的电离平衡受到抑制,有两种情况:①该溶液可能显酸性,c溶液(H+)=0.1 mol·L-1;②该溶液可能显碱性,c溶液(OH-)=0.1 mol·L-1。
纯水的导电能力非常弱,但是向其中加入电解质形成溶液后导电能力会增强。
联想 · 质疑
联想 · 质疑
水的电离非常弱,为什么生活中水会引发触电事故?
电解质溶液的导电能力一样吗?
二、电解质在水溶液中的存在形态
等体积、等浓度的盐酸、氨水、 CH3COOH 溶液、NaCl 溶液的导电实验
醋酸
盐酸
氨水
NaCl
强弱强弱
思考与交流
Ⅰ.四组灯泡都亮说明了什么?
四组溶液均能导电(存在自由移动的离子)。
Ⅱ.亮度不一样又说明了什么?
体积和浓度相同的条件下,盐酸、NaCl溶液中可以自由移动的离子比氨水和醋酸的多,导电能力更强。
Ⅲ.以上电解质在溶于水的过程中发生了什么变化?它们最终以什么形态存在?
HCl
H+
Cl-
H+
CH3COOH
CH3COOH
CH3COO-
HCl H+ + Cl-
CH3COOH CH3COO- + H+
完全电离
存在电离平衡
HCl和CH3COOH电离情况的比较
在盐酸、NaCl溶液中,全部变为自由移动的离子;而在CH3COOH、氨水中没有全部电离为离子,仍有大量溶质分子存在。
NaCl
Na+
Cl-
NH4
NH3·H2O
NH3·H2O
OH-
NaCl Na+ + Cl-
完全电离
存在电离平衡
NaCl和NH3·H2O电离情况的比较
NH3·H2O OH- + NH4
+
+
1. 强、弱电解质
(1)强电解质:在稀的水溶液里能完全电离的电解质。
包括:强酸、强碱、大部分盐
存在形态:离子
(2)弱电解质:在稀的水溶液里部分电离的电解质。
包括:弱酸、弱碱、水、极少数盐
存在形态:分子和离子
在写电离方程式时用“===”
在写电离方程式时用“ ”
①多元弱酸:分步电离,电离程度逐步减弱,必须分步书写。
②多元弱碱:分步进行,但一般按一步电离的形式书写。
Ⅰ.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强吗?
不一定,与电解质溶液的浓度有关,很稀的强电解质溶液也可能比浓度较大的弱电解质溶液的导电能力弱。
Ⅱ.电解质溶液的导电过程属于物理变化还是化学变化?
电解质溶液的导电过程属于化学变化。
思考与交流
2. 溶剂化作用
电解质溶液中,不论是离子还是分子,都不是单独存在的,而是与水分子相互吸引、相互结合,以“水合离子”或“水合分子”的形态存在的。这种溶质离子或分子与溶剂分子相互吸引的作用叫作溶剂化作用。
离子
水合物
【练一练】
1.某温度下,纯水中c平(H+)=2×10-7 mol·L-1,则此时纯水中的c平(OH-)为________mol·L-1;若温度不变,滴入稀硫酸使c平(H+)=0.5 mol·L-1,则溶液中c平(OH-)为________ mol·L-1,由水电离产生的c平(H+)为__________mol·L-1,此时温度________(填“高于”“低于”或“等于”)25 ℃。
2×10-7
8×10-14
8×10-14
高于
2.能影响水的电离平衡,并使溶液中的c平(H+)>c平(OH-)的操作是( )
A.向水中投入一小块金属钠
B.将水加热煮沸
C.向水中通入CO2气体
D.向水中加食盐晶体
C
3.室温下某溶液中由水电离产生的c(H+)=1×10-5 mol·L-1,该溶液不可能是( )
A. NaHSO4 B. NaCl C. HCl D. Ba(OH)2
B
4.下列物质中,属于电解质的是_____________ (填序号,下同),
属于强电解质的是___________,属于弱电解质的是________。
①HClO4 ②盐酸 ③氯气 ④CH3COONH4 ⑤乙醇 ⑥硫酸
⑦H2SO3 ⑧熔融Ba(OH)2 ⑨HCl ⑩氨气 CO2
⑦
①④⑥⑦⑧⑨
①④⑥⑧⑨
5.关于强、弱电解质的有关叙述错误的是( )
A.强电解质在稀的水溶液中完全电离成阴、阳离子
B.在溶液中,导电能力强的电解质是强电解质
C.对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同
D.纯净的强电解质在液态时,有的导电,有的不导电
有些强电解质是共价化合物,在液态时没有自由移动的离子,所以不导电
B
6.下列电离方程式正确的是( )
弱酸的酸式盐第一步是盐的完全电离,第二步是弱酸酸式酸根离子的部分电离。
C
7.(双选)25 ℃时,水的电离可达到平衡:H2O H++OH- ΔH>0。
下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c平(OH-)降低
B.将水加热,KW增大,c平(H+)增大
C.向水中加入少量CH3COONa固体,平衡逆向移动,c平(H+)降低
D.向水中加入少量固体硫酸氢钠,c平(H+)增大,KW不变
BD
水与水溶液
水的电离
电解质
水的离子积:
定义、表达式、影响因素
影响因素:
温度、溶质浓度
强电解质
弱电解质
电离方程式的书写
第1节 水与水溶液 课时1
1.理解水的电离以及水的离子积常数的含义,能用水的离子积常数进行相关计算;
2.知道强、弱电解质的区别,理解弱电解质的电离特点。
联想 · 质疑
联想 · 质疑
电解质溶液能导电。那么,纯水能导电吗?为了研究这个问题,有人曾经用经过很多次纯化处理所制得的纯水进行导电性实验。你认为实验结果会是怎样的?
水的类型 电导率(μS/cm)
绝对纯水 0.055
去离子水 0.8 ~ 4
28次蒸馏水(石英) 0.063
自来水 200 ~ 1200
海水 约30000
纯水具有微弱的导电性
H2O H+ + OH-
纯水中存在着电离平衡
一、水的电离
H2O H+ + OH-
1. 电离方程式
在水溶液中,H+ 和 OH- 都不是单独存在的。但是为了书写方便,我们通常仍写成H+和 OH-。
电离平衡常数:K=
+
+
+
-
c平(H+)·c平(OH-)
c(H2O)
一定温度下为定值
K·c(H2O) = c平(H+)·c平(OH-)
KW
2. 水的离子积常数
Kw = c平(H+)·c平(OH-)
(1)表达式:
[思考] 25℃时,测得纯水的 pH = 7,求该温度下,水的离子积常数。
pH = -lg c(H+)
25℃时,KW = c平(H+)·c平(OH-)
= 1×10﹣14 mol2·L﹣2
由pH=7可知:
c平(H+) = c平(OH-) = 1×10﹣7 mol·L﹣1
温度变化,KW会如何变化?
(2)影响因素——温度
T /℃ 水的pH c(H+)/mol·L-1 KW / mol2·L-2
10 7.26 5.40×10-8 2.9×10-15
25 7.00 1.00×10-7 1.0×10-14
40 6.77 1.71×10-7 2.9×10-14
50 6.63 2.34×10-7 5.5×10-14
90 6.21 6.16×10-7 3.8×10-13
100 6.12 7.42×10-7 5.5×10-13
不同温度下水的离子积常数
温度越高KW越大
水的电离——吸热反应
升温促进水的电离,
降温抑制水的电离。
(3)KW的适用范围:
不仅适用于纯水,也适用于酸、碱、盐的稀溶液。
注意:在Kw=c平(H+)·c平(OH-)中,c平(H+)、c平(OH-)均指整个溶液中的总物质的量浓度。
①中性溶液:
②稀酸溶液(25℃):若酸电离出的c平(H+)酸>10-5 mol·L-1,则忽略水的电离。
③稀碱溶液(25℃):若碱电离出的c平(H+)酸>10-5 mol·L-1,则忽略水的电离。
注意:任何水溶液中,由水电离出的OH-和H+的浓度都是相等的。
Kw=c平(H+)水·c平(OH-)水,c平(H+)=c平(OH-)
Kw=c平(H+)酸·c平(OH-)水
Kw=c平(H+)水·c平(OH-)碱
3. 外界条件对水电离平衡的影响
冷水
镁
带
热水
[思考]为什么镁与冷水和热水反应的剧烈程度不同
由于温度升高使水的电离平衡正向移动,H+浓度增大,所以热水中化学反应速率增大。
水的电
离平衡
增大H+或OH-的浓度
消耗H+或OH-
平衡逆向移动
平衡正向移动
(1)影响水电离平衡的因素
条件 平衡移动的方向 水的电离程度 c平(H+) c平(OH-) KW
升温
加酸
加碱
加Na
右移
增大
增大
增大
增大
左移
减小
增大
减小
不变
左移
减小
减小
增大
不变
右移
增大
减小
增大
不变
[思考]常温时,水电离出的c水(H+)为1×10-13 mol·L-1时,溶液的酸碱性如何
水的电离平衡受到抑制,有两种情况:①该溶液可能显酸性,c溶液(H+)=0.1 mol·L-1;②该溶液可能显碱性,c溶液(OH-)=0.1 mol·L-1。
纯水的导电能力非常弱,但是向其中加入电解质形成溶液后导电能力会增强。
联想 · 质疑
联想 · 质疑
水的电离非常弱,为什么生活中水会引发触电事故?
电解质溶液的导电能力一样吗?
二、电解质在水溶液中的存在形态
等体积、等浓度的盐酸、氨水、 CH3COOH 溶液、NaCl 溶液的导电实验
醋酸
盐酸
氨水
NaCl
强弱强弱
思考与交流
Ⅰ.四组灯泡都亮说明了什么?
四组溶液均能导电(存在自由移动的离子)。
Ⅱ.亮度不一样又说明了什么?
体积和浓度相同的条件下,盐酸、NaCl溶液中可以自由移动的离子比氨水和醋酸的多,导电能力更强。
Ⅲ.以上电解质在溶于水的过程中发生了什么变化?它们最终以什么形态存在?
HCl
H+
Cl-
H+
CH3COOH
CH3COOH
CH3COO-
HCl H+ + Cl-
CH3COOH CH3COO- + H+
完全电离
存在电离平衡
HCl和CH3COOH电离情况的比较
在盐酸、NaCl溶液中,全部变为自由移动的离子;而在CH3COOH、氨水中没有全部电离为离子,仍有大量溶质分子存在。
NaCl
Na+
Cl-
NH4
NH3·H2O
NH3·H2O
OH-
NaCl Na+ + Cl-
完全电离
存在电离平衡
NaCl和NH3·H2O电离情况的比较
NH3·H2O OH- + NH4
+
+
1. 强、弱电解质
(1)强电解质:在稀的水溶液里能完全电离的电解质。
包括:强酸、强碱、大部分盐
存在形态:离子
(2)弱电解质:在稀的水溶液里部分电离的电解质。
包括:弱酸、弱碱、水、极少数盐
存在形态:分子和离子
在写电离方程式时用“===”
在写电离方程式时用“ ”
①多元弱酸:分步电离,电离程度逐步减弱,必须分步书写。
②多元弱碱:分步进行,但一般按一步电离的形式书写。
Ⅰ.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强吗?
不一定,与电解质溶液的浓度有关,很稀的强电解质溶液也可能比浓度较大的弱电解质溶液的导电能力弱。
Ⅱ.电解质溶液的导电过程属于物理变化还是化学变化?
电解质溶液的导电过程属于化学变化。
思考与交流
2. 溶剂化作用
电解质溶液中,不论是离子还是分子,都不是单独存在的,而是与水分子相互吸引、相互结合,以“水合离子”或“水合分子”的形态存在的。这种溶质离子或分子与溶剂分子相互吸引的作用叫作溶剂化作用。
离子
水合物
【练一练】
1.某温度下,纯水中c平(H+)=2×10-7 mol·L-1,则此时纯水中的c平(OH-)为________mol·L-1;若温度不变,滴入稀硫酸使c平(H+)=0.5 mol·L-1,则溶液中c平(OH-)为________ mol·L-1,由水电离产生的c平(H+)为__________mol·L-1,此时温度________(填“高于”“低于”或“等于”)25 ℃。
2×10-7
8×10-14
8×10-14
高于
2.能影响水的电离平衡,并使溶液中的c平(H+)>c平(OH-)的操作是( )
A.向水中投入一小块金属钠
B.将水加热煮沸
C.向水中通入CO2气体
D.向水中加食盐晶体
C
3.室温下某溶液中由水电离产生的c(H+)=1×10-5 mol·L-1,该溶液不可能是( )
A. NaHSO4 B. NaCl C. HCl D. Ba(OH)2
B
4.下列物质中,属于电解质的是_____________ (填序号,下同),
属于强电解质的是___________,属于弱电解质的是________。
①HClO4 ②盐酸 ③氯气 ④CH3COONH4 ⑤乙醇 ⑥硫酸
⑦H2SO3 ⑧熔融Ba(OH)2 ⑨HCl ⑩氨气 CO2
⑦
①④⑥⑦⑧⑨
①④⑥⑧⑨
5.关于强、弱电解质的有关叙述错误的是( )
A.强电解质在稀的水溶液中完全电离成阴、阳离子
B.在溶液中,导电能力强的电解质是强电解质
C.对同一弱电解质来说,当溶液的温度和浓度不同时,其导电能力也不相同
D.纯净的强电解质在液态时,有的导电,有的不导电
有些强电解质是共价化合物,在液态时没有自由移动的离子,所以不导电
B
6.下列电离方程式正确的是( )
弱酸的酸式盐第一步是盐的完全电离,第二步是弱酸酸式酸根离子的部分电离。
C
7.(双选)25 ℃时,水的电离可达到平衡:H2O H++OH- ΔH>0。
下列叙述正确的是( )
A.向水中加入稀氨水,平衡逆向移动,c平(OH-)降低
B.将水加热,KW增大,c平(H+)增大
C.向水中加入少量CH3COONa固体,平衡逆向移动,c平(H+)降低
D.向水中加入少量固体硫酸氢钠,c平(H+)增大,KW不变
BD
水与水溶液
水的电离
电解质
水的离子积:
定义、表达式、影响因素
影响因素:
温度、溶质浓度
强电解质
弱电解质
电离方程式的书写
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
