3.3 课时2 沉淀溶解平衡的应用 课件 (共21张PPT)2023-2024学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 3.3 课时2 沉淀溶解平衡的应用 课件 (共21张PPT)2023-2024学年高二化学鲁科版(2019)选择性必修1 |

|
|
| 格式 | pptx | ||
| 文件大小 | 15.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 16:07:55 | ||
图片预览








文档简介
(共21张PPT)
第3节 沉淀溶解平衡 课时2
1.能利用平衡移动原理及溶度积常数分析沉淀的生成、溶解和转化。
2.学会利用沉淀溶解平衡的移动分析生产生活中的实际问题。
联想 · 质疑
联想 · 质疑
钡餐造影是指用BaSO4作为造影剂,病人服下BaSO4后,在X射线照射下显示消化道有无病变的一种检查方法。由于Ba2+有剧毒,水溶性钡盐不能用作造影剂,但BaSO4和BaCO3都难溶于水,为什么选用BaSO4作为造影剂而不用选用BaCO3呢?
一、沉淀的溶解与生成
钡餐
BaSO4(s) Ba2+(aq)+ SO(aq) Ksp=1.1×10-10 mol2 L-2
2-
4
BaCO3(s) Ba2+(aq)+ CO(aq) Ksp=5.1×10-9 mol2 L-2
2-
3
由溶度积可知,它们在饱和溶液中电离出的Ba2+ 的浓度相差并不是很大,但是 BaCO3 不可用作钡餐,这是为什么呢?
病人服下钡盐后进入胃部,胃酸的酸性很强(pH为0.9 ~1.5)。
一、沉淀溶解平衡的应用
钡餐
BaCO3(s) Ba2+ (aq)+ CO(aq)
2-
3
Q(BaCO4)H2O+CO2
2H+
+
c(Ba2+)高于使人中毒的危险值,使人中毒
平衡向右移动
不与胃酸中H+结合生成H2SO4,BaSO4沉淀溶解平衡不移动,c(Ba2+)小,保持在安全范围内。
如果误食可溶性钡盐如BaCl2,造成钡中毒,如何选用解毒药呢?
思考与交流
BaSO4(s) Ba2+(aq)+ SO(aq) Ksp=1.1×10-10 mol2 L-2
2-
4
Q(BaSO4) > Ksp(BaSO4)
选用5.0% 的Na2SO4溶液给患者洗胃
要使沉淀溶解平衡向着沉淀生成的方向移动,必要条件是Q> Ksp 。可以增大难溶电解质沉淀溶解平衡系统中有关离子的浓度,使沉淀生成。
2.沉淀的生成
要使沉淀溶解平衡向着沉淀溶解的方向移动,必要条件是 Q < Ksp 。可以加入某种离子,降低难溶电解质沉淀溶解平衡系统中有关离子的浓度,使沉淀溶解。
1.沉淀的溶解
溶洞
石灰岩中的CaCO3和H2O、CO2反应生成Ca(HCO3)2,
存在下列平衡:CaCO3+CO2+H2O??Ca(HCO3)2,
溶有Ca(HCO3)2的水从洞顶滴落时,水分蒸发,压强减小,温度升高等因素都会导致CO2的溶解度减小,平衡逆向移动而析出CaCO3,日积月累就形成了这些奇迹。
珊瑚的形状千姿百态,颜色鲜艳美丽,不仅可以作装饰品,并且还有很高的药用价值。珊瑚是如何形成的呢?
思考与交流
珊瑚虫(腔肠动物)
珊瑚(CaCO3)
c(CO2)
光合作用
沉淀生成
-
3
Ca2+ + 2HCO CaCO3 + H2O + CO2
?
二、沉淀的转化
工业上可用难溶的FeS作为沉淀剂除去废水中的Cu2+、Hg2+、Pb2+等重金属离子。
为什么可以用难溶物做沉淀剂?
一种难溶性盐可以生成另一种难溶性盐?
工业废水处理
观察 · 思考
观察 · 思考
请观察以下实验的现象,并尝试用沉淀溶解平衡的原理进行解释。
【实验现象】
向白色ZnS沉淀中加CuSO4溶液有黑色的CuS沉淀生成。
黑色CuS沉淀是如何生成的呢?
预测1:ZnSO4和Na2S反应生成ZnS沉淀时,Na2S过量,过量的S2-与Cu2+反应生成黑色CuS沉淀。
不成立,加入CuSO4前ZnS沉淀用蒸馏水洗涤2-3次,已经洗去溶液中过量的S2-及沉淀表面残留的S2-。
预测2:ZnS沉淀溶解产生的S2-与Cu2+生成黑色CuS沉淀。
ZnS(s) Zn2+(aq) + S2-(aq) Ksp=1.6×10-24 mol2 L-2
CuS(s) Cu2+(aq) + S2-(aq) Ksp=1.3×10-36 mol2 L-2
Ksp(CuS) Ksp(ZnS)
Cu2+(aq)
CuS(s)
+
ZnS(s) Zn2+(aq) + S2-(aq)
平衡正向移动
ZnS(s)+Cu2+(aq)=== CuS(s)+Zn2+(aq)
总反应式:
(ZnS溶解)
(CuS生成)
二、沉淀的转化
1.实质:
沉淀溶解平衡的移动
2.规律:
通常,一种沉淀可以转化为更难溶的沉淀;
两种难溶物的溶解能力差别越大,转化趋势越大。
学以致用
CaCO3
Mg(OH)2
MgCO3(s) Mg2+ (aq) + CO (aq)
2-
3
CO + H2O HCO + OH-
2-
3
-
3
Mg(OH)2 (s) Mg2+ (aq) + 2OH- (aq)
Q > Ksp Mg(OH)2生成
【练一练】
1.正误判断:正确的打“√”,错误的打“×”。
(1)洗涤沉淀时,洗涤次数越多越好( )
(2)为了减少BaSO4的损失,洗涤BaSO4沉淀时可用稀硫酸代替水( )
(3)常用Na2S等除去废水中某些重金属离子如Cu2+、Hg2+,是因为CuS、HgS的 Ksp都很小 ( )
(4)沉淀的转化只能由难溶的电解质转化为更难溶的电解质( )
(5)可用FeS除去废水中的Hg2+、Ag+等,是因为HgS、Ag2S比FeS更难溶( )
(6)向ZnS沉淀上滴加CuSO4溶液沉淀变为黑色,可推知同温下Ksp(ZnS)<
Ksp(CuS)( )
(7)向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生
成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]( )
2.T ℃时,Ksp[Cu(OH)2]=2.2×10-20 mol3·L-3,Ksp[Fe(OH)3]=1.1×10-38 mol4·L-4。此温度下要除去CuCl2溶液中的少量FeCl3,可以边搅拌边加入一种试剂,这种试剂是( )
A.CuO B.NaOH溶液
C.氨水 D.CuSO4溶液
C
3.自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析一定正确的是( )
A.Ksp(PbS)B.原生铜的硫化物具有还原性,而铜蓝没有还原性
C.CuSO4与ZnS反应的离子方程式是Cu2++S2- === CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
D
4.已知Ksp(AgCl)=1.56×10-10 mol2·L-2,Ksp(AgBr)=7.7×10-13 mol2·L-2,Ksp(Ag2CrO4)=9.0×10-12 mol3·L-3。某溶液中含有Cl-、Br-和 ,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、 B. 、Br-、Cl-
C.Br-、Cl-、 D.Br-、CrO、Cl-
C
5.表面覆盖的牙釉质是人体中最坚硬的部分,起着保护牙齿的作用,其主要成分为羟基磷酸钙[Ca5(PO4)3OH]。在牙齿表面存在着如下平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO(aq)+OH-(aq) Ksp=6.8×10-37。已知Ca5(PO4)3F(s)的Ksp=2.8×10-51。下列说法错误的是( )
A.残留在牙齿上的糖发酵会产生H+,经常吃糖易造成龋齿
B.由题述平衡可知,小孩长牙时要少吃糖多补钙
C.若减少OH-的浓度,题述平衡将向右移动,Ksp的值相应增大
D.使用含氟的牙膏能防止龋齿,是因为Ca5(PO4)3OH(s)转化为更难溶的Ca5(PO4)3F(s)
C
沉淀溶解平衡
自然现象(溶洞、珊瑚)
工业生产(废水处理)
医疗(钡餐)
沉淀的溶解
沉淀的生成
沉淀的转化
第3节 沉淀溶解平衡 课时2
1.能利用平衡移动原理及溶度积常数分析沉淀的生成、溶解和转化。
2.学会利用沉淀溶解平衡的移动分析生产生活中的实际问题。
联想 · 质疑
联想 · 质疑
钡餐造影是指用BaSO4作为造影剂,病人服下BaSO4后,在X射线照射下显示消化道有无病变的一种检查方法。由于Ba2+有剧毒,水溶性钡盐不能用作造影剂,但BaSO4和BaCO3都难溶于水,为什么选用BaSO4作为造影剂而不用选用BaCO3呢?
一、沉淀的溶解与生成
钡餐
BaSO4(s) Ba2+(aq)+ SO(aq) Ksp=1.1×10-10 mol2 L-2
2-
4
BaCO3(s) Ba2+(aq)+ CO(aq) Ksp=5.1×10-9 mol2 L-2
2-
3
由溶度积可知,它们在饱和溶液中电离出的Ba2+ 的浓度相差并不是很大,但是 BaCO3 不可用作钡餐,这是为什么呢?
病人服下钡盐后进入胃部,胃酸的酸性很强(pH为0.9 ~1.5)。
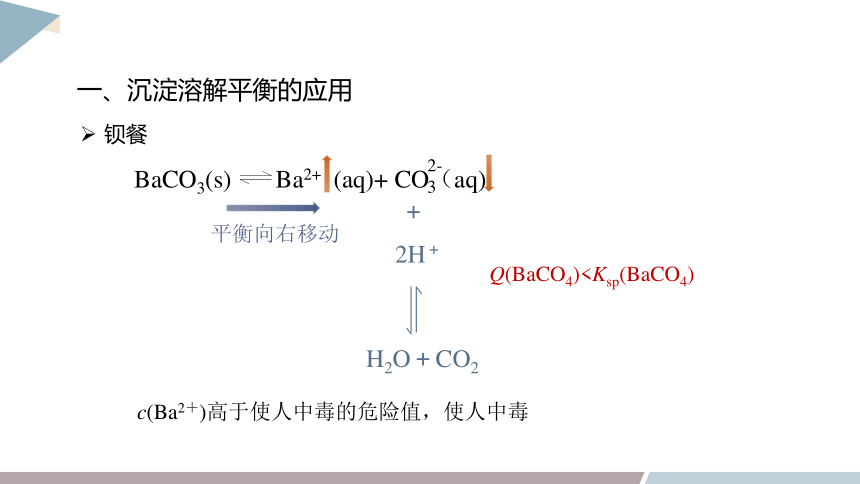
一、沉淀溶解平衡的应用
钡餐
BaCO3(s) Ba2+ (aq)+ CO(aq)
2-
3
Q(BaCO4)
2H+
+
c(Ba2+)高于使人中毒的危险值,使人中毒
平衡向右移动
不与胃酸中H+结合生成H2SO4,BaSO4沉淀溶解平衡不移动,c(Ba2+)小,保持在安全范围内。
如果误食可溶性钡盐如BaCl2,造成钡中毒,如何选用解毒药呢?
思考与交流
BaSO4(s) Ba2+(aq)+ SO(aq) Ksp=1.1×10-10 mol2 L-2
2-
4
Q(BaSO4) > Ksp(BaSO4)
选用5.0% 的Na2SO4溶液给患者洗胃
要使沉淀溶解平衡向着沉淀生成的方向移动,必要条件是Q> Ksp 。可以增大难溶电解质沉淀溶解平衡系统中有关离子的浓度,使沉淀生成。
2.沉淀的生成
要使沉淀溶解平衡向着沉淀溶解的方向移动,必要条件是 Q < Ksp 。可以加入某种离子,降低难溶电解质沉淀溶解平衡系统中有关离子的浓度,使沉淀溶解。
1.沉淀的溶解
溶洞
石灰岩中的CaCO3和H2O、CO2反应生成Ca(HCO3)2,
存在下列平衡:CaCO3+CO2+H2O??Ca(HCO3)2,
溶有Ca(HCO3)2的水从洞顶滴落时,水分蒸发,压强减小,温度升高等因素都会导致CO2的溶解度减小,平衡逆向移动而析出CaCO3,日积月累就形成了这些奇迹。
珊瑚的形状千姿百态,颜色鲜艳美丽,不仅可以作装饰品,并且还有很高的药用价值。珊瑚是如何形成的呢?
思考与交流
珊瑚虫(腔肠动物)
珊瑚(CaCO3)
c(CO2)
光合作用
沉淀生成
-
3
Ca2+ + 2HCO CaCO3 + H2O + CO2
?
二、沉淀的转化
工业上可用难溶的FeS作为沉淀剂除去废水中的Cu2+、Hg2+、Pb2+等重金属离子。
为什么可以用难溶物做沉淀剂?
一种难溶性盐可以生成另一种难溶性盐?
工业废水处理
观察 · 思考
观察 · 思考
请观察以下实验的现象,并尝试用沉淀溶解平衡的原理进行解释。
【实验现象】
向白色ZnS沉淀中加CuSO4溶液有黑色的CuS沉淀生成。
黑色CuS沉淀是如何生成的呢?
预测1:ZnSO4和Na2S反应生成ZnS沉淀时,Na2S过量,过量的S2-与Cu2+反应生成黑色CuS沉淀。
不成立,加入CuSO4前ZnS沉淀用蒸馏水洗涤2-3次,已经洗去溶液中过量的S2-及沉淀表面残留的S2-。
预测2:ZnS沉淀溶解产生的S2-与Cu2+生成黑色CuS沉淀。
ZnS(s) Zn2+(aq) + S2-(aq) Ksp=1.6×10-24 mol2 L-2
CuS(s) Cu2+(aq) + S2-(aq) Ksp=1.3×10-36 mol2 L-2
Ksp(CuS) Ksp(ZnS)
Cu2+(aq)
CuS(s)
+
ZnS(s) Zn2+(aq) + S2-(aq)
平衡正向移动
ZnS(s)+Cu2+(aq)=== CuS(s)+Zn2+(aq)
总反应式:
(ZnS溶解)
(CuS生成)
二、沉淀的转化
1.实质:
沉淀溶解平衡的移动
2.规律:
通常,一种沉淀可以转化为更难溶的沉淀;
两种难溶物的溶解能力差别越大,转化趋势越大。
学以致用
CaCO3
Mg(OH)2
MgCO3(s) Mg2+ (aq) + CO (aq)
2-
3
CO + H2O HCO + OH-
2-
3
-
3
Mg(OH)2 (s) Mg2+ (aq) + 2OH- (aq)
Q > Ksp Mg(OH)2生成
【练一练】
1.正误判断:正确的打“√”,错误的打“×”。
(1)洗涤沉淀时,洗涤次数越多越好( )
(2)为了减少BaSO4的损失,洗涤BaSO4沉淀时可用稀硫酸代替水( )
(3)常用Na2S等除去废水中某些重金属离子如Cu2+、Hg2+,是因为CuS、HgS的 Ksp都很小 ( )
(4)沉淀的转化只能由难溶的电解质转化为更难溶的电解质( )
(5)可用FeS除去废水中的Hg2+、Ag+等,是因为HgS、Ag2S比FeS更难溶( )
(6)向ZnS沉淀上滴加CuSO4溶液沉淀变为黑色,可推知同温下Ksp(ZnS)<
Ksp(CuS)( )
(7)向浓度均为0.1 mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先生
成蓝色沉淀,说明Ksp[Cu(OH)2]>Ksp[Mg(OH)2]( )
2.T ℃时,Ksp[Cu(OH)2]=2.2×10-20 mol3·L-3,Ksp[Fe(OH)3]=1.1×10-38 mol4·L-4。此温度下要除去CuCl2溶液中的少量FeCl3,可以边搅拌边加入一种试剂,这种试剂是( )
A.CuO B.NaOH溶液
C.氨水 D.CuSO4溶液
C
3.自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透,遇到难溶的ZnS或PbS,慢慢转变为铜蓝(CuS)。下列分析一定正确的是( )
A.Ksp(PbS)
C.CuSO4与ZnS反应的离子方程式是Cu2++S2- === CuS↓
D.整个过程涉及的反应类型有氧化还原反应和复分解反应
D
4.已知Ksp(AgCl)=1.56×10-10 mol2·L-2,Ksp(AgBr)=7.7×10-13 mol2·L-2,Ksp(Ag2CrO4)=9.0×10-12 mol3·L-3。某溶液中含有Cl-、Br-和 ,浓度均为0.010 mol·L-1,向该溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A.Cl-、Br-、 B. 、Br-、Cl-
C.Br-、Cl-、 D.Br-、CrO、Cl-
C
5.表面覆盖的牙釉质是人体中最坚硬的部分,起着保护牙齿的作用,其主要成分为羟基磷酸钙[Ca5(PO4)3OH]。在牙齿表面存在着如下平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO(aq)+OH-(aq) Ksp=6.8×10-37。已知Ca5(PO4)3F(s)的Ksp=2.8×10-51。下列说法错误的是( )
A.残留在牙齿上的糖发酵会产生H+,经常吃糖易造成龋齿
B.由题述平衡可知,小孩长牙时要少吃糖多补钙
C.若减少OH-的浓度,题述平衡将向右移动,Ksp的值相应增大
D.使用含氟的牙膏能防止龋齿,是因为Ca5(PO4)3OH(s)转化为更难溶的Ca5(PO4)3F(s)
C
沉淀溶解平衡
自然现象(溶洞、珊瑚)
工业生产(废水处理)
医疗(钡餐)
沉淀的溶解
沉淀的生成
沉淀的转化
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
