第1章 章末复习 课件(共37张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第1章 章末复习 课件(共37张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 16:29:24 | ||
图片预览






文档简介
(共37张PPT)
章末复习
第1章 物质的性质与转化
1.能进行反应焓变的简单计算,正确书写热化学方程式;
2.能分析、解释原电池和电解池的工作原理,设计简单的原电池和电解池;
3.能利用电化学原理解释金属腐蚀现象,选择并设计防腐措施;
4.能综合化学变化中的物质变化和能量变化来分析、解决实际问题。
知识点一:反应热 焓变
1.反应热
2.焓变
符号:
单位:
规定:
在等温条件下,化学反应体系向环境释放或从环境吸收的热量
生成物与反应物的焓值差,等压条件下的反应热也可称为“焓变”。
H
kJ/mol
当 H<0时,为放热反应;当 H>0时,为吸热反应
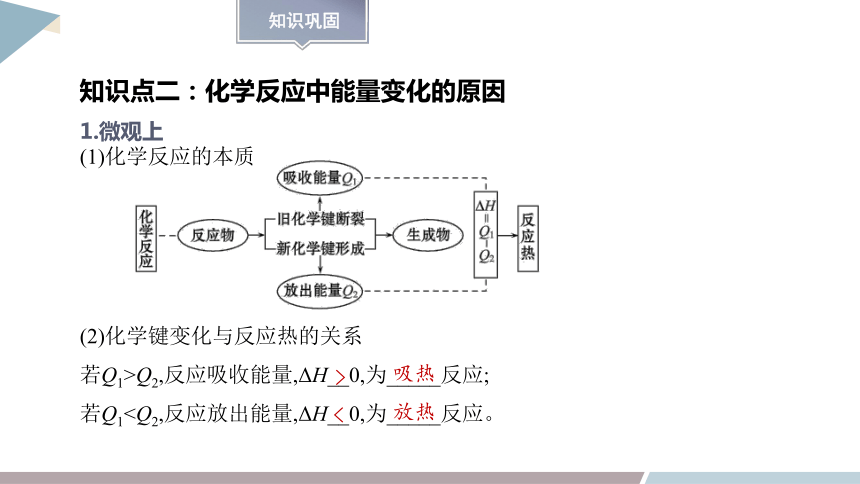
1.微观上
(1)化学反应的本质
(2)化学键变化与反应热的关系
若Q1>Q2,反应吸收能量,ΔH__0,为_____反应;
若Q1>
吸热
<
放热
知识点二:化学反应中能量变化的原因
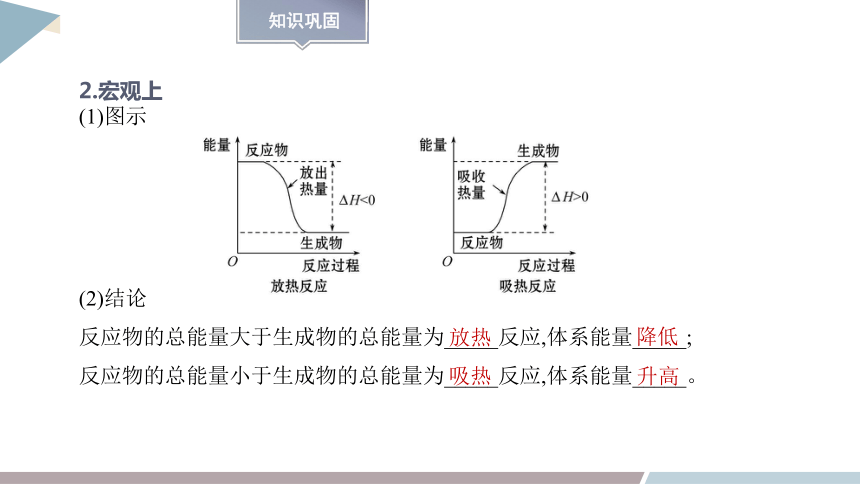
2.宏观上
(1)图示
(2)结论
反应物的总能量大于生成物的总能量为_____反应,体系能量_____;
反应物的总能量小于生成物的总能量为_____反应,体系能量_____。
放热
降低
吸热
升高
知识点三:热化学方程式的书写
1.定义:
表明反应所释放或吸收的热量的化学方程式。
表明了化学反应中的物质变化和能量变化。
2.含义:
3.书写热化学方程式步骤:
写出配平的化学方程式
用s、l、g、aq标明物质的聚集状态状态
根据吸热或者放热判断ΔH的正负
根据化学计量数计算写出ΔH的值
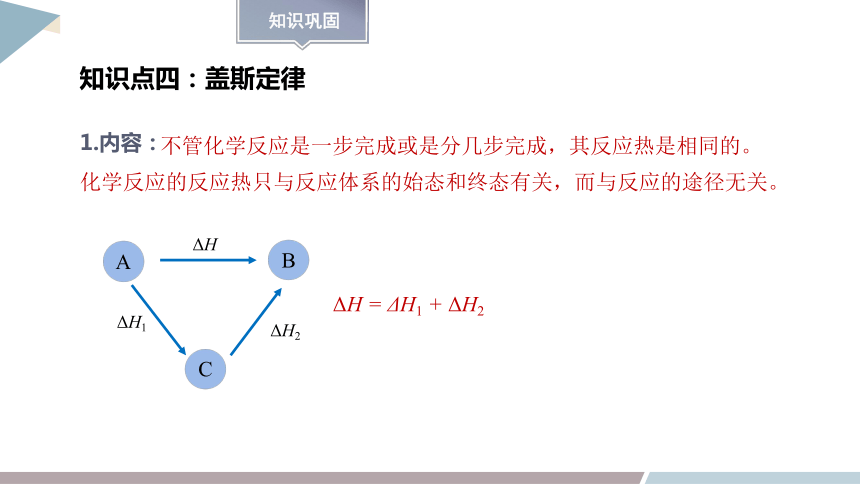
不管化学反应是一步完成或是分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
知识点四:盖斯定律
1.内容:
A
B
C
ΔH
ΔH1
ΔH2
ΔH = ΔH1 + ΔH2
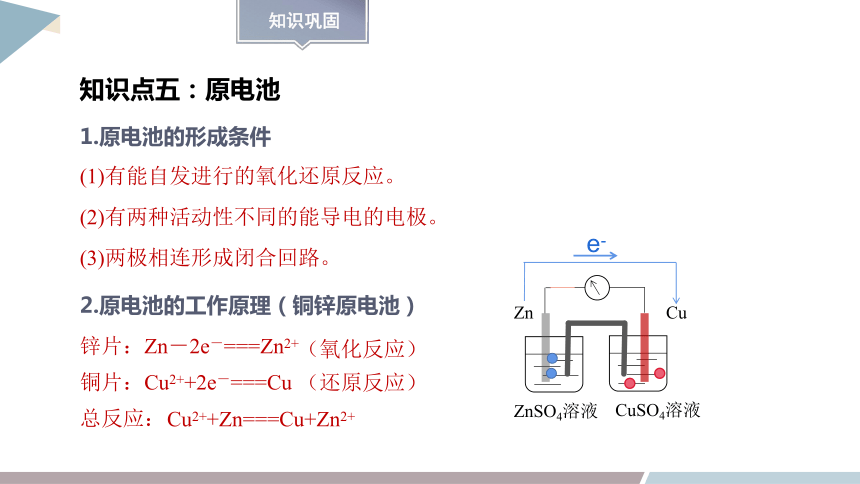
知识点五:原电池
1.原电池的形成条件
(1)有能自发进行的氧化还原反应。
(2)有两种活动性不同的能导电的电极。
(3)两极相连形成闭合回路。
2.原电池的工作原理(铜锌原电池)
CuSO4溶液
Zn
Cu
ZnSO4溶液
e-
锌片:Zn-2e-===Zn2+
铜片:Cu2++2e-===Cu
总反应:
Cu2++Zn===Cu+Zn2+
(还原反应)
(氧化反应)
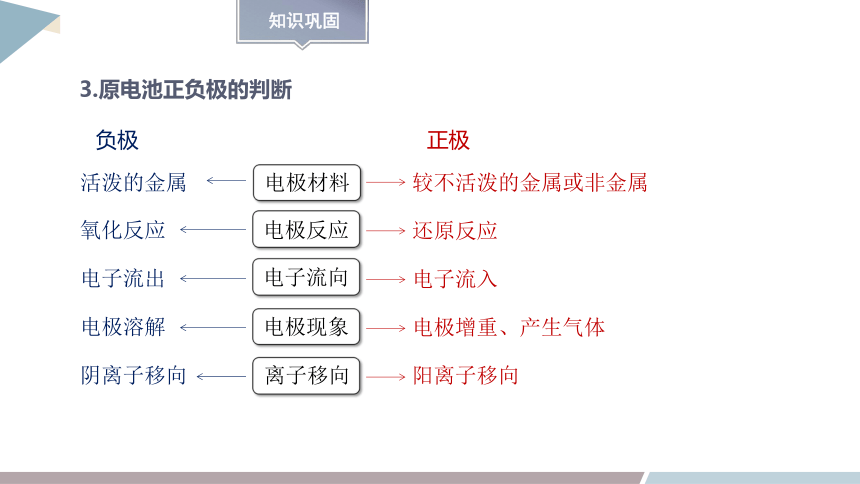
3.原电池正负极的判断
负极
正极
离子移向
电极材料
电极反应
电子流向
电极现象
活泼的金属
较不活泼的金属或非金属
阳离子移向
还原反应
电子流入
电极增重、产生气体
阴离子移向
氧化反应
电子流出
电极溶解
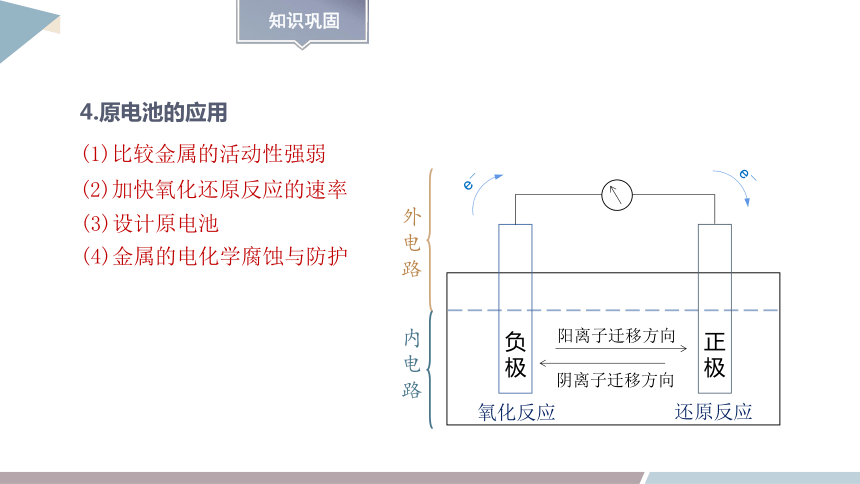
4.原电池的应用
(1)比较金属的活动性强弱
(2)加快氧化还原反应的速率
(4)金属的电化学腐蚀与防护
(3)设计原电池
e-
e-
负极
正极
氧化反应
还原反应
阳离子迁移方向
阴离子迁移方向
外电路
内电路
知识点六:化学电源
1.一次电池
放电后不可再充电的电池,也叫干电池,如碱性锌锰电池。
2.二次电池
放电后可以再充电而反复使用的电池,又称可充电电池或蓄电池。
化学能
电能
放电
充电
3.燃料电池
一种连续将燃料和氧化剂的化学能直接转换成电能的化学电池。
[燃料电池的规律]
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
知识点七:电解池
1.电解池:
2.电解池构成
直流电源
两个电极
电解质溶液或熔融电解质
形成闭合回路
3.电解:
使电流通过熔融电解质或电解质溶液,在阳极、阴极上分别发生氧化反应和还原反应的过程。
将电能转化为化学能的装置。
4.电解原理:
直流电源
-
+
e-
e-
阳极
阴极
氧化反应
还原反应
阳离子迁移方向
阴离子迁移方向
5.离子放电顺序:
(1)阴极放电顺序(阳离子得电子能力)
Ag+>Hg2+> Fe3+> Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+ >H+(水)>Al3+>Mg2+>Na+ >Ca2+>K+
活性金属电极
>S2->I->Br->Cl->OH->非还原性含氧酸根>F-
(2)阳极放电顺序
(阴离子失电子能力)
6.电解池电极反应式的书写
看电极→找离子→分阴阳→排顺序→写反应
7.电解类型
(用惰性电极电解某电解质的水溶液)
电解质组成特点 实例 电解质浓度变化 pH 复原需加入
分解电解质型
电解水型
放氢生碱型
放氧生酸型
无氧酸(除HF)
不活泼金属无氧酸盐
HCl
CuCl2
可溶性强碱
活泼金属含氧酸盐
NaOH
H2SO4
含氧酸
Na2SO4
活泼金属无氧酸盐
NaCl
不活泼金属含氧酸盐
CuSO4
增大
增大
增大
不变
—
减小
减小
水
水
水
氯化氢
氯化铜
氯化氢
氧化铜
减小
减小
增大
增大
增大
增大
减小
知识点八:电解原理的应用
1.电解饱和食盐水——氯碱工业
阳极:2Cl--2e-===Cl2↑
阴极:2H++2e-===H2↑
总反应:2NaCl+2H2O===Cl2↑+H2↑+2NaOH
电解
2Cl-+2H2O===Cl2↑+H2↑+2OH-
电解
阳极
阴极
OH-
Na+
H+
Cl-
e-
e-
e-
石墨
石墨
饱和食盐水
氯气、氢气和烧碱
2.电镀
(1)电镀池的构成:
阴极:待镀金属——镀件
阳极:镀层金属(如Cr、Ni、Ag和合金)
电解质溶液:含有镀层金属阳离子的电解质溶液——电镀液
(2)特点:
一多:阴极上有镀层金属沉积
一少:阳极上镀层金属溶解
一不变:电解质溶液浓度不变
3.电解精炼铜
4.电冶金
Mn++ne-===M。
NaCl— Na MgCl2—Mg Al2O3—Al
阴极:
Cu2++2e-==Cu
阳极:
Zn-2e-===Zn2+、
Fe-2e-===Fe2+、
Ni-2e-===Ni2+、
Cu-2e-===Cu2+等
知识点九:金属的腐蚀
1.本质
金属原子失去电子被氧化的过程。
2.分类 化学腐蚀 电化学腐蚀
条件
电流
现象
本质
影响因素
联系
金属或合金与氧化剂直接接触
不纯金属或合金与电解质溶液接触
无电流产生
有微弱电流产生
金属被腐蚀
较活泼金属被腐蚀
M ne =Mn+
M ne =Mn+
与氧化剂的氧化性及温度等有关
与电解质溶液的酸碱性及金属活动性等有关
两者往往同时发生,但电化学腐蚀更普遍。
类型 析氢腐蚀 吸氧腐蚀
条件
电极反应 负极
正极
总反应式
联系 更普遍
水膜酸性较强
水膜酸性很弱或呈中性
Fe-2e-===Fe2+
吸氧腐蚀
2H++2e-===H2↑
O2+2H2O+4e-===4OH-
Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
3.电化学腐蚀
知识点十:金属的防护
1.在金属表面覆盖保护层
2.电化学防护
(1)牺牲阳极保护法
原电池原理
正极:被保护金属
(2)外加电流阴极保护法
电解池原理
阴极:被保护金属
(3)阳极保护法
使电压维持在可使金属发生钝化作用的范围内
作阳极钝化
电化学腐蚀原理的应用
①快速测定空气中氧气的含量
②食品包装中的双吸剂
③一次性保暖贴
④微电解技术处理工业废水
【考点一】比较焓变大小
【例1】在同温同压下,下列各组热化学方程式中ΔH1>ΔH2的是( )
C
比较焓变大小的四种方法
(1)根据反应物或生成物的状态(同温、同压)比较焓变。
(2)根据反应物的物质的量比较焓变。
物质的量越多,对放热反应,放热越多,ΔH越小;对吸热反应,吸热越多,ΔH越大。
(3)根据ΔH的符号比较。
(4)可利用盖斯定律来判定,如由盖斯定律可得出ΔH1-ΔH2=ΔH3,若已知ΔH3>0,可求出ΔH1>ΔH2。
【考点二】焓变(ΔH)的计算
【例1】根据下图中的能量关系,可求得C—H键的键能为( )
A.414 kJ·mol-1
B.377 kJ·mol-1
C.235 kJ· mol-1
D.197 kJ·mol-1
A
1.SiHCl3在催化剂作用下发生反应:
2SiHCl3(g) === SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·mol-1
3SiH2Cl2(g) === SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g) === SiH4(g)+3SiCl4(g)的ΔH为 kJ·mol-1。
2.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
反应Ⅰ:2H2SO4(l)2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式: 。
【练一练】
+114
3SO2(g)+2H2O(g) === 2H2SO4(l)+S(s) ΔH=-254 kJ·mol-1
【考点三】燃料电池
【例1】以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是( )
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e- === 6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气理论上能生成标准状况下CO2气体 L
B
解答燃料电池题目的思维模型
解答燃料电池题目的几个关键点:
(1)明确离子导体是电解质溶液还是熔融盐或氧化物。
(2)通入负极的物质为燃料,通入正极的物质一般为氧气。
(3)通过离子导体中离子的移动方向,可判断电池的正、负极,
同时考虑该离子参与移向一极的电极反应。
1.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图。下列说法正确的是( )
A.a为CH4,b为CO2
B. 向正极移动
C.此电池在常温下也能工作
D.正极的电极反应为O2+2CO2+4e-===2
D
【练一练】
【考点三】有关电解的计算
【例1】以石墨电极电解200 mL CuSO4溶液,电解过程中转移电子的物质的量[n(e-)]与产生气体总体积[V(标准状况下)]的关系如图所示。下列说法中正确的是( )
A.电解前CuSO4溶液的物质的量浓度为2 mol·L-1
B.忽略溶液体积变化,Cu2+恰好完全放电时所得溶液中c(H+)=2 mol·L-1
C.当n(e-)=0.6 mol时,V(H2)∶V(O2)=3∶2
D.当n(e-)=0.8 mol时,向电解后的溶液中加入16 g CuO,则溶液可恢复到电解前的浓度
B
电解过程中的一般计算方法
(1)根据电子守恒:用于串联电路中各电极产物的计算,其依据是电路上转移的电子数相等。
(2)根据总反应。先写电极反应,再写出电解总反应,最后根据电解总反应计算。
(3)根据关系式。根据电子得失相等找到已知量与未知量之间的关系,从而推出计算所需的关系式。
1.将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一段时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑溶液体积的变化),此时溶液中氢离子的浓度约为( )
A.4×10-3 mol·L-1 B.2×10-3 mol·L-1
C.1×10-3 mol·L-1 D.1×10-7 mol·L-1
【练一练】
A
【考点三】电化学中的串联电路
【例1】某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,下列说法正确的是( )
A.电流方向:电极Ⅳ→ →电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e- === Cu
A
串联类电池的解题流程
有外接电源
无外接电源
能自发发生氧化还原反应的装置
不能自发发生氧化还原反应的装置
原电池
原电池
电解池
正极、负极
阳极、阴极
进行计算
判断电
池类型
确定电
极名称
书写电
极反应
解答实
际问题
依据“串联”电池各极
转移电子数相等
电解池
电解池
1.如图X是直流电源。Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒。
接通电路后,发现d附近显红色。
(1)①电源上b为 (填“正”“负”“阴”或“阳”,下同)极。
②Z槽中e极为 极。
③连接Y、Z槽线路中,电子流动的方向是d e(填“→”或“←”)。
(2)①写出c极上反应的电极反应: 。
②写出Y槽中总反应的化学方程式: 。
③写出Z槽中e极上的电极反应: 。
【练一练】
负
阳
←
2Cl--2e-===Cl2↑
Cu-2e-===Cu2+
2NaCl+2H2O===2NaOH+H2↑+Cl2↑
通电
【考点三】电化学中的“膜”化学
【例1】用一种阴、阳离子双隔膜三室电解槽处理废水中的 ,模拟装置
如图所示。下列说法正确的是( )
A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应为4OH--4e- === 2H2O+O2↑
C.电解一段时间后,阴极室溶液的酸性减弱
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
C
1.用电解法可提纯含有某种钾的含氧酸盐杂质(如硫酸钾、碳酸钾等)的粗KOH溶液,其工作原理如图所示。下列说法正确的是( )
A.电极N为阳极,电极M上H+发生还原反应
B.电极M的电极反应为4OH--4e- === 2H2O+O2↑
C.d处流进粗KOH溶液,e处流出纯KOH溶液
D.b处每产生11.2 L气体,必有1 mol K+穿过阳离子交换膜
B
【练一练】
化学反应与能量转化
化学反应的热效应
反应热
焓变
热化学方程式
电池
电解
金属的腐蚀与防护
电极反应的书写
原电池的设计
原电池原理
原电池原理的应用
电解原理
电解原理的应用
离子的放电顺序
金属的腐蚀
金属防护
化学腐蚀
电化学腐蚀
析氢腐蚀
吸氧腐蚀
改变金属内部组织结构
表面覆盖保护
牺牲阳极保护法
外加电流阴极保护法
章末复习
第1章 物质的性质与转化
1.能进行反应焓变的简单计算,正确书写热化学方程式;
2.能分析、解释原电池和电解池的工作原理,设计简单的原电池和电解池;
3.能利用电化学原理解释金属腐蚀现象,选择并设计防腐措施;
4.能综合化学变化中的物质变化和能量变化来分析、解决实际问题。
知识点一:反应热 焓变
1.反应热
2.焓变
符号:
单位:
规定:
在等温条件下,化学反应体系向环境释放或从环境吸收的热量
生成物与反应物的焓值差,等压条件下的反应热也可称为“焓变”。
H
kJ/mol
当 H<0时,为放热反应;当 H>0时,为吸热反应
1.微观上
(1)化学反应的本质
(2)化学键变化与反应热的关系
若Q1>Q2,反应吸收能量,ΔH__0,为_____反应;
若Q1
吸热
<
放热
知识点二:化学反应中能量变化的原因
2.宏观上
(1)图示
(2)结论
反应物的总能量大于生成物的总能量为_____反应,体系能量_____;
反应物的总能量小于生成物的总能量为_____反应,体系能量_____。
放热
降低
吸热
升高
知识点三:热化学方程式的书写
1.定义:
表明反应所释放或吸收的热量的化学方程式。
表明了化学反应中的物质变化和能量变化。
2.含义:
3.书写热化学方程式步骤:
写出配平的化学方程式
用s、l、g、aq标明物质的聚集状态状态
根据吸热或者放热判断ΔH的正负
根据化学计量数计算写出ΔH的值
不管化学反应是一步完成或是分几步完成,其反应热是相同的。
化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
知识点四:盖斯定律
1.内容:
A
B
C
ΔH
ΔH1
ΔH2
ΔH = ΔH1 + ΔH2
知识点五:原电池
1.原电池的形成条件
(1)有能自发进行的氧化还原反应。
(2)有两种活动性不同的能导电的电极。
(3)两极相连形成闭合回路。
2.原电池的工作原理(铜锌原电池)
CuSO4溶液
Zn
Cu
ZnSO4溶液
e-
锌片:Zn-2e-===Zn2+
铜片:Cu2++2e-===Cu
总反应:
Cu2++Zn===Cu+Zn2+
(还原反应)
(氧化反应)
3.原电池正负极的判断
负极
正极
离子移向
电极材料
电极反应
电子流向
电极现象
活泼的金属
较不活泼的金属或非金属
阳离子移向
还原反应
电子流入
电极增重、产生气体
阴离子移向
氧化反应
电子流出
电极溶解
4.原电池的应用
(1)比较金属的活动性强弱
(2)加快氧化还原反应的速率
(4)金属的电化学腐蚀与防护
(3)设计原电池
e-
e-
负极
正极
氧化反应
还原反应
阳离子迁移方向
阴离子迁移方向
外电路
内电路
知识点六:化学电源
1.一次电池
放电后不可再充电的电池,也叫干电池,如碱性锌锰电池。
2.二次电池
放电后可以再充电而反复使用的电池,又称可充电电池或蓄电池。
化学能
电能
放电
充电
3.燃料电池
一种连续将燃料和氧化剂的化学能直接转换成电能的化学电池。
[燃料电池的规律]
①燃料做负极,助燃剂氧气为正极
②电极材料一般不参加化学反应,只起传导电子的作用。
知识点七:电解池
1.电解池:
2.电解池构成
直流电源
两个电极
电解质溶液或熔融电解质
形成闭合回路
3.电解:
使电流通过熔融电解质或电解质溶液,在阳极、阴极上分别发生氧化反应和还原反应的过程。
将电能转化为化学能的装置。
4.电解原理:
直流电源
-
+
e-
e-
阳极
阴极
氧化反应
还原反应
阳离子迁移方向
阴离子迁移方向
5.离子放电顺序:
(1)阴极放电顺序(阳离子得电子能力)
Ag+>Hg2+> Fe3+> Cu2+>H+(酸)>Pb2+>Sn2+>Fe2+>Zn2+ >H+(水)>Al3+>Mg2+>Na+ >Ca2+>K+
活性金属电极
>S2->I->Br->Cl->OH->非还原性含氧酸根>F-
(2)阳极放电顺序
(阴离子失电子能力)
6.电解池电极反应式的书写
看电极→找离子→分阴阳→排顺序→写反应
7.电解类型
(用惰性电极电解某电解质的水溶液)
电解质组成特点 实例 电解质浓度变化 pH 复原需加入
分解电解质型
电解水型
放氢生碱型
放氧生酸型
无氧酸(除HF)
不活泼金属无氧酸盐
HCl
CuCl2
可溶性强碱
活泼金属含氧酸盐
NaOH
H2SO4
含氧酸
Na2SO4
活泼金属无氧酸盐
NaCl
不活泼金属含氧酸盐
CuSO4
增大
增大
增大
不变
—
减小
减小
水
水
水
氯化氢
氯化铜
氯化氢
氧化铜
减小
减小
增大
增大
增大
增大
减小
知识点八:电解原理的应用
1.电解饱和食盐水——氯碱工业
阳极:2Cl--2e-===Cl2↑
阴极:2H++2e-===H2↑
总反应:2NaCl+2H2O===Cl2↑+H2↑+2NaOH
电解
2Cl-+2H2O===Cl2↑+H2↑+2OH-
电解
阳极
阴极
OH-
Na+
H+
Cl-
e-
e-
e-
石墨
石墨
饱和食盐水
氯气、氢气和烧碱
2.电镀
(1)电镀池的构成:
阴极:待镀金属——镀件
阳极:镀层金属(如Cr、Ni、Ag和合金)
电解质溶液:含有镀层金属阳离子的电解质溶液——电镀液
(2)特点:
一多:阴极上有镀层金属沉积
一少:阳极上镀层金属溶解
一不变:电解质溶液浓度不变
3.电解精炼铜
4.电冶金
Mn++ne-===M。
NaCl— Na MgCl2—Mg Al2O3—Al
阴极:
Cu2++2e-==Cu
阳极:
Zn-2e-===Zn2+、
Fe-2e-===Fe2+、
Ni-2e-===Ni2+、
Cu-2e-===Cu2+等
知识点九:金属的腐蚀
1.本质
金属原子失去电子被氧化的过程。
2.分类 化学腐蚀 电化学腐蚀
条件
电流
现象
本质
影响因素
联系
金属或合金与氧化剂直接接触
不纯金属或合金与电解质溶液接触
无电流产生
有微弱电流产生
金属被腐蚀
较活泼金属被腐蚀
M ne =Mn+
M ne =Mn+
与氧化剂的氧化性及温度等有关
与电解质溶液的酸碱性及金属活动性等有关
两者往往同时发生,但电化学腐蚀更普遍。
类型 析氢腐蚀 吸氧腐蚀
条件
电极反应 负极
正极
总反应式
联系 更普遍
水膜酸性较强
水膜酸性很弱或呈中性
Fe-2e-===Fe2+
吸氧腐蚀
2H++2e-===H2↑
O2+2H2O+4e-===4OH-
Fe+2H+===Fe2++H2↑
2Fe+O2+2H2O===2Fe(OH)2
3.电化学腐蚀
知识点十:金属的防护
1.在金属表面覆盖保护层
2.电化学防护
(1)牺牲阳极保护法
原电池原理
正极:被保护金属
(2)外加电流阴极保护法
电解池原理
阴极:被保护金属
(3)阳极保护法
使电压维持在可使金属发生钝化作用的范围内
作阳极钝化
电化学腐蚀原理的应用
①快速测定空气中氧气的含量
②食品包装中的双吸剂
③一次性保暖贴
④微电解技术处理工业废水
【考点一】比较焓变大小
【例1】在同温同压下,下列各组热化学方程式中ΔH1>ΔH2的是( )
C
比较焓变大小的四种方法
(1)根据反应物或生成物的状态(同温、同压)比较焓变。
(2)根据反应物的物质的量比较焓变。
物质的量越多,对放热反应,放热越多,ΔH越小;对吸热反应,吸热越多,ΔH越大。
(3)根据ΔH的符号比较。
(4)可利用盖斯定律来判定,如由盖斯定律可得出ΔH1-ΔH2=ΔH3,若已知ΔH3>0,可求出ΔH1>ΔH2。
【考点二】焓变(ΔH)的计算
【例1】根据下图中的能量关系,可求得C—H键的键能为( )
A.414 kJ·mol-1
B.377 kJ·mol-1
C.235 kJ· mol-1
D.197 kJ·mol-1
A
1.SiHCl3在催化剂作用下发生反应:
2SiHCl3(g) === SiH2Cl2(g)+SiCl4(g) ΔH1=+48 kJ·mol-1
3SiH2Cl2(g) === SiH4(g)+2SiHCl3(g) ΔH2=-30 kJ·mol-1
则反应4SiHCl3(g) === SiH4(g)+3SiCl4(g)的ΔH为 kJ·mol-1。
2.近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:
反应Ⅰ:2H2SO4(l)2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式: 。
【练一练】
+114
3SO2(g)+2H2O(g) === 2H2SO4(l)+S(s) ΔH=-254 kJ·mol-1
【考点三】燃料电池
【例1】以葡萄糖为燃料的微生物燃料电池结构示意图如图所示。关于该电池的叙述正确的是( )
A.该电池能够在高温下工作
B.电池的负极反应为:C6H12O6+6H2O-24e- === 6CO2↑+24H+
C.放电过程中,H+从正极区向负极区迁移
D.在电池反应中,每消耗1 mol氧气理论上能生成标准状况下CO2气体 L
B
解答燃料电池题目的思维模型
解答燃料电池题目的几个关键点:
(1)明确离子导体是电解质溶液还是熔融盐或氧化物。
(2)通入负极的物质为燃料,通入正极的物质一般为氧气。
(3)通过离子导体中离子的移动方向,可判断电池的正、负极,
同时考虑该离子参与移向一极的电极反应。
1.某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图。下列说法正确的是( )
A.a为CH4,b为CO2
B. 向正极移动
C.此电池在常温下也能工作
D.正极的电极反应为O2+2CO2+4e-===2
D
【练一练】
【考点三】有关电解的计算
【例1】以石墨电极电解200 mL CuSO4溶液,电解过程中转移电子的物质的量[n(e-)]与产生气体总体积[V(标准状况下)]的关系如图所示。下列说法中正确的是( )
A.电解前CuSO4溶液的物质的量浓度为2 mol·L-1
B.忽略溶液体积变化,Cu2+恰好完全放电时所得溶液中c(H+)=2 mol·L-1
C.当n(e-)=0.6 mol时,V(H2)∶V(O2)=3∶2
D.当n(e-)=0.8 mol时,向电解后的溶液中加入16 g CuO,则溶液可恢复到电解前的浓度
B
电解过程中的一般计算方法
(1)根据电子守恒:用于串联电路中各电极产物的计算,其依据是电路上转移的电子数相等。
(2)根据总反应。先写电极反应,再写出电解总反应,最后根据电解总反应计算。
(3)根据关系式。根据电子得失相等找到已知量与未知量之间的关系,从而推出计算所需的关系式。
1.将两个铂电极插入500 mL CuSO4溶液中进行电解,通电一段时间后,某一电极增重0.064 g(设电解时该电极无氢气析出,且不考虑溶液体积的变化),此时溶液中氢离子的浓度约为( )
A.4×10-3 mol·L-1 B.2×10-3 mol·L-1
C.1×10-3 mol·L-1 D.1×10-7 mol·L-1
【练一练】
A
【考点三】电化学中的串联电路
【例1】某同学组装了如图所示的电化学装置,电极Ⅰ为Al,其他电极均为Cu,下列说法正确的是( )
A.电流方向:电极Ⅳ→ →电极Ⅰ
B.电极Ⅰ发生还原反应
C.电极Ⅱ逐渐溶解
D.电极Ⅲ的电极反应:Cu2++2e- === Cu
A
串联类电池的解题流程
有外接电源
无外接电源
能自发发生氧化还原反应的装置
不能自发发生氧化还原反应的装置
原电池
原电池
电解池
正极、负极
阳极、阴极
进行计算
判断电
池类型
确定电
极名称
书写电
极反应
解答实
际问题
依据“串联”电池各极
转移电子数相等
电解池
电解池
1.如图X是直流电源。Y槽中c、d为石墨棒,Z槽中e、f是质量相同的铜棒。
接通电路后,发现d附近显红色。
(1)①电源上b为 (填“正”“负”“阴”或“阳”,下同)极。
②Z槽中e极为 极。
③连接Y、Z槽线路中,电子流动的方向是d e(填“→”或“←”)。
(2)①写出c极上反应的电极反应: 。
②写出Y槽中总反应的化学方程式: 。
③写出Z槽中e极上的电极反应: 。
【练一练】
负
阳
←
2Cl--2e-===Cl2↑
Cu-2e-===Cu2+
2NaCl+2H2O===2NaOH+H2↑+Cl2↑
通电
【考点三】电化学中的“膜”化学
【例1】用一种阴、阳离子双隔膜三室电解槽处理废水中的 ,模拟装置
如图所示。下列说法正确的是( )
A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应为4OH--4e- === 2H2O+O2↑
C.电解一段时间后,阴极室溶液的酸性减弱
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
C
1.用电解法可提纯含有某种钾的含氧酸盐杂质(如硫酸钾、碳酸钾等)的粗KOH溶液,其工作原理如图所示。下列说法正确的是( )
A.电极N为阳极,电极M上H+发生还原反应
B.电极M的电极反应为4OH--4e- === 2H2O+O2↑
C.d处流进粗KOH溶液,e处流出纯KOH溶液
D.b处每产生11.2 L气体,必有1 mol K+穿过阳离子交换膜
B
【练一练】
化学反应与能量转化
化学反应的热效应
反应热
焓变
热化学方程式
电池
电解
金属的腐蚀与防护
电极反应的书写
原电池的设计
原电池原理
原电池原理的应用
电解原理
电解原理的应用
离子的放电顺序
金属的腐蚀
金属防护
化学腐蚀
电化学腐蚀
析氢腐蚀
吸氧腐蚀
改变金属内部组织结构
表面覆盖保护
牺牲阳极保护法
外加电流阴极保护法
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
