第二章《化学反应的方向、限度与速率》(含解析)测试题2023-2024学年上学期高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第二章《化学反应的方向、限度与速率》(含解析)测试题2023-2024学年上学期高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 19:11:27 | ||
图片预览




文档简介
第二章《化学反应的方向、限度与速率》测试题
一、单选题(共12题)
1.表示阿伏加德罗常数的值。下列说法正确的是
A.18g重水()中含有的中子数为
B.常温下,5.6g铁与硝酸反应,铁失去的电子数为
C.和于密闭容器中充分反应生成的分子总数小于
D.标准状况下,5.6L CO和混合气体中分子数目与碳原子数目均为
2.两个均充有H2S的刚性密闭容器,起始压强均为pkPa,以温度、Al2O3催化剂为条件变量,进行实验:2H2S(g)2H2(g)+S2(g),反应相同时间,结果如图所示。下列说法错误的是
A.温度升高,H2S分解的正,逆反应速率均增大
B.900℃,ts后达平衡,H2的平均生成速率为pkPa s 1
C.Al2O3催化剂使得正反应的活化能小于逆反应的活化能
D.1100℃,曲线II、III重合,说明Al2O3催化剂失去活性
3.工业上可通过甲醇羰基化法制取甲酸甲酯():,在容积固定的密闭容器中,投入等物质的量和CO,测得相同时间内CO的转化率随温度变化曲线如图所示。下列说法不正确的是
A.增大甲醇蒸气的浓度,CO的转化率增大
B.平衡常数K(75℃)>K(85℃)
C.b点反应速率
D.生产时反应温度控制在80~85℃为宜
4.在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
(已知N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ·mol-1)
容器 甲 乙 丙
反应物投入量 1mol N2、3mol H2 2mol N2、6mol H2 2mol NH3
NH3的浓度( mol·L-1) c1 c2 c3
反应的能量变化 放出Q1kJ 放出Q2kJ 吸收Q3kJ
体系压强(Pa) p1 p2 p3
反应物转化率 α1 α2 α3
A.2p1=2p3<p2
B.α2+α3<1
C.达到平衡时乙容器中NH3的体积分数最大
D.Q3+Q1>92.4
5.以下实验设计合理的有几项
①探究“浓度对反应速率的影响”:取两支试管,各加入4mL酸性溶液,然后向一支试管中加入2mL 0.01mol/L草酸溶液,记录溶液褪色所需的时间;向另一支试管中加入2mL 0.02mol/L草酸溶液,记录溶液褪色所需的时间
②探究“浓度对反应速率的影响”:取两支试管,向一支试管中加入4mL 0.01mol/L酸性溶液,向另一支试管中加入4mL 0.02mol/L酸性溶液,向两支试管中均加入2mL 0.2mol/L草酸溶液,分别记录溶液褪色所需时间
③探究“压强对化学平衡的影响”:一定条件下,分别在容积为1L和容积为2L的两个密闭容器中分别加入等量的氢气和碘蒸气,发生如下反应:,观察两容器的颜色变化
④探究“温度对反应速率的影响”:取两支试管各加入5mL 0.1mol/L溶液;另取两支试管各加入5mL 0.1mol/L溶液;将四支试管分成两组(各有一支盛有溶液和溶液的试管),分别混合搅拌,一组放入冷水中,另一组放入热水中,经过一段时间后,记录出现浑浊的时间
⑤探究“催化剂对反应速率的影响”:在两支试管中各加入4mL 0.01mol/L酸性溶液和2mL 0.1mol/L草酸溶液;再向其中一支试管中加入一粒黄豆大的固体,摇匀,记录溶液褪色所需时间
⑥探究“催化剂对反应速率的影响”:分别向两份相同的溶液中滴入5滴等浓度的溶液和溶液,后者产生气泡速率更快,比的催化效果好
⑦探究“与反应的限度”:取5mL溶液于试管中,加入1mL溶液,充分反应后滴入5滴15%溶液,若溶液变血红色,则与的反应有一定限度
A.2 B.3 C.4 D.5
6.NO和CO是环境污染性气体,某条件下,可在CeO2+(s)表面转化为无害气体,其反应为NO(g)+CO(g)=CO2(g)+N2(g) △H,该反应过程中的物质变化和能量变化如图所示。下列说法正确的是
A.△H=△H1+△H2 B.加入CeO2+(s)可使反应的焓变减小
C.反应速率由反应I决定 D.反应I的△S>0
7.下列有关说法或解释不正确的是( )
编号 说法 解释
① 锌与稀硫酸反应,加入硫酸钠固体,速率加快 增大了浓度,反应速率加快
② 锌与稀硫酸反应,滴入大量硫酸铜溶液,生成氢气的速率加快 锌置换出铜形成原电池,致使生成氢气的速率变快
③ 5%的H2O2溶液中加入二氧化锰粉末,H2O2分解速率迅速加快 降低了反应的焓变,活化分子数增多,有效碰撞次数增多,速率加快
④ 面粉生产车间容易发生爆炸 固体表面积大,反应速率加快
A.仅①④ B.仅②③ C.仅①②③ D.仅①②④
8.在密闭容器中进行反应:X2(g)+3Y2(g) 2Z(g),其中 X2、Y2、Z 的起始浓度分别为0.1 mol·L-1、0.4 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.c(Z)=0.4 mol·L-1
B.c(Y2)=0.1 mol·L-1
C.c(X2)=0.15mol·L-1 且 c(Z)=0.25mol·L-1
D.c(X2)=0.05 mol·L-1 且 c(Z)=0.3 mol·L-1
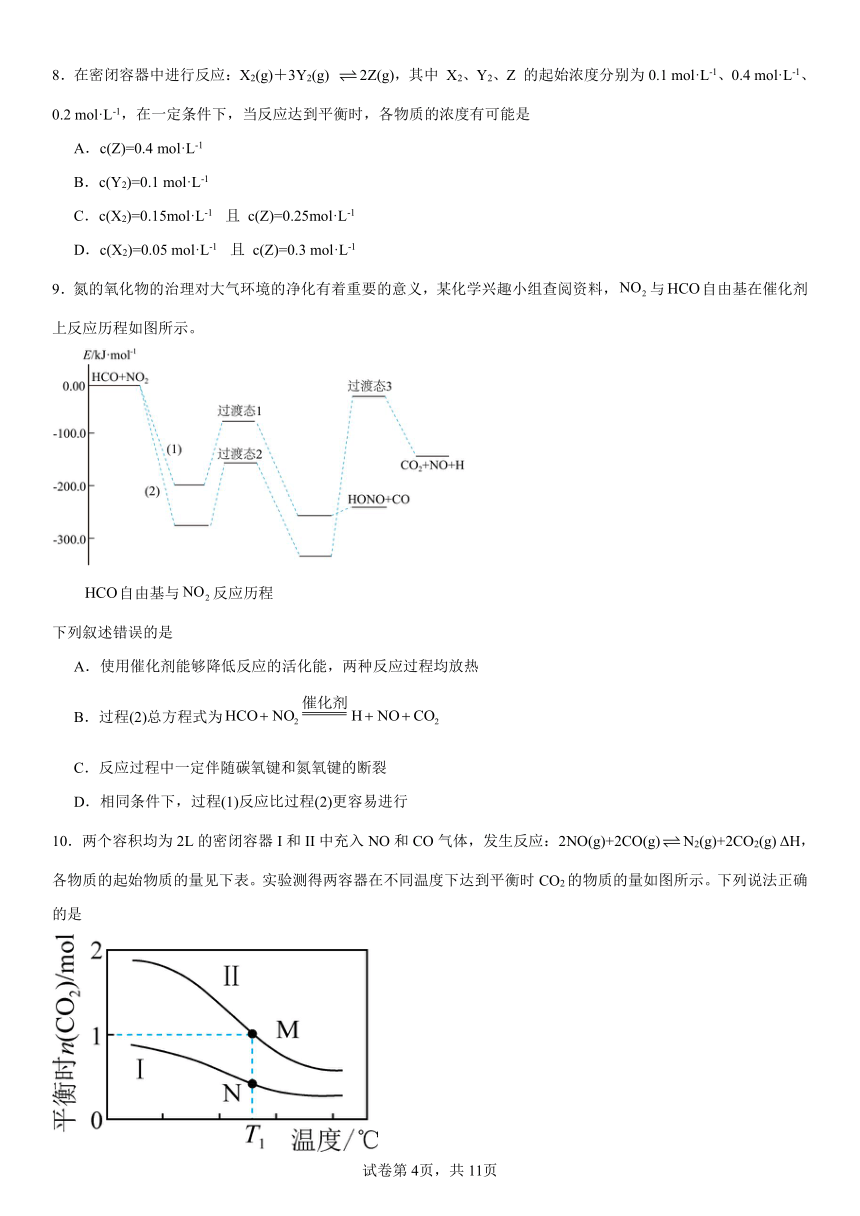
9.氮的氧化物的治理对大气环境的净化有着重要的意义,某化学兴趣小组查阅资料,与自由基在催化剂上反应历程如图所示。
自由基与反应历程
下列叙述错误的是
A.使用催化剂能够降低反应的活化能,两种反应过程均放热
B.过程(2)总方程式为
C.反应过程中一定伴随碳氧键和氮氧键的断裂
D.相同条件下,过程(1)反应比过程(2)更容易进行
10.两个容积均为2L的密闭容器I和II中充入NO和CO气体,发生反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH,各物质的起始物质的量见下表。实验测得两容器在不同温度下达到平衡时CO2的物质的量如图所示。下列说法正确的是
容器 起始物质的量
NO CO
I 1mol 3mol
II 6mol 2mol
A.ΔH>0
B.N点的平衡常数为0.08
C.若将容器I的容积改为1L,T1温度下达到平衡时NO的转化率为25%
D.图中M点所示条件下,再通入CO、N2各2mol,此时v(正)>v(逆)
11.在容积一定的密闭容器中,充入一定量的NO和足量碳发生化学反应C(s)+2NO(g) CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示, 则下列说法正确的是
A.增加碳的量,平衡正向移动
B.在T2时,若反应处于状态D,则此时v正>v逆
C.若状态B、C、D的压强分别为pB、pC、pD,则有pC=pD>pB
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
12.如图是催化硅氢化反应(Si-H与C=C的加成)的机理:
下列说法错误的是
A.硅氢化反应为CH2=CHCH2R’+HSiR3→R’(CH2)3SiR3
B.反应过程中Pt的成键数目发生变化
C.该反应过程包含四个动态配位平衡
D.6a、6b、6c是该反应的催化剂,5b是中间体
二、填空题(共9题)
13.回答下列问题:
(1)硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+O2(g)SO3(g) △H=-98kJ mol-1。当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图所示。反应在5.0MPa、550℃时的α= ,判断的依据是 。影响α的因素有 。
(2)乙烷在一定条件可发生如下反应:C2H6(g)C2H4(g)+H2(g) △H=+137kJ mol-1。提高该反应平衡转化率的方法有 、 。
14.汽车尾气是造成雾霾天气的重要原因之一。已知:
①N2(g)+O2(g)2NO(g)ΔH1
②2NO(g)+O2(g)2NO2(g)ΔH2
③CO2(g)CO(g)+O2(g)ΔH3
④2CO(g)+2NO(g)N2(g)+2CO2(g)ΔH4
请完成以下问题:
(1)根据图,该反应在 (填“高温”“低温”或“任意温度”)下有利于该反应正向自发。
(2)图表示反应④的反应物NO、CO的起始物质的量比、温度对平衡时CO2的体积分数的影响。
①W、Y、Z三点的平衡常数的大小关系为: (用W、Y、Z表示),X、Y、Z三点,CO的转化率由大到小的顺序是 (用X、Y、Z表示)。
②T1℃时,在1L密闭容器中,0.1molCO和0.1molNO,达到Y点时,测得NO的浓度为0.02mol/L,则此温度下平衡常数K= (算出数值)。若此温度下,某时刻测得CO、NO、N2、CO2的浓度分别为0.01mol/L、amol/L、0.01mol/L、0.04mol/L,要使反应向正方向进行,a的取值范围为 。
15.在一定温度下的2L的密闭容器中,加入3 mol A和1 mol B,发生如下反应:,5min达到平衡时,。
(1)0~5min内用B表示的平均反应速率为 ;达到平衡时,A的转化率为 。
(2)达到平衡时容器内气体压强与反应前容器内气体压强之比 。
(3)维持容器的温度不变,若缩小容器的体积,则平衡将向 (填“正向移动”“逆向移动”或“不移动”)。
(4)达到平衡后,若保持温度不变,将C从容器中分离出一部分,则化学平衡常数 (填“增大”、“减小”或“不变”)。
16.下图oa表示在密闭容器中反应:N2(g)+3H2(g)2NH3(g)△H<0达到平衡过程,由于条件改变引起反应速度和化学平衡发生a~d的一系列变化,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ;若增大压强时,将反应速度变化情况画在c~d处。(注意:画在图中,无图不给分)
17.与是大气主要污染物,需要经过净化处理后才能排放。
(1)汽车发动机工作时会引发和反应生成NO,其反应过程中的能量变化如表:
反应
反应热
则 (填“>”或“<”)。
(2)催化还原氨氧化物是目前应用广泛的烟气氨氧化物脱除技术,如用还原NO的反应为: 。
①实验分别测得、时NO的百分含量随时间变化关系如图所示,分析图象可得出该反应的 0(填“>”或“<”)。
②一定条件下该可逆反应达到平衡后,时刻改变某个外界条件,正反应的速率、逆反应的速率变化情况如图所示,则时刻改变的外界条件可能是 。
(3)利用电化学联合处理法可实现和NO同时除去,工作原理如图所示:
①阳极的电极反应式为 。
②若工作前后阴极室成分不变,被处理的和NO在相同条件下体积比 。
18.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示。
(1)从反应开始到10 s,用Z表示的反应速率为 ;
(2)X的物质的量浓度减少了 ,该反应的化学方程式为 ;。
(3)10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示,则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度B.t1时刻,缩小了容器体积C.t1时刻,升高了体系温度D.t1时刻,使用了催化剂
19.已知:① N2(g) + O2(g)=2NO(g) =+179.5 kJ/mol
②2NO(g) + O2(g)=2NO2(g) =-112.3 kJ/mol
③2NO(g) +2CO(g)=N2(g) +2CO2(g) =-759.8 kJ/mol
NO2(g)+CO(g)=NO(g) +CO2(g) = kJ/mol。
20.将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,
进行反应:H2O(g)+CO(g) CO 2(g)+H2(g),得到如下三组数据:
实验组 温度/℃ 起始量/mol 平衡量/mol 达到平衡所需时间/min
H2O CO CO H2
① 650 2 4 2.4 1.6 5
② 900 1 2 1.6 0.4 3
③ 900 a b c d t
①实验组①中以v(CO2)表示的反应速率为 ,此温度下的平衡常数为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、1mol CO、1 mol CO 2和 2 molH2,若要使反应在开始
时 进行。(填“正向”、“逆向”)
③若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系
为α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
21.利用测压法在刚性反应器中加入2molSO2、1molO2,研究T℃时,反应2SO2(g)+O2(g) 2SO3(g) △H<0,体系的总压强p随时间t的变化如下表所示:
反应时间/min 0 5 10 15 20 25 40
压强/kPa 20.0 19.5 18.3 16.0 16.0 16.0 22.0
(1)平衡时,SO2的转化率α= %;
(2)T℃时,反应2SO2(g)+O2(g) 2SO3(g)的平衡常数Kp= kPa-1[气体分压(p分)=气体总压(p总)×体积分数,Kp为以分压表示的平衡常数,计算结果保留1位小数]。
(3)下图分别代表焓变(△H)、混合气体平均相对分子()、SO2质量分数[ψ(SO2)]和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是___________。
A. B.
C. D.
(4)40min时,改变的条件可能是 (写2点)。
22.德国科学家BenjaminList发现了脯氨酸可以催化羟醛缩合反应,其反应历程简化如图所示。下列说法正确的是
A.有机物①能够降低反应的活化能
B.有机物③是反应的催化剂
C.反应中只涉及极性键的断裂与生成
D.如果用代替,可生成
E.有机物④有6种不同化学环境的氢原子
F.整个过程反应物的原子利用率为100%
G.增加浓度,可提高单位时间内②的转化率
23.某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体,起始时压强为100KPa,各物质物质的量随时间变化的曲线如图所示,由图中数据分析可得:
(1)该反应的化学方程式为 。
(2)若降低温度,则该反应的正反应速率 (填“加快”“减慢”或“不变”,下同),逆反应速率 。
(3)第4min时,正、逆反应速率的大小关系为v正 v逆(填“>”“<”或“=”)。
(4)0~4min内,用B的浓度变化来表示该反应的平均反应速率为 mol L-1 min-1。
(5)反应达到平衡,此时体系内压强与开始时的压强之比为 。
(6)平衡时混合气体中B的分压约为 kPa(保留3位有效数字)。(已知某物质的分压=该物质的体积分数×总压强)
(7)要提高上述反应的转化率,可采取的措施是 (任写一种)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.18g重水物质的量小于1mol,则其中含有的中子数小于10NA,A错误;
B.5.6g铁为0.1mol,硝酸的物质的量为0.3mol,则该反应中铁过量,硝酸不足,铁不能完全反应,铁失去电子数小于0.3NA,B错误;
C.氢气和氮气反应生成NH3的反应是可逆反应,故3molH2和1molN2反应生成的NH3分子总数小于2NA,C正确;
D.5.6L混合气体的物质的量为0.25mol,则其中碳原子的数目为0.25NA,分子数目为0.25NA,D错误;
故答案选C。
2.C
【详解】A.温度升高,反应速率均增大即H2S分解的正,逆反应速率均增大,故A正确;
B.900℃,ts后达平衡,硫化氢的转化率为50%,则氢气的压强为0.5pkPa,则H2的平均生成速率为,故B正确;
C.根据图中曲线分析,升高温度,硫化氢的转化率增大,因此该反应是吸热反应,则正反应的活化能大于逆反应的活化能,而加入Al2O3催化剂使正反应和逆反应活化能都降低,但正反应的活化能仍大于逆反应的活化能,故C错误;
D.催化剂需要适宜温度,在1100℃,曲线II、III重合,说明Al2O3催化剂可能几乎失去活性,故D正确。
综上所述,答案为C。
3.C
【详解】A.增大甲醇蒸气的浓度,平衡正向进行,CO的转化率增大,A正确;
B.温度超过约83℃时,随着温度的升高,CO的转化率降低,则说明该反应是放热反应;对于放热反应而言,温度越高,平衡常数K越小,故K(75℃)>K(85℃),B正确;
C.平衡之前,温度升高,反应速率增大,一氧化碳转化率增大,平衡之后,温度上高,平衡逆向移动,一氧化碳转化率减小,即b点还未平衡,反应正向进行,则此时正反应速率>逆反应速率,选项C错误;
D.根据图可知,温度在80~85℃的范围内,CO的转化率最高,超过该温度范围,随着温度的升高,CO的转化率降低,说明反应的最适温度在80~85℃之间,故生产时反应温度控制在80~85℃为宜,选项D正确;
故答案为:C。
4.C
【分析】甲投入1molN2、3molH2,丙容器投入量2molNH3,恒温恒容条件下,甲容器与丙容器是等效平衡,各组分的物质的量、含量、转化率等完全相等;而甲容器投入1molN2、3molH2,乙容器加入2molN2、6molH2,乙中加入量是甲中的二倍,如果恒温且乙容器容积是甲容器2倍,则甲容器与乙容器为等效平衡,所以乙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡,由于该反应是体积减小的反应,缩小容器体积,增大了压强,平衡向着正向移动,所以乙中氮气、氢气转化率大于甲和丙的,平衡后乙中氨气含量最大;据以上分析解答。
【详解】A.丙容器反应物投入量2molNH3,和甲起始量相同,甲和丙平衡状态相同,乙中压强为甲的二倍;由于乙中相当于增大压强,平衡向着向着正向移动,所以乙中压强减小,小于甲的2倍,即2P1=2p3>p2,故A错误;
B.丙容器中加入2molNH3,和甲最后达到相同的平衡状态,若平衡不移动,转化率α1+α3=1;乙容器反应物投入量2mol N2、6mol H2,由于乙中相当于增大压强,平衡向着向着正向移动,氨气的转化率增大,所以转化率α2+α3>1,故B错误;
C.丙容器反应物投入量2molNH3,采用极限转化法转化为反应物为1molN2、3molH2,和甲中的相同,乙容器加入2molN2、6molH2,乙中加入量是甲中的二倍,乙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡,由于该反应是体积减小的反应,缩小容器体积,增大了压强,平衡向着正向移动,所以乙中氮气、氢气转化率大于甲和丙的,平衡后乙中氨气含量最大,故C正确;
D.甲投入1molN2、3molH2,丙中投入2molNH3,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为92.4kJ,故Q1+Q3=92.4,故D错误;
故选C。
5.A
【详解】①探究“浓度对反应速率的影响”:是过量的,溶液不能褪色,不合理;
②探究“浓度对反应速率的影响”:记录溶液褪色所需时间,需要等量,草酸溶液浓度不同,不合理;
③探究“压强对化学平衡的影响”:反应前后气体体积不变,压强对其平衡无影响,不合理;
④探究“温度对反应速率的影响”:需要将试剂先放入冷水或热水中,然后再混合搅拌,记录出现浑浊的时间,不合理;
⑤探究“催化剂对反应速率的影响”:Mn2+是和草酸反应的催化剂,合理;
⑥探究“催化剂对反应速率的影响”:分别向两份相同的溶液中滴入5滴等浓度的溶液和溶液,后者产生气泡速率更快,是因为溶液和溶液发生了氧化还原反应生成了氧气,不合理;
⑦探究“与反应的限度”:取5mL溶液于试管中,加入1mL溶液,充分反应后滴入5滴15%溶液,溶液变血红色,说明在KI过量的情况下,Fe3+还有剩余,证明KI 与 FeCl3的反应有一定限度,合理;
故选A。
6.A
【详解】A.由盖斯定律可知,反应I+Ⅱ得到总反应,则△H=△H1+△H2,A正确;
B.加入CeO2+(s)改变了反应速率,但是不改变反应的焓变,B错误;
C.过渡态物质的总能量与反应物总能量的差值为活化能,即图中峰值越大则活化能越大,峰值越小则活化能越小,活化能越大反应越慢,决定总反应速率的是慢反应;由图可知,反应速率由反应Ⅱ决定,C错误;
D.反应I为气体分子数减小的反应,△S<0,D错误;
故选A。
7.C
【详解】①锌与稀硫酸反应的离子方程式为,由该离子方程式可知,该反应与钠离子和无关,所以加入硫酸钠固体,反应速率不变,故①错误;
②锌与稀硫酸反应,滴入大量硫酸铜溶液,因铜离子的氧化性大于氢离子,所以不一定有氢气生成,故②错误;
③二氧化锰是H2O2分解反应的催化剂,加入催化剂不能改变反应的焓变,但可以降低反应的活化能,故③错误;
④面粉的表面积大,增大固体的表面积,反应速率加快,所以面粉生产车间容易发生爆炸,故④正确。
综上所述,C项符合题意。
8.D
【详解】由于反应X2(g)+3Y2(g) 2Z(g)是一个可逆反应,故各物质均不可能完全转化,假设反应往正方向完全反应,故有:,假设反应往逆方向完全进行,则有:
综合得出:0故选D。
9.C
【详解】A.催化剂能够降低反应的活化能,观察图像可知,两种反应过程均放热,故A正确;
B.观察图像可知,反应物是和,产物是H、NO、,故总方程式为,故B正确;
C.从催化反应过程可以看出,CO键没有断裂,故C错误;
D.由图可知,过程(1)反应的活化能低,更容易进行,故D正确;
故选C。
10.D
【分析】T1温度下M点和N点的温度相同,化学平衡常数相等,由图可知,M点二氧化碳的物质的量为1mol,由方程式可知,平衡时一氧化氮、一氧化碳、氮气和二氧化碳的浓度分别为=2.5mol/L、=0.5mol/L、×=0.25mol/L、=0.5mol/L,则平衡常数K==0.04。
【详解】A.由图可知,温度升高,平衡时二氧化碳的物质的量减小,说明升高温度,平衡向逆反应方向移动,该反应为放热反应,反应ΔH<0,故A错误;
B.由分析可知,N点的平衡常数为0.04,故B错误;
C.化学平衡常数是温度函数,温度不变,化学平衡常数不变,设T1温度下达到平衡时NO的转化率为25%,由方程式可知,平衡时一氧化氮、一氧化碳、氮气和二氧化碳的浓度分别为=0.75mol/L、=2.75mol/L、×=0.125mol/L、=0.25mol/L,平衡常数K=≈0.0018≠0.04,故C错误;
D.若图中M点所示条件下,再通入一氧化碳和氮气各2mol,此时一氧化氮、一氧化碳、氮气和二氧化碳的浓度分别为2.5mol/L、1.5mol/L、1.25mol/L、0.5mol/L,浓度熵Qc=≈0.022<0.04,则平衡向逆反应方向移动,反应速率v(正)>v(逆),故D正确;
故选D。
11.B
【详解】A.C为固体,增加其用量对平衡无影响,A错误;
B.在T2℃时,若反应体系处于状态D,此时c(NO)高于平衡时NO浓度,故平衡正向移动,因此υ正>υ逆,B正确;
C.该反应是等体积反应,B、D温度相同,物质的量相同,因此PD=PB,C、D物质的量相等,温度C大于D点,因此压强PC>PD,C错误;
D.由图示知,升高温度,c(NO)浓度增大,说明平衡逆向移动,故平衡常数减小,因此K2<K1,D错误;
故答案选B。
12.D
【详解】A.根据机理可知,CH2=CHCH2R’和HSiR3为反应物,R’(CH2)3SiR3为生成物,因此硅氢化反应为CH2=CHCH2R’+HSiR3→R’(CH2)3SiR3,故A说法正确;
B.5b中Pt成键数目是4,6c中Pt成键数目是5,6a、6a'、6b中Pt成键数目是6,故B说法正确;
C.根据机理图可知,5b+H-SiR36a、6a’6a'、6a+CH2=CH-R6b、6b6c四个动态平衡,故C说法正确;
D.6a、6b、6c是该反应的中间体,故D说法错误;
答案为D。
13.(1) 0.975 该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa=p2,所以p1=5.0MPa 温度、压强和反应物的起始浓度(组成)
(2) 升高温度 减小压强(增大体积)
【详解】(1)5.0 MPa、550℃时,α=0.975。该反应正向为气体分子数减小的反应,温度相同时增大压强,化学平衡向正向移动,SO2的平衡转化率(α)增大,5.0MPa>2.5MPa=p2,故p1=5.0MPa。故判断依据:该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa=p2,所以p1=5.0MPa;影响α的因素:由图像可得温度升高,α减小,压强增大,α增大。另外起始充入的SO2与O2的物质的量之比影响SO2的平衡转化率,故影响因素为温度、压强和反应物的起始浓度(组成)。
(2)由于该反应为吸热反应、且为气体分子数增大的反应,因此可通过升高温度、减小压强(增大体积)等提高该反应的平衡转化率。
14. 低温 W>Y=Z Z>Y>X K=1600 a>0.01
【详解】(1)图象分析,反应是放热反应,反应的焓变ΔH=E1-E2=145kJ/mol-890kJ/mol=-745kJ/mol,热化学方程式为:2CO(g)+2NO(g)N2(g)+2CO2(g)ΔH4=-745kJ/mol;反应是放热反应,ΔH<0,ΔS<0,低温下ΔH-TΔS<0,有利于该反应正向自发,故答案为:低温;
(2)①图象分析,反应物NO、CO的起始物质的量比一定,反应是放热反应,温度越高平衡逆向进行,二氧化碳体积分数减小,平衡常数减小,T1>T2,由于Y、Z温度相同,故W、Y、Z三点的平衡常数的大小关系为:W>Y=Z;温度一定,随反应物NO、CO的起始物质的量比增大,X→Y反应正向进行,一氧化碳的转化率X<Y,Y→Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z,X、Y、Z三点,CO的转化率的从大到小的顺序Z>Y>X,故答案为:W>Y=Z;Z>Y>X;
②T1℃时,在1L密闭容器中,0.1molCO和0.1molNO,达到Y点时,测得NO的浓度为0.02mol/L,则
则此温度下平衡常数K==1600,某时刻测得CO、NO、N2、CO2的浓度分别为0.01mol/L、amol/L、0.01mol/L、0.04mol/L,要使反应向正方向进行,应满足Q<K=1600,Q=<1600,解得a>0.01,故答案为:1600;a>0.01。
15.(1) 60%
(2)7:10
(3)正向移动
(4)不变
【分析】根据三段式分析可知:,则有:即,解得x=0.6mol,据此分析解题。
(1)
0~5min内用B表示的平均反应速率为,达到平衡时,A的转化率为,故答案为:;60%;
(2)
根据阿伏加德罗定律及推论可知,同温同压下气体的压强之比等于其物质的量之比,故达到平衡时容器内气体压强与反应前容器内气体压强之比为[(3-3x)+(1-x)+2x]:(3+1)=(4-2x):4=(4-2×0.6):4=7:10,故答案为:7:10;
(3)
分析反应为一个正反应为气体体积缩小的反应,故维持容器的温度不变,若缩小容器的体积,则平衡将向正向移动,故答案为:正向移动;
(4)
化学平衡常数仅仅是温度的函数,温度不变平衡常数不变,故达到平衡后,若保持温度不变,将C从容器中分离出一部分,则化学平衡常数不变,故答案为:不变。
16.(1)升高温度(2)减小生成物浓度
(3)如图c d段
【详解】试题分析:(1)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果;
(2)b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因;
(3)增大压强,正反应速率下降,逆反应速率上升,且平衡正向移动,结果如图所示
考点:影响化学平衡移动的因素
17.(1)>
(2) > 增大压强
(3) SO2+2H2O-2e-=+4H+ 1:1
【详解】(1)断开化学键吸收能量,则ΔH2>0,故答案为:>;
(2)①由图可知,t1℃下反应先达到平衡状态,则t1>t2,t1℃时NO的百分含量小于t2℃,说明升高温度,平衡正向移动,则该反应为吸热反应,ΔH>0,故答案为:>;
②由图可知,改变的条件使反应速率加快,且平衡逆向移动,则t1时刻改变的外界条件可能是增大压强,故答案为:增大压强;
(3)①电解池中SO2在阳极失去电子生成H2SO4,电极反应式为SO2+2H2O-2e-=+4H+,故答案为:SO2+2H2O-2e-=+4H+;
②反应前后阴极室成分不变,即阳极转移电子数和NO生成N2时转移电子数相等,即SO2~~2e-~NO~N2,所以在相同条件下的体积比1:1,故答案为:1:1。
18. 0.079mol/(L·s) 0.395mol/L X(g)+Y(g) 2Z(g) BD
【详解】
(1)从反应开始到10s,Z的物质的量改变1.58mol,容器的体积为2L,则Z表示的反应速率为:=0.079mol/(L·s);
(2)根据图像可知,X的物质的量浓度减少了:=0.395mol/L;反应的物质的量之比等于化学计量数之比,则(1.2-0.41) mol:(1.00-0.21) mol:1.58mol=1:1:2,减少的为反应物,增大的为生成物,则方程式为X(g)+Y(g) 2Z(g);
(3) A.t1时刻,增大了X的浓度,X为反应物,则正反应速率增大,逆反应速率不变,A与图像不符;
B.反应为气体不变的反应,则t1时刻,缩小了容器体积,平衡不移动,正逆反应速率均增大,且增大的程度相同,B与图像符合;
C.t1时刻,升高了体系温度,正逆反应速率均增大,但增大的程度不同,C与图像不符;
D.t1时刻,使用了催化剂,正逆反应速率均增大,且增大的程度相同,D与图像符合;
答案为BD。
19.-234 20. 0.6mol/(L·min) 或2.67 减小 正向 0.4mol =
【解析】19.根据盖斯定律可知(①-②+③)÷2得到(179.5+112.3—759.8)÷2=-234 kJ/mol,则反应NO2(g)+CO(g)=NO(g) +CO2(g) =-234 kJ/mol;
20.①根据表中数据可知平衡时生成氢气的物质的量是1.6 mol,则根据方程式可知消耗CO2的物质的量是1.6 mol,其浓度是0.8 mol/L,则CO2表示的反应速率为=0.16 mol/(L·min);
所以平衡常数K==2.67;
该反应是放热反应,所以温度升高时平衡常数减小。
②650 ℃时,K=2.67,开始充入2 mol H2O(g)、1 mol CO、1 mol CO2和2 mol H2,Q=(0.5×1)÷(0.5×1)=1<2.67,则开始时反应正向进行;
③先求实验2条件下的平衡常数
则K= =0.17
若a=2,b=1,则
则K==0.17,解得x=0.2
容器的体积为2 L,则c=0.4 mol;
在这两种情况下实验组2中H2O(g)和实验组3中CO的转化率均是0.2÷0.5×100%=40%。
21.(1)60
(2)0.8
(3)BC
(4)升高温度、增加反应物或生成物的物质的量
【分析】由表格数据可知15 min时反应达到平衡,利用“三段式”:
根据压强之比等于物质的量之比:,解得x=0.6。
【详解】(1)平衡时,SO2的转化率;
(2)T℃时,反应2SO2(g)+O2(g) 2SO3(g)的平衡常数;
(3)A.化学反应伴随着能量变化,焓变不可能一直不变,故A错误;
B.因为2SO2(g)+O2(g) 2SO3(g)是气体分子数减小的反应,所以随着反应进行,混合气体平均相对分子质量逐渐增大,当混合气体平均相对分子质量不再变化,说明化学反应达到平衡状态,故B正确;
C.SO2属于反应物,随着反应进行,SO2质量分数逐渐减小,当SO2质量分数不再变化时,
说明反应达到平衡状态,故C正确;
D.因为2SO2(g)+O2(g) 2SO3(g)是气体分子数减小的反应,随着反应进行,压强逐渐减小,当压强不再改变时,反应达到平衡状态,故D错误。
故答案为:BC
(4)40min时,刚性容器中气体的压强增大。根据pV=nRT可知,升高温度可以增大体系的压强,而且升高温度可以使化学平衡向逆反应方向移动,体系的压强也增大。当然,直接增加气体的物质的量也能增大体系的压强。故改变的条件可能是升高温度,也可能是增加反应物或生成物的物质的量。
22.AG
【详解】A.有机物①最开始参与反应,到最后又被生成,故它是反应的催化剂,能够降低反应的活化能,A正确;
B.有机物③不是催化剂,是中间产物,B错误;
C.从⑤到⑥有C-C键生成,故有非极性键生成,C错误;
D.生成物的羰基应该在左起第三个碳原子上,D错误;
E.有机物④共有七个位置有H,且都属于不同的环境,即有7种环境的氢原子,E错误;
F.有水生成,故原子利用率没有达到100%,F错误;
G.氢离子是反应物,增加氢离子浓度可以提高单位时间内的化学反应速率,从而提升单位时间内的转化率,G正确;
故选AG。
23.(1)2A(g)B(g)
(2) 减慢 减慢
(3)>
(4)0.1
(5)7:10
(6)50.0
(7)增大压强
【解析】(1)
根据图示可知在前4 min内A减少0.4mol,B增加0.2mol,一定时间后A、B都存在,且物质的量不再发生变化,说明该反应是可逆反应,其中A是反应物,B是生成物,二者改变的物质的量的比是0.4mol:0.2mol=2:1,故反应方程式为:2A(g)B(g);
(2)
降低温度,活化分子百分数减小,有效碰撞几率减小,正、逆反应速率都减慢;
(3)
4 min后,A的物质的量减小,B的物质的量增加,则反应正向进行,因此正、逆反应速率的大小关系为v正>v逆;
(4)
在0~4 min B物质的量改变△n(B)=0.4 mol-0.2 mol=0.2 mol,则用B的浓度变化来表示该反应的平均反应速率为v(B)=;
(5)
该反应达到平衡时,n(A)=0.2 mol,n(B)=0.5 mol,恒温恒容下,气体的体积比等于气体的物质的量之比,故平衡时总压强和起始时总压比为(0.5+0.2)mol:(0.8+0.2)mol=7:10;
(6)
结合(5)可知7:10=p平:100kPa,因此平衡时总压p平=70kPa,平衡时B的体积分数为,则平衡时混合气体中B的分压为×70KPa=50.0kPa;
(7)
该反应为气体分子数减小的反应,要提高上述反应的转化率,可采取的措施是增大压强(合理即可)。
答案第1页,共2页
答案第1页,共2页
一、单选题(共12题)
1.表示阿伏加德罗常数的值。下列说法正确的是
A.18g重水()中含有的中子数为
B.常温下,5.6g铁与硝酸反应,铁失去的电子数为
C.和于密闭容器中充分反应生成的分子总数小于
D.标准状况下,5.6L CO和混合气体中分子数目与碳原子数目均为
2.两个均充有H2S的刚性密闭容器,起始压强均为pkPa,以温度、Al2O3催化剂为条件变量,进行实验:2H2S(g)2H2(g)+S2(g),反应相同时间,结果如图所示。下列说法错误的是
A.温度升高,H2S分解的正,逆反应速率均增大
B.900℃,ts后达平衡,H2的平均生成速率为pkPa s 1
C.Al2O3催化剂使得正反应的活化能小于逆反应的活化能
D.1100℃,曲线II、III重合,说明Al2O3催化剂失去活性
3.工业上可通过甲醇羰基化法制取甲酸甲酯():,在容积固定的密闭容器中,投入等物质的量和CO,测得相同时间内CO的转化率随温度变化曲线如图所示。下列说法不正确的是
A.增大甲醇蒸气的浓度,CO的转化率增大
B.平衡常数K(75℃)>K(85℃)
C.b点反应速率
D.生产时反应温度控制在80~85℃为宜
4.在温度相同、容积均为2L的3个恒容密闭容器中,按不同方式投入反应物,保持恒温,测得反应达到平衡时的有关数据如下,下列说法正确的是
(已知N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ·mol-1)
容器 甲 乙 丙
反应物投入量 1mol N2、3mol H2 2mol N2、6mol H2 2mol NH3
NH3的浓度( mol·L-1) c1 c2 c3
反应的能量变化 放出Q1kJ 放出Q2kJ 吸收Q3kJ
体系压强(Pa) p1 p2 p3
反应物转化率 α1 α2 α3
A.2p1=2p3<p2
B.α2+α3<1
C.达到平衡时乙容器中NH3的体积分数最大
D.Q3+Q1>92.4
5.以下实验设计合理的有几项
①探究“浓度对反应速率的影响”:取两支试管,各加入4mL酸性溶液,然后向一支试管中加入2mL 0.01mol/L草酸溶液,记录溶液褪色所需的时间;向另一支试管中加入2mL 0.02mol/L草酸溶液,记录溶液褪色所需的时间
②探究“浓度对反应速率的影响”:取两支试管,向一支试管中加入4mL 0.01mol/L酸性溶液,向另一支试管中加入4mL 0.02mol/L酸性溶液,向两支试管中均加入2mL 0.2mol/L草酸溶液,分别记录溶液褪色所需时间
③探究“压强对化学平衡的影响”:一定条件下,分别在容积为1L和容积为2L的两个密闭容器中分别加入等量的氢气和碘蒸气,发生如下反应:,观察两容器的颜色变化
④探究“温度对反应速率的影响”:取两支试管各加入5mL 0.1mol/L溶液;另取两支试管各加入5mL 0.1mol/L溶液;将四支试管分成两组(各有一支盛有溶液和溶液的试管),分别混合搅拌,一组放入冷水中,另一组放入热水中,经过一段时间后,记录出现浑浊的时间
⑤探究“催化剂对反应速率的影响”:在两支试管中各加入4mL 0.01mol/L酸性溶液和2mL 0.1mol/L草酸溶液;再向其中一支试管中加入一粒黄豆大的固体,摇匀,记录溶液褪色所需时间
⑥探究“催化剂对反应速率的影响”:分别向两份相同的溶液中滴入5滴等浓度的溶液和溶液,后者产生气泡速率更快,比的催化效果好
⑦探究“与反应的限度”:取5mL溶液于试管中,加入1mL溶液,充分反应后滴入5滴15%溶液,若溶液变血红色,则与的反应有一定限度
A.2 B.3 C.4 D.5
6.NO和CO是环境污染性气体,某条件下,可在CeO2+(s)表面转化为无害气体,其反应为NO(g)+CO(g)=CO2(g)+N2(g) △H,该反应过程中的物质变化和能量变化如图所示。下列说法正确的是
A.△H=△H1+△H2 B.加入CeO2+(s)可使反应的焓变减小
C.反应速率由反应I决定 D.反应I的△S>0
7.下列有关说法或解释不正确的是( )
编号 说法 解释
① 锌与稀硫酸反应,加入硫酸钠固体,速率加快 增大了浓度,反应速率加快
② 锌与稀硫酸反应,滴入大量硫酸铜溶液,生成氢气的速率加快 锌置换出铜形成原电池,致使生成氢气的速率变快
③ 5%的H2O2溶液中加入二氧化锰粉末,H2O2分解速率迅速加快 降低了反应的焓变,活化分子数增多,有效碰撞次数增多,速率加快
④ 面粉生产车间容易发生爆炸 固体表面积大,反应速率加快
A.仅①④ B.仅②③ C.仅①②③ D.仅①②④
8.在密闭容器中进行反应:X2(g)+3Y2(g) 2Z(g),其中 X2、Y2、Z 的起始浓度分别为0.1 mol·L-1、0.4 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.c(Z)=0.4 mol·L-1
B.c(Y2)=0.1 mol·L-1
C.c(X2)=0.15mol·L-1 且 c(Z)=0.25mol·L-1
D.c(X2)=0.05 mol·L-1 且 c(Z)=0.3 mol·L-1
9.氮的氧化物的治理对大气环境的净化有着重要的意义,某化学兴趣小组查阅资料,与自由基在催化剂上反应历程如图所示。
自由基与反应历程
下列叙述错误的是
A.使用催化剂能够降低反应的活化能,两种反应过程均放热
B.过程(2)总方程式为
C.反应过程中一定伴随碳氧键和氮氧键的断裂
D.相同条件下,过程(1)反应比过程(2)更容易进行
10.两个容积均为2L的密闭容器I和II中充入NO和CO气体,发生反应:2NO(g)+2CO(g)N2(g)+2CO2(g) ΔH,各物质的起始物质的量见下表。实验测得两容器在不同温度下达到平衡时CO2的物质的量如图所示。下列说法正确的是
容器 起始物质的量
NO CO
I 1mol 3mol
II 6mol 2mol
A.ΔH>0
B.N点的平衡常数为0.08
C.若将容器I的容积改为1L,T1温度下达到平衡时NO的转化率为25%
D.图中M点所示条件下,再通入CO、N2各2mol,此时v(正)>v(逆)
11.在容积一定的密闭容器中,充入一定量的NO和足量碳发生化学反应C(s)+2NO(g) CO2(g)+N2(g),平衡时c(NO)与温度T的关系如图所示, 则下列说法正确的是
A.增加碳的量,平衡正向移动
B.在T2时,若反应处于状态D,则此时v正>v逆
C.若状态B、C、D的压强分别为pB、pC、pD,则有pC=pD>pB
D.若T1、T2时的平衡常数分别为K1、K2,则K1<K2
12.如图是催化硅氢化反应(Si-H与C=C的加成)的机理:
下列说法错误的是
A.硅氢化反应为CH2=CHCH2R’+HSiR3→R’(CH2)3SiR3
B.反应过程中Pt的成键数目发生变化
C.该反应过程包含四个动态配位平衡
D.6a、6b、6c是该反应的催化剂,5b是中间体
二、填空题(共9题)
13.回答下列问题:
(1)硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是SO2的催化氧化:SO2(g)+O2(g)SO3(g) △H=-98kJ mol-1。当SO2(g)、O2(g)和N2(g)起始的物质的量分数分别为7.5%、10.5%和82%时,在0.5MPa、2.5MPa和5.0MPa压强下,SO2平衡转化率α随温度的变化如图所示。反应在5.0MPa、550℃时的α= ,判断的依据是 。影响α的因素有 。
(2)乙烷在一定条件可发生如下反应:C2H6(g)C2H4(g)+H2(g) △H=+137kJ mol-1。提高该反应平衡转化率的方法有 、 。
14.汽车尾气是造成雾霾天气的重要原因之一。已知:
①N2(g)+O2(g)2NO(g)ΔH1
②2NO(g)+O2(g)2NO2(g)ΔH2
③CO2(g)CO(g)+O2(g)ΔH3
④2CO(g)+2NO(g)N2(g)+2CO2(g)ΔH4
请完成以下问题:
(1)根据图,该反应在 (填“高温”“低温”或“任意温度”)下有利于该反应正向自发。
(2)图表示反应④的反应物NO、CO的起始物质的量比、温度对平衡时CO2的体积分数的影响。
①W、Y、Z三点的平衡常数的大小关系为: (用W、Y、Z表示),X、Y、Z三点,CO的转化率由大到小的顺序是 (用X、Y、Z表示)。
②T1℃时,在1L密闭容器中,0.1molCO和0.1molNO,达到Y点时,测得NO的浓度为0.02mol/L,则此温度下平衡常数K= (算出数值)。若此温度下,某时刻测得CO、NO、N2、CO2的浓度分别为0.01mol/L、amol/L、0.01mol/L、0.04mol/L,要使反应向正方向进行,a的取值范围为 。
15.在一定温度下的2L的密闭容器中,加入3 mol A和1 mol B,发生如下反应:,5min达到平衡时,。
(1)0~5min内用B表示的平均反应速率为 ;达到平衡时,A的转化率为 。
(2)达到平衡时容器内气体压强与反应前容器内气体压强之比 。
(3)维持容器的温度不变,若缩小容器的体积,则平衡将向 (填“正向移动”“逆向移动”或“不移动”)。
(4)达到平衡后,若保持温度不变,将C从容器中分离出一部分,则化学平衡常数 (填“增大”、“减小”或“不变”)。
16.下图oa表示在密闭容器中反应:N2(g)+3H2(g)2NH3(g)△H<0达到平衡过程,由于条件改变引起反应速度和化学平衡发生a~d的一系列变化,a b过程中改变的条件可能是 ;b c过程中改变的条件可能是 ;若增大压强时,将反应速度变化情况画在c~d处。(注意:画在图中,无图不给分)
17.与是大气主要污染物,需要经过净化处理后才能排放。
(1)汽车发动机工作时会引发和反应生成NO,其反应过程中的能量变化如表:
反应
反应热
则 (填“>”或“<”)。
(2)催化还原氨氧化物是目前应用广泛的烟气氨氧化物脱除技术,如用还原NO的反应为: 。
①实验分别测得、时NO的百分含量随时间变化关系如图所示,分析图象可得出该反应的 0(填“>”或“<”)。
②一定条件下该可逆反应达到平衡后,时刻改变某个外界条件,正反应的速率、逆反应的速率变化情况如图所示,则时刻改变的外界条件可能是 。
(3)利用电化学联合处理法可实现和NO同时除去,工作原理如图所示:
①阳极的电极反应式为 。
②若工作前后阴极室成分不变,被处理的和NO在相同条件下体积比 。
18.一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的量随时间变化的曲线如图所示。
(1)从反应开始到10 s,用Z表示的反应速率为 ;
(2)X的物质的量浓度减少了 ,该反应的化学方程式为 ;。
(3)10s后的某一时刻(t1)改变了外界条件,其速率随时间的变化图像如图所示,则下列说法符合该图像的是 。
A.t1时刻,增大了X的浓度B.t1时刻,缩小了容器体积C.t1时刻,升高了体系温度D.t1时刻,使用了催化剂
19.已知:① N2(g) + O2(g)=2NO(g) =+179.5 kJ/mol
②2NO(g) + O2(g)=2NO2(g) =-112.3 kJ/mol
③2NO(g) +2CO(g)=N2(g) +2CO2(g) =-759.8 kJ/mol
NO2(g)+CO(g)=NO(g) +CO2(g) = kJ/mol。
20.将不同物质的量的H2O(g)和CO(g)分别通入体积为2L的恒容密闭容器中,
进行反应:H2O(g)+CO(g) CO 2(g)+H2(g),得到如下三组数据:
实验组 温度/℃ 起始量/mol 平衡量/mol 达到平衡所需时间/min
H2O CO CO H2
① 650 2 4 2.4 1.6 5
② 900 1 2 1.6 0.4 3
③ 900 a b c d t
①实验组①中以v(CO2)表示的反应速率为 ,此温度下的平衡常数为 ,温度升高时平衡常数会 (填“增大”、“减小”或“不变”)。
②650℃时,若在此容器中开始充入2mol H2O(g)、1mol CO、1 mol CO 2和 2 molH2,若要使反应在开始
时 进行。(填“正向”、“逆向”)
③若a=2,b=1,则c= ,达平衡时实验组②中H2O(g)和实验组③中CO的转化率的关系
为α2 (H2O) α3 (CO)(填“<”、“>”或“=”)。
21.利用测压法在刚性反应器中加入2molSO2、1molO2,研究T℃时,反应2SO2(g)+O2(g) 2SO3(g) △H<0,体系的总压强p随时间t的变化如下表所示:
反应时间/min 0 5 10 15 20 25 40
压强/kPa 20.0 19.5 18.3 16.0 16.0 16.0 22.0
(1)平衡时,SO2的转化率α= %;
(2)T℃时,反应2SO2(g)+O2(g) 2SO3(g)的平衡常数Kp= kPa-1[气体分压(p分)=气体总压(p总)×体积分数,Kp为以分压表示的平衡常数,计算结果保留1位小数]。
(3)下图分别代表焓变(△H)、混合气体平均相对分子()、SO2质量分数[ψ(SO2)]和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是___________。
A. B.
C. D.
(4)40min时,改变的条件可能是 (写2点)。
22.德国科学家BenjaminList发现了脯氨酸可以催化羟醛缩合反应,其反应历程简化如图所示。下列说法正确的是
A.有机物①能够降低反应的活化能
B.有机物③是反应的催化剂
C.反应中只涉及极性键的断裂与生成
D.如果用代替,可生成
E.有机物④有6种不同化学环境的氢原子
F.整个过程反应物的原子利用率为100%
G.增加浓度,可提高单位时间内②的转化率
23.某温度时,在0.5L密闭容器中,某一可逆反应的A、B气体,起始时压强为100KPa,各物质物质的量随时间变化的曲线如图所示,由图中数据分析可得:
(1)该反应的化学方程式为 。
(2)若降低温度,则该反应的正反应速率 (填“加快”“减慢”或“不变”,下同),逆反应速率 。
(3)第4min时,正、逆反应速率的大小关系为v正 v逆(填“>”“<”或“=”)。
(4)0~4min内,用B的浓度变化来表示该反应的平均反应速率为 mol L-1 min-1。
(5)反应达到平衡,此时体系内压强与开始时的压强之比为 。
(6)平衡时混合气体中B的分压约为 kPa(保留3位有效数字)。(已知某物质的分压=该物质的体积分数×总压强)
(7)要提高上述反应的转化率,可采取的措施是 (任写一种)。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
【详解】A.18g重水物质的量小于1mol,则其中含有的中子数小于10NA,A错误;
B.5.6g铁为0.1mol,硝酸的物质的量为0.3mol,则该反应中铁过量,硝酸不足,铁不能完全反应,铁失去电子数小于0.3NA,B错误;
C.氢气和氮气反应生成NH3的反应是可逆反应,故3molH2和1molN2反应生成的NH3分子总数小于2NA,C正确;
D.5.6L混合气体的物质的量为0.25mol,则其中碳原子的数目为0.25NA,分子数目为0.25NA,D错误;
故答案选C。
2.C
【详解】A.温度升高,反应速率均增大即H2S分解的正,逆反应速率均增大,故A正确;
B.900℃,ts后达平衡,硫化氢的转化率为50%,则氢气的压强为0.5pkPa,则H2的平均生成速率为,故B正确;
C.根据图中曲线分析,升高温度,硫化氢的转化率增大,因此该反应是吸热反应,则正反应的活化能大于逆反应的活化能,而加入Al2O3催化剂使正反应和逆反应活化能都降低,但正反应的活化能仍大于逆反应的活化能,故C错误;
D.催化剂需要适宜温度,在1100℃,曲线II、III重合,说明Al2O3催化剂可能几乎失去活性,故D正确。
综上所述,答案为C。
3.C
【详解】A.增大甲醇蒸气的浓度,平衡正向进行,CO的转化率增大,A正确;
B.温度超过约83℃时,随着温度的升高,CO的转化率降低,则说明该反应是放热反应;对于放热反应而言,温度越高,平衡常数K越小,故K(75℃)>K(85℃),B正确;
C.平衡之前,温度升高,反应速率增大,一氧化碳转化率增大,平衡之后,温度上高,平衡逆向移动,一氧化碳转化率减小,即b点还未平衡,反应正向进行,则此时正反应速率>逆反应速率,选项C错误;
D.根据图可知,温度在80~85℃的范围内,CO的转化率最高,超过该温度范围,随着温度的升高,CO的转化率降低,说明反应的最适温度在80~85℃之间,故生产时反应温度控制在80~85℃为宜,选项D正确;
故答案为:C。
4.C
【分析】甲投入1molN2、3molH2,丙容器投入量2molNH3,恒温恒容条件下,甲容器与丙容器是等效平衡,各组分的物质的量、含量、转化率等完全相等;而甲容器投入1molN2、3molH2,乙容器加入2molN2、6molH2,乙中加入量是甲中的二倍,如果恒温且乙容器容积是甲容器2倍,则甲容器与乙容器为等效平衡,所以乙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡,由于该反应是体积减小的反应,缩小容器体积,增大了压强,平衡向着正向移动,所以乙中氮气、氢气转化率大于甲和丙的,平衡后乙中氨气含量最大;据以上分析解答。
【详解】A.丙容器反应物投入量2molNH3,和甲起始量相同,甲和丙平衡状态相同,乙中压强为甲的二倍;由于乙中相当于增大压强,平衡向着向着正向移动,所以乙中压强减小,小于甲的2倍,即2P1=2p3>p2,故A错误;
B.丙容器中加入2molNH3,和甲最后达到相同的平衡状态,若平衡不移动,转化率α1+α3=1;乙容器反应物投入量2mol N2、6mol H2,由于乙中相当于增大压强,平衡向着向着正向移动,氨气的转化率增大,所以转化率α2+α3>1,故B错误;
C.丙容器反应物投入量2molNH3,采用极限转化法转化为反应物为1molN2、3molH2,和甲中的相同,乙容器加入2molN2、6molH2,乙中加入量是甲中的二倍,乙所到达的平衡,可以看作在恒温且容积是甲容器两倍条件下,到达平衡后,再压缩体积为与甲容器体积相等所到达的平衡,由于该反应是体积减小的反应,缩小容器体积,增大了压强,平衡向着正向移动,所以乙中氮气、氢气转化率大于甲和丙的,平衡后乙中氨气含量最大,故C正确;
D.甲投入1molN2、3molH2,丙中投入2molNH3,则甲与乙是完全等效的,根据盖斯定律可知,甲与乙的反应的能量变化之和为92.4kJ,故Q1+Q3=92.4,故D错误;
故选C。
5.A
【详解】①探究“浓度对反应速率的影响”:是过量的,溶液不能褪色,不合理;
②探究“浓度对反应速率的影响”:记录溶液褪色所需时间,需要等量,草酸溶液浓度不同,不合理;
③探究“压强对化学平衡的影响”:反应前后气体体积不变,压强对其平衡无影响,不合理;
④探究“温度对反应速率的影响”:需要将试剂先放入冷水或热水中,然后再混合搅拌,记录出现浑浊的时间,不合理;
⑤探究“催化剂对反应速率的影响”:Mn2+是和草酸反应的催化剂,合理;
⑥探究“催化剂对反应速率的影响”:分别向两份相同的溶液中滴入5滴等浓度的溶液和溶液,后者产生气泡速率更快,是因为溶液和溶液发生了氧化还原反应生成了氧气,不合理;
⑦探究“与反应的限度”:取5mL溶液于试管中,加入1mL溶液,充分反应后滴入5滴15%溶液,溶液变血红色,说明在KI过量的情况下,Fe3+还有剩余,证明KI 与 FeCl3的反应有一定限度,合理;
故选A。
6.A
【详解】A.由盖斯定律可知,反应I+Ⅱ得到总反应,则△H=△H1+△H2,A正确;
B.加入CeO2+(s)改变了反应速率,但是不改变反应的焓变,B错误;
C.过渡态物质的总能量与反应物总能量的差值为活化能,即图中峰值越大则活化能越大,峰值越小则活化能越小,活化能越大反应越慢,决定总反应速率的是慢反应;由图可知,反应速率由反应Ⅱ决定,C错误;
D.反应I为气体分子数减小的反应,△S<0,D错误;
故选A。
7.C
【详解】①锌与稀硫酸反应的离子方程式为,由该离子方程式可知,该反应与钠离子和无关,所以加入硫酸钠固体,反应速率不变,故①错误;
②锌与稀硫酸反应,滴入大量硫酸铜溶液,因铜离子的氧化性大于氢离子,所以不一定有氢气生成,故②错误;
③二氧化锰是H2O2分解反应的催化剂,加入催化剂不能改变反应的焓变,但可以降低反应的活化能,故③错误;
④面粉的表面积大,增大固体的表面积,反应速率加快,所以面粉生产车间容易发生爆炸,故④正确。
综上所述,C项符合题意。
8.D
【详解】由于反应X2(g)+3Y2(g) 2Z(g)是一个可逆反应,故各物质均不可能完全转化,假设反应往正方向完全反应,故有:,假设反应往逆方向完全进行,则有:
综合得出:0
9.C
【详解】A.催化剂能够降低反应的活化能,观察图像可知,两种反应过程均放热,故A正确;
B.观察图像可知,反应物是和,产物是H、NO、,故总方程式为,故B正确;
C.从催化反应过程可以看出,CO键没有断裂,故C错误;
D.由图可知,过程(1)反应的活化能低,更容易进行,故D正确;
故选C。
10.D
【分析】T1温度下M点和N点的温度相同,化学平衡常数相等,由图可知,M点二氧化碳的物质的量为1mol,由方程式可知,平衡时一氧化氮、一氧化碳、氮气和二氧化碳的浓度分别为=2.5mol/L、=0.5mol/L、×=0.25mol/L、=0.5mol/L,则平衡常数K==0.04。
【详解】A.由图可知,温度升高,平衡时二氧化碳的物质的量减小,说明升高温度,平衡向逆反应方向移动,该反应为放热反应,反应ΔH<0,故A错误;
B.由分析可知,N点的平衡常数为0.04,故B错误;
C.化学平衡常数是温度函数,温度不变,化学平衡常数不变,设T1温度下达到平衡时NO的转化率为25%,由方程式可知,平衡时一氧化氮、一氧化碳、氮气和二氧化碳的浓度分别为=0.75mol/L、=2.75mol/L、×=0.125mol/L、=0.25mol/L,平衡常数K=≈0.0018≠0.04,故C错误;
D.若图中M点所示条件下,再通入一氧化碳和氮气各2mol,此时一氧化氮、一氧化碳、氮气和二氧化碳的浓度分别为2.5mol/L、1.5mol/L、1.25mol/L、0.5mol/L,浓度熵Qc=≈0.022<0.04,则平衡向逆反应方向移动,反应速率v(正)>v(逆),故D正确;
故选D。
11.B
【详解】A.C为固体,增加其用量对平衡无影响,A错误;
B.在T2℃时,若反应体系处于状态D,此时c(NO)高于平衡时NO浓度,故平衡正向移动,因此υ正>υ逆,B正确;
C.该反应是等体积反应,B、D温度相同,物质的量相同,因此PD=PB,C、D物质的量相等,温度C大于D点,因此压强PC>PD,C错误;
D.由图示知,升高温度,c(NO)浓度增大,说明平衡逆向移动,故平衡常数减小,因此K2<K1,D错误;
故答案选B。
12.D
【详解】A.根据机理可知,CH2=CHCH2R’和HSiR3为反应物,R’(CH2)3SiR3为生成物,因此硅氢化反应为CH2=CHCH2R’+HSiR3→R’(CH2)3SiR3,故A说法正确;
B.5b中Pt成键数目是4,6c中Pt成键数目是5,6a、6a'、6b中Pt成键数目是6,故B说法正确;
C.根据机理图可知,5b+H-SiR36a、6a’6a'、6a+CH2=CH-R6b、6b6c四个动态平衡,故C说法正确;
D.6a、6b、6c是该反应的中间体,故D说法错误;
答案为D。
13.(1) 0.975 该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa=p2,所以p1=5.0MPa 温度、压强和反应物的起始浓度(组成)
(2) 升高温度 减小压强(增大体积)
【详解】(1)5.0 MPa、550℃时,α=0.975。该反应正向为气体分子数减小的反应,温度相同时增大压强,化学平衡向正向移动,SO2的平衡转化率(α)增大,5.0MPa>2.5MPa=p2,故p1=5.0MPa。故判断依据:该反应气体分子数减少,增大压强,α提高。5.0MPa>2.5MPa=p2,所以p1=5.0MPa;影响α的因素:由图像可得温度升高,α减小,压强增大,α增大。另外起始充入的SO2与O2的物质的量之比影响SO2的平衡转化率,故影响因素为温度、压强和反应物的起始浓度(组成)。
(2)由于该反应为吸热反应、且为气体分子数增大的反应,因此可通过升高温度、减小压强(增大体积)等提高该反应的平衡转化率。
14. 低温 W>Y=Z Z>Y>X K=1600 a>0.01
【详解】(1)图象分析,反应是放热反应,反应的焓变ΔH=E1-E2=145kJ/mol-890kJ/mol=-745kJ/mol,热化学方程式为:2CO(g)+2NO(g)N2(g)+2CO2(g)ΔH4=-745kJ/mol;反应是放热反应,ΔH<0,ΔS<0,低温下ΔH-TΔS<0,有利于该反应正向自发,故答案为:低温;
(2)①图象分析,反应物NO、CO的起始物质的量比一定,反应是放热反应,温度越高平衡逆向进行,二氧化碳体积分数减小,平衡常数减小,T1>T2,由于Y、Z温度相同,故W、Y、Z三点的平衡常数的大小关系为:W>Y=Z;温度一定,随反应物NO、CO的起始物质的量比增大,X→Y反应正向进行,一氧化碳的转化率X<Y,Y→Z平衡正向进行,一氧化氮增大会提高一氧化碳的转化率,则Y<Z,X、Y、Z三点,CO的转化率的从大到小的顺序Z>Y>X,故答案为:W>Y=Z;Z>Y>X;
②T1℃时,在1L密闭容器中,0.1molCO和0.1molNO,达到Y点时,测得NO的浓度为0.02mol/L,则
则此温度下平衡常数K==1600,某时刻测得CO、NO、N2、CO2的浓度分别为0.01mol/L、amol/L、0.01mol/L、0.04mol/L,要使反应向正方向进行,应满足Q<K=1600,Q=<1600,解得a>0.01,故答案为:1600;a>0.01。
15.(1) 60%
(2)7:10
(3)正向移动
(4)不变
【分析】根据三段式分析可知:,则有:即,解得x=0.6mol,据此分析解题。
(1)
0~5min内用B表示的平均反应速率为,达到平衡时,A的转化率为,故答案为:;60%;
(2)
根据阿伏加德罗定律及推论可知,同温同压下气体的压强之比等于其物质的量之比,故达到平衡时容器内气体压强与反应前容器内气体压强之比为[(3-3x)+(1-x)+2x]:(3+1)=(4-2x):4=(4-2×0.6):4=7:10,故答案为:7:10;
(3)
分析反应为一个正反应为气体体积缩小的反应,故维持容器的温度不变,若缩小容器的体积,则平衡将向正向移动,故答案为:正向移动;
(4)
化学平衡常数仅仅是温度的函数,温度不变平衡常数不变,故达到平衡后,若保持温度不变,将C从容器中分离出一部分,则化学平衡常数不变,故答案为:不变。
16.(1)升高温度(2)减小生成物浓度
(3)如图c d段
【详解】试题分析:(1)a时逆反应速率大于正反应速率,且正逆反应速率都增大,说明平衡应向逆反应方向移动,该反应的正反应放热,应为升高温度的结果;
(2)b时正反应速率不变,逆反应速率减小,在此基础上逐渐减小,应为减小生成物的原因;
(3)增大压强,正反应速率下降,逆反应速率上升,且平衡正向移动,结果如图所示
考点:影响化学平衡移动的因素
17.(1)>
(2) > 增大压强
(3) SO2+2H2O-2e-=+4H+ 1:1
【详解】(1)断开化学键吸收能量,则ΔH2>0,故答案为:>;
(2)①由图可知,t1℃下反应先达到平衡状态,则t1>t2,t1℃时NO的百分含量小于t2℃,说明升高温度,平衡正向移动,则该反应为吸热反应,ΔH>0,故答案为:>;
②由图可知,改变的条件使反应速率加快,且平衡逆向移动,则t1时刻改变的外界条件可能是增大压强,故答案为:增大压强;
(3)①电解池中SO2在阳极失去电子生成H2SO4,电极反应式为SO2+2H2O-2e-=+4H+,故答案为:SO2+2H2O-2e-=+4H+;
②反应前后阴极室成分不变,即阳极转移电子数和NO生成N2时转移电子数相等,即SO2~~2e-~NO~N2,所以在相同条件下的体积比1:1,故答案为:1:1。
18. 0.079mol/(L·s) 0.395mol/L X(g)+Y(g) 2Z(g) BD
【详解】
(1)从反应开始到10s,Z的物质的量改变1.58mol,容器的体积为2L,则Z表示的反应速率为:=0.079mol/(L·s);
(2)根据图像可知,X的物质的量浓度减少了:=0.395mol/L;反应的物质的量之比等于化学计量数之比,则(1.2-0.41) mol:(1.00-0.21) mol:1.58mol=1:1:2,减少的为反应物,增大的为生成物,则方程式为X(g)+Y(g) 2Z(g);
(3) A.t1时刻,增大了X的浓度,X为反应物,则正反应速率增大,逆反应速率不变,A与图像不符;
B.反应为气体不变的反应,则t1时刻,缩小了容器体积,平衡不移动,正逆反应速率均增大,且增大的程度相同,B与图像符合;
C.t1时刻,升高了体系温度,正逆反应速率均增大,但增大的程度不同,C与图像不符;
D.t1时刻,使用了催化剂,正逆反应速率均增大,且增大的程度相同,D与图像符合;
答案为BD。
19.-234 20. 0.6mol/(L·min) 或2.67 减小 正向 0.4mol =
【解析】19.根据盖斯定律可知(①-②+③)÷2得到(179.5+112.3—759.8)÷2=-234 kJ/mol,则反应NO2(g)+CO(g)=NO(g) +CO2(g) =-234 kJ/mol;
20.①根据表中数据可知平衡时生成氢气的物质的量是1.6 mol,则根据方程式可知消耗CO2的物质的量是1.6 mol,其浓度是0.8 mol/L,则CO2表示的反应速率为=0.16 mol/(L·min);
所以平衡常数K==2.67;
该反应是放热反应,所以温度升高时平衡常数减小。
②650 ℃时,K=2.67,开始充入2 mol H2O(g)、1 mol CO、1 mol CO2和2 mol H2,Q=(0.5×1)÷(0.5×1)=1<2.67,则开始时反应正向进行;
③先求实验2条件下的平衡常数
则K= =0.17
若a=2,b=1,则
则K==0.17,解得x=0.2
容器的体积为2 L,则c=0.4 mol;
在这两种情况下实验组2中H2O(g)和实验组3中CO的转化率均是0.2÷0.5×100%=40%。
21.(1)60
(2)0.8
(3)BC
(4)升高温度、增加反应物或生成物的物质的量
【分析】由表格数据可知15 min时反应达到平衡,利用“三段式”:
根据压强之比等于物质的量之比:,解得x=0.6。
【详解】(1)平衡时,SO2的转化率;
(2)T℃时,反应2SO2(g)+O2(g) 2SO3(g)的平衡常数;
(3)A.化学反应伴随着能量变化,焓变不可能一直不变,故A错误;
B.因为2SO2(g)+O2(g) 2SO3(g)是气体分子数减小的反应,所以随着反应进行,混合气体平均相对分子质量逐渐增大,当混合气体平均相对分子质量不再变化,说明化学反应达到平衡状态,故B正确;
C.SO2属于反应物,随着反应进行,SO2质量分数逐渐减小,当SO2质量分数不再变化时,
说明反应达到平衡状态,故C正确;
D.因为2SO2(g)+O2(g) 2SO3(g)是气体分子数减小的反应,随着反应进行,压强逐渐减小,当压强不再改变时,反应达到平衡状态,故D错误。
故答案为:BC
(4)40min时,刚性容器中气体的压强增大。根据pV=nRT可知,升高温度可以增大体系的压强,而且升高温度可以使化学平衡向逆反应方向移动,体系的压强也增大。当然,直接增加气体的物质的量也能增大体系的压强。故改变的条件可能是升高温度,也可能是增加反应物或生成物的物质的量。
22.AG
【详解】A.有机物①最开始参与反应,到最后又被生成,故它是反应的催化剂,能够降低反应的活化能,A正确;
B.有机物③不是催化剂,是中间产物,B错误;
C.从⑤到⑥有C-C键生成,故有非极性键生成,C错误;
D.生成物的羰基应该在左起第三个碳原子上,D错误;
E.有机物④共有七个位置有H,且都属于不同的环境,即有7种环境的氢原子,E错误;
F.有水生成,故原子利用率没有达到100%,F错误;
G.氢离子是反应物,增加氢离子浓度可以提高单位时间内的化学反应速率,从而提升单位时间内的转化率,G正确;
故选AG。
23.(1)2A(g)B(g)
(2) 减慢 减慢
(3)>
(4)0.1
(5)7:10
(6)50.0
(7)增大压强
【解析】(1)
根据图示可知在前4 min内A减少0.4mol,B增加0.2mol,一定时间后A、B都存在,且物质的量不再发生变化,说明该反应是可逆反应,其中A是反应物,B是生成物,二者改变的物质的量的比是0.4mol:0.2mol=2:1,故反应方程式为:2A(g)B(g);
(2)
降低温度,活化分子百分数减小,有效碰撞几率减小,正、逆反应速率都减慢;
(3)
4 min后,A的物质的量减小,B的物质的量增加,则反应正向进行,因此正、逆反应速率的大小关系为v正>v逆;
(4)
在0~4 min B物质的量改变△n(B)=0.4 mol-0.2 mol=0.2 mol,则用B的浓度变化来表示该反应的平均反应速率为v(B)=;
(5)
该反应达到平衡时,n(A)=0.2 mol,n(B)=0.5 mol,恒温恒容下,气体的体积比等于气体的物质的量之比,故平衡时总压强和起始时总压比为(0.5+0.2)mol:(0.8+0.2)mol=7:10;
(6)
结合(5)可知7:10=p平:100kPa,因此平衡时总压p平=70kPa,平衡时B的体积分数为,则平衡时混合气体中B的分压为×70KPa=50.0kPa;
(7)
该反应为气体分子数减小的反应,要提高上述反应的转化率,可采取的措施是增大压强(合理即可)。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
