第三章《铁金属材料》(含解析)测试题2023-2024学年上学期高一化学人教版(2019)必修第一册
文档属性
| 名称 | 第三章《铁金属材料》(含解析)测试题2023-2024学年上学期高一化学人教版(2019)必修第一册 |  | |
| 格式 | docx | ||
| 文件大小 | 371.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 19:11:53 | ||
图片预览



文档简介
第三章《铁金属材料》测试题
一、单选题
1.下列物质的转化在给定条件下能实现的是
A.
B.
C.
D.
2.下列物质与其用途完全符合的有
①Na2CO3—制玻璃 ②SiO2—制光导纤维
③AgBr—照相底片感光剂 ④NaCl—制纯碱
⑤Al2O3—焊接钢轨 ⑥NaClO—消毒剂
⑦Fe2O3—制红色油漆或涂料 ⑧MgO—制耐火材料
A.4个 B.5个 C.6个 D.7个
3.已知某校回收的含银悬浊废水中含有AgCl、Ag(NH3)2NO3、AgNO3、CH3COONH4、NaCl等,设计从废水中回收硝酸银的具体流程如下:
下列说法不正确的是
A.步骤Ⅱ中发生的主要反应的离子方程:3AgCl+Al+4OH-=3Ag+AlO2-+3Cl-+2H2O
B.实验中用铝粉代替铝片可以加快反应速率并简化实验操作
C.步骤Ⅲ中若先将Ag氧化为Ag2O,再加入稀硝酸反应有利于环保
D.操作Ⅰ包括蒸发浓缩、冷却结晶、过滤、洗涤等
4.四氧化三铁(Fe3O4)的组成可表示为FeO Fe2O3,下列关于Fe3O4的说法不正确的是
A.Fe3O4是一种混合物
B.FeO在空气中受热能迅速被氧化为Fe3O4
C.Fe3O4与盐酸反应的产物中有两种铁的价态
D.Fe3O4俗称磁性氧化铁,常用作磁性材料
5.下列离子方程式正确的是
A.金属铝溶于氢氧化钠溶液:Al+2OH- =AlO+H2↑
B.实验室制氯气:MnO2+4H++4Cl-MnCl2+Cl2↑+2H2O
C.CuSO4溶液与Ba(OH)2溶液反应:
D.BaCO3与盐酸反应:BaCO3+2H+ =Ba2++CO2↑+H2O
6.下列离子能大量共存的是
A.某弱碱溶液中:、、Na+、Cl-
B.与Al反应放出H2的溶液中: Fe2+、K+、、
C.c(Fe3+)= 1mol/L的溶液中:Na+、、 SCN-、
D.无色透明溶液中:K+、、Cl-、
7.化学在生活中有着广泛的应用,下列对应关系正确的是
选项 化学性质 实际应用
A Na具有强还原性 制备金属钾
B CO2不支持燃烧 扑灭Mg燃烧的火焰
C 铝的金属活动性强于氢 用铝制容器贮运浓硝酸
D FeCl3溶液能与Cu反应 蚀刻铜箔制造电路板
A.A B.B C.C D.D
8.化学与生产、生活、社会、环境密切相关,下列说法中正确的是
A.铝制容器不能盛放酸性或碱性食品,但可长期盛放腌制食品
B.明矾净水过程中只涉及了物理变化
C.向氢氧化铁胶体中滴加稀硫酸,开始有红褐色沉淀生成,最终沉淀会完全溶解
D.溶于水能导电,故是电解质
9.下列说法不正确的是
A.Fe在O2中燃烧生成四氧化三铁
B.Fe与Cl2发生反应生成氯化亚铁
C.Fe在潮湿的环境中易生锈
D.Fe在氧气中燃烧需要在集气瓶中放少量沙子,以免炸裂集气瓶
10.下列关于元素及其化合物的说法正确的是
A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸发生剧烈的反应
B.NaHCO3可用于制备纯碱,治疗胃酸过多的药剂、食品发酵剂
C.通过丁达尔效应可以鉴别豆浆和Fe(OH)3胶体
D.摩尔质量实际上就是该元素的相对原子质量
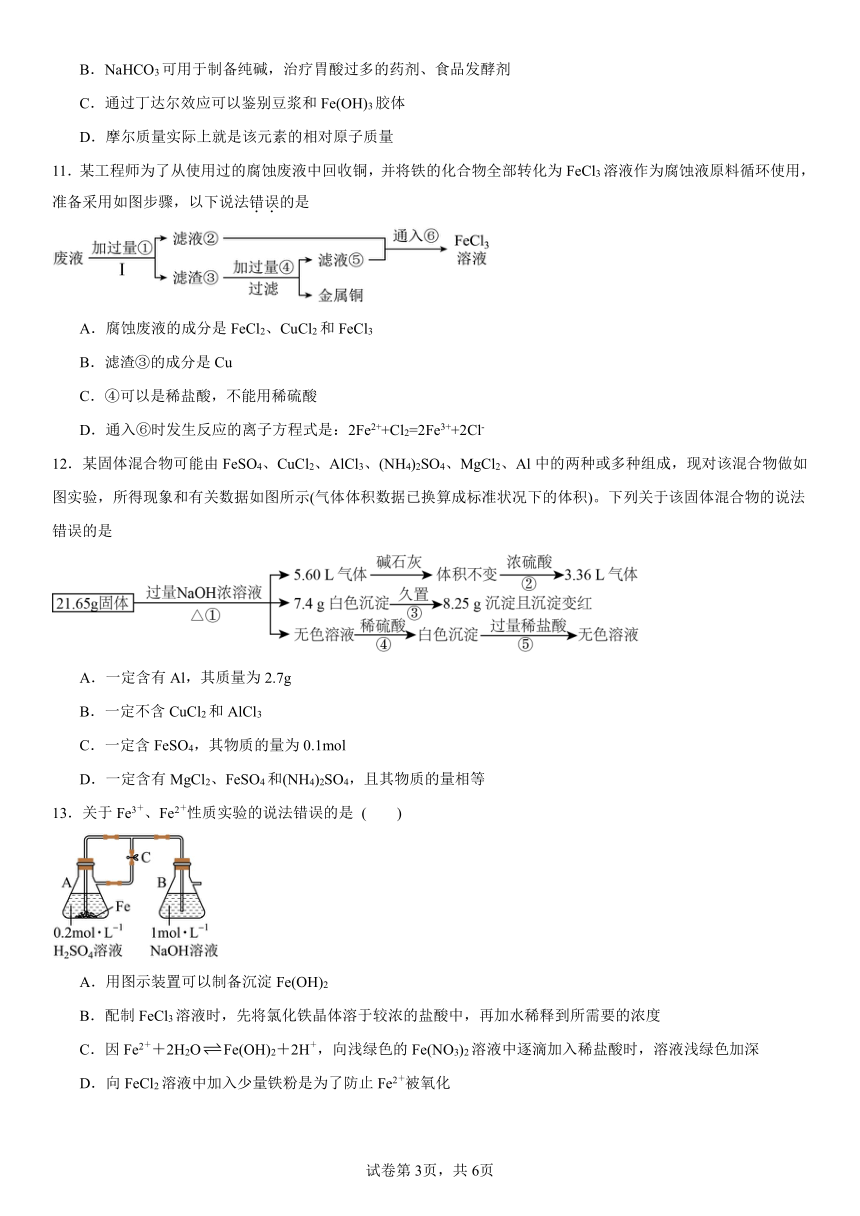
11.某工程师为了从使用过的腐蚀废液中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用如图步骤,以下说法错误的是
A.腐蚀废液的成分是FeCl2、CuCl2和FeCl3
B.滤渣③的成分是Cu
C.④可以是稀盐酸,不能用稀硫酸
D.通入⑥时发生反应的离子方程式是:2Fe2++Cl2=2Fe3++2Cl-
12.某固体混合物可能由FeSO4、CuCl2、AlCl3、(NH4)2SO4、MgCl2、Al中的两种或多种组成,现对该混合物做如图实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积)。下列关于该固体混合物的说法错误的是
A.一定含有Al,其质量为2.7g
B.一定不含CuCl2和AlCl3
C.一定含FeSO4,其物质的量为0.1mol
D.一定含有MgCl2、FeSO4和(NH4)2SO4,且其物质的量相等
13.关于Fe3+、Fe2+性质实验的说法错误的是 ( )
A.用图示装置可以制备沉淀Fe(OH)2
B.配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度
C.因Fe2++2H2OFe(OH)2+2H+,向浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,溶液浅绿色加深
D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
二、填空题
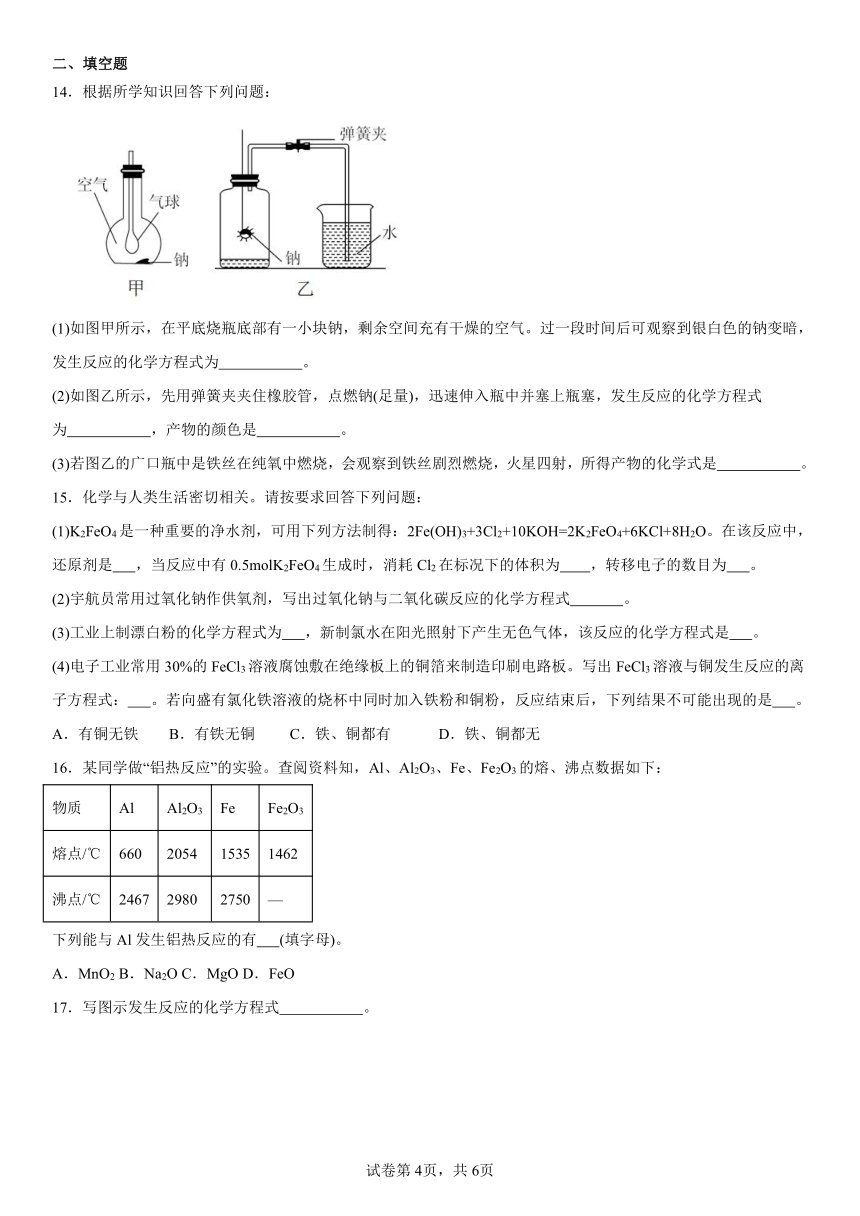
14.根据所学知识回答下列问题:
(1)如图甲所示,在平底烧瓶底部有一小块钠,剩余空间充有干燥的空气。过一段时间后可观察到银白色的钠变暗,发生反应的化学方程式为 。
(2)如图乙所示,先用弹簧夹夹住橡胶管,点燃钠(足量),迅速伸入瓶中并塞上瓶塞,发生反应的化学方程式为 ,产物的颜色是 。
(3)若图乙的广口瓶中是铁丝在纯氧中燃烧,会观察到铁丝剧烈燃烧,火星四射,所得产物的化学式是 。
15.化学与人类生活密切相关。请按要求回答下列问题:
(1)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O。在该反应中,还原剂是 ,当反应中有0.5molK2FeO4生成时,消耗Cl2在标况下的体积为 ,转移电子的数目为 。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式 。
(3)工业上制漂白粉的化学方程式为 ,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是 。
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式: 。若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是 。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
16.某同学做“铝热反应”的实验。查阅资料知,Al、Al2O3、Fe、Fe2O3的熔、沸点数据如下:
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2054 1535 1462
沸点/℃ 2467 2980 2750 —
下列能与Al发生铝热反应的有 (填字母)。
A.MnO2 B.Na2O C.MgO D.FeO
17.写图示发生反应的化学方程式 。
18.Ⅰ.下表是生活、生产中常见的物质,表中列出了它们的一种主要成分(其他成分未列出)。
编号 ① ② ③ ④
名称 绿矾 醋 苏打 酒精
主要成分 FeSO4 CH3COOH Na2CO3 CH3CH2OH
编号 ⑤ ⑥ ⑦ ⑧
名称 铜导线 蔗糖 烧碱 铁锈
主要成分 Cu C12H22O11 NaOH Fe2O3
(1)请你对表中①~⑧的主要成分进行分类(填编号):属于盐的是 ,属于电解质的是 ,属于非电解质的是 。
(2)写出②与⑦反应的离子方程式: ,少量盐酸与③反应的离子方程式为 。
Ⅱ.在Fe(OH)3胶体中逐渐滴入HI稀溶液,会出现一系列变化:
(3)①先出现红褐色沉淀,原因是 。
②随后沉淀溶解,溶液呈黄色,此反应的离子方程式是
③最后溶液颜色加深,此反应的离子方程式是
(4)若用稀盐酸代替HI稀溶液,能出现(3)中所述变化现象中的 (填写上面各题序号)。
19.一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
(1)维生素C在这一反应中具有 性;维生素C又称为 。
(2)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐。此反应的离子方程式为 。
20.下图是某儿童微量元素体检报告单的部分数据:
大连市医疗机构临床检验结果报告单
分析项目 检测结果 单位 参考范围
1 锌(Zn) 115.92 μmol·L-1 66~120
2 铁(Fe) 6.95↓ mmol·L-1 7.52~11.82
4 钙(Ca) 1.68 mmol·L-1 1.55~2.10
… … … … …
根据上表的数据,回答下列问题。
(1)该儿童缺乏 元素。
(2)报告单中“μmol·L-1”是 (填“质量”“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中体现维生素C的 (填“氧化性”或“还原性”)。
(4)缺铁性贫血患者应补充Fe2+,一些补铁剂以硫酸亚铁为主要成分,将硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的主要作用是 。
(5)关于铁的氢氧化物有两种,请写出氢氧化亚铁在空气中被氧化成氢氧化铁的实验现象 ,对应化学反应方程式为
21.H7N9型禽流感是一种新型禽流感,研究表明,该病毒对热敏感,煮沸2分钟以上即可失去活性,许多常用消毒药物如:高锰酸钾、漂白粉、氯气等,也都可以将该病毒杀灭。
(1)新制氯水中含有多种微粒,将紫色石蕊试液滴入氯水中,溶液显红色起作用的微粒是 ;过一会儿,溶液颜色逐渐褪去,起作用的微粒是 。
(2)工业上制取漂白粉的反应方程式为: 。
(3)已知高锰酸钾与浓盐酸混合能产生氯气,化学反应方程式为:2KMnO4 +16HCl 2MnCl2+2KCl+8H2O+5Cl2↑
该反应中氧化剂为 。请用双线桥法表示电子转移的情况。
(4)向漂白粉清液中滴加碳酸钠溶液,有白色沉淀生成,写出发生反应的离子方程式 。
(5)将过量氯气通入FeBr2溶液中,写出该反应的离子方程式 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.NH3催化氧化只能生成NO,氨的催化氧化温度在780~840℃,二氧化氮在150℃以上开始分解,到650℃完全分解为一氧化氮和氧气,所以氨的催化氧化过程中无法生成NO2,A错误;
B.Al与NaOH溶液反应生成NaAlO2和H2,NaAlO2溶液蒸发结晶,可获得NaAlO2晶体,B正确;
C.Fe在高温条件下与水蒸气反应,生成Fe3O4和H2,C错误;
D.乙烯与水的加成反应是在高温高压催化剂条件下生成乙醇,D错误。
故选B。
2.D
【详解】①碳酸钠和二氧化硅在高温条件下反应制取玻璃,①符合;②高纯度的二氧化硅用来做制光导纤维,②符合;③溴化银有感光性,可用于照相底片感光剂,③符合;④饱和氯化钠溶液、氨气和二氧化碳反应生成碳酸氢钠,碳酸氢钠再受热分解得到碳酸钠,④符合;⑤铝和氧化铁能发生铝热反应用于焊接钢轨,⑤不符合;⑥次氯酸钠有强氧化性,可以做消毒剂,漂白织物,⑥符合;⑦氧化铁为红棕色固体,可以做红色油漆或涂料,⑦符合;⑧氧化镁熔点较高,可以做耐火材料,⑧符合;符合的有①②③④⑥⑦⑧,故D正确;
答案选D。
3.B
【分析】含银悬浊废水中含有AgCl、Ag(NH3)2NO3、AgNO3、CH3COONH4、NaCl等,加入盐酸后生成氯化银沉淀,过滤后,滤渣的主要成分是氯化银,在氯化银中加入铝片、氢氧化钠溶液后置换出银,然后用硝酸溶解得到硝酸银溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤得到硝酸银晶体,据此分析解答。
【详解】A、步骤Ⅱ中主要发生铝、氢氧化钠溶液与氯化银的置换反应,发生的主要反应的离子方程式为:3AgCl+Al+4OH-=3Ag+AlO2-+3Cl-+2H2O,故A正确;
B、若实验中用铝粉代替铝片可以加快反应速率,但置换出的银中混入了铝粉,还需要分离提纯,没有简化实验操作,故B错误;
C、银与稀硝酸反应会生成NO,污染环境,若先将Ag氧化为Ag2O,再加入稀硝酸反应,可以防止NO的生成,有利于环保,故C正确;
D、操作Ⅰ是从硝酸银溶液中获得硝酸银晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤等,故D正确;
故选B。
4.A
【详解】A. Fe3O4是一种铁的氧化物,属于纯净物,A错误;
B.+2价铁具有较强还原性、容易被氧化, FeO在空气中受热能迅速被氧化为Fe3O4,B正确;
C. Fe3O4中铁元素呈+2、+3价,与盐酸反应得到氯化亚铁、氯化铁,则产物中有两种铁的价态,C正确;
D. Fe3O4具有铁磁性,俗称磁性氧化铁,常用作磁性材料,D正确;
答案选A。
5.D
【详解】A.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,发生反应的离子方程式为2Al+2OH– +2H2O = 2AlO+3H2↑,A错误;
B.实验室用二氧化锰与浓盐酸加热制氯气,发生反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O,B选项MnCl2为可溶性盐,应拆成离子形式,B错误;
C.CuSO4溶液与Ba(OH)2溶液反应生成硫酸钡沉淀和氢氧化铜沉淀,离子方程式为Cu2+++Ba2++2OH– = BaSO4↓+Cu(OH)2↓,C错误;
D.盐酸为强酸,碳酸为弱酸,BaCO3与盐酸反应生成二氧化碳和水且BaCO3为难溶盐不拆,故D正确。
6.A
【详解】A.某弱碱溶液中:、、Na+、Cl-在溶液中不发生化学反应,可以大量共存,故A符合题意;
B.与Al反应放出H2的溶液中:可能为酸性溶液或碱性溶液,若为酸性溶液,存在 与铝反应形成氮的氧化物,不释放氢气,且酸性条件下和Fe2+之间发生氧化还原反应,若为碱性溶液,Fe2+在碱性条件下会发生反应生成氢氧化亚铁沉淀,再被空气氧化成氢氧化铁沉淀,故不能大量共存,故B不符合题意;
C.c(Fe3+)=1mol/L的溶液中:Fe3+和会发生反应生成络合物,不能大量共存,故C不符合题意;
D.是蓝色,不能存在于无色透明溶液中:不能大量共存, 故D不符合题意;
答案选A。
7.D
【详解】A.钾比钠活泼,所以钠不能制备金属钾,故A错误;
B.CO2可以与金属镁反应生成氧化镁和碳,所以CO2不能扑灭Mg燃烧的火焰,故B错误;
C.在常温下,铝在浓硝酸中钝化,所以可用铝制容器贮运浓硝酸,故C错误;
D. FeCl3溶液能与Cu反应,所以可用于蚀刻铜箔制造电路板,故D正确。
故选D。
8.C
【详解】A.金属铝既能和酸反应又能和碱反应,不能盛放酸性或碱性食品,也不能长期盛放腌制食品,里面有氯化钠,会形对铝制容器进行腐蚀,故A错误;
B.明矾水解生成氢氧化铝胶体,胶体具有吸附性而吸附水中的杂质,该过程涉及了化学变化,故B错误;
C.盐酸是电解质溶液,氢氧化铁胶体遇到盐酸,胶体发生聚沉,生成氢氧化铁沉淀;再滴加盐酸,氢氧化铁沉淀与盐酸反应生成氯化铁,故C选项正确;
D.溶于水能导电是因为氨气与水反应生成一水合氨电解质,一水合氨电离产生自由移动的离子,氨气本身不能电离产生自由移动的离子,所以不是电解质,故D错误。
故选C选项。
9.B
【详解】A.Fe在O2中燃烧生成黑色四氧化三铁,故A正确;
B.点燃条件下,Fe与Cl2发生反应生成氯化铁,故B错误;
C.Fe在潮湿的环境中与氧气、水接触易生锈,故C正确;
D.Fe在氧气中燃烧生成Fe3O4,并放出大量的热,需要在集气瓶中放少量沙子,以免生成物熔化后溅落炸裂集气瓶,故D正确;
选B。
10.B
【详解】A. Fe在常温下可与浓硝酸、浓硫酸发生钝化,故A错误;
B. NaHCO3具有不稳定性, NaHCO3可用于制备纯碱, NaHCO3能与HCl反应,可用于作治疗胃酸过多的药剂、食品发酵剂,故B正确;
C. 通过丁达尔效应无法鉴别豆浆和Fe(OH)3胶体,两者都有丁达尔现象,故C错误;
D. 摩尔质量以g·mol-1作单位时,数值上等于该元素的相对原子质量,故D错误;
故选B。
11.B
【分析】由流程可知,腐蚀废液中含有氯化铜、氯化亚铁,加入过量①为Fe,与氯化铜反应生成金属铜和氯化亚铁,经过滤所得滤液②含氯化亚铁,滤渣③是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量④为盐酸可以将铜分离,得到的滤液⑤为氯化亚铁,滤液合并后通入氯气,能将亚铁离子氧化生成氯化铁,以此解答该题。
【详解】A.Cu与氯化铁反应得到腐蚀废液的成分是FeCl2、CuCl2和FeCl3,故A正确;
B.由上述分析可知,滤渣③含Cu、Fe,故B错误;
C.最终得到氯化铁,则④可以是稀盐酸,不能用稀硫酸,故C正确;
D.通入⑥时氯气氧化亚铁离子,发生反应的离子方程式是:2Fe2++Cl2═2Fe3++2Cl ,故D正确;
故选:B。
12.C
【分析】21.65g固体加入过量的氢氧化钠溶液中产生气体,可以是铵盐和碱反应生成氨气,也可以是金属铝与氢氧化钠溶液反应生成氢气,5.60L(0.25mol)气体通过碱石灰无变化,说明气体中没有能与碱石灰反应的气体,且无水蒸气的存在,通过浓硫酸,气体剩余3.36L,体积减少5.60L-3.36L=2.24L,结合混合物可能存在的物质可知,一定含有硫酸铵(0.05mol,质量为6.6g),与氢氧化钠反应生成的氨气为2.24L,剩余的气体只能是氢气,其体积为3.36L,说明原混合物中一定含有铝(0.1mol,质量为2.7g);21.65g固体加入过量的氢氧化钠溶液中产生白色沉淀7.4g,久置变红色且质量增大0.85g,增大的质量相当于的质量,由于氢氧化铝溶于强碱,氢氧化铜为蓝色沉淀,所以生成的白色沉淀中一定含有和,白色沉淀久置于空气中,,故的物质的量为0.05mol,质量为4.5g,的质量为2.9g.物质的量为0.05mol,故原混合物中的物质的量为0.05mol、质量为7.6g,的物质的量为0.05mol,质量为4.75g;
【详解】A.根据以上分析原混合物中没有和,原混合物中一定含有Al,其质量为2.7g,故A正确;
B.根据以上分析原混合物中没有和,B正确;
C.根据已知条件中白色沉淀由白色变为红色判断原混合物中一定含有,根据原子守恒得物质的量为0.05mol,故C错误;
D.根据以上分析原混合物中含有、和,且其物质的量相等,D正确。
【点睛】此题考查物质混合物的含量测定;注意根据元素守恒进行计算。
13.C
【详解】A.由图可知,A中发生Fe与稀硫酸的反应生成硫酸亚铁和氢气,利用氢气将装置中的空气排出,然后关闭C,氢气将硫酸亚铁压入B中,硫酸亚铁与NaOH反应生成Fe(OH)2,故用图示装置可以制备沉淀Fe(OH)2,A项正确;
B.FeCl3易水解,配制FeCl3溶液时应防止FeCl3因水解生成氢氧化铁沉淀,可先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度,B项正确;
C.Fe(NO3)2溶液中加入盐酸时发生反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,有棕黄色的Fe3+生成,溶液颜色由浅绿色变成棕黄色,C项错误;
D.Fe3+与铁反应可生成Fe2+,则向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化,D项正确;
答案选C。
【点睛】C选项:因为NO3-(H+)具有氧化性,可将Fe2+氧化为Fe3+,应考虑发生的氧化还原反应,不能直接从平衡的移动方面去考虑。
14. 淡黄色 Fe3O4
【详解】(1) 钠在常温下即可与氧气反应生成氧化钠,致使钠表面变暗,氧气消耗,瓶内压强减小,气球膨胀,化学反应方程式为:,故答案为:;
(2) 钠在加热条件下与氧气反应生成过氧化钠,化学反应方程式为:,产物为淡黄色;故答案为:;淡黄色;
(3)铁在氧气中燃烧生成的产物为Fe3O4;故答案为:Fe3O4。
15. Fe(OH)3 16.8L 1.5NA 2Na2O2+2CO2=2Na2CO3+O2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2HClO2HCl+O2↑ Cu+2Fe3+=2Fe2++Cu2+ B
【详解】(1)由反应方程式可知,反应中铁元素的化合价升高被氧化,氢氧化铁是反应的还原剂,当反应中有0.5mol高铁酸钾生成时,消耗标准状况下氯气的体积为0.5mol××22.4L/mol=16.8L,反应转移电子数目为0.5mol×3×NAmol—1=1.5NA,故答案为:Fe(OH)3;16.8L;1.5NA;
(2)过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)工业上制漂白粉的反应为氯气与石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;次氯酸遇光发生分解反应生成盐酸和氧气,反应的化学方程式为2HClO2HCl+O2↑,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;2HClO2HCl+O2↑;
(4)氯化铁溶液与铜反应生成氯化亚铁和氯化铜,反应的离子方程式为Cu+2Fe3+=2Fe2++Cu2+;若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,铁比铜活泼,溶液中铁先发生反应Fe+2Fe3+=3Fe2+,若FeCl3溶液过量,则铜与氯化铁溶液发生反应Cu+2Fe3+=2Fe2++Cu2+;
A.由分析可知,若铜过量,剩余固体中可能会有铜无铁,故不符合题意;
B.由分析可知,铁先参与反应,若氯化铁溶液过量,铜会参与反应,因此不可能出现有铁无铜的结果,故符合题意;
C.由分析可知,假如铁过量,则会出现铁和铜同时存在的结果,故不符合题意;
D.假如氯化铁溶液与铁和铜完全反应,铜和铁均无剩余,故不符合题意;
故选B,故答案为:Cu+2Fe3+=2Fe2++Cu2+;B。
16.AD
【详解】若铝热反应能够进行,制取的金属的还原性需比金属铝还原性弱,金属Na、Mg还原性均强于Al,所以无法通过铝热反应得到,即Na2O、MgO不能和Al发生铝热反应,故答案为:AD。
17.
【详解】从提炼金属的角度而言,铝热反应的优点是作用时间短,放出大量热,因此,作为一种便携的熔融态热源,铝热剂非常适合在焊接钢轨等场合应用。在实验室,可用如图所示装置,使铝粉与氧化铁粉末发生铝热反应,点燃镁条引发反应,整个过程可观察到的现象有:镁条剧烈燃烧,发出耀眼的白光,Fe2O3和铝粉剧烈反应放出大量的热,纸漏斗的下部被炸穿,有熔融物落入沙中,发生反应的化学方程式。
18. ①③ ①②③⑦⑧ ④⑥ CH3COOH+OH-=CH3COO-+H2O +H+= 加入可溶性电解质使胶体聚沉 Fe(OH)3+3H+=Fe3++3H2O 2Fe3++2I-=2Fe2++I2 ①②
【详解】(1)盐类是由酸根阴离子和金属阳离子(或铵根)构成的化合物,①FeSO4、③Na2CO3属于盐类;在水溶液中或熔融状态下可以导电的化合物为电解质,①FeSO4、②CH3COOH、③Na2CO3、⑦NaOH、⑧Fe2O3属于电解质;在水溶液中和熔融状态下都不能导电的化合物为非电解质,④CH3CH2OH、⑥C12H22O11属于非电解质;
(2)醋酸和氢氧化钠可以发生中和反应,离子方程式为CH3COOH+OH-=CH3COO-+H2O;少量盐酸和碳酸钠反应生成碳酸氢钠,离子方程式为+H+=;
(3)①HI稀溶液为电解质溶液,加入可溶性电解质使胶体聚沉,所以会出现红褐色的氢氧化铁沉淀;
②之后氢氧化铁沉淀和HI发生中和反应,离子方程式为Fe(OH)3+3H+=Fe3++3H2O;
③Fe3+具有氧化性,可以将I-氧化成碘单质,离子方程式为2Fe3++2I-=2Fe2++I2;
(4)由于铁离子不能将氯离子氧化,所以沉淀溶解后颜色不会加深,所以能出现(3)中所述变化现象中的①②。
19. 还原 抗坏血酸 Fe+2HCl═FeCl2+H2↑
【详解】(1)Fe3+具有氧化性,与维生素C发生氧化还原反应,说明维生素C具有还原性,维生素C可用于防治坏血病,故答案为还原;抗坏血酸;
(2)胃酸的主要成分是盐酸,铁可以与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑,故答案为Fe+2HCl═FeCl2+H2↑。
20. 铁(或Fe) 浓度 还原性 阻止Fe2+被氧化 白色→灰绿色→红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【详解】(1)从表中可以看出,该儿童铁含量低于参考范围,所以缺乏铁(或Fe)元素。答案为:铁(或Fe);
(2)报告单中“μmol·L-1”是浓度的单位。答案为:浓度;
(3)Fe3+转化为Fe2+,体现氧化性,则在这个过程中体现维生素C的还原性。答案为:还原性;
(4)Fe2+具有较强的还原性,能被空气中的氧气氧化,则糖衣的主要作用是阻止Fe2+被氧化。答案为:阻止Fe2+被氧化;
(5) Fe(OH)2呈无色,Fe(OH)3呈红褐色,则氢氧化亚铁在空气中被氧化成氢氧化铁的实验现象为白色→灰绿色→红褐色,对应化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。答案为:白色→灰绿色→红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3。
21.(1) H+ HClO
(2)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(3) KMnO4
(4)Ca2++CO=CaCO3↓
(5)2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
【详解】(1)氯水是氯气溶于水得到的水溶液,氯水中有H+、Cl-、Cl2、HClO、H2O等多种微粒,将紫色石蕊试液滴入氯水中,溶液显红色起作用的微粒是H+;过一会儿,溶液颜色逐渐褪去,起作用的微粒是HClO;
(2)工业上用氯气与石灰乳反应来制取漂白粉,化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)根据化学反应,Mn元素的化合价由+7价降低到+2价,得电子发生还原反应,所以该反应中氧化剂为KMnO4,用双线桥法表示的电子转移情况如下:;
(4)漂粉精中有CaCl2和Ca(ClO)2,CaCl2与加入的Na2CO3反应生成白色沉淀,则反应的离子方程式为Ca2++CO=CaCO3↓;
(5)氯气具有强氧化性,能将Fe2+、Br-氧化成Fe3+、Br2,所以将过量氯气通入FeBr2溶液中反应的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列物质的转化在给定条件下能实现的是
A.
B.
C.
D.
2.下列物质与其用途完全符合的有
①Na2CO3—制玻璃 ②SiO2—制光导纤维
③AgBr—照相底片感光剂 ④NaCl—制纯碱
⑤Al2O3—焊接钢轨 ⑥NaClO—消毒剂
⑦Fe2O3—制红色油漆或涂料 ⑧MgO—制耐火材料
A.4个 B.5个 C.6个 D.7个
3.已知某校回收的含银悬浊废水中含有AgCl、Ag(NH3)2NO3、AgNO3、CH3COONH4、NaCl等,设计从废水中回收硝酸银的具体流程如下:
下列说法不正确的是
A.步骤Ⅱ中发生的主要反应的离子方程:3AgCl+Al+4OH-=3Ag+AlO2-+3Cl-+2H2O
B.实验中用铝粉代替铝片可以加快反应速率并简化实验操作
C.步骤Ⅲ中若先将Ag氧化为Ag2O,再加入稀硝酸反应有利于环保
D.操作Ⅰ包括蒸发浓缩、冷却结晶、过滤、洗涤等
4.四氧化三铁(Fe3O4)的组成可表示为FeO Fe2O3,下列关于Fe3O4的说法不正确的是
A.Fe3O4是一种混合物
B.FeO在空气中受热能迅速被氧化为Fe3O4
C.Fe3O4与盐酸反应的产物中有两种铁的价态
D.Fe3O4俗称磁性氧化铁,常用作磁性材料
5.下列离子方程式正确的是
A.金属铝溶于氢氧化钠溶液:Al+2OH- =AlO+H2↑
B.实验室制氯气:MnO2+4H++4Cl-MnCl2+Cl2↑+2H2O
C.CuSO4溶液与Ba(OH)2溶液反应:
D.BaCO3与盐酸反应:BaCO3+2H+ =Ba2++CO2↑+H2O
6.下列离子能大量共存的是
A.某弱碱溶液中:、、Na+、Cl-
B.与Al反应放出H2的溶液中: Fe2+、K+、、
C.c(Fe3+)= 1mol/L的溶液中:Na+、、 SCN-、
D.无色透明溶液中:K+、、Cl-、
7.化学在生活中有着广泛的应用,下列对应关系正确的是
选项 化学性质 实际应用
A Na具有强还原性 制备金属钾
B CO2不支持燃烧 扑灭Mg燃烧的火焰
C 铝的金属活动性强于氢 用铝制容器贮运浓硝酸
D FeCl3溶液能与Cu反应 蚀刻铜箔制造电路板
A.A B.B C.C D.D
8.化学与生产、生活、社会、环境密切相关,下列说法中正确的是
A.铝制容器不能盛放酸性或碱性食品,但可长期盛放腌制食品
B.明矾净水过程中只涉及了物理变化
C.向氢氧化铁胶体中滴加稀硫酸,开始有红褐色沉淀生成,最终沉淀会完全溶解
D.溶于水能导电,故是电解质
9.下列说法不正确的是
A.Fe在O2中燃烧生成四氧化三铁
B.Fe与Cl2发生反应生成氯化亚铁
C.Fe在潮湿的环境中易生锈
D.Fe在氧气中燃烧需要在集气瓶中放少量沙子,以免炸裂集气瓶
10.下列关于元素及其化合物的说法正确的是
A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸发生剧烈的反应
B.NaHCO3可用于制备纯碱,治疗胃酸过多的药剂、食品发酵剂
C.通过丁达尔效应可以鉴别豆浆和Fe(OH)3胶体
D.摩尔质量实际上就是该元素的相对原子质量
11.某工程师为了从使用过的腐蚀废液中回收铜,并将铁的化合物全部转化为FeCl3溶液作为腐蚀液原料循环使用,准备采用如图步骤,以下说法错误的是
A.腐蚀废液的成分是FeCl2、CuCl2和FeCl3
B.滤渣③的成分是Cu
C.④可以是稀盐酸,不能用稀硫酸
D.通入⑥时发生反应的离子方程式是:2Fe2++Cl2=2Fe3++2Cl-
12.某固体混合物可能由FeSO4、CuCl2、AlCl3、(NH4)2SO4、MgCl2、Al中的两种或多种组成,现对该混合物做如图实验,所得现象和有关数据如图所示(气体体积数据已换算成标准状况下的体积)。下列关于该固体混合物的说法错误的是
A.一定含有Al,其质量为2.7g
B.一定不含CuCl2和AlCl3
C.一定含FeSO4,其物质的量为0.1mol
D.一定含有MgCl2、FeSO4和(NH4)2SO4,且其物质的量相等
13.关于Fe3+、Fe2+性质实验的说法错误的是 ( )
A.用图示装置可以制备沉淀Fe(OH)2
B.配制FeCl3溶液时,先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度
C.因Fe2++2H2OFe(OH)2+2H+,向浅绿色的Fe(NO3)2溶液中逐滴加入稀盐酸时,溶液浅绿色加深
D.向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化
二、填空题
14.根据所学知识回答下列问题:
(1)如图甲所示,在平底烧瓶底部有一小块钠,剩余空间充有干燥的空气。过一段时间后可观察到银白色的钠变暗,发生反应的化学方程式为 。
(2)如图乙所示,先用弹簧夹夹住橡胶管,点燃钠(足量),迅速伸入瓶中并塞上瓶塞,发生反应的化学方程式为 ,产物的颜色是 。
(3)若图乙的广口瓶中是铁丝在纯氧中燃烧,会观察到铁丝剧烈燃烧,火星四射,所得产物的化学式是 。
15.化学与人类生活密切相关。请按要求回答下列问题:
(1)K2FeO4是一种重要的净水剂,可用下列方法制得:2Fe(OH)3+3Cl2+10KOH=2K2FeO4+6KCl+8H2O。在该反应中,还原剂是 ,当反应中有0.5molK2FeO4生成时,消耗Cl2在标况下的体积为 ,转移电子的数目为 。
(2)宇航员常用过氧化钠作供氧剂,写出过氧化钠与二氧化碳反应的化学方程式 。
(3)工业上制漂白粉的化学方程式为 ,新制氯水在阳光照射下产生无色气体,该反应的化学方程式是 。
(4)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔来制造印刷电路板。写出FeCl3溶液与铜发生反应的离子方程式: 。若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,下列结果不可能出现的是 。
A.有铜无铁 B.有铁无铜 C.铁、铜都有 D.铁、铜都无
16.某同学做“铝热反应”的实验。查阅资料知,Al、Al2O3、Fe、Fe2O3的熔、沸点数据如下:
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2054 1535 1462
沸点/℃ 2467 2980 2750 —
下列能与Al发生铝热反应的有 (填字母)。
A.MnO2 B.Na2O C.MgO D.FeO
17.写图示发生反应的化学方程式 。
18.Ⅰ.下表是生活、生产中常见的物质,表中列出了它们的一种主要成分(其他成分未列出)。
编号 ① ② ③ ④
名称 绿矾 醋 苏打 酒精
主要成分 FeSO4 CH3COOH Na2CO3 CH3CH2OH
编号 ⑤ ⑥ ⑦ ⑧
名称 铜导线 蔗糖 烧碱 铁锈
主要成分 Cu C12H22O11 NaOH Fe2O3
(1)请你对表中①~⑧的主要成分进行分类(填编号):属于盐的是 ,属于电解质的是 ,属于非电解质的是 。
(2)写出②与⑦反应的离子方程式: ,少量盐酸与③反应的离子方程式为 。
Ⅱ.在Fe(OH)3胶体中逐渐滴入HI稀溶液,会出现一系列变化:
(3)①先出现红褐色沉淀,原因是 。
②随后沉淀溶解,溶液呈黄色,此反应的离子方程式是
③最后溶液颜色加深,此反应的离子方程式是
(4)若用稀盐酸代替HI稀溶液,能出现(3)中所述变化现象中的 (填写上面各题序号)。
19.一个体重50kg的健康人,体内约含有2g铁,这2g铁在人体内不是以单质的形式存在,而是以Fe2+ 和Fe3+的形式存在。正二价铁离子易被吸收,给贫血者补充铁时,应给予含Fe2+的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的Fe3+还原成Fe2+,有利于人体吸收。
(1)维生素C在这一反应中具有 性;维生素C又称为 。
(2)市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐。此反应的离子方程式为 。
20.下图是某儿童微量元素体检报告单的部分数据:
大连市医疗机构临床检验结果报告单
分析项目 检测结果 单位 参考范围
1 锌(Zn) 115.92 μmol·L-1 66~120
2 铁(Fe) 6.95↓ mmol·L-1 7.52~11.82
4 钙(Ca) 1.68 mmol·L-1 1.55~2.10
… … … … …
根据上表的数据,回答下列问题。
(1)该儿童缺乏 元素。
(2)报告单中“μmol·L-1”是 (填“质量”“体积”或“浓度”)的单位。
(3)服用维生素C可使食物中的Fe3+转化为Fe2+,在这个过程中体现维生素C的 (填“氧化性”或“还原性”)。
(4)缺铁性贫血患者应补充Fe2+,一些补铁剂以硫酸亚铁为主要成分,将硫酸亚铁制成药片时外表包有一层特殊的糖衣,推测糖衣的主要作用是 。
(5)关于铁的氢氧化物有两种,请写出氢氧化亚铁在空气中被氧化成氢氧化铁的实验现象 ,对应化学反应方程式为
21.H7N9型禽流感是一种新型禽流感,研究表明,该病毒对热敏感,煮沸2分钟以上即可失去活性,许多常用消毒药物如:高锰酸钾、漂白粉、氯气等,也都可以将该病毒杀灭。
(1)新制氯水中含有多种微粒,将紫色石蕊试液滴入氯水中,溶液显红色起作用的微粒是 ;过一会儿,溶液颜色逐渐褪去,起作用的微粒是 。
(2)工业上制取漂白粉的反应方程式为: 。
(3)已知高锰酸钾与浓盐酸混合能产生氯气,化学反应方程式为:2KMnO4 +16HCl 2MnCl2+2KCl+8H2O+5Cl2↑
该反应中氧化剂为 。请用双线桥法表示电子转移的情况。
(4)向漂白粉清液中滴加碳酸钠溶液,有白色沉淀生成,写出发生反应的离子方程式 。
(5)将过量氯气通入FeBr2溶液中,写出该反应的离子方程式 。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.B
【详解】A.NH3催化氧化只能生成NO,氨的催化氧化温度在780~840℃,二氧化氮在150℃以上开始分解,到650℃完全分解为一氧化氮和氧气,所以氨的催化氧化过程中无法生成NO2,A错误;
B.Al与NaOH溶液反应生成NaAlO2和H2,NaAlO2溶液蒸发结晶,可获得NaAlO2晶体,B正确;
C.Fe在高温条件下与水蒸气反应,生成Fe3O4和H2,C错误;
D.乙烯与水的加成反应是在高温高压催化剂条件下生成乙醇,D错误。
故选B。
2.D
【详解】①碳酸钠和二氧化硅在高温条件下反应制取玻璃,①符合;②高纯度的二氧化硅用来做制光导纤维,②符合;③溴化银有感光性,可用于照相底片感光剂,③符合;④饱和氯化钠溶液、氨气和二氧化碳反应生成碳酸氢钠,碳酸氢钠再受热分解得到碳酸钠,④符合;⑤铝和氧化铁能发生铝热反应用于焊接钢轨,⑤不符合;⑥次氯酸钠有强氧化性,可以做消毒剂,漂白织物,⑥符合;⑦氧化铁为红棕色固体,可以做红色油漆或涂料,⑦符合;⑧氧化镁熔点较高,可以做耐火材料,⑧符合;符合的有①②③④⑥⑦⑧,故D正确;
答案选D。
3.B
【分析】含银悬浊废水中含有AgCl、Ag(NH3)2NO3、AgNO3、CH3COONH4、NaCl等,加入盐酸后生成氯化银沉淀,过滤后,滤渣的主要成分是氯化银,在氯化银中加入铝片、氢氧化钠溶液后置换出银,然后用硝酸溶解得到硝酸银溶液,经过蒸发浓缩、冷却结晶、过滤、洗涤得到硝酸银晶体,据此分析解答。
【详解】A、步骤Ⅱ中主要发生铝、氢氧化钠溶液与氯化银的置换反应,发生的主要反应的离子方程式为:3AgCl+Al+4OH-=3Ag+AlO2-+3Cl-+2H2O,故A正确;
B、若实验中用铝粉代替铝片可以加快反应速率,但置换出的银中混入了铝粉,还需要分离提纯,没有简化实验操作,故B错误;
C、银与稀硝酸反应会生成NO,污染环境,若先将Ag氧化为Ag2O,再加入稀硝酸反应,可以防止NO的生成,有利于环保,故C正确;
D、操作Ⅰ是从硝酸银溶液中获得硝酸银晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤等,故D正确;
故选B。
4.A
【详解】A. Fe3O4是一种铁的氧化物,属于纯净物,A错误;
B.+2价铁具有较强还原性、容易被氧化, FeO在空气中受热能迅速被氧化为Fe3O4,B正确;
C. Fe3O4中铁元素呈+2、+3价,与盐酸反应得到氯化亚铁、氯化铁,则产物中有两种铁的价态,C正确;
D. Fe3O4具有铁磁性,俗称磁性氧化铁,常用作磁性材料,D正确;
答案选A。
5.D
【详解】A.铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,发生反应的离子方程式为2Al+2OH– +2H2O = 2AlO+3H2↑,A错误;
B.实验室用二氧化锰与浓盐酸加热制氯气,发生反应的离子方程式为MnO2+4H++2Cl-Mn2++Cl2↑+2H2O,B选项MnCl2为可溶性盐,应拆成离子形式,B错误;
C.CuSO4溶液与Ba(OH)2溶液反应生成硫酸钡沉淀和氢氧化铜沉淀,离子方程式为Cu2+++Ba2++2OH– = BaSO4↓+Cu(OH)2↓,C错误;
D.盐酸为强酸,碳酸为弱酸,BaCO3与盐酸反应生成二氧化碳和水且BaCO3为难溶盐不拆,故D正确。
6.A
【详解】A.某弱碱溶液中:、、Na+、Cl-在溶液中不发生化学反应,可以大量共存,故A符合题意;
B.与Al反应放出H2的溶液中:可能为酸性溶液或碱性溶液,若为酸性溶液,存在 与铝反应形成氮的氧化物,不释放氢气,且酸性条件下和Fe2+之间发生氧化还原反应,若为碱性溶液,Fe2+在碱性条件下会发生反应生成氢氧化亚铁沉淀,再被空气氧化成氢氧化铁沉淀,故不能大量共存,故B不符合题意;
C.c(Fe3+)=1mol/L的溶液中:Fe3+和会发生反应生成络合物,不能大量共存,故C不符合题意;
D.是蓝色,不能存在于无色透明溶液中:不能大量共存, 故D不符合题意;
答案选A。
7.D
【详解】A.钾比钠活泼,所以钠不能制备金属钾,故A错误;
B.CO2可以与金属镁反应生成氧化镁和碳,所以CO2不能扑灭Mg燃烧的火焰,故B错误;
C.在常温下,铝在浓硝酸中钝化,所以可用铝制容器贮运浓硝酸,故C错误;
D. FeCl3溶液能与Cu反应,所以可用于蚀刻铜箔制造电路板,故D正确。
故选D。
8.C
【详解】A.金属铝既能和酸反应又能和碱反应,不能盛放酸性或碱性食品,也不能长期盛放腌制食品,里面有氯化钠,会形对铝制容器进行腐蚀,故A错误;
B.明矾水解生成氢氧化铝胶体,胶体具有吸附性而吸附水中的杂质,该过程涉及了化学变化,故B错误;
C.盐酸是电解质溶液,氢氧化铁胶体遇到盐酸,胶体发生聚沉,生成氢氧化铁沉淀;再滴加盐酸,氢氧化铁沉淀与盐酸反应生成氯化铁,故C选项正确;
D.溶于水能导电是因为氨气与水反应生成一水合氨电解质,一水合氨电离产生自由移动的离子,氨气本身不能电离产生自由移动的离子,所以不是电解质,故D错误。
故选C选项。
9.B
【详解】A.Fe在O2中燃烧生成黑色四氧化三铁,故A正确;
B.点燃条件下,Fe与Cl2发生反应生成氯化铁,故B错误;
C.Fe在潮湿的环境中与氧气、水接触易生锈,故C正确;
D.Fe在氧气中燃烧生成Fe3O4,并放出大量的热,需要在集气瓶中放少量沙子,以免生成物熔化后溅落炸裂集气瓶,故D正确;
选B。
10.B
【详解】A. Fe在常温下可与浓硝酸、浓硫酸发生钝化,故A错误;
B. NaHCO3具有不稳定性, NaHCO3可用于制备纯碱, NaHCO3能与HCl反应,可用于作治疗胃酸过多的药剂、食品发酵剂,故B正确;
C. 通过丁达尔效应无法鉴别豆浆和Fe(OH)3胶体,两者都有丁达尔现象,故C错误;
D. 摩尔质量以g·mol-1作单位时,数值上等于该元素的相对原子质量,故D错误;
故选B。
11.B
【分析】由流程可知,腐蚀废液中含有氯化铜、氯化亚铁,加入过量①为Fe,与氯化铜反应生成金属铜和氯化亚铁,经过滤所得滤液②含氯化亚铁,滤渣③是金属铜和过量的铁,铜不能盐酸反应,而金属铁可以,加入过量④为盐酸可以将铜分离,得到的滤液⑤为氯化亚铁,滤液合并后通入氯气,能将亚铁离子氧化生成氯化铁,以此解答该题。
【详解】A.Cu与氯化铁反应得到腐蚀废液的成分是FeCl2、CuCl2和FeCl3,故A正确;
B.由上述分析可知,滤渣③含Cu、Fe,故B错误;
C.最终得到氯化铁,则④可以是稀盐酸,不能用稀硫酸,故C正确;
D.通入⑥时氯气氧化亚铁离子,发生反应的离子方程式是:2Fe2++Cl2═2Fe3++2Cl ,故D正确;
故选:B。
12.C
【分析】21.65g固体加入过量的氢氧化钠溶液中产生气体,可以是铵盐和碱反应生成氨气,也可以是金属铝与氢氧化钠溶液反应生成氢气,5.60L(0.25mol)气体通过碱石灰无变化,说明气体中没有能与碱石灰反应的气体,且无水蒸气的存在,通过浓硫酸,气体剩余3.36L,体积减少5.60L-3.36L=2.24L,结合混合物可能存在的物质可知,一定含有硫酸铵(0.05mol,质量为6.6g),与氢氧化钠反应生成的氨气为2.24L,剩余的气体只能是氢气,其体积为3.36L,说明原混合物中一定含有铝(0.1mol,质量为2.7g);21.65g固体加入过量的氢氧化钠溶液中产生白色沉淀7.4g,久置变红色且质量增大0.85g,增大的质量相当于的质量,由于氢氧化铝溶于强碱,氢氧化铜为蓝色沉淀,所以生成的白色沉淀中一定含有和,白色沉淀久置于空气中,,故的物质的量为0.05mol,质量为4.5g,的质量为2.9g.物质的量为0.05mol,故原混合物中的物质的量为0.05mol、质量为7.6g,的物质的量为0.05mol,质量为4.75g;
【详解】A.根据以上分析原混合物中没有和,原混合物中一定含有Al,其质量为2.7g,故A正确;
B.根据以上分析原混合物中没有和,B正确;
C.根据已知条件中白色沉淀由白色变为红色判断原混合物中一定含有,根据原子守恒得物质的量为0.05mol,故C错误;
D.根据以上分析原混合物中含有、和,且其物质的量相等,D正确。
【点睛】此题考查物质混合物的含量测定;注意根据元素守恒进行计算。
13.C
【详解】A.由图可知,A中发生Fe与稀硫酸的反应生成硫酸亚铁和氢气,利用氢气将装置中的空气排出,然后关闭C,氢气将硫酸亚铁压入B中,硫酸亚铁与NaOH反应生成Fe(OH)2,故用图示装置可以制备沉淀Fe(OH)2,A项正确;
B.FeCl3易水解,配制FeCl3溶液时应防止FeCl3因水解生成氢氧化铁沉淀,可先将氯化铁晶体溶于较浓的盐酸中,再加水稀释到所需要的浓度,B项正确;
C.Fe(NO3)2溶液中加入盐酸时发生反应:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,有棕黄色的Fe3+生成,溶液颜色由浅绿色变成棕黄色,C项错误;
D.Fe3+与铁反应可生成Fe2+,则向FeCl2溶液中加入少量铁粉是为了防止Fe2+被氧化,D项正确;
答案选C。
【点睛】C选项:因为NO3-(H+)具有氧化性,可将Fe2+氧化为Fe3+,应考虑发生的氧化还原反应,不能直接从平衡的移动方面去考虑。
14. 淡黄色 Fe3O4
【详解】(1) 钠在常温下即可与氧气反应生成氧化钠,致使钠表面变暗,氧气消耗,瓶内压强减小,气球膨胀,化学反应方程式为:,故答案为:;
(2) 钠在加热条件下与氧气反应生成过氧化钠,化学反应方程式为:,产物为淡黄色;故答案为:;淡黄色;
(3)铁在氧气中燃烧生成的产物为Fe3O4;故答案为:Fe3O4。
15. Fe(OH)3 16.8L 1.5NA 2Na2O2+2CO2=2Na2CO3+O2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 2HClO2HCl+O2↑ Cu+2Fe3+=2Fe2++Cu2+ B
【详解】(1)由反应方程式可知,反应中铁元素的化合价升高被氧化,氢氧化铁是反应的还原剂,当反应中有0.5mol高铁酸钾生成时,消耗标准状况下氯气的体积为0.5mol××22.4L/mol=16.8L,反应转移电子数目为0.5mol×3×NAmol—1=1.5NA,故答案为:Fe(OH)3;16.8L;1.5NA;
(2)过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2,故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)工业上制漂白粉的反应为氯气与石灰乳反应生成氯化钙、次氯酸钙和水,反应的化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;次氯酸遇光发生分解反应生成盐酸和氧气,反应的化学方程式为2HClO2HCl+O2↑,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;2HClO2HCl+O2↑;
(4)氯化铁溶液与铜反应生成氯化亚铁和氯化铜,反应的离子方程式为Cu+2Fe3+=2Fe2++Cu2+;若向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,铁比铜活泼,溶液中铁先发生反应Fe+2Fe3+=3Fe2+,若FeCl3溶液过量,则铜与氯化铁溶液发生反应Cu+2Fe3+=2Fe2++Cu2+;
A.由分析可知,若铜过量,剩余固体中可能会有铜无铁,故不符合题意;
B.由分析可知,铁先参与反应,若氯化铁溶液过量,铜会参与反应,因此不可能出现有铁无铜的结果,故符合题意;
C.由分析可知,假如铁过量,则会出现铁和铜同时存在的结果,故不符合题意;
D.假如氯化铁溶液与铁和铜完全反应,铜和铁均无剩余,故不符合题意;
故选B,故答案为:Cu+2Fe3+=2Fe2++Cu2+;B。
16.AD
【详解】若铝热反应能够进行,制取的金属的还原性需比金属铝还原性弱,金属Na、Mg还原性均强于Al,所以无法通过铝热反应得到,即Na2O、MgO不能和Al发生铝热反应,故答案为:AD。
17.
【详解】从提炼金属的角度而言,铝热反应的优点是作用时间短,放出大量热,因此,作为一种便携的熔融态热源,铝热剂非常适合在焊接钢轨等场合应用。在实验室,可用如图所示装置,使铝粉与氧化铁粉末发生铝热反应,点燃镁条引发反应,整个过程可观察到的现象有:镁条剧烈燃烧,发出耀眼的白光,Fe2O3和铝粉剧烈反应放出大量的热,纸漏斗的下部被炸穿,有熔融物落入沙中,发生反应的化学方程式。
18. ①③ ①②③⑦⑧ ④⑥ CH3COOH+OH-=CH3COO-+H2O +H+= 加入可溶性电解质使胶体聚沉 Fe(OH)3+3H+=Fe3++3H2O 2Fe3++2I-=2Fe2++I2 ①②
【详解】(1)盐类是由酸根阴离子和金属阳离子(或铵根)构成的化合物,①FeSO4、③Na2CO3属于盐类;在水溶液中或熔融状态下可以导电的化合物为电解质,①FeSO4、②CH3COOH、③Na2CO3、⑦NaOH、⑧Fe2O3属于电解质;在水溶液中和熔融状态下都不能导电的化合物为非电解质,④CH3CH2OH、⑥C12H22O11属于非电解质;
(2)醋酸和氢氧化钠可以发生中和反应,离子方程式为CH3COOH+OH-=CH3COO-+H2O;少量盐酸和碳酸钠反应生成碳酸氢钠,离子方程式为+H+=;
(3)①HI稀溶液为电解质溶液,加入可溶性电解质使胶体聚沉,所以会出现红褐色的氢氧化铁沉淀;
②之后氢氧化铁沉淀和HI发生中和反应,离子方程式为Fe(OH)3+3H+=Fe3++3H2O;
③Fe3+具有氧化性,可以将I-氧化成碘单质,离子方程式为2Fe3++2I-=2Fe2++I2;
(4)由于铁离子不能将氯离子氧化,所以沉淀溶解后颜色不会加深,所以能出现(3)中所述变化现象中的①②。
19. 还原 抗坏血酸 Fe+2HCl═FeCl2+H2↑
【详解】(1)Fe3+具有氧化性,与维生素C发生氧化还原反应,说明维生素C具有还原性,维生素C可用于防治坏血病,故答案为还原;抗坏血酸;
(2)胃酸的主要成分是盐酸,铁可以与盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑,故答案为Fe+2HCl═FeCl2+H2↑。
20. 铁(或Fe) 浓度 还原性 阻止Fe2+被氧化 白色→灰绿色→红褐色 4Fe(OH)2+O2+2H2O=4Fe(OH)3
【详解】(1)从表中可以看出,该儿童铁含量低于参考范围,所以缺乏铁(或Fe)元素。答案为:铁(或Fe);
(2)报告单中“μmol·L-1”是浓度的单位。答案为:浓度;
(3)Fe3+转化为Fe2+,体现氧化性,则在这个过程中体现维生素C的还原性。答案为:还原性;
(4)Fe2+具有较强的还原性,能被空气中的氧气氧化,则糖衣的主要作用是阻止Fe2+被氧化。答案为:阻止Fe2+被氧化;
(5) Fe(OH)2呈无色,Fe(OH)3呈红褐色,则氢氧化亚铁在空气中被氧化成氢氧化铁的实验现象为白色→灰绿色→红褐色,对应化学反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3。答案为:白色→灰绿色→红褐色;4Fe(OH)2+O2+2H2O=4Fe(OH)3。
21.(1) H+ HClO
(2)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(3) KMnO4
(4)Ca2++CO=CaCO3↓
(5)2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
【详解】(1)氯水是氯气溶于水得到的水溶液,氯水中有H+、Cl-、Cl2、HClO、H2O等多种微粒,将紫色石蕊试液滴入氯水中,溶液显红色起作用的微粒是H+;过一会儿,溶液颜色逐渐褪去,起作用的微粒是HClO;
(2)工业上用氯气与石灰乳反应来制取漂白粉,化学方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(3)根据化学反应,Mn元素的化合价由+7价降低到+2价,得电子发生还原反应,所以该反应中氧化剂为KMnO4,用双线桥法表示的电子转移情况如下:;
(4)漂粉精中有CaCl2和Ca(ClO)2,CaCl2与加入的Na2CO3反应生成白色沉淀,则反应的离子方程式为Ca2++CO=CaCO3↓;
(5)氯气具有强氧化性,能将Fe2+、Br-氧化成Fe3+、Br2,所以将过量氯气通入FeBr2溶液中反应的离子方程式为2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-。
答案第1页,共2页
答案第1页,共2页
