粤教版九下化学第六章 金 属第4节《珍惜和保护金属资源》参考课件(共19张PPT)
文档属性
| 名称 | 粤教版九下化学第六章 金 属第4节《珍惜和保护金属资源》参考课件(共19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 710.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-06-27 00:00:00 | ||
图片预览





文档简介
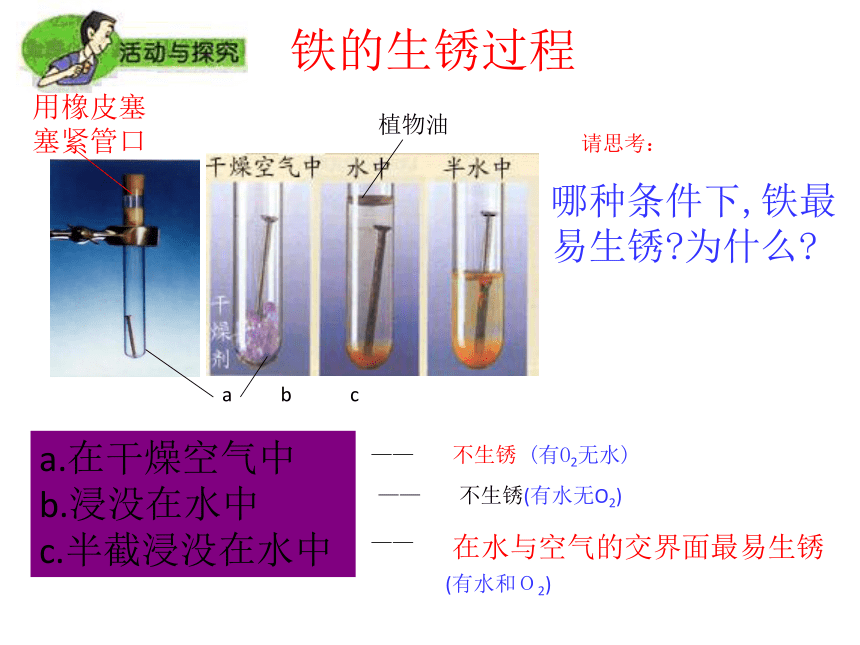
课件19张PPT。课题4 珍惜和保护金属资源为什么要保护金属资源?金属资源保护保护金属资源的原因:⑴每年大量开采(数以亿吨计)⑵每年大量的金属被腐蚀(相当于年产量的20%~40%)1.金属的腐蚀和防护人们采取了许多措施,但每年全世界因生锈而损失的钢铁约 占世界年产量的四分之一!如何防锈?——a.在干燥空气中
b.浸没在水中
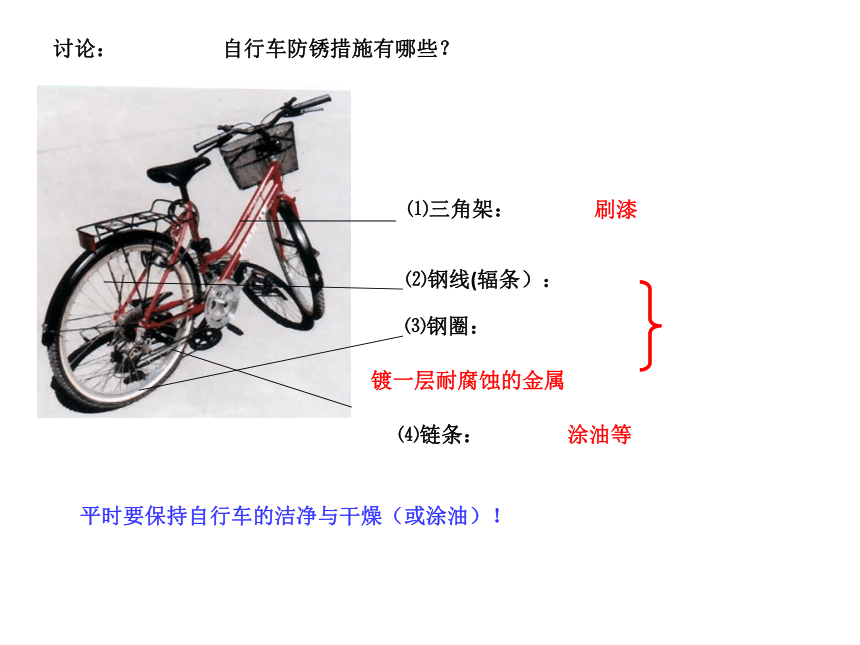
c.半截浸没在水中铁的生锈过程哪种条件下,铁最易生锈?为什么?不生锈(有水无O2) 不生锈 (有O2无水)在水与空气的交界面最易生锈 ————植物油 a b c请思考:用橡皮塞塞紧管口(有水和O2)铁与空气中的氧气、水蒸气发生化学反应。铁锈的成份很复杂,主要为氧化铁Fe2O3 · XH2O。(Fe2O3 · XH2O很疏松,易吸水,不能阻碍里层的铁继续与氧气、水蒸气反应,如不及时除去,会加快铁制品的生锈,使铁全部被腐蚀。而铝不同,铝与氧气反应生成致密的Al2O3薄膜,覆盖在铝的表面,从而保护里层的铝不再与氧气反应,所以铝耐腐蚀。)铁生锈的条件:⑴要有能够发生反应的物质(Fe、H2O、O2);铁制品锈蚀的条件:⑵反应物要能相互接触;⑶生成物不会对反应起阻碍作用。4Fe+3O2+2XH2O=2Fe2O3 · XH2O (缓慢氧化)防止铁生锈的方法(破坏铁生锈的条件即可):1.保持铁制品表面的洁净和干燥。 2.在铁制品表面涂油、刷漆、搪瓷、镀上 耐腐蚀的金属、烤蓝(即表面生成致密的氧化膜保护层),使铁制品与空气隔绝。 3.制成耐腐蚀的合金,如不锈钢,就是在钢中加入一点镍和铬而制成的合金。⑴三角架:⑵钢线(辐条):⑷链条:刷漆镀一层耐腐蚀的金属涂油等平时要保持自行车的洁净与干燥(或涂油)!自行车防锈措施有哪些?讨论:⑶钢圈:图8-25 据估计一些矿物可供开采的年限2.金属资源保护⑴为什么要保护金属资源?矿物的储量是有限的,而且不能再生。2、怎样保护金属资源呢? ⑴防止金属的腐蚀。⑵金属的回收与利用。 ⑶有计划,合理地开采矿物,严禁不顾国家利益的乱采矿。⑷寻找金属代用品。如以塑代钢。图8-26 金属的回收利用 回收一个铝制的易拉罐比制造一个新的铝制的易拉罐要便宜20%,而且还可以节约金属资源和95%能源。目前世界上有50%以上的铁和90%以上的金得到回收利用。反馈练习 1.在下列情况下,埋在地下的铸铁管道腐蚀最快的是 ( )
A.在潮湿、致密的土壤中
B.在干燥、致密的土壤中
C.在潮湿、疏松的土壤中
D.在干燥、疏松的土壤中 2.某运输用铁船,在水中行驶,最易生锈的部位是( )CBA.水面上的船头部分
B.水面附近的船体部分
C.水面下的船底部分
D.各部分都一样速度生锈3.日常生活中的一些铁制品经常会被锈蚀。
下列做法中不能起防锈作用的是( )
①在铁制品表面镀锌
②在铁制品表面涂油脂
③保留铁件表面的铁锈作保护层
④在铁器表面刷油漆
⑤自行车脏了用清水冲洗
⑥用废酸液冲洗铁制污水管道
⑦切完咸菜后,尽快将菜刀洗净擦干
A.②⑤ B.③⑤⑥
C.①③⑦ D.②⑥⑦ B 4.全世界每年因生锈损失的钢铁约占世界
钢铁年产量的1/4。某学生想探究铁生锈的条件,他将
干净的铁钉分别同时入放A、B、C三支试管中进行研究。
⑴请你帮助该学生完成下列实验设计的内容:加热烘干试管,小心放入铁钉,塞上塞子 探究铁在有水而无空气
(氧气)时的生锈情况小心放入铁钉,注入蒸馏水,使铁钉部分浸入水中 ⑵一周后,编号为________的试管中的铁钉最易生锈。
⑶用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在南方比安装在北方更易生锈,其原因是
___________________________________。C南方比北方天气潮湿,铁更易生锈铁在干燥空气中铁在有水而无空气(氧气)时铁在有空气和水时4.某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。实验数据如下表:
请你认真分析数据,回答下列问题:
⑴哪位同学所取用的稀硫酸与铁样品恰好完全反应;
⑵计算样品中铁的质量分数;
⑶若生产1000 t这种纯度的铁,至少需要含氧化铁(Fe2O3)80%的赤铁矿多少吨? 改正:(烧杯的质量为25.4g;计算结果精确到0.1%) 解:⑴分析表中数据可知,甲、乙、丙三人的实验生成气的质量都是0.3g(如甲为200g+9g-208.7g=0.3g),即各人的实验中都有一种反应物完全反应。由甲、乙数据可知,9g铁样品中的铁完全反应,甲中的酸过量。由乙、丙数据可知,(150g- 25.4g)=124.6g的稀硫酸中的H2SO4完全反应,丙中的金属过量。综合分析可知乙同学所取用的稀硫酸与铁样品恰好完全反应。解:⑵乙反应生成氢气的质量为150g+9g-158.7g=0.3g。
设Fe的质量为X。
Fe + H2SO4 = FeSO4 + H2↑
2
X 0.3g⑵计算样品中铁的质量分数;答:样品中铁的质量分数为93.3%。⑶若生产1000 t这种纯度的铁,至少需要含氧化铁(Fe2O3)80%的赤铁矿多少吨?解:⑶需要含氧化铁80%的赤铁矿的质量为Y。
1000 t这种纯度的铁含纯铁的质量为1000t×93.3%=930t。160 112
Y×80% 930t160:112=Y×80%: 930t Y=1666.1t答:生产1000 t这种纯度的铁,至少需要含氧化铁(Fe2O3)80%的赤铁矿为1666.1t。 1.把铁矿石冶炼成铁是一个复杂的过程,其主要反应原理是在高温条件下CO作还原剂,夺取铁矿石里的氧,将铁还原出来。 2.在实际生产时,所用的原料或产物一般都含有杂质,在计算用料时和产量时,应考虑到杂质问题。 3.铁生锈的条件是铁与空气中的氧气、水(或水蒸气)直接接触,如果隔绝了空气和水,就能在一定程度上防止钢铁生锈。在铁表面涂油、刷漆、镀上耐磨和 耐腐蚀的铬及制造耐腐蚀的合金,如不锈钢等,就能防止钢铁生锈。 4. 保护金属资源的有效途径是防止金属的腐蚀、回收与利用废旧金属、合理有效地地开采矿物,以及寻找金属代用品等。列比例时,一定要用纯量。m(纯) = m(不纯 )×纯度4Fe+3O2+2XH2O=2Fe2O3 · XH2O
b.浸没在水中
c.半截浸没在水中铁的生锈过程哪种条件下,铁最易生锈?为什么?不生锈(有水无O2) 不生锈 (有O2无水)在水与空气的交界面最易生锈 ————植物油 a b c请思考:用橡皮塞塞紧管口(有水和O2)铁与空气中的氧气、水蒸气发生化学反应。铁锈的成份很复杂,主要为氧化铁Fe2O3 · XH2O。(Fe2O3 · XH2O很疏松,易吸水,不能阻碍里层的铁继续与氧气、水蒸气反应,如不及时除去,会加快铁制品的生锈,使铁全部被腐蚀。而铝不同,铝与氧气反应生成致密的Al2O3薄膜,覆盖在铝的表面,从而保护里层的铝不再与氧气反应,所以铝耐腐蚀。)铁生锈的条件:⑴要有能够发生反应的物质(Fe、H2O、O2);铁制品锈蚀的条件:⑵反应物要能相互接触;⑶生成物不会对反应起阻碍作用。4Fe+3O2+2XH2O=2Fe2O3 · XH2O (缓慢氧化)防止铁生锈的方法(破坏铁生锈的条件即可):1.保持铁制品表面的洁净和干燥。 2.在铁制品表面涂油、刷漆、搪瓷、镀上 耐腐蚀的金属、烤蓝(即表面生成致密的氧化膜保护层),使铁制品与空气隔绝。 3.制成耐腐蚀的合金,如不锈钢,就是在钢中加入一点镍和铬而制成的合金。⑴三角架:⑵钢线(辐条):⑷链条:刷漆镀一层耐腐蚀的金属涂油等平时要保持自行车的洁净与干燥(或涂油)!自行车防锈措施有哪些?讨论:⑶钢圈:图8-25 据估计一些矿物可供开采的年限2.金属资源保护⑴为什么要保护金属资源?矿物的储量是有限的,而且不能再生。2、怎样保护金属资源呢? ⑴防止金属的腐蚀。⑵金属的回收与利用。 ⑶有计划,合理地开采矿物,严禁不顾国家利益的乱采矿。⑷寻找金属代用品。如以塑代钢。图8-26 金属的回收利用 回收一个铝制的易拉罐比制造一个新的铝制的易拉罐要便宜20%,而且还可以节约金属资源和95%能源。目前世界上有50%以上的铁和90%以上的金得到回收利用。反馈练习 1.在下列情况下,埋在地下的铸铁管道腐蚀最快的是 ( )
A.在潮湿、致密的土壤中
B.在干燥、致密的土壤中
C.在潮湿、疏松的土壤中
D.在干燥、疏松的土壤中 2.某运输用铁船,在水中行驶,最易生锈的部位是( )CBA.水面上的船头部分
B.水面附近的船体部分
C.水面下的船底部分
D.各部分都一样速度生锈3.日常生活中的一些铁制品经常会被锈蚀。
下列做法中不能起防锈作用的是( )
①在铁制品表面镀锌
②在铁制品表面涂油脂
③保留铁件表面的铁锈作保护层
④在铁器表面刷油漆
⑤自行车脏了用清水冲洗
⑥用废酸液冲洗铁制污水管道
⑦切完咸菜后,尽快将菜刀洗净擦干
A.②⑤ B.③⑤⑥
C.①③⑦ D.②⑥⑦ B 4.全世界每年因生锈损失的钢铁约占世界
钢铁年产量的1/4。某学生想探究铁生锈的条件,他将
干净的铁钉分别同时入放A、B、C三支试管中进行研究。
⑴请你帮助该学生完成下列实验设计的内容:加热烘干试管,小心放入铁钉,塞上塞子 探究铁在有水而无空气
(氧气)时的生锈情况小心放入铁钉,注入蒸馏水,使铁钉部分浸入水中 ⑵一周后,编号为________的试管中的铁钉最易生锈。
⑶用相同材料制作,经过相同时间防锈处理的铁栏杆,安装在南方比安装在北方更易生锈,其原因是
___________________________________。C南方比北方天气潮湿,铁更易生锈铁在干燥空气中铁在有水而无空气(氧气)时铁在有空气和水时4.某课外兴趣小组对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所取用的稀硫酸与铁样品恰好完全反应。实验数据如下表:
请你认真分析数据,回答下列问题:
⑴哪位同学所取用的稀硫酸与铁样品恰好完全反应;
⑵计算样品中铁的质量分数;
⑶若生产1000 t这种纯度的铁,至少需要含氧化铁(Fe2O3)80%的赤铁矿多少吨? 改正:(烧杯的质量为25.4g;计算结果精确到0.1%) 解:⑴分析表中数据可知,甲、乙、丙三人的实验生成气的质量都是0.3g(如甲为200g+9g-208.7g=0.3g),即各人的实验中都有一种反应物完全反应。由甲、乙数据可知,9g铁样品中的铁完全反应,甲中的酸过量。由乙、丙数据可知,(150g- 25.4g)=124.6g的稀硫酸中的H2SO4完全反应,丙中的金属过量。综合分析可知乙同学所取用的稀硫酸与铁样品恰好完全反应。解:⑵乙反应生成氢气的质量为150g+9g-158.7g=0.3g。
设Fe的质量为X。
Fe + H2SO4 = FeSO4 + H2↑
2
X 0.3g⑵计算样品中铁的质量分数;答:样品中铁的质量分数为93.3%。⑶若生产1000 t这种纯度的铁,至少需要含氧化铁(Fe2O3)80%的赤铁矿多少吨?解:⑶需要含氧化铁80%的赤铁矿的质量为Y。
1000 t这种纯度的铁含纯铁的质量为1000t×93.3%=930t。160 112
Y×80% 930t160:112=Y×80%: 930t Y=1666.1t答:生产1000 t这种纯度的铁,至少需要含氧化铁(Fe2O3)80%的赤铁矿为1666.1t。 1.把铁矿石冶炼成铁是一个复杂的过程,其主要反应原理是在高温条件下CO作还原剂,夺取铁矿石里的氧,将铁还原出来。 2.在实际生产时,所用的原料或产物一般都含有杂质,在计算用料时和产量时,应考虑到杂质问题。 3.铁生锈的条件是铁与空气中的氧气、水(或水蒸气)直接接触,如果隔绝了空气和水,就能在一定程度上防止钢铁生锈。在铁表面涂油、刷漆、镀上耐磨和 耐腐蚀的铬及制造耐腐蚀的合金,如不锈钢等,就能防止钢铁生锈。 4. 保护金属资源的有效途径是防止金属的腐蚀、回收与利用废旧金属、合理有效地地开采矿物,以及寻找金属代用品等。列比例时,一定要用纯量。m(纯) = m(不纯 )×纯度4Fe+3O2+2XH2O=2Fe2O3 · XH2O
