第八章常见的酸、碱、盐复习题(含解析) 2023-2024学年科粤版(2012)九年级化学下册
文档属性
| 名称 | 第八章常见的酸、碱、盐复习题(含解析) 2023-2024学年科粤版(2012)九年级化学下册 |  | |
| 格式 | docx | ||
| 文件大小 | 164.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 科粤版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 19:30:21 | ||
图片预览




文档简介
第八章 常见的酸、碱、盐 复习题
一、单选题
1.类比推理是化学学习中常用的思维方式。下列推理正确的是( )
A.CaO与水反应生成Ca(OH)2,同理Na2O与水反应生成NaOH
B.室温下,pH<7的溶液是酸性,同理pH<7的雨水是酸雨
C.单质中只含有一种元素,所以含一种元素的物质一定是单质
D.碳酸盐与盐酸反应会产生气体,所以与盐酸反应生成气体的物质一定是碳酸盐
2.如图所示,甲、乙、丙、丁、戊五种物质分别是铁、盐酸、氢氧化钙、硫酸铜、碳酸钠中的一种。连线两端的物质间能发生化学反应,乙与戊之间发生中和反应,丙溶液为蓝色。
下列能替代图中丁物质的是
A.Ag B.NaOH C.BaCl2 D.CuO
3.向某氯化钡溶液中加入一定质量的硫酸溶液,二者恰好完全反应,过滤,所得溶液的质量与原氯化钡溶液的质量相等。则所加硫酸溶液中溶质质量分数的计算式为( )
A.×100% B.×100% C.×100% D.×100%
4.下列做法符合安全要求的是
A.加油站、面粉加工厂严禁烟火
B.稀释浓硫酸时将水缓缓倒入浓硫酸中,并不断搅拌
C.直接将鼻孔凑到试剂瓶口闻药品的气味
D.氢氧化钠不慎洁到皮肤上,立即用硫酸清洗
5.“安全教育,时刻牢记”。我们无论在生活还是在实验中,都要注意安全,而安全离不开化学。下列说法正确的是
A.室内着火,立即打开所有门窗通风
B.燃气泄漏时,应立即关闭阀门,再开窗通风
C.浓硫酸滴到手上时,要立即用大量水冲洗,再涂上氢氧化钠溶液
D.酒精洒到桌上着火了,立即用水浇灭
6.下列有关化学实验操作或现象记录中正确的是
A.化学兴趣小组使用pH试纸测得某次酸雨的pH为4.8
B.向10g98%的浓硫酸中注入90g蒸馏水,并不断搅拌,可以配制成100g9.8%的稀硫酸
C.观察到铁丝在氧气中剧烈燃烧、生成四氧化三铁
D.硫粉在空气中燃烧产生微弱的淡蓝色火焰
7.物质的性质决定用途,下列有关性质与用途对应关系的说法不正确的是
A.氮气化学性质不活泼,可用于生产氮肥
B.熟石灰具有碱性,可用于改良酸性土壤
C.活性炭有吸附性,可用于制糖工业脱色
D.洗洁精具有乳化作用,可用于除油污
8.除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是
A.氮气(氧气)——通过灼热的氧化铜
B.KCl固体(MnO2)——加足量水溶解、过滤、蒸发结晶
C.NaCl溶液(Na2CO3)——加入适量CaCl2溶液,过滤
D.FeCl2溶液(CuCl2)——加过量的铁粉,过滤
9.一包混有杂质的Na2CO3,其杂质可能是Ba(NO3)2、KCl、NaHCO3的一种或几种。取10.6g样品,溶于水得澄清溶液;另取10.6 g样品,加入足量的盐酸,收集到4 g CO2,则下列判断正确的是
A.样品中只混有KCl
B.样品中有NaHCO3,也有Ba(NO3)2
C.样品中一定混有KCl,可能有NaHCO3
D.样品中一定混有NaHCO3,可能有KCl
10.宏观辨识与微观探析是化学学科的核心素养之一、下列微观解释不合理的是
选项 事实 解释
A 1滴水中大约有1.67×1021个水分子 分子很小
B 压缩的乒乓球放入热水中重新鼓起 乒乓球内每个分子的体积都增大
C 滴有酚酞的氢氧化钠溶液加入足量盐酸后,溶液由红色变为无色 氢离子和氢氧根离子结合生成水分子
D 氧气和液氧都能支持燃烧 物质的分子相同,其化学性质相同
A.A B.B C.C D.D
11.谚语“雷雨发庄稼”是指空气中的氮气在雷电的作用下,经过一系列变化成为农作物生长所需的氮肥。下列属于氮肥的是
A.Ca(H2PO4)2 B.CO(NH2)2 C.K2SO4 D.KH2PO4
12.下列除杂方法(括号内为杂质),正确的是
序号 混合物 除杂方法
A CO2(HCl) 将混合气体依次通过饱和NaHCO3溶液、浓硫酸
B Cu(CuO) 将混合物灼烧
C NaNO3溶液(Na2CO3) 加适量的CaCl2溶液,过滤
D FeCl2溶液(CuCl2) 加过量锌粉、过滤
A.A B.B C.C D.D
二、填空题
13.请从下列物质中选择填空(填序号):①肥皂水、②稀有气体、③硫酸铜、④洗洁精。
(1)可用作霓虹灯的电光源的是 。
(2)可除去餐具上油污的是 。
(3)可用于区分硬水和软水的是 。
(4)可用于配制波尔多液的是 。
14.请按要求从①氯化钠②碳酸氢钠③一氧化碳④氢氧化铜⑤氧化钙⑥氮气这六种物质中,选择合适的物质,将其化学式填写在下列横线上:
(1)常用作食品干燥剂的氧化物 ;
(2)具有还原性的有毒气体 ;
(3)一种难溶于水的碱 ;
(4)可以治疗胃酸过多症的盐 ;
(5)做调味品的盐 ;
(6)用于食品防腐的单质 。
15.小明在制作“叶脉书签”时,经历了①选取树叶——②腐蚀叶肉——③清洗叶脉——④漂白、染色、干燥等环节,在②中要用到20g的5%的氢氧化钠溶液,需要称量 g的氢氧化钠固体,使用托盘天平称量时,要将氢氧化钠放在烧杯里,其理由是 。
16.化学就在我们身边,人类的衣、食、住、行都离不开化学,回答下列问题。
(1)衣:棉布是用棉花纺织而成,棉花属于天然纤维,与合成纤维相比较,棉纤维在性能上具有的优点是 (答一点)。
(2)食:厨房中有食盐、食醋、小苏打、加铁酱油等物质。其中焙制糕点所用发酵粉的主要成分是 (写化学式)。炒菜时油锅中的油不慎着火,用锅盖将其盖灭的原理是 。喝了冰镇汽水后,常常会打嗝,这种现象说明气体的溶解度与 有关。
(3)住:新房装修会产生有毒物质,为了减少对人体的伤害可采取的措施是: (写一种即可)。
(4)行:自行车是绿色出行的交通工具,自行车支架表面喷漆,是为了防止其与空气中的 发生反应而生锈。
17.科学家设想利用太阳能加热器“捕捉CO2”“释放CO2”,实现碳循环,如图所示:
(1)步骤中可循环的物质除CO2外还有 。
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤及现象 则分解不完全。
(3)CO2是宝贵的碳氧资源。CO2和H2在一定条件下可直接化合成甲酸(HCOOH),写出该反应的化学方程式 。
(4)通过以上探究,小组同学认为科学家的设想在反应原理上是可行的。上述设想的优点有 (填字母)。
A原料易得
B充分利用太阳能
C释放出的CO2可作为重要资源加以利用
三、推断题
18.已知A、B、C、D、E是初中化学中常见的不同类别的物质。它们之间的关系如图所示(“→”表示物质间的转化关系,“-”表示两端的物质能发生化学反应)。A是使用最广泛的金属,C是常用的食品干燥剂,E是配制波尔多液的主要成份之一,其溶液为蓝色,F为三种元素组成的化合物。请回答:
(1)写出下列物质的化学式:A ,C 。
(2)写出物质B的一种用途: 。
(3)写出D转化为F的化学方程式 ,图中所涉及的反应没有包含的基本反应类型是 。
四、流程题
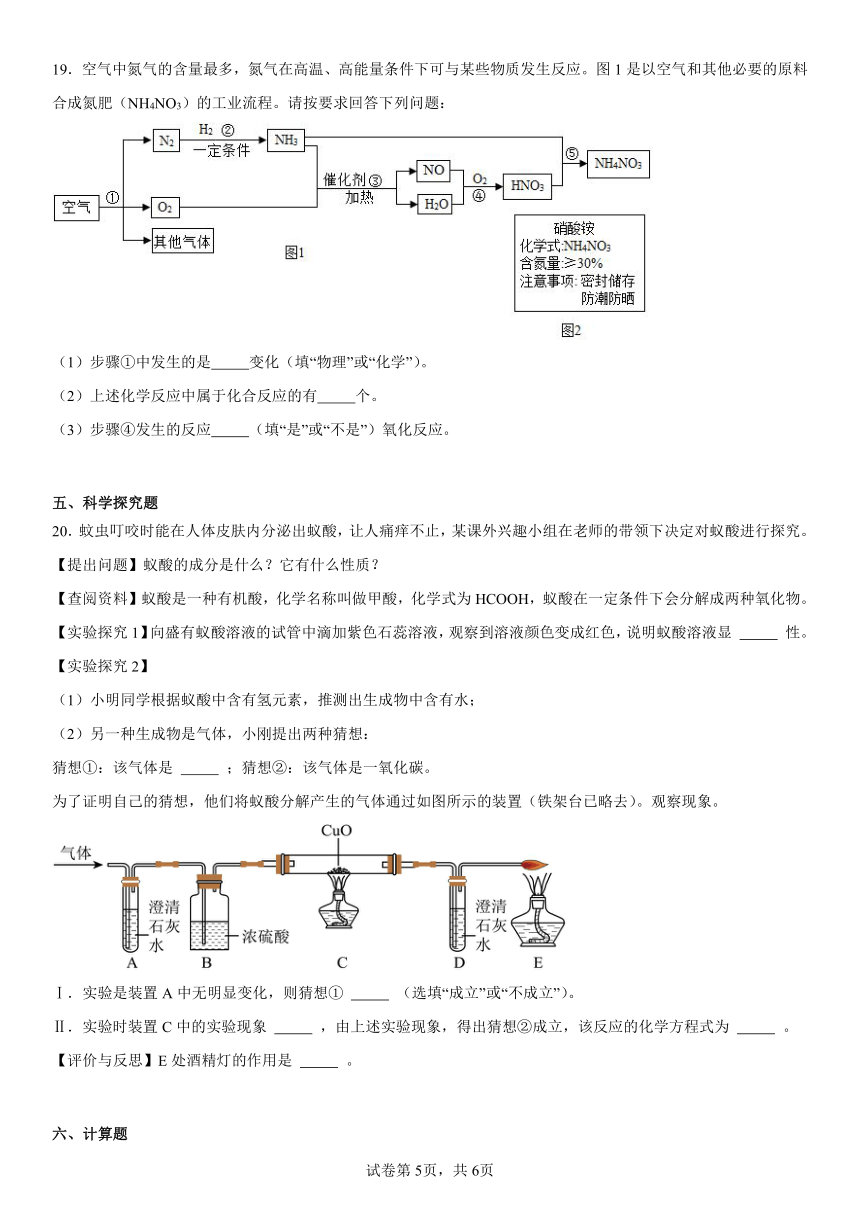
19.空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。图1是以空气和其他必要的原料合成氮肥(NH4NO3)的工业流程。请按要求回答下列问题:
(1)步骤①中发生的是 变化(填“物理”或“化学”)。
(2)上述化学反应中属于化合反应的有 个。
(3)步骤④发生的反应 (填“是”或“不是”)氧化反应。
五、科学探究题
20.蚊虫叮咬时能在人体皮肤内分泌出蚁酸,让人痛痒不止,某课外兴趣小组在老师的带领下决定对蚁酸进行探究。
【提出问题】蚁酸的成分是什么?它有什么性质?
【查阅资料】蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH,蚁酸在一定条件下会分解成两种氧化物。
【实验探究1】向盛有蚁酸溶液的试管中滴加紫色石蕊溶液,观察到溶液颜色变成红色,说明蚁酸溶液显 性。
【实验探究2】
(1)小明同学根据蚁酸中含有氢元素,推测出生成物中含有水;
(2)另一种生成物是气体,小刚提出两种猜想:
猜想①:该气体是 ;猜想②:该气体是一氧化碳。
为了证明自己的猜想,他们将蚁酸分解产生的气体通过如图所示的装置(铁架台已略去)。观察现象。
Ⅰ.实验是装置A中无明显变化,则猜想① (选填“成立”或“不成立”)。
Ⅱ.实验时装置C中的实验现象 ,由上述实验现象,得出猜想②成立,该反应的化学方程式为 。
【评价与反思】E处酒精灯的作用是 。
六、计算题
21.某纯碱样品中含有杂质NaCl,为测定该样品中Na2CO3的质量分数,称取纯碱样品15g,向其中逐渐加入稀盐酸,如图是产生的气体质量与加入稀盐酸质量的关系图.
(1)样品中Na2CO3的质量分数是__;
(2)恰好反应后所得溶液中溶质的质量分数___;(写出计算过程,结果保留一位小数)
(3)当加入稀盐酸80.0g时,所得溶液中Na+的质量为__.(结果保留一位小数)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A、氧化钙与水反应生成氢氧化钙,氧化钠与水反应生成氢氧化钠,故选项推理正确;
B、室温下,pH<7的溶液是酸性,由于空气中有二氧化碳,所以正常雨水显酸性,酸雨是pH小于5.6的雨水,故选项推理不正确;
C、含一种元素的物质可能是纯净物,也可能是混合物,如氧气与臭氧的混合物中只含氧元素,故选项推理不正确;
D、碳酸盐与盐酸反应会产生气体,所以与盐酸反应生成气体的物质不一定是碳酸盐,也可能是碳酸氢盐或活泼金属,故选项推理不正确。
故选A。
2.B
【详解】丙溶液呈蓝色,则丙是硫酸铜;乙与戊之间发生中和反应,则乙与戊是盐酸和氢氧化钙中的一种;甲既能与酸反应,又能与碱反应,则甲为碳酸钠;那么丁为铁。铁能与硫酸铜反应,也能与盐酸反应,故戊是盐酸,乙是氢氧化钙。分析所给选项,只有氢氧化钠既会与盐酸反应,也会与硫酸铜溶液反应,所以能替代丁物质的是NaOH。故选B。
点睛:在解此类题时,首先分析题中所给物质两两之间的反应,然后结合题中的转化关系推出各种物质,最后进行验证即可。
3.B
【详解】方法一:生成硫酸钡沉淀的质量等于所加的硫酸溶液的质量,
设生成硫酸钡沉淀的质量为x,参加反应的纯硫酸的质量为y
所加硫酸溶液中溶质的质量分数为:。
方法二:根据反应的化学方程式可以看出,生成硫酸钡的质量为233,则加入的硫酸溶液的质量为233,参加反应的硫酸的质量98,所加硫酸溶液中溶质的质量分数为:。
故选:B。
4.A
【详解】A、加油站、面粉加工厂严禁烟火,以防发生爆炸,故做法正确;
B、浓硫酸稀释时放出大量的热,所以稀释浓硫酸时,将浓硫酸沿杯内壁缓缓倒入中水并用玻璃棒不断搅拌,故做法错误;
C、闻药品的气味要在瓶口轻轻扇动,不能把鼻子凑到容器口去闻药品的气味,故做法错误;
D、氢氧化钠不慎沾到皮肤上,立即用大量水冲洗,再涂上硼酸溶液,不能用硫酸(具有腐蚀性)冲洗,故做法错误。
故选A。
5.B
【详解】A、室内着火,不能打开所有门窗通风,否则空气流通使氧气更充足,火势更旺,故A错误,不符合题意;
B、燃气泄漏时,应立即关闭阀门,再开窗通风,故B正确,符合题意;
C、浓硫酸滴到手上时,要立即用大量水冲洗,再涂上碳酸氢钠溶液,氢氧化钠溶液有强烈的腐蚀性,故不能用氢氧化钠溶液,故C错误,不符合题意;
D、酒精洒到桌上着火了,不能用水浇灭,因为不同浓度的酒精溶液也是可以燃烧的,用水会使火势蔓延,应用湿抹布盖灭,故D错误,不符合题意。
故选:B。
6.D
【详解】A、由于标准比色卡上的数字只有整数,则pH不可能为4.8,选项错误;
B、浓硫酸稀释应浓硫酸往水里加,并不断搅拌,使稀释产生的热量及时散出,选项错误;
C、“生成四氧化三铁”是实验结论,不是实验现象,选项错误;
D、硫粉在空气中燃烧产生微弱的淡蓝色火焰,选项正确。
故选D。
7.A
【详解】A、氮气的化学性质不活泼,因此氮气可用作保护气,氮气是由氮元素组成的,因此可用氮气生产氮肥,性质与用途对应关系错误,故A错误;
B、熟石灰具有碱性,能与酸性物质反应,可用于改良酸性土壤,故B正确;
C、活性炭有吸附性,可以吸附色素,因此活性炭可用于制糖工业脱色,故C正确;
D、洗洁精可用于除油污,是因为洗洁精具有乳化作用,故D正确。
故选A。
8.A
【详解】A、氮气和氧气都不能和氧化铜反应,所以不能除去杂质,选项错误,符合题意;
B、KCl溶于水,MnO2不溶于水,采用加入足量的水溶解,过滤,蒸发结晶的方法,能够除去二氧化锰,得到纯净的KCl,符合除杂原则,选项正确,不符合题意;
C、NaCl溶液不和氯化钙反应,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠溶液,过滤除去碳酸钙沉淀,得到氯化钠溶液,将杂质转化为欲保留的物质,符合除杂原则,选项正确,不符合题意;
D、向FeCl2和CuCl2混合溶液中加入过量的铁粉,铁与氯化铜反应生成氯化亚铁和铜,过滤掉过量的铁粉和生成的铜,得到氯化亚铁溶液,将杂质转化为欲保留的物质,符合除杂原则,选项正确,不符合题意。
故选A。
9.C
【分析】碳酸钠和硝酸钡反应生成碳酸钡沉淀和硝酸钠,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,碳酸氢钠和稀盐酸反应生成氯化钠、水和二氧化碳。
【详解】A、碳酸钠、碳酸氢钠和稀盐酸反应的化学方程式及其质量关系为
,,
加入足量的盐酸,收集到4gCO2,则样品中一定含有氯化钾,可能含有碳酸氢钠,故A不正确;
B、取10.6g样品,溶于水得澄清溶液,说明样品中不含有硝酸钡,故B不正确;
C、加入足量的盐酸,收集到4gCO2,则样品中一定含有氯化钾,可能含有碳酸氢钠,故C正确;
D、样品中一定含有氯化钾,可能含有碳酸氢钠,故D不正确。故选C。
10.B
【详解】A、1滴水中大约有1.67×1021个水分子,说明分子的质量和体积很小,不符合题意;
B、压缩的乒乓球放入热水中重新鼓起,是因为温度升高,分子之间的间隔变大,分子的大小不变,符合题意;
C、滴有酚酞的氢氧化钠溶液加入足量盐酸后,溶液由红色变为无色,是因为氢离子和氢氧根离子结合生成了水,氢离子过量,无色酚酞试液在酸性溶液中不变色,不符合题意;
D、氧气和液氧都能支持燃烧,是因为氧气和液氧均是由氧分子构成,分子构成相同,化学性质相同,不符合题意。
故选B。
11.B
【分析】植物所需要的营养元素为N、P、K,化学肥料根据所含元素分为氮肥、磷肥、钾肥、复合肥等。含有氮元素的是氮肥,含有钾元素的是钾肥,含有磷元素的是磷肥,含有两种或两种以上营养元素的化学肥料是复合肥。
【详解】A、Ca(H2PO4)2中含有磷元素,属于磷肥,不符合题意;
B、CO(NH2)2中含有氮元素,属于氮肥,符合题意;
C、K2SO4中含有钾元素,属于钾肥,不符合题意;
D、KH2PO4中含有钾和磷两种元素,属于复合肥,不符合题意;
故选B。
12.A
【详解】A、饱和碳酸氢钠溶液不会再溶解二氧化碳,HCl能与饱和NaHCO3溶液反应生成氯化钠、水和二氧化碳,再通过浓硫酸进行干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故A正确;
B、Cu在空气中灼烧生成氧化铜,反而会把原物质除去,不符合除杂原则,故B错误;
C、Na2CO3能与适量的CaCl2溶液反应生成碳酸钙沉淀和氯化钠,能除去杂质但引入了新的杂质氯化钠,不符合除杂原则,故C错误;
D、FeCl2溶液和CuCl2均能与过量锌粉反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故D错误;
故选:A。
13.(1)②
(2)④
(3)①
(4)③
【详解】(1)稀有气体通电时能发出有色光,可用于填充霓虹灯,故填:②;
(2)用洗涤剂除去餐具上的油污,是利用了洗涤剂的乳化作用,可使油污在水中分散成无数细小的液滴,而随水流冲走,故填:④;
(3)生活中常用肥皂水来区分硬水和软水,产生泡沫较多的是软水,产生泡沫较少的是硬水,故填:①;
(4)用硫酸铜和石灰乳配制波尔多液,故填:③。
14. CaO CO Cu(OH)2 NaHCO3 NaCl N2
【详解】(1)氧化钙和水反应生成氢氧化钙,是常用作食品干燥剂的氧化物,氧化钙中氧元素的化合价为+2,氧元素的化合价为-2,则化学式为CaO。
(2)一氧化碳具有还原性,有毒,具有还原性的有毒气体是一氧化碳,氧元素的化合价为-2,碳元素的化合价为+2,则化学式为CO。
(3)一种难溶于水的碱是氢氧化铜,氢氧根离子的化合价为-1,铜元素的化合价为+2,则化学式为Cu(OH)2。
(4)胃酸的主要成分是盐酸,盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,可以治疗胃酸过多症的盐是碳酸氢钠,碳酸氢根离子的的化合价为-1,钠元素的化合价为+1,碳酸氢钠的化学式为NaHCO3。
(5)氯化钠有咸味,是做调味品的盐,氯元素的化合价为-1,钠元素的化合价为+1,化学式为NaCl。
(6)氮气常温下化学性质稳定,是用于食品防腐的单质,氮气的化学式为N2。
15. 1 氢氧化钠具有腐蚀性
【详解】溶质质量=溶液质量×溶质的质量分数,配制20g5%的氢氧化钠溶液,需氢氧化钠的质量=20g×5%=1g;
氢氧化钠具有腐蚀性,为防止腐蚀托盘,使用托盘天平称量时,要将氢氧化钠放在烧杯里。
16.(1)吸水性强或者透气性强
(2) NaHCO3 与氧气隔绝 温度
(3)通风
(4)氧气、水
【详解】(1)棉纤维在性能上具有的优点是吸水性强或者透气性强;
(2)发酵粉的主要成分是碳酸氢钠,化学式为NaHCO3;灭火原理有去除可燃物、降温、隔绝氧气,炒菜时油锅中的油不慎着火,用锅盖将其盖灭的原理是隔绝氧气;喝了冰镇汽水后,常常会打嗝,原因是温度升高,二氧化碳的溶解度减小,这种现象说明气体的溶解度与温度有关;
(3)为了减少对人体的伤害可采取的措施是:通风或用活性炭吸附等;
(4)铁生锈是铁与氧气、水发生反应的过程,自行车支架表面喷漆,是为了防止其与空气中的氧气、水发生反应而生锈。
17. CaO 取样,滴加盐酸,产生气泡 ABC
【详解】(1)步骤1中加入了氧化钙,步骤2中又生成了氧化钙,故步骤中可循环的物质除CO2外还有CaO;
(2)碳酸钙与盐酸反应能生成二氧化碳。为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤及现象为取样,滴加盐酸,产生气泡,则分解不完全;
(3)CO2和H2在一定条件下可直接化合成甲酸(HCOOH),反应的化学方程式为;
(4)上述设想的优点有原料易得、充分利用太阳能、释放出的CO2可作为重要资源加以利用,故选ABC。
18. Fe CaO 金属除锈 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 分解反应
【分析】A是使用最广泛的金属,因此A是铁;C是常用的食品干燥剂,因此C是氧化钙;E是配制波尔多液的主要成份之一,其溶液为蓝色,因此E是硫酸铜;F为三种元素组成的化合物;铁与硫酸反应生成硫酸亚铁和氢气,因此B是硫酸;硫酸和氢氧化钙反应生成硫酸钙和水,因此D是氢氧化钙;碳酸钠和氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠,因此F是氢氧化钠。
【详解】(1)A是使用最广泛的金属,因此A是铁,化学式为;C是常用的食品干燥剂,因此C是氧化钙。
(2)B是硫酸,硫酸可用于金属除锈等。
(3)碳酸钠和氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠,化学方程式为
;图中所涉及的反应没有包含的基本反应类型是分解反应。
【点睛】A是使用最广泛的金属,因此A是铁;C是常用的食品干燥剂,因此C是氧化钙;E是配制波尔多液的主要成份之一,其溶液为蓝色,因此E是硫酸铜。
19. 物理 3 是
【详解】(1)步骤①为工业分郭液态空气制取氧气的方法,属于物理变化;
(2)反应②氮气 和氢气合成氨气,两种物质生成一种物质,是化合反应;反应③为氨气和氧气反应生成一氧化氮和水,为两种物质反应生成两种物质,不属于化合反;反应④一氧化氮、水、氧气反应生成硝酸,是三种物质反应生成一种物质,是化合反应;反应为硝酸和氨气反应,生成硝酸铵,两种物质生成一种物质,是化合反应,故其中有三个反应为化合反应;
(3)步骤④有氧气参与反应,所以是氧化反应。
20. 酸 二氧化碳 不成立 黑色粉末变成红色; CuO+COCu+CO2 把一氧化碳转化成二氧化碳,避免空气污染
【详解】实验探究1
向盛有蚁酸溶液的试管中滴加紫色石蕊溶液,观察到溶液颜色变成红色,说明蚁酸溶液显酸性;
实验探究2:
猜想①:该气体是二氧化碳;猜想②:该气体是一氧化碳;
Ⅰ.二氧化碳能使澄清石灰变浑浊,常用于检验二氧化碳。实验是装置A中无明显变化,说明气体不是二氧化碳,则猜想①不成立;
Ⅱ.一氧化碳与氧化铜在高温条件反应生成铜和二氧化碳。实验时装置C中黑色粉末变成红色,说明氧化铜和一氧化碳发生了反应,得出猜想②成立,该反应的化学方程式为:CuO+COCu+CO2;
评价与反思:
一氧化碳有毒,排放到空气会污染空气。一氧化碳在空气燃烧生二氧化碳。E处酒精灯的作用是把一氧化碳转化成二氧化碳,避免空气污染。
21.(1)70.7%
(2)22.8%(详见解析)
(3)6.3g
【详解】设生成4.4g二氧化碳需要的碳酸钠的质量为x,生成的氯化钠的质量为y。
样品中碳酸钠的质量分数为
所得溶液中氯化钠的质量为11.7g+(15g﹣10.6g)=16.1g
恰好反应所得溶液中氯化钠的质量分数为;
当加入稀盐酸80.0g时,其中含有的钠离子的质量为。
答:(1)样品中Na2CO3的质量分数是70.7%;
(2)恰好反应后所得溶液中溶质的质量分数为22.8%;
(3)当加入稀盐酸80.0g时,所得溶液中Na+的质量为6.3g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.类比推理是化学学习中常用的思维方式。下列推理正确的是( )
A.CaO与水反应生成Ca(OH)2,同理Na2O与水反应生成NaOH
B.室温下,pH<7的溶液是酸性,同理pH<7的雨水是酸雨
C.单质中只含有一种元素,所以含一种元素的物质一定是单质
D.碳酸盐与盐酸反应会产生气体,所以与盐酸反应生成气体的物质一定是碳酸盐
2.如图所示,甲、乙、丙、丁、戊五种物质分别是铁、盐酸、氢氧化钙、硫酸铜、碳酸钠中的一种。连线两端的物质间能发生化学反应,乙与戊之间发生中和反应,丙溶液为蓝色。
下列能替代图中丁物质的是
A.Ag B.NaOH C.BaCl2 D.CuO
3.向某氯化钡溶液中加入一定质量的硫酸溶液,二者恰好完全反应,过滤,所得溶液的质量与原氯化钡溶液的质量相等。则所加硫酸溶液中溶质质量分数的计算式为( )
A.×100% B.×100% C.×100% D.×100%
4.下列做法符合安全要求的是
A.加油站、面粉加工厂严禁烟火
B.稀释浓硫酸时将水缓缓倒入浓硫酸中,并不断搅拌
C.直接将鼻孔凑到试剂瓶口闻药品的气味
D.氢氧化钠不慎洁到皮肤上,立即用硫酸清洗
5.“安全教育,时刻牢记”。我们无论在生活还是在实验中,都要注意安全,而安全离不开化学。下列说法正确的是
A.室内着火,立即打开所有门窗通风
B.燃气泄漏时,应立即关闭阀门,再开窗通风
C.浓硫酸滴到手上时,要立即用大量水冲洗,再涂上氢氧化钠溶液
D.酒精洒到桌上着火了,立即用水浇灭
6.下列有关化学实验操作或现象记录中正确的是
A.化学兴趣小组使用pH试纸测得某次酸雨的pH为4.8
B.向10g98%的浓硫酸中注入90g蒸馏水,并不断搅拌,可以配制成100g9.8%的稀硫酸
C.观察到铁丝在氧气中剧烈燃烧、生成四氧化三铁
D.硫粉在空气中燃烧产生微弱的淡蓝色火焰
7.物质的性质决定用途,下列有关性质与用途对应关系的说法不正确的是
A.氮气化学性质不活泼,可用于生产氮肥
B.熟石灰具有碱性,可用于改良酸性土壤
C.活性炭有吸附性,可用于制糖工业脱色
D.洗洁精具有乳化作用,可用于除油污
8.除去下列物质中混有的少量杂质(括号内为杂质),拟定的实验方案不可行的是
A.氮气(氧气)——通过灼热的氧化铜
B.KCl固体(MnO2)——加足量水溶解、过滤、蒸发结晶
C.NaCl溶液(Na2CO3)——加入适量CaCl2溶液,过滤
D.FeCl2溶液(CuCl2)——加过量的铁粉,过滤
9.一包混有杂质的Na2CO3,其杂质可能是Ba(NO3)2、KCl、NaHCO3的一种或几种。取10.6g样品,溶于水得澄清溶液;另取10.6 g样品,加入足量的盐酸,收集到4 g CO2,则下列判断正确的是
A.样品中只混有KCl
B.样品中有NaHCO3,也有Ba(NO3)2
C.样品中一定混有KCl,可能有NaHCO3
D.样品中一定混有NaHCO3,可能有KCl
10.宏观辨识与微观探析是化学学科的核心素养之一、下列微观解释不合理的是
选项 事实 解释
A 1滴水中大约有1.67×1021个水分子 分子很小
B 压缩的乒乓球放入热水中重新鼓起 乒乓球内每个分子的体积都增大
C 滴有酚酞的氢氧化钠溶液加入足量盐酸后,溶液由红色变为无色 氢离子和氢氧根离子结合生成水分子
D 氧气和液氧都能支持燃烧 物质的分子相同,其化学性质相同
A.A B.B C.C D.D
11.谚语“雷雨发庄稼”是指空气中的氮气在雷电的作用下,经过一系列变化成为农作物生长所需的氮肥。下列属于氮肥的是
A.Ca(H2PO4)2 B.CO(NH2)2 C.K2SO4 D.KH2PO4
12.下列除杂方法(括号内为杂质),正确的是
序号 混合物 除杂方法
A CO2(HCl) 将混合气体依次通过饱和NaHCO3溶液、浓硫酸
B Cu(CuO) 将混合物灼烧
C NaNO3溶液(Na2CO3) 加适量的CaCl2溶液,过滤
D FeCl2溶液(CuCl2) 加过量锌粉、过滤
A.A B.B C.C D.D
二、填空题
13.请从下列物质中选择填空(填序号):①肥皂水、②稀有气体、③硫酸铜、④洗洁精。
(1)可用作霓虹灯的电光源的是 。
(2)可除去餐具上油污的是 。
(3)可用于区分硬水和软水的是 。
(4)可用于配制波尔多液的是 。
14.请按要求从①氯化钠②碳酸氢钠③一氧化碳④氢氧化铜⑤氧化钙⑥氮气这六种物质中,选择合适的物质,将其化学式填写在下列横线上:
(1)常用作食品干燥剂的氧化物 ;
(2)具有还原性的有毒气体 ;
(3)一种难溶于水的碱 ;
(4)可以治疗胃酸过多症的盐 ;
(5)做调味品的盐 ;
(6)用于食品防腐的单质 。
15.小明在制作“叶脉书签”时,经历了①选取树叶——②腐蚀叶肉——③清洗叶脉——④漂白、染色、干燥等环节,在②中要用到20g的5%的氢氧化钠溶液,需要称量 g的氢氧化钠固体,使用托盘天平称量时,要将氢氧化钠放在烧杯里,其理由是 。
16.化学就在我们身边,人类的衣、食、住、行都离不开化学,回答下列问题。
(1)衣:棉布是用棉花纺织而成,棉花属于天然纤维,与合成纤维相比较,棉纤维在性能上具有的优点是 (答一点)。
(2)食:厨房中有食盐、食醋、小苏打、加铁酱油等物质。其中焙制糕点所用发酵粉的主要成分是 (写化学式)。炒菜时油锅中的油不慎着火,用锅盖将其盖灭的原理是 。喝了冰镇汽水后,常常会打嗝,这种现象说明气体的溶解度与 有关。
(3)住:新房装修会产生有毒物质,为了减少对人体的伤害可采取的措施是: (写一种即可)。
(4)行:自行车是绿色出行的交通工具,自行车支架表面喷漆,是为了防止其与空气中的 发生反应而生锈。
17.科学家设想利用太阳能加热器“捕捉CO2”“释放CO2”,实现碳循环,如图所示:
(1)步骤中可循环的物质除CO2外还有 。
(2)为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤及现象 则分解不完全。
(3)CO2是宝贵的碳氧资源。CO2和H2在一定条件下可直接化合成甲酸(HCOOH),写出该反应的化学方程式 。
(4)通过以上探究,小组同学认为科学家的设想在反应原理上是可行的。上述设想的优点有 (填字母)。
A原料易得
B充分利用太阳能
C释放出的CO2可作为重要资源加以利用
三、推断题
18.已知A、B、C、D、E是初中化学中常见的不同类别的物质。它们之间的关系如图所示(“→”表示物质间的转化关系,“-”表示两端的物质能发生化学反应)。A是使用最广泛的金属,C是常用的食品干燥剂,E是配制波尔多液的主要成份之一,其溶液为蓝色,F为三种元素组成的化合物。请回答:
(1)写出下列物质的化学式:A ,C 。
(2)写出物质B的一种用途: 。
(3)写出D转化为F的化学方程式 ,图中所涉及的反应没有包含的基本反应类型是 。
四、流程题
19.空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应。图1是以空气和其他必要的原料合成氮肥(NH4NO3)的工业流程。请按要求回答下列问题:
(1)步骤①中发生的是 变化(填“物理”或“化学”)。
(2)上述化学反应中属于化合反应的有 个。
(3)步骤④发生的反应 (填“是”或“不是”)氧化反应。
五、科学探究题
20.蚊虫叮咬时能在人体皮肤内分泌出蚁酸,让人痛痒不止,某课外兴趣小组在老师的带领下决定对蚁酸进行探究。
【提出问题】蚁酸的成分是什么?它有什么性质?
【查阅资料】蚁酸是一种有机酸,化学名称叫做甲酸,化学式为HCOOH,蚁酸在一定条件下会分解成两种氧化物。
【实验探究1】向盛有蚁酸溶液的试管中滴加紫色石蕊溶液,观察到溶液颜色变成红色,说明蚁酸溶液显 性。
【实验探究2】
(1)小明同学根据蚁酸中含有氢元素,推测出生成物中含有水;
(2)另一种生成物是气体,小刚提出两种猜想:
猜想①:该气体是 ;猜想②:该气体是一氧化碳。
为了证明自己的猜想,他们将蚁酸分解产生的气体通过如图所示的装置(铁架台已略去)。观察现象。
Ⅰ.实验是装置A中无明显变化,则猜想① (选填“成立”或“不成立”)。
Ⅱ.实验时装置C中的实验现象 ,由上述实验现象,得出猜想②成立,该反应的化学方程式为 。
【评价与反思】E处酒精灯的作用是 。
六、计算题
21.某纯碱样品中含有杂质NaCl,为测定该样品中Na2CO3的质量分数,称取纯碱样品15g,向其中逐渐加入稀盐酸,如图是产生的气体质量与加入稀盐酸质量的关系图.
(1)样品中Na2CO3的质量分数是__;
(2)恰好反应后所得溶液中溶质的质量分数___;(写出计算过程,结果保留一位小数)
(3)当加入稀盐酸80.0g时,所得溶液中Na+的质量为__.(结果保留一位小数)
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【详解】A、氧化钙与水反应生成氢氧化钙,氧化钠与水反应生成氢氧化钠,故选项推理正确;
B、室温下,pH<7的溶液是酸性,由于空气中有二氧化碳,所以正常雨水显酸性,酸雨是pH小于5.6的雨水,故选项推理不正确;
C、含一种元素的物质可能是纯净物,也可能是混合物,如氧气与臭氧的混合物中只含氧元素,故选项推理不正确;
D、碳酸盐与盐酸反应会产生气体,所以与盐酸反应生成气体的物质不一定是碳酸盐,也可能是碳酸氢盐或活泼金属,故选项推理不正确。
故选A。
2.B
【详解】丙溶液呈蓝色,则丙是硫酸铜;乙与戊之间发生中和反应,则乙与戊是盐酸和氢氧化钙中的一种;甲既能与酸反应,又能与碱反应,则甲为碳酸钠;那么丁为铁。铁能与硫酸铜反应,也能与盐酸反应,故戊是盐酸,乙是氢氧化钙。分析所给选项,只有氢氧化钠既会与盐酸反应,也会与硫酸铜溶液反应,所以能替代丁物质的是NaOH。故选B。
点睛:在解此类题时,首先分析题中所给物质两两之间的反应,然后结合题中的转化关系推出各种物质,最后进行验证即可。
3.B
【详解】方法一:生成硫酸钡沉淀的质量等于所加的硫酸溶液的质量,
设生成硫酸钡沉淀的质量为x,参加反应的纯硫酸的质量为y
所加硫酸溶液中溶质的质量分数为:。
方法二:根据反应的化学方程式可以看出,生成硫酸钡的质量为233,则加入的硫酸溶液的质量为233,参加反应的硫酸的质量98,所加硫酸溶液中溶质的质量分数为:。
故选:B。
4.A
【详解】A、加油站、面粉加工厂严禁烟火,以防发生爆炸,故做法正确;
B、浓硫酸稀释时放出大量的热,所以稀释浓硫酸时,将浓硫酸沿杯内壁缓缓倒入中水并用玻璃棒不断搅拌,故做法错误;
C、闻药品的气味要在瓶口轻轻扇动,不能把鼻子凑到容器口去闻药品的气味,故做法错误;
D、氢氧化钠不慎沾到皮肤上,立即用大量水冲洗,再涂上硼酸溶液,不能用硫酸(具有腐蚀性)冲洗,故做法错误。
故选A。
5.B
【详解】A、室内着火,不能打开所有门窗通风,否则空气流通使氧气更充足,火势更旺,故A错误,不符合题意;
B、燃气泄漏时,应立即关闭阀门,再开窗通风,故B正确,符合题意;
C、浓硫酸滴到手上时,要立即用大量水冲洗,再涂上碳酸氢钠溶液,氢氧化钠溶液有强烈的腐蚀性,故不能用氢氧化钠溶液,故C错误,不符合题意;
D、酒精洒到桌上着火了,不能用水浇灭,因为不同浓度的酒精溶液也是可以燃烧的,用水会使火势蔓延,应用湿抹布盖灭,故D错误,不符合题意。
故选:B。
6.D
【详解】A、由于标准比色卡上的数字只有整数,则pH不可能为4.8,选项错误;
B、浓硫酸稀释应浓硫酸往水里加,并不断搅拌,使稀释产生的热量及时散出,选项错误;
C、“生成四氧化三铁”是实验结论,不是实验现象,选项错误;
D、硫粉在空气中燃烧产生微弱的淡蓝色火焰,选项正确。
故选D。
7.A
【详解】A、氮气的化学性质不活泼,因此氮气可用作保护气,氮气是由氮元素组成的,因此可用氮气生产氮肥,性质与用途对应关系错误,故A错误;
B、熟石灰具有碱性,能与酸性物质反应,可用于改良酸性土壤,故B正确;
C、活性炭有吸附性,可以吸附色素,因此活性炭可用于制糖工业脱色,故C正确;
D、洗洁精可用于除油污,是因为洗洁精具有乳化作用,故D正确。
故选A。
8.A
【详解】A、氮气和氧气都不能和氧化铜反应,所以不能除去杂质,选项错误,符合题意;
B、KCl溶于水,MnO2不溶于水,采用加入足量的水溶解,过滤,蒸发结晶的方法,能够除去二氧化锰,得到纯净的KCl,符合除杂原则,选项正确,不符合题意;
C、NaCl溶液不和氯化钙反应,碳酸钠和氯化钙反应生成碳酸钙沉淀和氯化钠溶液,过滤除去碳酸钙沉淀,得到氯化钠溶液,将杂质转化为欲保留的物质,符合除杂原则,选项正确,不符合题意;
D、向FeCl2和CuCl2混合溶液中加入过量的铁粉,铁与氯化铜反应生成氯化亚铁和铜,过滤掉过量的铁粉和生成的铜,得到氯化亚铁溶液,将杂质转化为欲保留的物质,符合除杂原则,选项正确,不符合题意。
故选A。
9.C
【分析】碳酸钠和硝酸钡反应生成碳酸钡沉淀和硝酸钠,碳酸钠和稀盐酸反应生成氯化钠、水和二氧化碳,碳酸氢钠和稀盐酸反应生成氯化钠、水和二氧化碳。
【详解】A、碳酸钠、碳酸氢钠和稀盐酸反应的化学方程式及其质量关系为
,,
加入足量的盐酸,收集到4gCO2,则样品中一定含有氯化钾,可能含有碳酸氢钠,故A不正确;
B、取10.6g样品,溶于水得澄清溶液,说明样品中不含有硝酸钡,故B不正确;
C、加入足量的盐酸,收集到4gCO2,则样品中一定含有氯化钾,可能含有碳酸氢钠,故C正确;
D、样品中一定含有氯化钾,可能含有碳酸氢钠,故D不正确。故选C。
10.B
【详解】A、1滴水中大约有1.67×1021个水分子,说明分子的质量和体积很小,不符合题意;
B、压缩的乒乓球放入热水中重新鼓起,是因为温度升高,分子之间的间隔变大,分子的大小不变,符合题意;
C、滴有酚酞的氢氧化钠溶液加入足量盐酸后,溶液由红色变为无色,是因为氢离子和氢氧根离子结合生成了水,氢离子过量,无色酚酞试液在酸性溶液中不变色,不符合题意;
D、氧气和液氧都能支持燃烧,是因为氧气和液氧均是由氧分子构成,分子构成相同,化学性质相同,不符合题意。
故选B。
11.B
【分析】植物所需要的营养元素为N、P、K,化学肥料根据所含元素分为氮肥、磷肥、钾肥、复合肥等。含有氮元素的是氮肥,含有钾元素的是钾肥,含有磷元素的是磷肥,含有两种或两种以上营养元素的化学肥料是复合肥。
【详解】A、Ca(H2PO4)2中含有磷元素,属于磷肥,不符合题意;
B、CO(NH2)2中含有氮元素,属于氮肥,符合题意;
C、K2SO4中含有钾元素,属于钾肥,不符合题意;
D、KH2PO4中含有钾和磷两种元素,属于复合肥,不符合题意;
故选B。
12.A
【详解】A、饱和碳酸氢钠溶液不会再溶解二氧化碳,HCl能与饱和NaHCO3溶液反应生成氯化钠、水和二氧化碳,再通过浓硫酸进行干燥,能除去杂质且没有引入新的杂质,符合除杂原则,故A正确;
B、Cu在空气中灼烧生成氧化铜,反而会把原物质除去,不符合除杂原则,故B错误;
C、Na2CO3能与适量的CaCl2溶液反应生成碳酸钙沉淀和氯化钠,能除去杂质但引入了新的杂质氯化钠,不符合除杂原则,故C错误;
D、FeCl2溶液和CuCl2均能与过量锌粉反应,不但能把杂质除去,也会把原物质除去,不符合除杂原则,故D错误;
故选:A。
13.(1)②
(2)④
(3)①
(4)③
【详解】(1)稀有气体通电时能发出有色光,可用于填充霓虹灯,故填:②;
(2)用洗涤剂除去餐具上的油污,是利用了洗涤剂的乳化作用,可使油污在水中分散成无数细小的液滴,而随水流冲走,故填:④;
(3)生活中常用肥皂水来区分硬水和软水,产生泡沫较多的是软水,产生泡沫较少的是硬水,故填:①;
(4)用硫酸铜和石灰乳配制波尔多液,故填:③。
14. CaO CO Cu(OH)2 NaHCO3 NaCl N2
【详解】(1)氧化钙和水反应生成氢氧化钙,是常用作食品干燥剂的氧化物,氧化钙中氧元素的化合价为+2,氧元素的化合价为-2,则化学式为CaO。
(2)一氧化碳具有还原性,有毒,具有还原性的有毒气体是一氧化碳,氧元素的化合价为-2,碳元素的化合价为+2,则化学式为CO。
(3)一种难溶于水的碱是氢氧化铜,氢氧根离子的化合价为-1,铜元素的化合价为+2,则化学式为Cu(OH)2。
(4)胃酸的主要成分是盐酸,盐酸和碳酸氢钠反应生成氯化钠、水和二氧化碳,可以治疗胃酸过多症的盐是碳酸氢钠,碳酸氢根离子的的化合价为-1,钠元素的化合价为+1,碳酸氢钠的化学式为NaHCO3。
(5)氯化钠有咸味,是做调味品的盐,氯元素的化合价为-1,钠元素的化合价为+1,化学式为NaCl。
(6)氮气常温下化学性质稳定,是用于食品防腐的单质,氮气的化学式为N2。
15. 1 氢氧化钠具有腐蚀性
【详解】溶质质量=溶液质量×溶质的质量分数,配制20g5%的氢氧化钠溶液,需氢氧化钠的质量=20g×5%=1g;
氢氧化钠具有腐蚀性,为防止腐蚀托盘,使用托盘天平称量时,要将氢氧化钠放在烧杯里。
16.(1)吸水性强或者透气性强
(2) NaHCO3 与氧气隔绝 温度
(3)通风
(4)氧气、水
【详解】(1)棉纤维在性能上具有的优点是吸水性强或者透气性强;
(2)发酵粉的主要成分是碳酸氢钠,化学式为NaHCO3;灭火原理有去除可燃物、降温、隔绝氧气,炒菜时油锅中的油不慎着火,用锅盖将其盖灭的原理是隔绝氧气;喝了冰镇汽水后,常常会打嗝,原因是温度升高,二氧化碳的溶解度减小,这种现象说明气体的溶解度与温度有关;
(3)为了减少对人体的伤害可采取的措施是:通风或用活性炭吸附等;
(4)铁生锈是铁与氧气、水发生反应的过程,自行车支架表面喷漆,是为了防止其与空气中的氧气、水发生反应而生锈。
17. CaO 取样,滴加盐酸,产生气泡 ABC
【详解】(1)步骤1中加入了氧化钙,步骤2中又生成了氧化钙,故步骤中可循环的物质除CO2外还有CaO;
(2)碳酸钙与盐酸反应能生成二氧化碳。为确定步骤2中的碳酸钙是否完全分解,设计的实验步骤及现象为取样,滴加盐酸,产生气泡,则分解不完全;
(3)CO2和H2在一定条件下可直接化合成甲酸(HCOOH),反应的化学方程式为;
(4)上述设想的优点有原料易得、充分利用太阳能、释放出的CO2可作为重要资源加以利用,故选ABC。
18. Fe CaO 金属除锈 Ca(OH)2+Na2CO3=CaCO3↓+2NaOH 分解反应
【分析】A是使用最广泛的金属,因此A是铁;C是常用的食品干燥剂,因此C是氧化钙;E是配制波尔多液的主要成份之一,其溶液为蓝色,因此E是硫酸铜;F为三种元素组成的化合物;铁与硫酸反应生成硫酸亚铁和氢气,因此B是硫酸;硫酸和氢氧化钙反应生成硫酸钙和水,因此D是氢氧化钙;碳酸钠和氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠,因此F是氢氧化钠。
【详解】(1)A是使用最广泛的金属,因此A是铁,化学式为;C是常用的食品干燥剂,因此C是氧化钙。
(2)B是硫酸,硫酸可用于金属除锈等。
(3)碳酸钠和氢氧化钙反应生成碳酸钙白色沉淀和氢氧化钠,化学方程式为
;图中所涉及的反应没有包含的基本反应类型是分解反应。
【点睛】A是使用最广泛的金属,因此A是铁;C是常用的食品干燥剂,因此C是氧化钙;E是配制波尔多液的主要成份之一,其溶液为蓝色,因此E是硫酸铜。
19. 物理 3 是
【详解】(1)步骤①为工业分郭液态空气制取氧气的方法,属于物理变化;
(2)反应②氮气 和氢气合成氨气,两种物质生成一种物质,是化合反应;反应③为氨气和氧气反应生成一氧化氮和水,为两种物质反应生成两种物质,不属于化合反;反应④一氧化氮、水、氧气反应生成硝酸,是三种物质反应生成一种物质,是化合反应;反应为硝酸和氨气反应,生成硝酸铵,两种物质生成一种物质,是化合反应,故其中有三个反应为化合反应;
(3)步骤④有氧气参与反应,所以是氧化反应。
20. 酸 二氧化碳 不成立 黑色粉末变成红色; CuO+COCu+CO2 把一氧化碳转化成二氧化碳,避免空气污染
【详解】实验探究1
向盛有蚁酸溶液的试管中滴加紫色石蕊溶液,观察到溶液颜色变成红色,说明蚁酸溶液显酸性;
实验探究2:
猜想①:该气体是二氧化碳;猜想②:该气体是一氧化碳;
Ⅰ.二氧化碳能使澄清石灰变浑浊,常用于检验二氧化碳。实验是装置A中无明显变化,说明气体不是二氧化碳,则猜想①不成立;
Ⅱ.一氧化碳与氧化铜在高温条件反应生成铜和二氧化碳。实验时装置C中黑色粉末变成红色,说明氧化铜和一氧化碳发生了反应,得出猜想②成立,该反应的化学方程式为:CuO+COCu+CO2;
评价与反思:
一氧化碳有毒,排放到空气会污染空气。一氧化碳在空气燃烧生二氧化碳。E处酒精灯的作用是把一氧化碳转化成二氧化碳,避免空气污染。
21.(1)70.7%
(2)22.8%(详见解析)
(3)6.3g
【详解】设生成4.4g二氧化碳需要的碳酸钠的质量为x,生成的氯化钠的质量为y。
样品中碳酸钠的质量分数为
所得溶液中氯化钠的质量为11.7g+(15g﹣10.6g)=16.1g
恰好反应所得溶液中氯化钠的质量分数为;
当加入稀盐酸80.0g时,其中含有的钠离子的质量为。
答:(1)样品中Na2CO3的质量分数是70.7%;
(2)恰好反应后所得溶液中溶质的质量分数为22.8%;
(3)当加入稀盐酸80.0g时,所得溶液中Na+的质量为6.3g。
答案第1页,共2页
答案第1页,共2页
