粤教版九下化学第八章 常见的酸、碱、盐第2节《常见的酸和碱》复习课件(共26张PPT)
文档属性
| 名称 | 粤教版九下化学第八章 常见的酸、碱、盐第2节《常见的酸和碱》复习课件(共26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 431.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-06-27 00:00:00 | ||
图片预览






文档简介
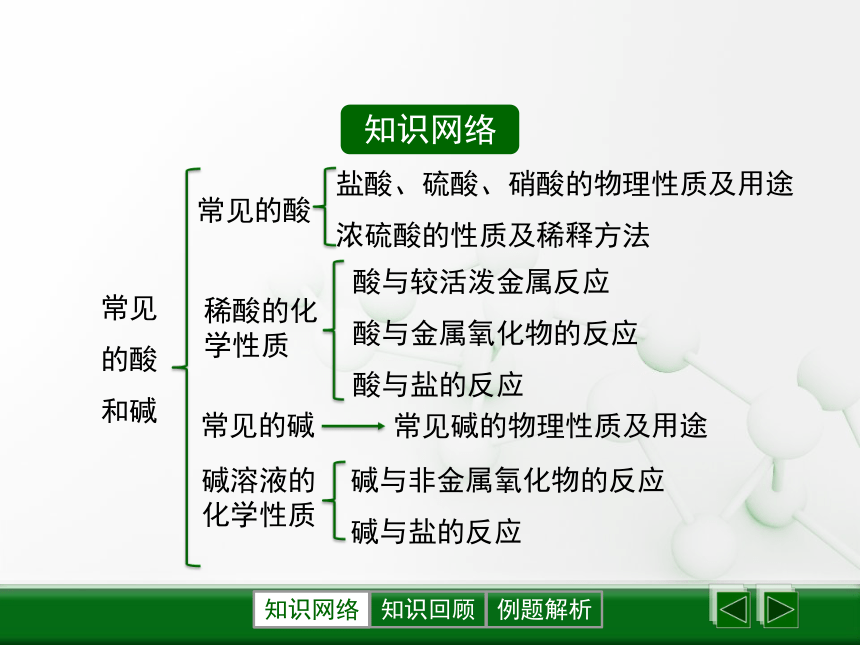
课件26张PPT。第2节 常见的酸和碱知识网络知识网络常见的酸和碱常见的酸稀酸的化学性质常见的碱盐酸、硫酸、硝酸的物理性质及用途
浓硫酸的性质及稀释方法常见碱的物理性质及用途碱与非金属氧化物的反应
碱与盐的反应碱溶液的化学性质酸与较活泼金属反应
酸与金属氧化物的反应
酸与盐的反应知识点1 常见的酸知识回顾知识回顾硫酸、盐酸、硝酸的物理性质及用途H2SO4HClHNO3无色、易挥发,有刺激性气味电镀、食品、化工生产无色油状液体、不易挥发,强腐蚀性,密度较大车用电池、化肥、农药、精炼石油无色液体、易挥发,强腐蚀性,有特殊刺激性气味生产化肥、燃料、炸药知识回顾浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有________________。——可做____________。浓硫酸有强吸水性浓硫酸对衣物、皮肤等有____________。
如果不慎沾上硫酸,应立即用布抹去,再用大量水冲洗。强脱水性强腐蚀性干燥剂浓硫酸的稀释方法:把________缓缓注入盛有_____的烧杯中,用________引流(或沿着烧杯壁缓缓倾倒)并不断______。玻璃棒浓硫酸水搅拌1.酸与指示剂的反应
变红色知识点2 稀酸的化学性质不变色变红色不变色2.酸与较活泼金属的反应
有气泡产生,反应速率:镁>铝>锌>铁①Zn + 2HCl === ZnCl2 + H2↑
②Mg + 2HCl === MgCl2 + H2↑
③2Al + 6HCl === 2AlCl3 + 3H2↑
④Fe + 2HCl === FeCl2 + H2↑知识回顾知识回顾Fe2O3+3H2SO4 == Fe2(SO4)3 + 3H2O铁锈溶解,溶液变黄3.酸与金属氧化物的反应
4.酸与盐的反应
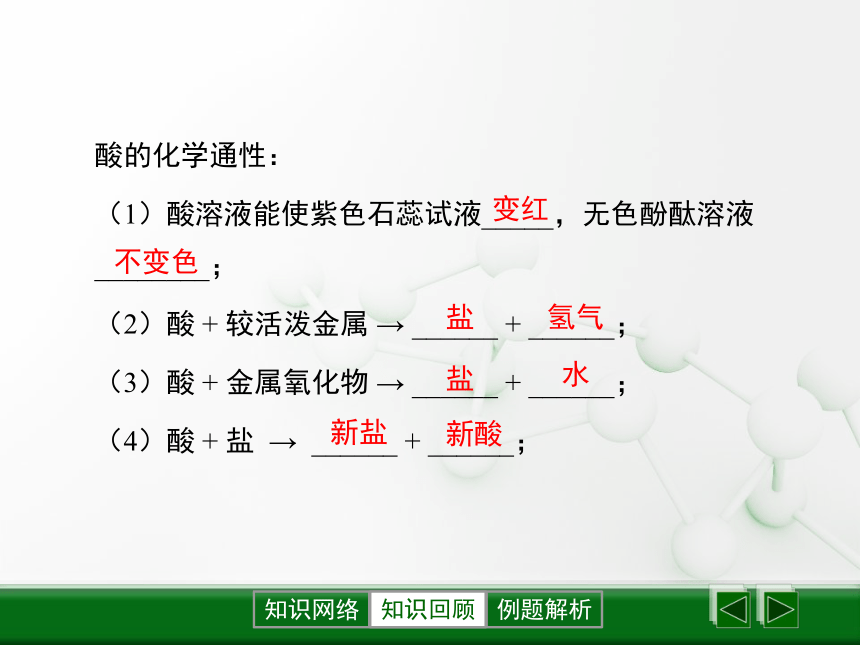
AgNO3+HCl == AgCl ↓ + HNO3有白色沉淀生成酸的化学通性:
(1)酸溶液能使紫色石蕊试液_____,无色酚酞溶液________;
(2)酸 + 较活泼金属 → ______ + ______;
(3)酸 + 金属氧化物 → ______ + ______;
(4)酸 + 盐 → ______ + ______;
知识回顾变红不变色盐氢气盐水新盐新酸【注意】
(1)硝酸的性质比较特殊,它与较活泼金属反应时,一般不产生氢气,而是生成氮氧化物等,故无此通性;
(2)由金属离子和酸根离子组成的化合物统称为盐;
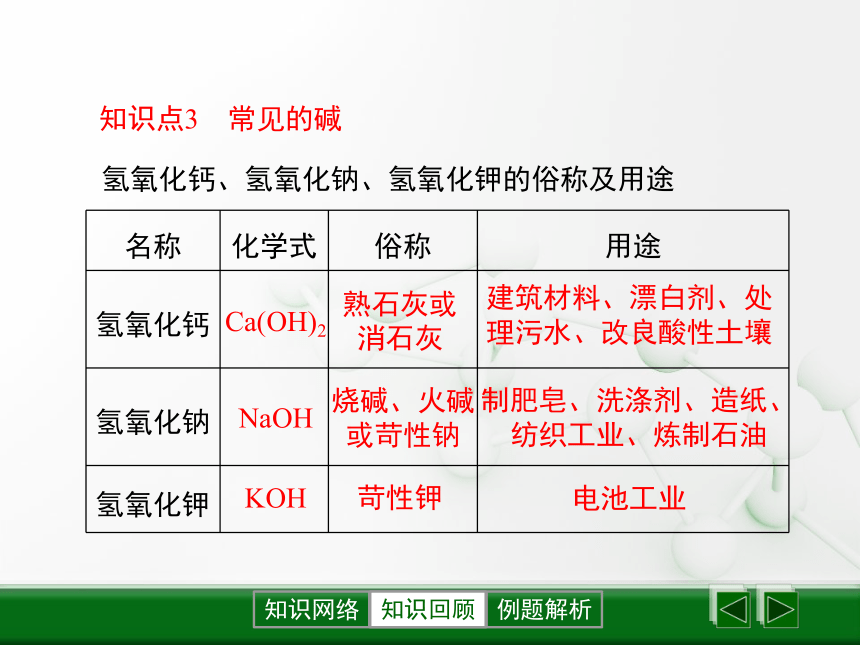
(3)硝酸银呈白色沉淀,且不溶于稀硝酸,是检验氯离子的试剂。知识回顾知识点3 常见的碱知识回顾氢氧化钙、氢氧化钠、氢氧化钾的俗称及用途熟石灰或消石灰烧碱、火碱或苛性钠苛性钾Ca(OH)2NaOHKOH建筑材料、漂白剂、处理污水、改良酸性土壤制肥皂、洗涤剂、造纸、纺织工业、炼制石油电池工业知识回顾由石灰石生产熟石灰过程中的化学反应:
①__________________________________________;
②__________________________________________。NaOH溶液和石灰水都能吸收_____________,固体氢氧化钠在空气中不但易吸收水蒸气而_____,还能吸收二氧化碳气体而_______。氢氧化钠具有强烈的___________,使用时要小心。
二氧化碳气体潮解变质腐蚀性 CaO + H2O == Ca(OH)2CaCO3 === CaO + CO2↑高温2.碱与非金属氧化物的反应知识点4 碱溶液的化学性质1.碱与指示剂的反应
变蓝色变红色变蓝色变红色试管液面上升,第一支试管液面比第二支低①H2O + CO2 == H2CO3
②2NaOH+CO2=Na2CO3+H2O知识回顾3.碱与盐反应①蓝色退去,生成蓝色沉淀
②黄色退去,生成红褐色沉淀①Ca(OH)2+CuSO4 ==Cu(OH)2↓+CaSO4
②2FeCl3 +3Ca(OH)2 ==2Fe(OH)3↓ +3CaCl2 知识回顾碱的化学通性:
(1)碱溶液能使紫色石蕊试液_____,无色酚酞溶液________;
(2)碱 + 非金属氧化物 → ______ + ______;
(3)碱 + 盐 → ______ + ______;
变蓝变红盐水新盐新碱碱(或酸)具有相似化学性质的原因:
碱在水溶液中都能产生氢氧根离子(OH--),酸在水溶液中都能产生大量的氢离子(H+)。知识回顾例题解析例题解析命题角度:考查学生对浓硫酸稀释方法的掌握
例1 如图所示是稀释浓硫酸实验的示意图。
?类型一 浓硫酸的稀释(1)写出右图中a、b两种仪器的名称:a ________,b _______;
(2)b容器所盛的试剂是 ______(填“水”或“浓硫酸”);
(3)稀释时,若两种试剂添加顺序颠倒,将会发生 ____________;
(4)在稀释过程中玻璃棒的作用是 ___________________________________________。玻璃棒量筒浓硫酸液体溅出搅拌加速溶解,并使热量及时的散发掉例题解析例题解析【解析】(1)由图可知仪器为:玻璃棒,量筒;
(2)由于稀释浓硫酸时,是把浓硫酸的注入到水中;
(3)由于水的密度比浓硫酸小,而且两者混合时会放出大量的热,因此若把水注入到浓硫酸中时会引起水沸腾,液体溅出;
(4)由于浓硫酸和水混合时会放出大量的热,因此应该用玻璃棒不断的搅拌,使产生的热量及时的散发掉。例题解析命题角度:考查学生对常见酸的物理性质的掌握情况。
例2 下列说法正确的是( )
A.盐酸能使紫色石蕊试液变蓝
B.浓硫酸露置于空气中,溶质质量分数变大
C.露置于空气中的固体氢氧化钠,其成分不会发生变化
D.打开浓盐酸的试剂瓶,瓶口会产生白雾D?类型二 常见酸的物理性质和用途例题解析【解析】A、盐酸能使紫色石蕊试液变红,故A错误;B、浓硫酸露置于空气中,由于强吸水性,导致溶剂质量增大,溶质质量不变,故溶质质量分数变小,故B错误;C、固体氢氧化钠露置于空气中,会吸水,并与空气中二氧化碳反应生成碳酸钠,会发生变质,故C错误;D、浓盐酸具有较强挥发性,打开瓶塞会有大量的氯化氢气体挥发出,形成白色雾,故D正确;
故选:D。例题解析命题角度:考查学生对稀酸的化学性质的认识
例3 甲酸(HCOOH)是一种无色、有刺激性气味的液体,有较强的腐蚀性.
(1)若证明甲酸具有酸性,可选用的指示剂是____(2)甲酸与盐酸化学性质相似,能与碳酸钠反应,产生__________气体.
(3)利用浓硫酸的脱水性,将甲酸和浓硫酸混合加热.甲酸脱水后会转变成____________________.?类型三 酸的化学通性石蕊试剂二氧化碳一氧化碳例题解析【解析】(1)若证明甲酸具有酸性,可选用的指示剂是紫色石蕊溶液因为紫色石蕊试液遇酸性溶液变红;
(2)甲酸与盐酸化学性质相似,能与碳酸钠反应,产生二氧化碳气体;
(3)利用浓硫酸的脱水性,将甲酸和浓硫酸混合加热.从一个甲酸分子中按水的组成脱去一个水分子后会转变成 一氧化碳。【变式题】盐酸或稀硫酸常用作金属表面的清洁剂是利用了它们化学性质中的( )
A 、能与碱反应
B 、能与金属反应
C 、能与某些金属氧化物反应
D 、能与紫色石蕊试液反应C例题解析【解析】
金属表面清洁实际上是除锈,实际上是酸与金属氧化物反应生成可溶性的盐的过程,因此酸与碱、金属以及指示剂均无关系,只有酸与金属氧化物的反应与该过程有关。
故选C。例题解析例题解析命题角度:考查学生对常见碱的认识。
例4 下列关于氢氧化钠的叙述不正确的是( )
A、固体氢氧化钠要密封保存,因为在氢氧化钠空气中易潮解但不变质
B、氢氧化钠溶液能使紫色石蕊试液变红
C、固体氢氧化钠可作氢气、氧气、一氧化碳这些气体的干燥剂
D、氢氧化钠溶液对皮肤、纸张、织物有强腐蚀性
?类型四 常见碱的性质和用途B例题解析【解析】氢氧化钠(NaOH),俗称烧碱、火碱、苛性钠,常温下是一种白色晶体,具有强腐蚀性.易吸收空气中的水分易潮解可用作干燥剂和易与空气中二氧化碳反应生成碳酸钠故密封干燥保存.易溶于水,其水溶液呈强碱性,能使酚酞变红;使紫色石蕊试液变蓝.由以上所知道的内容可判断选项A、C、D错误。
故选B。例题解析命题角度:考查学生对碱溶液的化学性质的掌握情况。
例5 氢氧化钠、氢氧化钙都是实验室常用的碱.要鉴别氢氧化钠稀溶液和饱和氢氧化钙溶液,下列方法不能够达到目的是( )
A.分别滴加碳酸钠溶液 B.分别通入二氧化碳
C.分别滴加稀盐酸 D.分别加热原溶液至80℃C?类型五 碱溶液的化学性质【解析】A、向氢氧化钠、氢氧化钙溶液分别滴加碳酸钠溶液,有白色沉淀生成的是氢氧化钙溶液,无现象的是氢氧化钠;B、二氧化碳能使澄清的石灰水变浑浊,通入二氧化碳后变浑浊的是氢氧化钙,没有明显现象的是氢氧化钠;C、向氢氧化钠、氢氧化钙溶液中分别滴加稀盐酸,都生成盐和水,没有明显现象,无法区别;D、将氢氧化钠稀溶液和饱和氢氧化钙溶液分别加热原溶液至80℃,由于氢氧化钙越升温溶解度越小,所以会有晶体析出,氢氧化钠则没有晶体析出。故选C。结束例题解析
浓硫酸的性质及稀释方法常见碱的物理性质及用途碱与非金属氧化物的反应
碱与盐的反应碱溶液的化学性质酸与较活泼金属反应
酸与金属氧化物的反应
酸与盐的反应知识点1 常见的酸知识回顾知识回顾硫酸、盐酸、硝酸的物理性质及用途H2SO4HClHNO3无色、易挥发,有刺激性气味电镀、食品、化工生产无色油状液体、不易挥发,强腐蚀性,密度较大车用电池、化肥、农药、精炼石油无色液体、易挥发,强腐蚀性,有特殊刺激性气味生产化肥、燃料、炸药知识回顾浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有________________。——可做____________。浓硫酸有强吸水性浓硫酸对衣物、皮肤等有____________。
如果不慎沾上硫酸,应立即用布抹去,再用大量水冲洗。强脱水性强腐蚀性干燥剂浓硫酸的稀释方法:把________缓缓注入盛有_____的烧杯中,用________引流(或沿着烧杯壁缓缓倾倒)并不断______。玻璃棒浓硫酸水搅拌1.酸与指示剂的反应
变红色知识点2 稀酸的化学性质不变色变红色不变色2.酸与较活泼金属的反应
有气泡产生,反应速率:镁>铝>锌>铁①Zn + 2HCl === ZnCl2 + H2↑
②Mg + 2HCl === MgCl2 + H2↑
③2Al + 6HCl === 2AlCl3 + 3H2↑
④Fe + 2HCl === FeCl2 + H2↑知识回顾知识回顾Fe2O3+3H2SO4 == Fe2(SO4)3 + 3H2O铁锈溶解,溶液变黄3.酸与金属氧化物的反应
4.酸与盐的反应
AgNO3+HCl == AgCl ↓ + HNO3有白色沉淀生成酸的化学通性:
(1)酸溶液能使紫色石蕊试液_____,无色酚酞溶液________;
(2)酸 + 较活泼金属 → ______ + ______;
(3)酸 + 金属氧化物 → ______ + ______;
(4)酸 + 盐 → ______ + ______;
知识回顾变红不变色盐氢气盐水新盐新酸【注意】
(1)硝酸的性质比较特殊,它与较活泼金属反应时,一般不产生氢气,而是生成氮氧化物等,故无此通性;
(2)由金属离子和酸根离子组成的化合物统称为盐;
(3)硝酸银呈白色沉淀,且不溶于稀硝酸,是检验氯离子的试剂。知识回顾知识点3 常见的碱知识回顾氢氧化钙、氢氧化钠、氢氧化钾的俗称及用途熟石灰或消石灰烧碱、火碱或苛性钠苛性钾Ca(OH)2NaOHKOH建筑材料、漂白剂、处理污水、改良酸性土壤制肥皂、洗涤剂、造纸、纺织工业、炼制石油电池工业知识回顾由石灰石生产熟石灰过程中的化学反应:
①__________________________________________;
②__________________________________________。NaOH溶液和石灰水都能吸收_____________,固体氢氧化钠在空气中不但易吸收水蒸气而_____,还能吸收二氧化碳气体而_______。氢氧化钠具有强烈的___________,使用时要小心。
二氧化碳气体潮解变质腐蚀性 CaO + H2O == Ca(OH)2CaCO3 === CaO + CO2↑高温2.碱与非金属氧化物的反应知识点4 碱溶液的化学性质1.碱与指示剂的反应
变蓝色变红色变蓝色变红色试管液面上升,第一支试管液面比第二支低①H2O + CO2 == H2CO3
②2NaOH+CO2=Na2CO3+H2O知识回顾3.碱与盐反应①蓝色退去,生成蓝色沉淀
②黄色退去,生成红褐色沉淀①Ca(OH)2+CuSO4 ==Cu(OH)2↓+CaSO4
②2FeCl3 +3Ca(OH)2 ==2Fe(OH)3↓ +3CaCl2 知识回顾碱的化学通性:
(1)碱溶液能使紫色石蕊试液_____,无色酚酞溶液________;
(2)碱 + 非金属氧化物 → ______ + ______;
(3)碱 + 盐 → ______ + ______;
变蓝变红盐水新盐新碱碱(或酸)具有相似化学性质的原因:
碱在水溶液中都能产生氢氧根离子(OH--),酸在水溶液中都能产生大量的氢离子(H+)。知识回顾例题解析例题解析命题角度:考查学生对浓硫酸稀释方法的掌握
例1 如图所示是稀释浓硫酸实验的示意图。
?类型一 浓硫酸的稀释(1)写出右图中a、b两种仪器的名称:a ________,b _______;
(2)b容器所盛的试剂是 ______(填“水”或“浓硫酸”);
(3)稀释时,若两种试剂添加顺序颠倒,将会发生 ____________;
(4)在稀释过程中玻璃棒的作用是 ___________________________________________。玻璃棒量筒浓硫酸液体溅出搅拌加速溶解,并使热量及时的散发掉例题解析例题解析【解析】(1)由图可知仪器为:玻璃棒,量筒;
(2)由于稀释浓硫酸时,是把浓硫酸的注入到水中;
(3)由于水的密度比浓硫酸小,而且两者混合时会放出大量的热,因此若把水注入到浓硫酸中时会引起水沸腾,液体溅出;
(4)由于浓硫酸和水混合时会放出大量的热,因此应该用玻璃棒不断的搅拌,使产生的热量及时的散发掉。例题解析命题角度:考查学生对常见酸的物理性质的掌握情况。
例2 下列说法正确的是( )
A.盐酸能使紫色石蕊试液变蓝
B.浓硫酸露置于空气中,溶质质量分数变大
C.露置于空气中的固体氢氧化钠,其成分不会发生变化
D.打开浓盐酸的试剂瓶,瓶口会产生白雾D?类型二 常见酸的物理性质和用途例题解析【解析】A、盐酸能使紫色石蕊试液变红,故A错误;B、浓硫酸露置于空气中,由于强吸水性,导致溶剂质量增大,溶质质量不变,故溶质质量分数变小,故B错误;C、固体氢氧化钠露置于空气中,会吸水,并与空气中二氧化碳反应生成碳酸钠,会发生变质,故C错误;D、浓盐酸具有较强挥发性,打开瓶塞会有大量的氯化氢气体挥发出,形成白色雾,故D正确;
故选:D。例题解析命题角度:考查学生对稀酸的化学性质的认识
例3 甲酸(HCOOH)是一种无色、有刺激性气味的液体,有较强的腐蚀性.
(1)若证明甲酸具有酸性,可选用的指示剂是____(2)甲酸与盐酸化学性质相似,能与碳酸钠反应,产生__________气体.
(3)利用浓硫酸的脱水性,将甲酸和浓硫酸混合加热.甲酸脱水后会转变成____________________.?类型三 酸的化学通性石蕊试剂二氧化碳一氧化碳例题解析【解析】(1)若证明甲酸具有酸性,可选用的指示剂是紫色石蕊溶液因为紫色石蕊试液遇酸性溶液变红;
(2)甲酸与盐酸化学性质相似,能与碳酸钠反应,产生二氧化碳气体;
(3)利用浓硫酸的脱水性,将甲酸和浓硫酸混合加热.从一个甲酸分子中按水的组成脱去一个水分子后会转变成 一氧化碳。【变式题】盐酸或稀硫酸常用作金属表面的清洁剂是利用了它们化学性质中的( )
A 、能与碱反应
B 、能与金属反应
C 、能与某些金属氧化物反应
D 、能与紫色石蕊试液反应C例题解析【解析】
金属表面清洁实际上是除锈,实际上是酸与金属氧化物反应生成可溶性的盐的过程,因此酸与碱、金属以及指示剂均无关系,只有酸与金属氧化物的反应与该过程有关。
故选C。例题解析例题解析命题角度:考查学生对常见碱的认识。
例4 下列关于氢氧化钠的叙述不正确的是( )
A、固体氢氧化钠要密封保存,因为在氢氧化钠空气中易潮解但不变质
B、氢氧化钠溶液能使紫色石蕊试液变红
C、固体氢氧化钠可作氢气、氧气、一氧化碳这些气体的干燥剂
D、氢氧化钠溶液对皮肤、纸张、织物有强腐蚀性
?类型四 常见碱的性质和用途B例题解析【解析】氢氧化钠(NaOH),俗称烧碱、火碱、苛性钠,常温下是一种白色晶体,具有强腐蚀性.易吸收空气中的水分易潮解可用作干燥剂和易与空气中二氧化碳反应生成碳酸钠故密封干燥保存.易溶于水,其水溶液呈强碱性,能使酚酞变红;使紫色石蕊试液变蓝.由以上所知道的内容可判断选项A、C、D错误。
故选B。例题解析命题角度:考查学生对碱溶液的化学性质的掌握情况。
例5 氢氧化钠、氢氧化钙都是实验室常用的碱.要鉴别氢氧化钠稀溶液和饱和氢氧化钙溶液,下列方法不能够达到目的是( )
A.分别滴加碳酸钠溶液 B.分别通入二氧化碳
C.分别滴加稀盐酸 D.分别加热原溶液至80℃C?类型五 碱溶液的化学性质【解析】A、向氢氧化钠、氢氧化钙溶液分别滴加碳酸钠溶液,有白色沉淀生成的是氢氧化钙溶液,无现象的是氢氧化钠;B、二氧化碳能使澄清的石灰水变浑浊,通入二氧化碳后变浑浊的是氢氧化钙,没有明显现象的是氢氧化钠;C、向氢氧化钠、氢氧化钙溶液中分别滴加稀盐酸,都生成盐和水,没有明显现象,无法区别;D、将氢氧化钠稀溶液和饱和氢氧化钙溶液分别加热原溶液至80℃,由于氢氧化钙越升温溶解度越小,所以会有晶体析出,氢氧化钠则没有晶体析出。故选C。结束例题解析
