粤教版九下化学第八章《常见的酸、碱、盐》复习课件(共31张PPT)
文档属性
| 名称 | 粤教版九下化学第八章《常见的酸、碱、盐》复习课件(共31张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 487.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2015-06-27 15:43:54 | ||
图片预览










文档简介
课件31张PPT。第八章 常见的酸、碱、盐知识网络知识网络常见的酸碱盐溶液的酸碱性常见的酸和碱酸和碱的反应酸碱指示剂
pH常见的盐化学肥料溶液的酸碱性物质酸碱性强弱常见酸的物理性质及用途,稀酸的化学通性
常见碱的物理性质及用途,碱溶液的化学通性中和反应
中和反应的应用复分解反应几种常见盐的用途
盐的组成和化学性质复分解反应发生条件常用化肥的成分及功效
铵态氮肥的检验及合理施用化肥知识点1 溶液的酸碱性知识回顾知识回顾1.像石蕊、酚酞这样,能跟酸或碱的溶液起作用而显示不同颜色的物质叫_____________。遇酸溶液______遇碱溶液______酚酞试液遇酸溶液_______遇碱溶液_____石蕊试液酸碱指示剂变红变蓝不变色变红知识回顾2.人们用_______来表示溶液酸性和碱性强弱的程度。pH=7时,溶液呈____pH<7时,溶液呈____pH>7时,溶液呈____溶液酸性越强,pH____;溶液碱性越强,pH_____。越小越大中性酸性碱性pHpH测定方法:在__________上放一小片pH试纸,用__________蘸取被测液,滴到试纸上,把试纸的颜色与______________比较。玻璃片玻璃棒标准比色卡【注意】
①指示剂遇到酸性溶液或碱性溶液时,变色的是指示剂,而不是酸性溶液或碱性溶液;
②根据指示剂颜色的变化,能判断溶液的酸碱性,但不能确定此溶液一定是酸或一定是碱。因为有的盐溶液可能会显酸性或碱性,如Na2CO3溶液显碱性。
③pH试纸测溶液的pH时,pH试纸不能用水润湿;
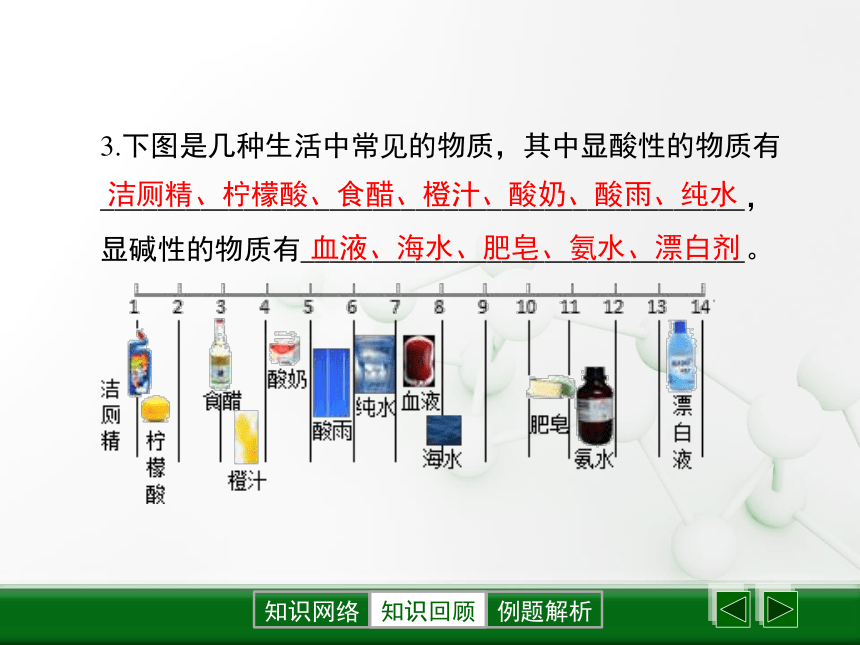
④不能将pH试纸直接放入待测试样溶液中,会污染试剂。知识回顾知识回顾3.下图是几种生活中常见的物质,其中显酸性的物质有_____________________________________________,
显碱性的物质有_______________________________。洁厕精、柠檬酸、食醋、橙汁、酸奶、酸雨、纯水血液、海水、肥皂、氨水、漂白剂知识回顾4.pH与生命活动
①人的体液都有一定的____范围,测定人体内或排泄出的体液的pH,可以了解人体的健康状况。
②农作物适宜在pH为____或接近____的土壤中生长。
③测定雨水的pH(因溶解有CO2,正常雨水的pH约为____,酸雨的pH______),可以了解空气的污染情况。pH775.65.6知识点2 常见的酸和碱知识回顾1.硫酸、盐酸、硝酸的物理性质及用途H2SO4HClHNO3无色、易挥发,有刺激性气味电镀、食品、化工生产无色油状液体、不易挥发,强腐蚀性,密度较大车用电池、化肥、农药、精炼石油无色液体、易挥发,强腐蚀性,有特殊刺激性气味生产化肥、燃料、炸药知识回顾2.浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有________________。——可做____________。浓硫酸有强吸水性强脱水性强腐蚀性干燥剂浓硫酸的稀释方法:把________缓缓注入盛有_____的烧杯中,用________引流(或沿着烧杯壁缓缓倾倒)并不断______。玻璃棒浓硫酸水搅拌浓硫酸对衣物、皮肤等有____________。
如果不慎沾上硫酸,应立即用布抹去,再用大量水冲洗。变红不变色盐氢气盐水新盐新酸3.酸的化学通性:
(1)酸溶液能使紫色石蕊试液_____,无色酚酞溶液________;
(2)酸 + 较活泼金属 → ______ + ______;
(3)酸 + 金属氧化物 → ______ + ______;
(4)酸 + 盐 → ______ + ______;
知识回顾【注意】
(1)硝酸的性质比较特殊,它与较活泼金属反应时,一般不产生氢气,而是生成氮氧化物等,故无此通性;
(2)由金属离子和酸根离子组成的化合物统称为盐;
(3)硝酸银呈白色沉淀,且不溶于稀硝酸,是检验氯离子的试剂。知识回顾4.氢氧化钙、氢氧化钠、氢氧化钾的俗称及用途熟石灰或消石灰烧碱、火碱或苛性钠苛性钾Ca(OH)2NaOHKOH建筑材料、漂白剂、处理污水、改良酸性土壤制肥皂、洗涤剂、造纸、纺织工业、炼制石油电池工业注:NaOH溶液和石灰水都能吸收_____________,固体氢氧化钠在空气中不但易吸收水蒸气而_____,还能吸收二氧化碳气体而_____。氢氧化钠具有强烈的________,使用时要小心。二氧化碳气体潮解变质腐蚀性知识回顾5.碱的化学通性:
(1)碱溶液能使紫色石蕊试液_____,无色酚酞溶液________;
(2)碱 + 非金属氧化物 → ______ + ______;
(3)碱 + 盐 → ______ + ______;
变蓝变红盐水新盐新碱6.碱(或酸)具有相似化学性质的原因:
碱在水溶液中都能产生氢氧根离子(OH--),酸在水溶液中都能产生大量的氢离子(H+)。知识回顾知识点3 酸和碱的反应1.中和反应:_____和_____生成_____和_____。
反应的实质是酸中解离出的____与碱中解离出的____反应生成水:___________________。酸碱盐水OH-H+H+ + OH- == H2O【注意】
①不少中和反应没有明显的实验现象(如NaOH溶液与稀盐酸的反应),常需借助指示剂来判断反应的发生。
②发生中和反应时,会放出热量。
③中和反应属于基本反应类型中的复分解反应。知识回顾2.中和反应的应用①改良酸性或碱性土壤—中和土壤,减轻土壤危害;
②废水处理—中和废水,减轻环境污染;
③医药应用—中和甲酸或胃酸,减轻身体疼痛。3.由两种化合物互相交换成分,生成另外两种化合物的反应,叫做_______________________________。(AB + CD == AD + CB)复分解反应复分解反应发生的条件(满足以下一点即可):
a.___________ ;b.__________ ;c._________ 。有沉淀生成有气体放出有水生成知识回顾知识点4 常见的盐1.几种常见盐的用途无无纯碱小苏打玻璃、造纸、纺织和洗涤剂的生产等焙制糕点、治疗胃酸过多、灭火剂的原料建筑材料、补钙剂、炼铁、炼钢原料等食品加工调味、医用生理盐水、化工原料等知识回顾2.盐的分类:根据________的不同,盐可以分为钠盐、钾盐、镁盐、铁盐、铵盐等。根据________的不同,盐可以分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等。阳离子阴离子3.盐与酸、碱、其它盐间可能发生复分解反应:
盐 + 酸 → ______+ ______
盐 + 碱 → ______ + ______
盐1 + 盐2 → _______ + ______
新盐 新酸新盐 新碱 新盐1 新盐2 注:①铵根离子和酸根离子组成的化合物也属盐(铵盐);
②硫酸钡沉淀不溶于稀硝酸,可用氯化钡溶液鉴别硫酸和可溶性硫酸盐。知识回顾知识点5 化学肥料1.最主要的化学肥料_______、_______、_______、________。
2.各类化肥的主要功效:氮肥______、磷肥______、钾肥_______、复合肥________。
3.铵态氮肥与碱混合加热,都有刺激性气味______放出,能使湿润的红色石蕊试纸____,这些可用于铵态氮肥的检验。
4.化肥的不合理施用会带来______问题,提倡合肥的____________,减少_______。氮肥磷肥钾肥复合肥壮叶壮果壮茎多元肥效氨气变蓝环境合理施用污染知识回顾例题解析例题解析?类型一 酸碱指示剂
命题角度:考查学生对酸碱指示剂的掌握情况。
例1 某同学在晚会上表演如下魔术:用毛笔蘸取一种无色液体在一张白纸上写了“化学魔术”四字,然后再喷上一种无色液体,白纸上立即出现了红色的“化学魔术”四字。该生先后所用的无色液体可能是( )
A.石蕊试液、稀硫酸 B.酚酞试液、“雪碧”饮料
C.NaOH溶液、酚酞试剂 D.CuSO4溶液、NaOH溶液C例题解析【解析】从题目信息可知是两种无色物质混合后呈现红色,石蕊溶液为紫色,CuSO4溶液为蓝色,故A项和D项错误;“雪碧”饮料呈现酸性,遇酚酞不会变色。
故选C。例题解析?类型二 pH 值苹果红命题角度:考查学生对溶液酸碱度的认识
例2 一些食物的近似pH如下表:
(1)苹果汁和葡萄汁相比较,酸性较强的是______,它能使紫色石蕊试液变成______色;例题解析(2)人的胃酸中主要成分是______,对于胃酸过多的人,空腹时最宜食用上述食物中的______;在医疗上,治疗胃酸过多的药物之一“胃舒平”其主要成分是________,请写出它与胃酸反应的化学方程式______________________
盐酸【解析】(1)从表中可以看出苹果的pH<葡萄的pH,所以苹果汁的酸性较强,酸性溶液能使紫色石蕊试液变红色; (2)人的胃酸中主要成分是盐酸,可食用偏碱性的食物中和胃酸过多,表格中的玉米偏碱性,可食用;氢氧化铝是主要成分,和盐酸发生中和反应,生成对应的盐AlCl3和水玉米氢氧化铝Al(OH)3+3HCl═AlCl3+3H2O例题解析命题角度:考查学生对常见酸的知识的掌握情况
例3 生锈的铁钉放入足量的稀盐酸中,片刻观察到的现象是_________________________________,发生的化学方程式___________________________;反应一段时间后,又观察到的现象是_____________,发生反应的化学方程式为_____________________。?类型三 常见酸的性质和用途铁锈逐渐消失,无色溶液变成黄色Fe2O3 + 6HCl == 2FeCl3+3H2O有气泡产生Fe + 2HCl == FeCl2 + H2↑例题解析【解析】铁锈的主要成分是氧化铁(Fe2O3),将生锈的铁钉放入稀盐酸中,先是表面的铁锈的主要成分氧化铁与盐酸反应生成氯化铁与水,反应现象为:铁锈逐渐消失,无色溶液变成黄色,反应的化学方程式为:Fe2O3 + 6HCl == 2FeCl3+3H2O;当铁锈完全反应后,铁与稀盐酸发生反应,生成氯化亚铁与氢气,反应现象是有气泡产生,反应的化学方程式为:Fe + 2HCl == FeCl2 + H2↑。例题解析命题角度:考查学生对常见碱的知识的掌握情况
例4 氢氧化钠有强烈的________性,所以它的俗名叫苛性钠、火碱或烧碱,氢氧化钠固体曝露在空气中时容易吸收水分而溶解,还易与空气中的____________发生反应而变质,其反应的化学方程式为:___________________________________。?类型四 常见碱的性质和用途腐蚀二氧化碳CO2+ 2NaOH == Na2CO3 + H2O例题解析【解析】氢氧化钠具有强烈的腐蚀性,易与空气中的二氧化碳反应生成碳酸钠和水而变质,化学方程式是:CO2+ 2NaOH == Na2CO3 + H2O。
故答案为:腐蚀; 二氧化碳(CO2);
CO2 + 2NaOH == Na2CO3 + H2O。命题角度:考查学生对中和反应的掌握情况。
例5 下列反应中属于中和反应的是( )
A.CaO + 2HCl == CaCl2 + H2O
B.Ca(OH )2 + 2HCl == CaCl2 + 2H2O
C.CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
D.2NaOH + CO2 == Na2CO3 + H2O?类型五 酸与碱的中和反应B【解析】判断中和反应时,一看反应物是否是酸和碱,二看生成物是否是盐和水。例题解析例题解析命题角度:考查学生对常见盐的知识的掌握情况。
例6 下列实验现象描述正确的是( )
A.氯化铜溶液中加入铁粉后,溶液颜色变为无色
B.硫酸铵中加入氢氧化钠溶液后,微热有无色无味的气体生成
C.硫酸铜溶液中滴加氢氧化钾溶液后,有蓝色沉淀生成
D.酚酞试液中通入二氧化碳变红 ?类型六 常见盐的性质和用途C【解析】A、氯化铜加入铁粉会生成氯化亚铁溶液会变成浅绿色,故此选项错误;
B、铵盐遇碱会放出氨气,氨气有刺激性气味,故此选项错误;
C、硫酸铜能与氢氧化钾反应生成氢氧化铜沉淀,氢氧化铜是蓝色沉淀,故此选项正确;
D、酚酞遇碱性溶液会变红,二氧化碳通入到酚酞中不会生成碱,故此选项错误。
故选C。例题解析命题角度:考查学生对化学肥料知识点的掌握情况
例7 下列关于化肥的说法中不正确的是( )
A.铵盐不能与碱类物质混放或混用
B.化肥对提高农作物产量具有重要作用,应尽量多施用
C.复合肥料能同时均匀地供给作物几种养分,肥效高 D.长期使用硫酸铵、硫酸钾会使土壤酸化、板结。?类型七 化学肥料B例题解析【解析】A、铵盐与碱性物质发生酸碱中和反应,而不能混放和混用.故A正确;
B、化肥对提高农作物产量具有重要作用,但应适量施用.故B错误;
C、复合肥料能同时均匀地供给作物几种养分,肥效高.故C正确;
D、长期施用硫酸铵、硫酸钾会使土壤酸化、板结,应施些复合肥.故D正确;
故选B。结束例题解析
pH常见的盐化学肥料溶液的酸碱性物质酸碱性强弱常见酸的物理性质及用途,稀酸的化学通性
常见碱的物理性质及用途,碱溶液的化学通性中和反应
中和反应的应用复分解反应几种常见盐的用途
盐的组成和化学性质复分解反应发生条件常用化肥的成分及功效
铵态氮肥的检验及合理施用化肥知识点1 溶液的酸碱性知识回顾知识回顾1.像石蕊、酚酞这样,能跟酸或碱的溶液起作用而显示不同颜色的物质叫_____________。遇酸溶液______遇碱溶液______酚酞试液遇酸溶液_______遇碱溶液_____石蕊试液酸碱指示剂变红变蓝不变色变红知识回顾2.人们用_______来表示溶液酸性和碱性强弱的程度。pH=7时,溶液呈____pH<7时,溶液呈____pH>7时,溶液呈____溶液酸性越强,pH____;溶液碱性越强,pH_____。越小越大中性酸性碱性pHpH测定方法:在__________上放一小片pH试纸,用__________蘸取被测液,滴到试纸上,把试纸的颜色与______________比较。玻璃片玻璃棒标准比色卡【注意】
①指示剂遇到酸性溶液或碱性溶液时,变色的是指示剂,而不是酸性溶液或碱性溶液;
②根据指示剂颜色的变化,能判断溶液的酸碱性,但不能确定此溶液一定是酸或一定是碱。因为有的盐溶液可能会显酸性或碱性,如Na2CO3溶液显碱性。
③pH试纸测溶液的pH时,pH试纸不能用水润湿;
④不能将pH试纸直接放入待测试样溶液中,会污染试剂。知识回顾知识回顾3.下图是几种生活中常见的物质,其中显酸性的物质有_____________________________________________,
显碱性的物质有_______________________________。洁厕精、柠檬酸、食醋、橙汁、酸奶、酸雨、纯水血液、海水、肥皂、氨水、漂白剂知识回顾4.pH与生命活动
①人的体液都有一定的____范围,测定人体内或排泄出的体液的pH,可以了解人体的健康状况。
②农作物适宜在pH为____或接近____的土壤中生长。
③测定雨水的pH(因溶解有CO2,正常雨水的pH约为____,酸雨的pH______),可以了解空气的污染情况。pH775.65.6知识点2 常见的酸和碱知识回顾1.硫酸、盐酸、硝酸的物理性质及用途H2SO4HClHNO3无色、易挥发,有刺激性气味电镀、食品、化工生产无色油状液体、不易挥发,强腐蚀性,密度较大车用电池、化肥、农药、精炼石油无色液体、易挥发,强腐蚀性,有特殊刺激性气味生产化肥、燃料、炸药知识回顾2.浓硫酸很快使蔗糖、纸张等脱水,变成碳,可见它有________________。——可做____________。浓硫酸有强吸水性强脱水性强腐蚀性干燥剂浓硫酸的稀释方法:把________缓缓注入盛有_____的烧杯中,用________引流(或沿着烧杯壁缓缓倾倒)并不断______。玻璃棒浓硫酸水搅拌浓硫酸对衣物、皮肤等有____________。
如果不慎沾上硫酸,应立即用布抹去,再用大量水冲洗。变红不变色盐氢气盐水新盐新酸3.酸的化学通性:
(1)酸溶液能使紫色石蕊试液_____,无色酚酞溶液________;
(2)酸 + 较活泼金属 → ______ + ______;
(3)酸 + 金属氧化物 → ______ + ______;
(4)酸 + 盐 → ______ + ______;
知识回顾【注意】
(1)硝酸的性质比较特殊,它与较活泼金属反应时,一般不产生氢气,而是生成氮氧化物等,故无此通性;
(2)由金属离子和酸根离子组成的化合物统称为盐;
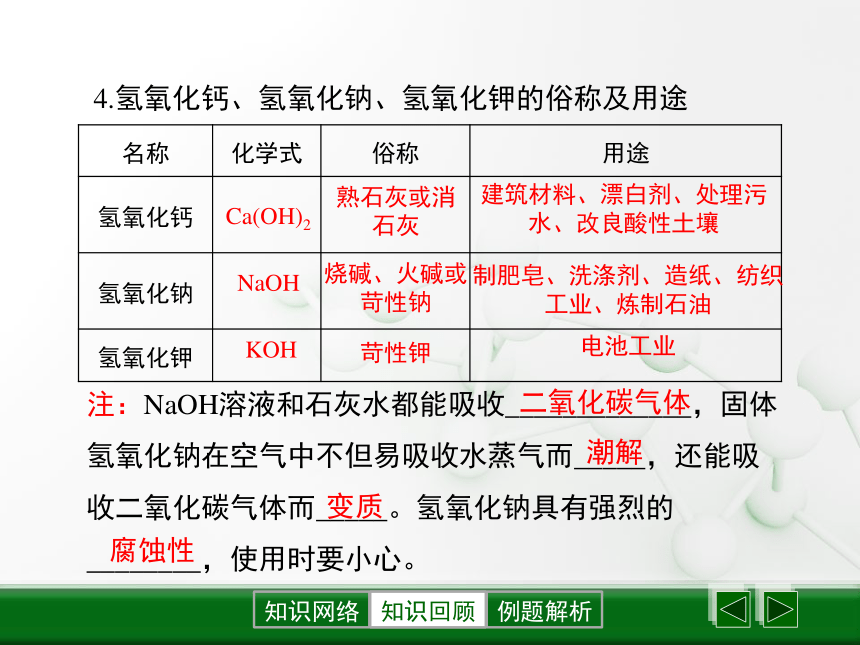
(3)硝酸银呈白色沉淀,且不溶于稀硝酸,是检验氯离子的试剂。知识回顾4.氢氧化钙、氢氧化钠、氢氧化钾的俗称及用途熟石灰或消石灰烧碱、火碱或苛性钠苛性钾Ca(OH)2NaOHKOH建筑材料、漂白剂、处理污水、改良酸性土壤制肥皂、洗涤剂、造纸、纺织工业、炼制石油电池工业注:NaOH溶液和石灰水都能吸收_____________,固体氢氧化钠在空气中不但易吸收水蒸气而_____,还能吸收二氧化碳气体而_____。氢氧化钠具有强烈的________,使用时要小心。二氧化碳气体潮解变质腐蚀性知识回顾5.碱的化学通性:
(1)碱溶液能使紫色石蕊试液_____,无色酚酞溶液________;
(2)碱 + 非金属氧化物 → ______ + ______;
(3)碱 + 盐 → ______ + ______;
变蓝变红盐水新盐新碱6.碱(或酸)具有相似化学性质的原因:
碱在水溶液中都能产生氢氧根离子(OH--),酸在水溶液中都能产生大量的氢离子(H+)。知识回顾知识点3 酸和碱的反应1.中和反应:_____和_____生成_____和_____。
反应的实质是酸中解离出的____与碱中解离出的____反应生成水:___________________。酸碱盐水OH-H+H+ + OH- == H2O【注意】
①不少中和反应没有明显的实验现象(如NaOH溶液与稀盐酸的反应),常需借助指示剂来判断反应的发生。
②发生中和反应时,会放出热量。
③中和反应属于基本反应类型中的复分解反应。知识回顾2.中和反应的应用①改良酸性或碱性土壤—中和土壤,减轻土壤危害;
②废水处理—中和废水,减轻环境污染;
③医药应用—中和甲酸或胃酸,减轻身体疼痛。3.由两种化合物互相交换成分,生成另外两种化合物的反应,叫做_______________________________。(AB + CD == AD + CB)复分解反应复分解反应发生的条件(满足以下一点即可):
a.___________ ;b.__________ ;c._________ 。有沉淀生成有气体放出有水生成知识回顾知识点4 常见的盐1.几种常见盐的用途无无纯碱小苏打玻璃、造纸、纺织和洗涤剂的生产等焙制糕点、治疗胃酸过多、灭火剂的原料建筑材料、补钙剂、炼铁、炼钢原料等食品加工调味、医用生理盐水、化工原料等知识回顾2.盐的分类:根据________的不同,盐可以分为钠盐、钾盐、镁盐、铁盐、铵盐等。根据________的不同,盐可以分为硫酸盐、碳酸盐、硝酸盐、盐酸盐等。阳离子阴离子3.盐与酸、碱、其它盐间可能发生复分解反应:
盐 + 酸 → ______+ ______
盐 + 碱 → ______ + ______
盐1 + 盐2 → _______ + ______
新盐 新酸新盐 新碱 新盐1 新盐2 注:①铵根离子和酸根离子组成的化合物也属盐(铵盐);
②硫酸钡沉淀不溶于稀硝酸,可用氯化钡溶液鉴别硫酸和可溶性硫酸盐。知识回顾知识点5 化学肥料1.最主要的化学肥料_______、_______、_______、________。
2.各类化肥的主要功效:氮肥______、磷肥______、钾肥_______、复合肥________。
3.铵态氮肥与碱混合加热,都有刺激性气味______放出,能使湿润的红色石蕊试纸____,这些可用于铵态氮肥的检验。
4.化肥的不合理施用会带来______问题,提倡合肥的____________,减少_______。氮肥磷肥钾肥复合肥壮叶壮果壮茎多元肥效氨气变蓝环境合理施用污染知识回顾例题解析例题解析?类型一 酸碱指示剂
命题角度:考查学生对酸碱指示剂的掌握情况。
例1 某同学在晚会上表演如下魔术:用毛笔蘸取一种无色液体在一张白纸上写了“化学魔术”四字,然后再喷上一种无色液体,白纸上立即出现了红色的“化学魔术”四字。该生先后所用的无色液体可能是( )
A.石蕊试液、稀硫酸 B.酚酞试液、“雪碧”饮料
C.NaOH溶液、酚酞试剂 D.CuSO4溶液、NaOH溶液C例题解析【解析】从题目信息可知是两种无色物质混合后呈现红色,石蕊溶液为紫色,CuSO4溶液为蓝色,故A项和D项错误;“雪碧”饮料呈现酸性,遇酚酞不会变色。
故选C。例题解析?类型二 pH 值苹果红命题角度:考查学生对溶液酸碱度的认识
例2 一些食物的近似pH如下表:
(1)苹果汁和葡萄汁相比较,酸性较强的是______,它能使紫色石蕊试液变成______色;例题解析(2)人的胃酸中主要成分是______,对于胃酸过多的人,空腹时最宜食用上述食物中的______;在医疗上,治疗胃酸过多的药物之一“胃舒平”其主要成分是________,请写出它与胃酸反应的化学方程式______________________
盐酸【解析】(1)从表中可以看出苹果的pH<葡萄的pH,所以苹果汁的酸性较强,酸性溶液能使紫色石蕊试液变红色; (2)人的胃酸中主要成分是盐酸,可食用偏碱性的食物中和胃酸过多,表格中的玉米偏碱性,可食用;氢氧化铝是主要成分,和盐酸发生中和反应,生成对应的盐AlCl3和水玉米氢氧化铝Al(OH)3+3HCl═AlCl3+3H2O例题解析命题角度:考查学生对常见酸的知识的掌握情况
例3 生锈的铁钉放入足量的稀盐酸中,片刻观察到的现象是_________________________________,发生的化学方程式___________________________;反应一段时间后,又观察到的现象是_____________,发生反应的化学方程式为_____________________。?类型三 常见酸的性质和用途铁锈逐渐消失,无色溶液变成黄色Fe2O3 + 6HCl == 2FeCl3+3H2O有气泡产生Fe + 2HCl == FeCl2 + H2↑例题解析【解析】铁锈的主要成分是氧化铁(Fe2O3),将生锈的铁钉放入稀盐酸中,先是表面的铁锈的主要成分氧化铁与盐酸反应生成氯化铁与水,反应现象为:铁锈逐渐消失,无色溶液变成黄色,反应的化学方程式为:Fe2O3 + 6HCl == 2FeCl3+3H2O;当铁锈完全反应后,铁与稀盐酸发生反应,生成氯化亚铁与氢气,反应现象是有气泡产生,反应的化学方程式为:Fe + 2HCl == FeCl2 + H2↑。例题解析命题角度:考查学生对常见碱的知识的掌握情况
例4 氢氧化钠有强烈的________性,所以它的俗名叫苛性钠、火碱或烧碱,氢氧化钠固体曝露在空气中时容易吸收水分而溶解,还易与空气中的____________发生反应而变质,其反应的化学方程式为:___________________________________。?类型四 常见碱的性质和用途腐蚀二氧化碳CO2+ 2NaOH == Na2CO3 + H2O例题解析【解析】氢氧化钠具有强烈的腐蚀性,易与空气中的二氧化碳反应生成碳酸钠和水而变质,化学方程式是:CO2+ 2NaOH == Na2CO3 + H2O。
故答案为:腐蚀; 二氧化碳(CO2);
CO2 + 2NaOH == Na2CO3 + H2O。命题角度:考查学生对中和反应的掌握情况。
例5 下列反应中属于中和反应的是( )
A.CaO + 2HCl == CaCl2 + H2O
B.Ca(OH )2 + 2HCl == CaCl2 + 2H2O
C.CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
D.2NaOH + CO2 == Na2CO3 + H2O?类型五 酸与碱的中和反应B【解析】判断中和反应时,一看反应物是否是酸和碱,二看生成物是否是盐和水。例题解析例题解析命题角度:考查学生对常见盐的知识的掌握情况。
例6 下列实验现象描述正确的是( )
A.氯化铜溶液中加入铁粉后,溶液颜色变为无色
B.硫酸铵中加入氢氧化钠溶液后,微热有无色无味的气体生成
C.硫酸铜溶液中滴加氢氧化钾溶液后,有蓝色沉淀生成
D.酚酞试液中通入二氧化碳变红 ?类型六 常见盐的性质和用途C【解析】A、氯化铜加入铁粉会生成氯化亚铁溶液会变成浅绿色,故此选项错误;
B、铵盐遇碱会放出氨气,氨气有刺激性气味,故此选项错误;
C、硫酸铜能与氢氧化钾反应生成氢氧化铜沉淀,氢氧化铜是蓝色沉淀,故此选项正确;
D、酚酞遇碱性溶液会变红,二氧化碳通入到酚酞中不会生成碱,故此选项错误。
故选C。例题解析命题角度:考查学生对化学肥料知识点的掌握情况
例7 下列关于化肥的说法中不正确的是( )
A.铵盐不能与碱类物质混放或混用
B.化肥对提高农作物产量具有重要作用,应尽量多施用
C.复合肥料能同时均匀地供给作物几种养分,肥效高 D.长期使用硫酸铵、硫酸钾会使土壤酸化、板结。?类型七 化学肥料B例题解析【解析】A、铵盐与碱性物质发生酸碱中和反应,而不能混放和混用.故A正确;
B、化肥对提高农作物产量具有重要作用,但应适量施用.故B错误;
C、复合肥料能同时均匀地供给作物几种养分,肥效高.故C正确;
D、长期施用硫酸铵、硫酸钾会使土壤酸化、板结,应施些复合肥.故D正确;
故选B。结束例题解析
