第2章《化学键 化学反应规律》(含解析)课时测试题2023-2024学年高一下学期鲁科版(2019)必修第二册
文档属性
| 名称 | 第2章《化学键 化学反应规律》(含解析)课时测试题2023-2024学年高一下学期鲁科版(2019)必修第二册 |  | |
| 格式 | docx | ||
| 文件大小 | 369.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 19:36:12 | ||
图片预览




文档简介
第2章《化学键 化学反应规律》课时测试题
一、单选题
1.下列变化中,属于吸热反应的是( )
①液态水汽化②将胆矾加热变为白色粉末③浓H2SO4稀释④KClO3分解制O2⑤生石灰跟水反应生成熟石灰⑥CaCO3高温分解⑦CO2+C2CO ⑧Ba(OH)2·8H2O与固体NH4Cl混合⑨C+H2O(g) CO+H2⑩Al与盐酸反应
A.①②④⑥⑦⑧⑨ B.②④⑥⑦⑧⑨
C.①③④⑤⑥⑧⑩ D.②④⑧⑨⑩
2.下列物质中含有共价键的化合物的是( )
A.CaO B.NaCl C.H2 D.HCl
3.下列图示变化为吸热反应的是( )
A B C D
A.A B.B C.C D.D
4.下列关于σ键和π键的理解错误的是( )
A.σ键能单独形成,而π键一定不能单独形成
B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C.双键中一定有1个σ键和1个π键,三键中一定有1个σ键和2个π键
D.气体单质中一定存在σ键,可能存在π键
5.下列设备工作时,将化学能转化为电能的是( )
A B C D
硅太阳能电池 锂离子电池 太阳能集热器 燃气灶
A.A B.B C.C D.D
6.下列关于化学键的说法中正确的是( )
A.化学键的形成过程中一定伴随着电子的得失
B.只要有化学键的断裂,一定发生化学反应
C.在共价化合物分子内,一定不存在离子键
D.某物质熔融状态时能导电,则该物质中一定含有离子键
7.研究电化学腐蚀及防护的装置如右图所示。有关说法正确的是( )
A.锌片发生氧化反应作阴极
B.电子从铁片经过导线流向锌片
C.铁片上电极反应为:2H+ + 2e→H2↑
D.该装置可用于研究牺牲阳极的阴极保护法
8.温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见表:
t 0 50 150 250 350
n(PCl3)/mol 0 0.16 0.19 0.20 0.20
下列说法不正确的是( )
A.反应在前50s的平均速率为v(PCl3)=0.001 6 mol L﹣1 s﹣1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol L﹣1,则反应的△H>0
C.相同温度下,起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 molPCl3、2.0 molCl2,达到平衡时,PCl3的转化率大于80%
9.下列事实不能用勒夏特列原理解释的是( )
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.工业合成氨中,将氨气液化分离以提高氨气产率
C.由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
10.X 、Y 为两种主族元素,其原子的最外层电子数分别为1 和6 ,则X 、Y 两种元素形成的化合物( )
A.一定是离子化合物 B.一定是共价化合物
C.一定形成从X2Y型化合物 D.以上说法均不妥当
11.利用Cu+2FeCl3=CuCl2+2FeCl2反应设计一个原电池,下列说法中正确的是( )
A.电极材料为铁和铜,电解质溶液为氯化铁溶液
B.电极材料为铜和石墨,电解质溶液为硝酸铁溶液
C.正极反应式为2Fe3++2e-=2Fe2+
D.负极质量减小,正极质量增加
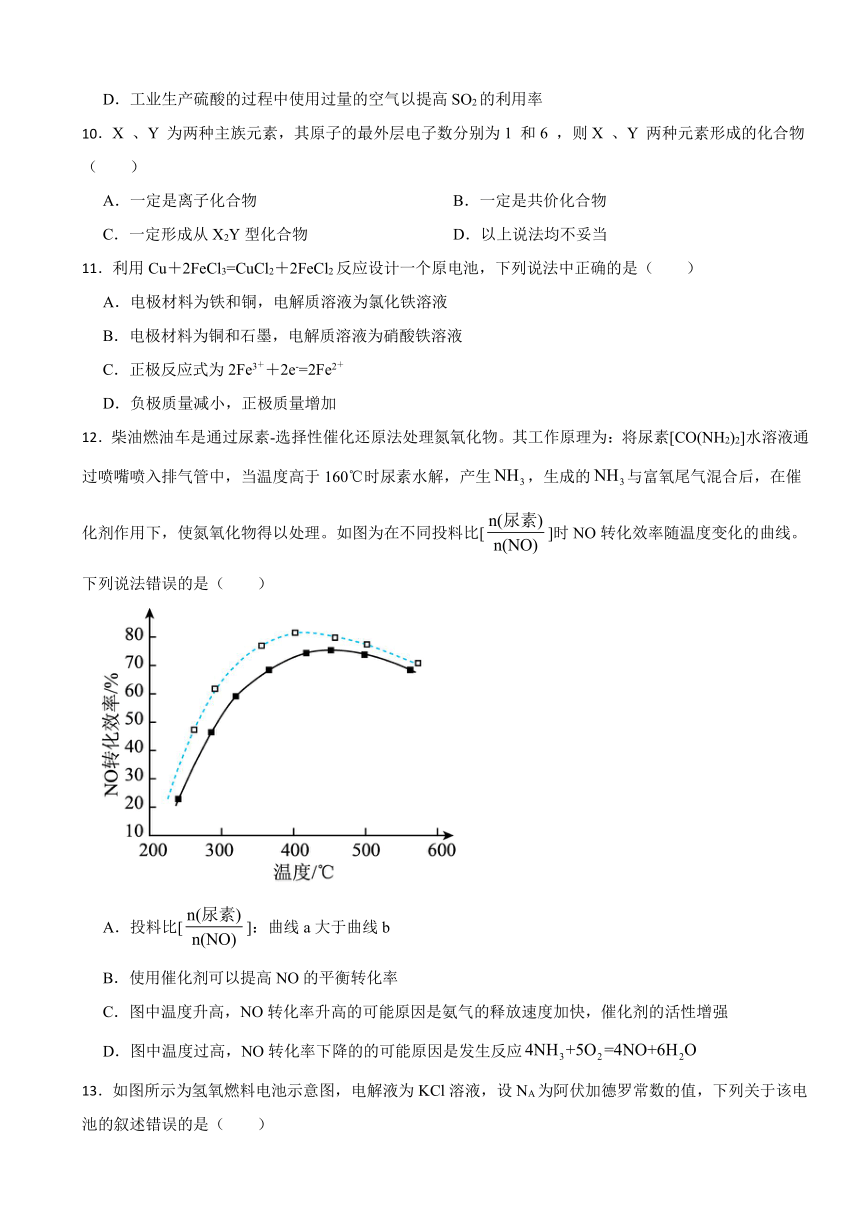
12.柴油燃油车是通过尿素-选择性催化还原法处理氮氧化物。其工作原理为:将尿素[CO(NH2)2]水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解,产生,生成的与富氧尾气混合后,在催化剂作用下,使氮氧化物得以处理。如图为在不同投料比[]时NO转化效率随温度变化的曲线。下列说法错误的是( )
A.投料比[]:曲线a大于曲线b
B.使用催化剂可以提高NO的平衡转化率
C.图中温度升高,NO转化率升高的可能原因是氨气的释放速度加快,催化剂的活性增强
D.图中温度过高,NO转化率下降的的可能原因是发生反应
13.如图所示为氢氧燃料电池示意图,电解液为KCl溶液,设NA为阿伏加德罗常数的值,下列关于该电池的叙述错误的是( )
A.a为负极,b为正极
B.消耗22.4LH2时,电路中转移2NA个电子
C.b极的电极反应式为O2+2H2O+4e-=4OH-
D.电池工作一段时间后,KCl溶液浓度降低
14.已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)= v(NH3) B.v(H2O)= v(O2)
C.v(H2O)= v(NH3) D.v(NO)= v(O2)
15.已知[Co(NH3)6]3+呈正八面体结构,若其中有两个NH3分子分别被H2O取代,所形成的[Co(NH3)4(H2O)2]3+的几何异构体种数有几种(不考虑光学异构)( )
A.2种 B.3种 C.4种 D.6种
16.二氧化硫一空气质子交换膜燃料电池将化学能转变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,其原理如图所示。下列说法错误的是( )
A.负极的电极反应式为SO2+2H2O-2e-=SO42-+4H+
B.反应总式为2SO2+O2+2H2O=2H2SO4
C.质子的移动方向为从电极B到电极A
D.SO2气流速度的大小可能影响电池的电动势
17.下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
B.合成氨工业中使用铁触媒做催化剂
C.用饱和食盐水除去氯气中氯化氢杂质
D.对2HI(g) H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
18.微生物燃料电池(MFC)是一种现代化氨氮去除技术。如图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法错误的是( )
A.好氧微生物反应器中反应为NH +2O2=NO +2H++H2O
B.电子由A极沿导线流向B极
C.标准状况下,B极上每生成3. 36L气体时,理论上电路中有1mol电子通过
D.A极的电极反应式为CH3COO- -8e -+2H2O=2CO2↑+7H+
19.在容积一定的密闭容器中,进行可逆反应N2(g)+3H2(g) 2NH3(g)ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中错误的是( )
A.T2<T1
B.P2>P1
C.若P3<P4,y轴表示N2的转化率
D.若P3>P4,y轴表示NH3的体积分数
二、综合题
20.t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H=﹣196.6kJ/mol.2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为 ;平衡时SO2转化率为 .
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是 .
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%,SO2的转化率为 .
21.
(1)一定条件下的密闭容器中,反应3H2(g)+3CO(g) CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.升高温度 b.加入催化剂 c.减小CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 CH3OH CH3OCH3 H2O
浓度/(mol·L-1) 0.44 0.6 0.6
①比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
22.已知:T℃、P kpa时,容积为V 的密闭容器中充有1molA和2molB,保持恒温恒压使反应达平衡:A(g)+B(g) C(g),平衡时C 的体积分数为40℅。
(1)欲保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,则平衡时体系容积为 ,C的体积分数为 。
(2)另取一个容积固定不变的密闭容器,仍控制温度为T℃,加入1molB和1molC,要使平衡时C 的体积分数仍为40℅,则该密闭容器体积为 。
23.
(1)下列方法中可以证明 2HI(g) H2(g)+I2(g)已达平衡状态的是 。
①单位时间内生成 n mol H2 的同时生成 n mol HI;
②一个 H-H 键断裂的同时有一个 H-I键断裂;
③百分组成ω(HI)=ω(I2);
④反应速率v(H2)=v(I2)= v(HI)时;
⑤c(HI):c(H2):c(I2)=2:1:1 时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均相对分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化;
(2)对于合成氨上述能说明达到平衡状态的是 。
24.一定条件下,在密闭容器中充入1 mol SO2与2 moI NO2发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)△H=-42kJ·mol-1。回答下列问题:
(1)恒温恒容下,在反应平衡体系中再充入一定量SO2,则NO2的平衡转化率 (填“增大”“减小”或“不变”,下同)
(2)恒温恒压下,在反应平衡体系中再充入一定量NO2,则NO2的平衡浓度 。
(3)恒容下,升高温度,上述反应的平衡常数K 。
(4)恒容下,降低温度,重新达到平衡时 。
答案解析部分
1.【答案】B
【解析】【解答】①液态水汽化为吸热过程,为物理变化,故不选;
②将胆矾加热变为白色粉末,为分解反应,属于吸热反应,故选;
③浓H2SO4稀释放出大量的热,为物理变化,故不选;
④KClO3分解制O2,为分解反应属于吸热反应,故选;
⑤生石灰跟水反应生成熟石灰,为放热反应,故不选;
⑥CaCO3高温分解,为分解反应,属于吸热反应,故选;
⑦CO2+C2CO为吸热反应,
故答案为:;
⑧Ba(OH)2 8H2O与固体NH4Cl混合,为吸热反应,故选;
⑨C+H2O(g)CO+H2,为吸热反应,故选;
⑩Al与HCl反应为放热反应,故不选;
故答案为:B。
【分析】常见吸热反应:①大多数分解反应;②盐的水解;③Ba(OH)2.8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应等。
2.【答案】D
【解析】【解答】A.CaO含有离子键,A不符合题意;
B.NaCl含有离子键,B不符合题意;
C.H2含有共价键但是却为单质,C不符合题意;
D.HCl含有共价键且为化合物,D符合题意;
故答案为:D。
【分析】非金属元素的原子之间易形成共价键,活泼金属和活泼非金属元素之间易形成离子键。
3.【答案】D
【解析】【解答】A、锌粉和稀盐酸的反应为放热反应,故A不符合题意;
B、A+B的总能量高于C的总能量,为放热反应,故B不符合题意;
C、浓硫酸稀释时放热,且该反应不是化学反应,故C不符合题意;
D、稀盐酸和碳酸氢钠反应吸热,故D符合题意;
故答案为:D。
【分析】常见的放热反应有:绝大多数的化合反应(灼热的炭与二氧化碳反应除外)、燃烧反应、金属与水或酸的反应、酸碱中和,铝热反应等;
常见的吸热反应有:绝大多数的分解反应、个别的化合反应(如灼热的炭与二氧化碳反应)、少数的复分解反应(如盐酸与碳酸氢钠反应)、以C、CO、H2为还原剂的氧化还原反应反应等。
4.【答案】D
【解析】【解答】A.共价单键中只含 σ键,共价双键和共价三键中含π键和σ键,所以π键一定不能单独形成,A不符合题意;
B.σ键为轴对称,π键为镜面对称,则σ键可以绕键轴旋转,π键不能绕键轴旋转, B不符合题意;
C.双键中一定有1个σ键和1个π键,三键中一定有1个σ键和2个π键,C不符合题意;
D.稀有气体是单原子分子,分子中不存在共价键,也就不存在σ键,所以气体单质中不一定存在 σ键,D符合题意。
【分析】本题考查共价键的形成及类型,注意σ键和π键的形成过程及判断的一般规律即可。
5.【答案】B
【解析】【解答】A.硅太阳能电池将太阳能转化为电能,A不符合题意;
B.锂离子电池的放电过程是将化学能转化为电能,B符合题意;
C.太阳能集热器将太阳能转化为热能,C不符合题意;
D.燃气灶将化学能转化成热能,D不符合题意;
故答案为:B。
【分析】将化学能转化为电能的装置是原电池,找出原电池即可
6.【答案】C
【解析】【解答】A. 有些化学键的形成过程中伴随着电子的得失,共价键是通过共用电子对形成的,没有电子得失,A不符合题意;
B. 发生化学反应的时候,既要有化学键的断裂,又有化学键的形成,有些变化只有化学键断裂,不一定是化学反应,比如氯化氢气体溶于水发生电离,B不符合题意;
C. 在共价化合物分子内,只有共价键,一定不存在离子键,C符合题意;
D. 某化合物熔融状态时能导电,则该化合物中一定含有离子键,金属也可以导电,D不符合题意;
故答案为:C。
【分析】A.化学键的形成常常伴随着能量的变化,出现氧化还原反应时伴随着电子的转移或得失
B.化学变化是化学键的断裂和形成的过程
C.离子化合物中一定有离子键,可能有共价键,但共价化合物中只有共价键
D.金属属于单质,存在金属键
7.【答案】D
【解析】【解答】A、锌片比铁片活泼,根据原电池工作原理,锌片作负极,发生氧化反应,故A不符合题意;
B、根据原电池工作原理,电子从负极经外电路流向正极,即从锌片经外电路流向铁片,故B不符合题意;
C、因为环境时弱碱性,因此发生吸氧腐蚀,正极反应式:O2+2H2O+4e-=4OH-,故C不符合题意;
D、此装置保护铁不被腐蚀,根据原理,该装置课用于研究牺牲阳极的阴极保护法,故D符合题意。
故答案为:D
【分析】A、负极为较活泼的金属;
B、电子从负极流向正极;
C、吸氧腐蚀是指金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化学腐蚀;
D、根据阴极铁不被腐蚀;
8.【答案】D
【解析】【解答】解:A.反应在前50s的平均速率为v(PCl3)= =0.001 6 mol L﹣1 s﹣1,故A正确;
B.由表格数据可知,250s达到平衡,c(PCl3)= =0.1mol/L,则升高温度,平衡时,c(PCl3)=0.11 mol L﹣1,可知升高温度平衡正向移动,则正反应为吸热反应,反应的△H>0,故B正确;
C.
PCl5(g) PCl3(g)+ Cl2(g)
起始 0.5 0 0
转化 0.1 0.1 0.1
平衡 0.4 0.1 0.1
K= =0.025,
起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,Qc= =0.02<K,平衡正向移动,则达到平衡前v(正)>v(逆),故C正确;
D.相同温度下,互为逆反应时,K为倒数关系,起始时向容器中充入2.0 molPCl3、2.0 molCl2,浓度分别均为1mol/L,设转化PCl3的为x,
PCl3(g)+ Cl2(g) PCl5(g)
起始 1 1 0
转化 x x x
平衡 1-x 1-x x
则 = ,解得x=0.51,则转化率为 ×100%=51%<80%,故D错误;
故选D.
【分析】A.结合v= 计算;
B.由表格数据可知,250s达到平衡,c(PCl3)= =0.1mol/L,则升高温度,平衡时,c(PCl3)=0.11 mol L﹣1,可知升高温度平衡正向移动;
C.
PCl5(g) PCl3(g)+ Cl2(g)
起始 0.5 0 0
转化 0.1 0.1 0.1
平衡 0.4 0.1 0.1
K= =0.025,
起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,Qc= =0.02<K;
D.相同温度下,起始时向容器中充入2.0 molPCl3、2.0 molCl2,浓度分别均为1mol/L,设转化PCl3的为x,
PCl3(g)+ Cl2(g) PCl5(g)
起始 1 1 0
转化 x x x
平衡 1-x 1-x x
则 = ,解得x=0.51,以此来解答.
9.【答案】C
【解析】【解答】A.硫氰根离子和铁离子反应存在化学平衡,Fe(SCN)3溶液中加入固体KSCN后颜色变深,平衡向生成硫氰化铁方向移动,所以能用平衡移动原理解释,选项A不符合;
B.将氨气液化分离,平衡向正反应方向移动,提高氨气产率,符合勒夏特列原理,选项B不符合;
C.H2(g)+I2(g) 2HI(g),该反应的反应前后气体计量数之和不变,所以压强不影响平衡移动,由H2、I2蒸气、HI组成的平衡体系加压后颜色变深,说明体积减小碘蒸气浓度增大,颜色加深,与平衡移动无关,所以不能用勒夏特里原理解释,选项C符合;
D.增大空气的量,即增大反应物浓度,平衡正向移动,所以可以提高二氧化硫的转化率,能用勒夏特列原理解释,选项D不符合;
故答案为:C。
【分析】依据勒夏特列原理,改变影响平衡的一个因素,平衡将向减弱这种改变的方向移动分析。
10.【答案】D
【解析】【解答】X、Y为两种主族元素,其原子的最外层电子数分别为1和6,则X、Y两种元素的化合价分别为+1和-2价,可形成X2Y型化合物,也可形成X2Y2型化合物,如过氧化氢,可以是离子化合氧化钠或者过氧化钠,
故答案为:D。
【分析】最外层电子数为1的元素可能是H元素,也可能是碱金属元素,据此分析即可。
11.【答案】C
【解析】【解答】该原电池的总反应可分为两个电极反应,负极:Cu-2e-=Cu2+,正极:2Fe3++2e-=2Fe2+。铜作负极,其质量不断减小;活动性比铜弱的金属或导电非金属作正极,其质量不变;氯化铁溶液为电解质溶液。
A. 若电极材料为铁和铜,铁比铜活泼,铁做负极,铜做正极,与分析不符,故A不符合题意;
B. 利用Cu+2FeCl3=CuCl2+2FeCl2反应设计一个原电池,电解质溶液为氯化铁溶液,故B不符合题意;
C. 根据分析,正极反应式为2Fe3++2e-=2Fe2+,故C符合题意;
D. 根据分析,负极质量减小,正极质量不变,故D不符合题意;
故答案为:C。
【分析】A、电极材料为铁和铜,则负极为铁,故A不符合题意
B、若为硝酸铁,则为铜与硝酸铁反应而不是氯化铁,电解质溶液为氯化铁,故B不符合题意
D、负极质量减小,正极质量不变,故D不符合题意。
12.【答案】B
【解析】【解答】A.尿素分解产生氨气,氨气的浓度越大,越有利于NO的转化,则尿素与NO的比值为a曲线大于b曲线,A项不符合题意;
B.催化剂可加快反应速率,对于平衡转化率不会改变,B项符合题意;
C.随着温度升高,尿素分解氨气的速率加快,NH3的浓度变大,温度升高催化剂活性增加,导致化学反应速率加快,C项不符合题意;
D.温度过高,NO的转化效率下降,NO的浓度反而升高,发生反应,D项不符合题意;
故答案为:B。
【分析】A.尿素分解产生氨气,氨气的浓度越大,越有利于NO的转化;
B.催化剂不影响平衡转化率;
C.温度对催化剂的活性产生影响;
D.高温下发生反应。
13.【答案】B
【解析】【解答】A. a极通入,元素化合价升高发生氧化反应,所以为负极,极通入,元素化合价降低发生还原反应,所以为正极,故A不符合题意;
B. 未指明气体所处状态,故B符合题意;
C. 极为得电子生成,故C不符合题意;
D. 反应有水生成,一段时间后溶液浓度降低,故D不符合题意。
故答案为:B
【分析】解答新型化学电源的步骤:(1)判断电池类型→确认电池原理→核实电子、离子移动方向。(2)确定电池两极→判断电子、离子移动方向→书写电极反应和电池反应。(3)失去电子的一极为负极。(4)电极反应→根据电荷守恒、原子守恒配平电极方程式
14.【答案】A
【解析】【解答】对于反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),
A.速率之比等于化学计量数之比,故v(NH3):v(O2)=4:5,即v(O2)= v(NH3),故A符合题意;
B.速率之比等于化学计量数之比,故v(O2):v(H2O)=5:6,即v(H2O)= v(O2),故B不符合题意;
C.速率之比等于化学计量数之比,故v(NH3):v(H2O)=4:6,即v(H2O)= v(NH3) ,故C不符合题意;
D.速率之比等于化学计量数之比,故v(O2):v(NO)=5:4,即v(NO)= v(O2) ,故D不符合题意;
故答案为A。
【分析】同一化学反应中,不同物质表示的化学反应速率之比等于其化学计量数之比。
15.【答案】A
【解析】【解答】[Co(NH3)6]3+呈正八面体结构,若其中有两个NH3分子分别被H2O取代, 所形成的[Co(NH3)4(H2O)2]3+的几何异构体种数有正八面体和斜八面体两种不同的类型,因此选项是A。
【分析】根据空间构型可以知道Co处于中心,而氨气分子处于八面体的留个顶点位置,结构高度对称,上下的顶点一样,以及中间四个顶点一样,取代时可以都是上下顶点,还可以是上下各一个顶点,以及中间四个顶点任意一个,形成两种结构
16.【答案】C
【解析】【解答】A. A极通入SO2,SO2在负极失电子生成SO42-,则电极反应为SO2+2H2O-2e-=SO42-+4H+,故A不符合题意;
B.该电池的反应原理为二氧化硫与氧气的反应,反应总式为2SO2+O2+2H2O=2H2SO4,故B不符合题意;
C. A为负极,B为正极,质子的移动方向为从电极A到电极B,故C符合题意;
D.反应物的浓度大,反应速率快,SO2气流速度的大小可能影响电池的电动势,故D不符合题意;
故答案为:C。
【分析】原电池是将化学能转变成电能,负极失电子发生氧化反应,正极得电子发生还原反应。电子从负极流向正极。
17.【答案】B
【解析】【解答】勒夏特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。A、加入硝酸银溶液后,银离子消耗溴水中的溴离子,生成溴化银沉淀,溶液中溴离子浓度减小,平衡向着正向移动,能够用勒夏特列原理解释,不符合题意;
B、因为催化剂不影响化学平衡,不能用勒夏特列原理解释,符合题意;
C、用饱和食盐水除去氯气中氯化氢杂质的反应原理为:Cl2+H2O HCl+HClO,饱和食盐水中氯离子的浓度很高,氯离子的浓度高能使该反应平衡向逆向移动,能够用勒夏特列原理解释,不符合题意;
D、通入氢气后氢气浓度增大,平衡向着氢气浓度减小的方向移动,能够用勒夏特列原理解释,不符合题意;
故答案为:B。
【分析】勒夏特列原理是化学平衡原理,而催化剂能同等程度的加快正逆反应速率,正逆反应速率仍然相等,化学平衡不移动。
18.【答案】C
【解析】【解答】A.NH4+在好氧微生物反应器中转化为NO3-,结合电子守恒、电荷守恒得到反应的离子方程式为NH4++2O2═NO3-+2H++H2O,故A不符合题意;
B.微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,所以电子由A(负)极沿导线流向B(正)极,故B不符合题意;
C.NO3-离子在B(正)极得到电子生成氮气,电极反应式为2NO3-+12H++10e-=N2↑+6H2O,标准状况下,生成3. 36LN2时,即n(N2)= =0.15mol,理论上电路中有1.5mol电子通过;故C符合题意;
D.酸性介质中,CH3COO-在原电池A(负)极失电子,发生氧化反应生成CO2气体,则A极的电极反应式为CH3COO--8e-+2H2O═2CO2↑+7H+,故D不符合题意;
故答案为:C。
【分析】A.铵根离子氮元素-3价,具有还原性,氧气具有氧化性,可发生氧化还原反应
B.A极区,通入的醋酸跟,出来的是二氧化碳,碳元素的化合价升高,失去电子,发生氧化反应,做负极,B极区,硝酸根中氮元素得电子,发生还原反应,变为氮气。
C.根据B极电极反应式进行计算
D.A极区,通入的醋酸跟,出来的是二氧化碳,碳元素的化合价升高,失去电子,发生氧化反应
19.【答案】C
【解析】【解答】A.根据图1可知,在压强均为P2的条件下,温度为T1的曲线首先达到平衡状态,这说明温度为T1时反应速率快,达到平衡的时间少。温度高反应速率快,所以温度是T2<T1,A不符合题意;
B.碳氧根据图1可知,在温度均T1的条件下,压强为P2的首先达到平衡状态,这说明压强为P2时反应速率快,达到平衡的时间少,压强大反应速率快,所以压强是P2>P1,B不符合题意;
C.该反应是体积减小的可逆反应,增大压强反应物的转化率增大。若P3<P4,则压强为P4时的转化率大于压强P3时的转化率,C符合题意;
D.增大压强平衡向正反应方向移动,氨气的体积分数增大,所以若P3>P4,y轴可以表示NH3的体积分数,D不符合题意;
故答案为:C。
【分析】根据“先拐先平数值大”进行分析,根据化学平衡的移动分析转化率和体积分数的变化。
20.【答案】(1)0.1mol L﹣1 min﹣1;20%
(2)A;B;E
(3)A;D
(4)80%
【解析】【解答】解:(1)还剩余0.8 mol氧气可知:反应消耗0.4mol SO2和0.2mol O2,生成0.4mol SO3,
三氧化硫的反应速率为v(SO3)= = =0.1mol L﹣1 min﹣1,
SO2转化率= ×100%= ×100%=20%,
故答案为:0.1mol L﹣1 min﹣1;20%;(2)A.容器内压强不再发生变化,该反应两边气体体积不相等,反应过程中压强是变量,压强不变,该反应达到了平衡状态,故A正确;
B.SO2的体积分数不再发生变化,表明正逆反应速率相等,达到了平衡状态,故B正确;
C.容器内气体原子总数不再发生变化,根据原子守恒,原子总数始终不变,所以原子总数不能作为判断平衡状态的依据,故C错误;
D.相同时间内消耗2nmolSO2的同时消耗nmolO2,都是指的是正反应方向,因此不能作为判断平衡状态的依据,故D错误;
E.相同时间内消耗2nmolSO2的同时生成nmolO2,相同时间内消耗2n mol SO2等效于消耗n mol O2,同时生成n mol O2,正反应速率等于逆反应速率,故E正确;
故答案:ABE;(3)A.向容器中通入少量O2,即增大氧气的浓度,能使平衡正向移动并能提高SO2转化率,故A正确;
B.向容器中通入少量SO2,即增大二氧化硫的浓度,能使平衡正向移动但是能降低了SO2转化率,故B错误;
C.使用催化剂,不会影响化学平衡的移动,也不会改变二氧化硫的转化率,故C错误;
D.降低温度,化学平衡正向移动,并能提高SO2转化率,故D正确;
E.向容器中通入少量氦气,当恒容时,各组分的浓度不变,则平衡不移动,故E错误.
故选:AD;(4)t℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,设二氧化硫和氧气物质的量为1mol,反应达到化学平衡时,混合气体体积减少了20%,则反应的氧气体积为2×20%=40%,则反应的二氧化硫为80%,即转化率为80%,
故答案为:80%.
【分析】(1)根据平均反应速率v= 计算出反应速率;根据平衡时SO2转化率= ×100%计算;(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变,据此判断平衡状态;(3)根据化学平衡的影响因素来回答;(4)依据反应前后气体体积减少为反应氧气的量分析计算.
21.【答案】(1)c、e
(2)>;0.04 mol·L-1;0.16 mol·(L·min)-1
【解析】【解答】(1)正反应是放热反应,升高温度平衡左移,CO转化率减小;加入催化剂,平衡不移动,转化率不变;减少CO2的浓度、分离出二甲醚,平衡右移,CO转化率增大;增大CO浓度,平衡右移,但CO转化率降低,故答案为:c、e。
(2)此时的浓度商Qc=1.86<400,反应未达到平衡状态,向正反应方向移动,故v(正)>v(逆);设平衡时生成物的浓度为(0.6 mol·L-1+x),则甲醇的浓度为(0.44 mol·L-1-2x),根据平衡常数表达式可得,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。由表可知,甲醇的起始浓度为(0.44+1.2) mol·L-1=1.64 mol·L-1,其平衡浓度为0.04 mol·L-1,10 min内变化的浓度为1.6 mol·L-1,故v(CH3OH)=0.16 mol·(L·min)-1。
【分析】(1)要提高CO的转化率,则应使平衡正向移动,结合平衡移动的影响因素进行分析;
(2)①由浓度商与平衡常数的大小确定反应进行的方向,从而确定正逆反应速率的大小;
②由平衡时各物质的物质的量浓度,结合平衡常数进行计算;
根据速率公式计算反应速率;
22.【答案】(1)10V/7;40%
(2)5V/7
【解析】【解答】⑴欲保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,这是在恒温恒容条件下的等效平衡
A(g) + B(g)
C(g)
起始(mol) 1 2 0
转化(mol) x x x
平衡(mol) 1-x 2-x x
依题意可知:
解之得:
也就是说平衡后总的物质的量为:
3mol的混合气体占的体积为V,那么
的气体占的体积为:
所以,保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,则平衡时体系容积为
;但是平衡不移动,体积分数不变。
⑵这是等温等容条件下的等效平衡,体积只能是等于原来的
【分析】(1) 保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,相当于等效平衡,按照原平衡计算体积比,然后按照倍数关系进行分析即可;
(2)按照恒温恒容下化学计量数不相等的等效平衡进行分析。
23.【答案】(1)⑥⑨
(2)⑥⑦⑧⑩
【解析】【解答】(1)2HI(g) H2(g)+I2(g)为气体物质的量不变的反应。
①单位时间内生成n mol H2的同时,生成n mol HI,速率之比不等于物质的量之比,正逆反应速率不等,不是平衡状态,故①不符合题意;②一个H-H键断裂等效于两个H-I键形成,同时有一个H-I键断裂,正逆反应速率不等,不是平衡状态,故②不符合题意;③百分组成w(HI)=w(I2),不能说明组成不变,不能说明是平衡状态,故③不符合题意;④反应速率v(H2)=v(I2)=0.5v(HI),不能说明正逆反应速率相等,不能说明是平衡状态,故④不符合题意;⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1,不能说明浓度是否不变,不能说明是平衡状态,故⑤不符合题意;⑥温度和体积一定时,生成物浓度不再变化,说明正逆反应速率相等,达平衡状态,故⑥符合题意;⑦温度和体积一定时,容器压强始终不变,容器内压强不再变化,不能说明是平衡状态,故⑦不符合题意;⑧条件一定,混合气体的质量不变,物质的量不变,平均相对分子质量始终不变,混合气体的平均相对分子质量不再变化,不能说明是平衡状态,故⑧不符合题意;⑨温度和体积一定时,混合气体的颜色不再变化,说明碘蒸气的浓度不变,说明为平衡状态,故⑨符合题意;⑩温度和压强一定时,混合气体的质量不变,气体的体积不变,混合气体的密度一直不变,混合气体的密度不再变化,不能说明是平衡状态,故⑩不符合题意;
已达平衡状态的是⑥⑨;故答案为:⑥⑨;(2)N2 + 3H2 2NH3为气体物质的量减小的反应。①单位时间内生成n mol H2的同时,生成n mol NH3,速率之比不等于物质的量之比,正逆反应速率不等,不是平衡状态,故①不符合题意;②3个H-H键断裂等效于6个H-N键形成,同时有一个H-N键断裂,正逆反应速率不等,不是平衡状态,故②不符合题意;③百分组成w(NH3)=w(H2),不能说明组成不变,不能说明是平衡状态,故③不符合题意;④速率之比等于化学计量数之比,不能说明正逆反应速率相等,不能说明是平衡状态,故④不符合题意;⑤浓度之比等于化学计量数之比,不能说明浓度是否不变,不能说明是平衡状态,故⑤不符合题意;⑥温度和体积一定时,生成物浓度不再变化,说明正逆反应速率相等,达平衡状态,故⑥符合题意;⑦温度和体积一定时,气体的物质的量减小,容器内气体的氧气为变量,容器内压强不再变化,说明是平衡状态,故⑦符合题意;
⑧条件一定,混合气体的质量不变,物质的量减小,平均相对分子质量增大,混合气体的平均相对分子质量不再变化,说明是平衡状态,故⑧符合题意;
⑨温度和体积一定时,混合气体的颜色始终为无色,不能说明为平衡状态,故⑨不符合题意;
⑩温度和压强一定时,混合气体的质量不变,气体的体积减小,混合气体的密度增大,混合气体的密度不再变化,说明是平衡状态,故⑩符合题意;
已达平衡状态的是⑥⑦⑧⑩;故答案为:⑥⑦⑧⑩。
【分析】2HI(g) H2(g)+I2(g)为气体物质的量不变的反应,N2 + 3H2 2NH3为气体物质的量减小的反应。根据化学平衡状态的特征和标志分析判断。
24.【答案】(1)增大
(2)增大
(3)减小
(4)减小
【解析】【解答】(1)恒温恒容下,在平衡体系中再充入一定量SO2,则c(SO2)增大,平衡正向移动,NO2的转化率增大;
(2)恒温恒压下,在平衡体系中再充入一定量的NO2,则c(NO2)增大,平衡正向移动,由于平衡移动是减弱改变,而不能抵消改变,因此达到新的平衡后,体系中c(NO2)增大;
(3)由于该反应为放热反应,因此升高温度后,平衡逆向移动,因此反应的平衡常数K减小;
(4)由于该反应为放热反应,因此降低温度后,平衡正向移动,达到新的平衡后,c(SO2)减小,c(NO)增大,因此达到新的平衡时减小;
【分析】此题是对反应速率和化学平衡的考查,结合浓度、温度、压强对反应速率和平衡移动的影响进行分析。
一、单选题
1.下列变化中,属于吸热反应的是( )
①液态水汽化②将胆矾加热变为白色粉末③浓H2SO4稀释④KClO3分解制O2⑤生石灰跟水反应生成熟石灰⑥CaCO3高温分解⑦CO2+C2CO ⑧Ba(OH)2·8H2O与固体NH4Cl混合⑨C+H2O(g) CO+H2⑩Al与盐酸反应
A.①②④⑥⑦⑧⑨ B.②④⑥⑦⑧⑨
C.①③④⑤⑥⑧⑩ D.②④⑧⑨⑩
2.下列物质中含有共价键的化合物的是( )
A.CaO B.NaCl C.H2 D.HCl
3.下列图示变化为吸热反应的是( )
A B C D
A.A B.B C.C D.D
4.下列关于σ键和π键的理解错误的是( )
A.σ键能单独形成,而π键一定不能单独形成
B.σ键可以绕键轴旋转,π键一定不能绕键轴旋转
C.双键中一定有1个σ键和1个π键,三键中一定有1个σ键和2个π键
D.气体单质中一定存在σ键,可能存在π键
5.下列设备工作时,将化学能转化为电能的是( )
A B C D
硅太阳能电池 锂离子电池 太阳能集热器 燃气灶
A.A B.B C.C D.D
6.下列关于化学键的说法中正确的是( )
A.化学键的形成过程中一定伴随着电子的得失
B.只要有化学键的断裂,一定发生化学反应
C.在共价化合物分子内,一定不存在离子键
D.某物质熔融状态时能导电,则该物质中一定含有离子键
7.研究电化学腐蚀及防护的装置如右图所示。有关说法正确的是( )
A.锌片发生氧化反应作阴极
B.电子从铁片经过导线流向锌片
C.铁片上电极反应为:2H+ + 2e→H2↑
D.该装置可用于研究牺牲阳极的阴极保护法
8.温度为T时,向2.0L恒容密闭容器中充入1.0molPCl5,反应PCl5(g) PCl3(g)+Cl2(g)经一段时间后达到平衡.反应过程中测定的部分数据见表:
t 0 50 150 250 350
n(PCl3)/mol 0 0.16 0.19 0.20 0.20
下列说法不正确的是( )
A.反应在前50s的平均速率为v(PCl3)=0.001 6 mol L﹣1 s﹣1
B.保持其他条件不变,升高温度,平衡时,c(PCl3)=0.11 mol L﹣1,则反应的△H>0
C.相同温度下,起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0 molPCl3、2.0 molCl2,达到平衡时,PCl3的转化率大于80%
9.下列事实不能用勒夏特列原理解释的是( )
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.工业合成氨中,将氨气液化分离以提高氨气产率
C.由H2(g)、I2(g)、HI(g)组成的平衡体系加压后颜色变深
D.工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
10.X 、Y 为两种主族元素,其原子的最外层电子数分别为1 和6 ,则X 、Y 两种元素形成的化合物( )
A.一定是离子化合物 B.一定是共价化合物
C.一定形成从X2Y型化合物 D.以上说法均不妥当
11.利用Cu+2FeCl3=CuCl2+2FeCl2反应设计一个原电池,下列说法中正确的是( )
A.电极材料为铁和铜,电解质溶液为氯化铁溶液
B.电极材料为铜和石墨,电解质溶液为硝酸铁溶液
C.正极反应式为2Fe3++2e-=2Fe2+
D.负极质量减小,正极质量增加
12.柴油燃油车是通过尿素-选择性催化还原法处理氮氧化物。其工作原理为:将尿素[CO(NH2)2]水溶液通过喷嘴喷入排气管中,当温度高于160℃时尿素水解,产生,生成的与富氧尾气混合后,在催化剂作用下,使氮氧化物得以处理。如图为在不同投料比[]时NO转化效率随温度变化的曲线。下列说法错误的是( )
A.投料比[]:曲线a大于曲线b
B.使用催化剂可以提高NO的平衡转化率
C.图中温度升高,NO转化率升高的可能原因是氨气的释放速度加快,催化剂的活性增强
D.图中温度过高,NO转化率下降的的可能原因是发生反应
13.如图所示为氢氧燃料电池示意图,电解液为KCl溶液,设NA为阿伏加德罗常数的值,下列关于该电池的叙述错误的是( )
A.a为负极,b为正极
B.消耗22.4LH2时,电路中转移2NA个电子
C.b极的电极反应式为O2+2H2O+4e-=4OH-
D.电池工作一段时间后,KCl溶液浓度降低
14.已知 4NH3+5O2 = 4NO+6H2O(g),若反应速率分别用 v(NH3)、v(O2)、v(NO)、v(H2O)表示,则正确的关系是( )
A.v(O2)= v(NH3) B.v(H2O)= v(O2)
C.v(H2O)= v(NH3) D.v(NO)= v(O2)
15.已知[Co(NH3)6]3+呈正八面体结构,若其中有两个NH3分子分别被H2O取代,所形成的[Co(NH3)4(H2O)2]3+的几何异构体种数有几种(不考虑光学异构)( )
A.2种 B.3种 C.4种 D.6种
16.二氧化硫一空气质子交换膜燃料电池将化学能转变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,其原理如图所示。下列说法错误的是( )
A.负极的电极反应式为SO2+2H2O-2e-=SO42-+4H+
B.反应总式为2SO2+O2+2H2O=2H2SO4
C.质子的移动方向为从电极B到电极A
D.SO2气流速度的大小可能影响电池的电动势
17.下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A.溴水中有下列平衡Br2+H2O HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
B.合成氨工业中使用铁触媒做催化剂
C.用饱和食盐水除去氯气中氯化氢杂质
D.对2HI(g) H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
18.微生物燃料电池(MFC)是一种现代化氨氮去除技术。如图为MFC碳氮联合同时去除的转化系统原理示意图。下列说法错误的是( )
A.好氧微生物反应器中反应为NH +2O2=NO +2H++H2O
B.电子由A极沿导线流向B极
C.标准状况下,B极上每生成3. 36L气体时,理论上电路中有1mol电子通过
D.A极的电极反应式为CH3COO- -8e -+2H2O=2CO2↑+7H+
19.在容积一定的密闭容器中,进行可逆反应N2(g)+3H2(g) 2NH3(g)ΔH<0,有图Ⅰ、Ⅱ所示的反应曲线(T表示温度,P表示压强,C%表示NH3的体积分数),下列说法中错误的是( )
A.T2<T1
B.P2>P1
C.若P3<P4,y轴表示N2的转化率
D.若P3>P4,y轴表示NH3的体积分数
二、综合题
20.t℃时,将2molSO2和1molO2通入体积为2L的恒温恒容密闭容器中,发生如下反应:2SO2(g)+O2(g) 2SO3(g),△H=﹣196.6kJ/mol.2min时反应达到化学平衡,此时测得反应物O2还乘余0.8mol,请填写下列空白:
(1)从反应开始到达化学平衡,生成SO3的平均反应速率为 ;平衡时SO2转化率为 .
(2)下列叙述能证明该反应已达到化学平衡状态的是(填标号,下同)
A.溶器内压强不再发生变化
B.SO2的体积分数不再发生变化
C.容器内气体原子总数不再发生变化
D.相同时间内消耗2nmolSO2的同时消耗nmolO2
E.相同时间内消耗2nmolSO2的同时生成nmolO2
(3)反应达到化学平衡后,以下操作将引起平衡向正反方向移动并能提高SO2转化率的是 .
A.向容器中通入少量O2
B.向容器中通入少量SO2
C.使用催化剂
D.降低温度
E.向容器中通入少量氦气(已知:氦气和SO2、O2、SO3都不发生反应)
(4)t2℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,反应达到平衡时,混合气体体积减少了20%,SO2的转化率为 .
21.
(1)一定条件下的密闭容器中,反应3H2(g)+3CO(g) CH3OCH3(二甲醚)(g)+CO2(g) ΔH<0达到平衡,要提高CO的转化率,可以采取的措施是 (填字母代号)。
a.升高温度 b.加入催化剂 c.减小CO2的浓度 d.增加CO的浓度 e.分离出二甲醚
(2)已知反应②2CH3OH(g) CH3OCH3(g)+H2O(g)在某温度下的平衡常数为400。此温度下,在密闭容器中加入CH3OH,反应到某时刻测得各组分的浓度如下:
物质 CH3OH CH3OCH3 H2O
浓度/(mol·L-1) 0.44 0.6 0.6
①比较此时正、逆反应速率的大小:v(正) v(逆)(填“>”“<”或“=”)。
②若加入CH3OH后,经10 min反应达到平衡,此时c(CH3OH)= ;该时间内反应速率v(CH3OH)= 。
22.已知:T℃、P kpa时,容积为V 的密闭容器中充有1molA和2molB,保持恒温恒压使反应达平衡:A(g)+B(g) C(g),平衡时C 的体积分数为40℅。
(1)欲保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,则平衡时体系容积为 ,C的体积分数为 。
(2)另取一个容积固定不变的密闭容器,仍控制温度为T℃,加入1molB和1molC,要使平衡时C 的体积分数仍为40℅,则该密闭容器体积为 。
23.
(1)下列方法中可以证明 2HI(g) H2(g)+I2(g)已达平衡状态的是 。
①单位时间内生成 n mol H2 的同时生成 n mol HI;
②一个 H-H 键断裂的同时有一个 H-I键断裂;
③百分组成ω(HI)=ω(I2);
④反应速率v(H2)=v(I2)= v(HI)时;
⑤c(HI):c(H2):c(I2)=2:1:1 时;
⑥温度和体积一定时,某一生成物浓度不再变化;
⑦温度和体积一定时,容器内压强不再变化;
⑧条件一定,混合气体的平均相对分子质量不再变化;
⑨温度和体积一定时,混合气体的颜色不再变化;
⑩温度和压强一定时,混合气体的密度不再变化;
(2)对于合成氨上述能说明达到平衡状态的是 。
24.一定条件下,在密闭容器中充入1 mol SO2与2 moI NO2发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)△H=-42kJ·mol-1。回答下列问题:
(1)恒温恒容下,在反应平衡体系中再充入一定量SO2,则NO2的平衡转化率 (填“增大”“减小”或“不变”,下同)
(2)恒温恒压下,在反应平衡体系中再充入一定量NO2,则NO2的平衡浓度 。
(3)恒容下,升高温度,上述反应的平衡常数K 。
(4)恒容下,降低温度,重新达到平衡时 。
答案解析部分
1.【答案】B
【解析】【解答】①液态水汽化为吸热过程,为物理变化,故不选;
②将胆矾加热变为白色粉末,为分解反应,属于吸热反应,故选;
③浓H2SO4稀释放出大量的热,为物理变化,故不选;
④KClO3分解制O2,为分解反应属于吸热反应,故选;
⑤生石灰跟水反应生成熟石灰,为放热反应,故不选;
⑥CaCO3高温分解,为分解反应,属于吸热反应,故选;
⑦CO2+C2CO为吸热反应,
故答案为:;
⑧Ba(OH)2 8H2O与固体NH4Cl混合,为吸热反应,故选;
⑨C+H2O(g)CO+H2,为吸热反应,故选;
⑩Al与HCl反应为放热反应,故不选;
故答案为:B。
【分析】常见吸热反应:①大多数分解反应;②盐的水解;③Ba(OH)2.8H2O与NH4Cl反应;④碳和水蒸气、C和CO2的反应等。
2.【答案】D
【解析】【解答】A.CaO含有离子键,A不符合题意;
B.NaCl含有离子键,B不符合题意;
C.H2含有共价键但是却为单质,C不符合题意;
D.HCl含有共价键且为化合物,D符合题意;
故答案为:D。
【分析】非金属元素的原子之间易形成共价键,活泼金属和活泼非金属元素之间易形成离子键。
3.【答案】D
【解析】【解答】A、锌粉和稀盐酸的反应为放热反应,故A不符合题意;
B、A+B的总能量高于C的总能量,为放热反应,故B不符合题意;
C、浓硫酸稀释时放热,且该反应不是化学反应,故C不符合题意;
D、稀盐酸和碳酸氢钠反应吸热,故D符合题意;
故答案为:D。
【分析】常见的放热反应有:绝大多数的化合反应(灼热的炭与二氧化碳反应除外)、燃烧反应、金属与水或酸的反应、酸碱中和,铝热反应等;
常见的吸热反应有:绝大多数的分解反应、个别的化合反应(如灼热的炭与二氧化碳反应)、少数的复分解反应(如盐酸与碳酸氢钠反应)、以C、CO、H2为还原剂的氧化还原反应反应等。
4.【答案】D
【解析】【解答】A.共价单键中只含 σ键,共价双键和共价三键中含π键和σ键,所以π键一定不能单独形成,A不符合题意;
B.σ键为轴对称,π键为镜面对称,则σ键可以绕键轴旋转,π键不能绕键轴旋转, B不符合题意;
C.双键中一定有1个σ键和1个π键,三键中一定有1个σ键和2个π键,C不符合题意;
D.稀有气体是单原子分子,分子中不存在共价键,也就不存在σ键,所以气体单质中不一定存在 σ键,D符合题意。
【分析】本题考查共价键的形成及类型,注意σ键和π键的形成过程及判断的一般规律即可。
5.【答案】B
【解析】【解答】A.硅太阳能电池将太阳能转化为电能,A不符合题意;
B.锂离子电池的放电过程是将化学能转化为电能,B符合题意;
C.太阳能集热器将太阳能转化为热能,C不符合题意;
D.燃气灶将化学能转化成热能,D不符合题意;
故答案为:B。
【分析】将化学能转化为电能的装置是原电池,找出原电池即可
6.【答案】C
【解析】【解答】A. 有些化学键的形成过程中伴随着电子的得失,共价键是通过共用电子对形成的,没有电子得失,A不符合题意;
B. 发生化学反应的时候,既要有化学键的断裂,又有化学键的形成,有些变化只有化学键断裂,不一定是化学反应,比如氯化氢气体溶于水发生电离,B不符合题意;
C. 在共价化合物分子内,只有共价键,一定不存在离子键,C符合题意;
D. 某化合物熔融状态时能导电,则该化合物中一定含有离子键,金属也可以导电,D不符合题意;
故答案为:C。
【分析】A.化学键的形成常常伴随着能量的变化,出现氧化还原反应时伴随着电子的转移或得失
B.化学变化是化学键的断裂和形成的过程
C.离子化合物中一定有离子键,可能有共价键,但共价化合物中只有共价键
D.金属属于单质,存在金属键
7.【答案】D
【解析】【解答】A、锌片比铁片活泼,根据原电池工作原理,锌片作负极,发生氧化反应,故A不符合题意;
B、根据原电池工作原理,电子从负极经外电路流向正极,即从锌片经外电路流向铁片,故B不符合题意;
C、因为环境时弱碱性,因此发生吸氧腐蚀,正极反应式:O2+2H2O+4e-=4OH-,故C不符合题意;
D、此装置保护铁不被腐蚀,根据原理,该装置课用于研究牺牲阳极的阴极保护法,故D符合题意。
故答案为:D
【分析】A、负极为较活泼的金属;
B、电子从负极流向正极;
C、吸氧腐蚀是指金属在酸性很弱或中性溶液里,空气里的氧气溶解于金属表面水膜中而发生的电化学腐蚀;
D、根据阴极铁不被腐蚀;
8.【答案】D
【解析】【解答】解:A.反应在前50s的平均速率为v(PCl3)= =0.001 6 mol L﹣1 s﹣1,故A正确;
B.由表格数据可知,250s达到平衡,c(PCl3)= =0.1mol/L,则升高温度,平衡时,c(PCl3)=0.11 mol L﹣1,可知升高温度平衡正向移动,则正反应为吸热反应,反应的△H>0,故B正确;
C.
PCl5(g) PCl3(g)+ Cl2(g)
起始 0.5 0 0
转化 0.1 0.1 0.1
平衡 0.4 0.1 0.1
K= =0.025,
起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,Qc= =0.02<K,平衡正向移动,则达到平衡前v(正)>v(逆),故C正确;
D.相同温度下,互为逆反应时,K为倒数关系,起始时向容器中充入2.0 molPCl3、2.0 molCl2,浓度分别均为1mol/L,设转化PCl3的为x,
PCl3(g)+ Cl2(g) PCl5(g)
起始 1 1 0
转化 x x x
平衡 1-x 1-x x
则 = ,解得x=0.51,则转化率为 ×100%=51%<80%,故D错误;
故选D.
【分析】A.结合v= 计算;
B.由表格数据可知,250s达到平衡,c(PCl3)= =0.1mol/L,则升高温度,平衡时,c(PCl3)=0.11 mol L﹣1,可知升高温度平衡正向移动;
C.
PCl5(g) PCl3(g)+ Cl2(g)
起始 0.5 0 0
转化 0.1 0.1 0.1
平衡 0.4 0.1 0.1
K= =0.025,
起始时向容器中充入1.0 molPCl5、0.20 molPCl3和0.20 molCl2,Qc= =0.02<K;
D.相同温度下,起始时向容器中充入2.0 molPCl3、2.0 molCl2,浓度分别均为1mol/L,设转化PCl3的为x,
PCl3(g)+ Cl2(g) PCl5(g)
起始 1 1 0
转化 x x x
平衡 1-x 1-x x
则 = ,解得x=0.51,以此来解答.
9.【答案】C
【解析】【解答】A.硫氰根离子和铁离子反应存在化学平衡,Fe(SCN)3溶液中加入固体KSCN后颜色变深,平衡向生成硫氰化铁方向移动,所以能用平衡移动原理解释,选项A不符合;
B.将氨气液化分离,平衡向正反应方向移动,提高氨气产率,符合勒夏特列原理,选项B不符合;
C.H2(g)+I2(g) 2HI(g),该反应的反应前后气体计量数之和不变,所以压强不影响平衡移动,由H2、I2蒸气、HI组成的平衡体系加压后颜色变深,说明体积减小碘蒸气浓度增大,颜色加深,与平衡移动无关,所以不能用勒夏特里原理解释,选项C符合;
D.增大空气的量,即增大反应物浓度,平衡正向移动,所以可以提高二氧化硫的转化率,能用勒夏特列原理解释,选项D不符合;
故答案为:C。
【分析】依据勒夏特列原理,改变影响平衡的一个因素,平衡将向减弱这种改变的方向移动分析。
10.【答案】D
【解析】【解答】X、Y为两种主族元素,其原子的最外层电子数分别为1和6,则X、Y两种元素的化合价分别为+1和-2价,可形成X2Y型化合物,也可形成X2Y2型化合物,如过氧化氢,可以是离子化合氧化钠或者过氧化钠,
故答案为:D。
【分析】最外层电子数为1的元素可能是H元素,也可能是碱金属元素,据此分析即可。
11.【答案】C
【解析】【解答】该原电池的总反应可分为两个电极反应,负极:Cu-2e-=Cu2+,正极:2Fe3++2e-=2Fe2+。铜作负极,其质量不断减小;活动性比铜弱的金属或导电非金属作正极,其质量不变;氯化铁溶液为电解质溶液。
A. 若电极材料为铁和铜,铁比铜活泼,铁做负极,铜做正极,与分析不符,故A不符合题意;
B. 利用Cu+2FeCl3=CuCl2+2FeCl2反应设计一个原电池,电解质溶液为氯化铁溶液,故B不符合题意;
C. 根据分析,正极反应式为2Fe3++2e-=2Fe2+,故C符合题意;
D. 根据分析,负极质量减小,正极质量不变,故D不符合题意;
故答案为:C。
【分析】A、电极材料为铁和铜,则负极为铁,故A不符合题意
B、若为硝酸铁,则为铜与硝酸铁反应而不是氯化铁,电解质溶液为氯化铁,故B不符合题意
D、负极质量减小,正极质量不变,故D不符合题意。
12.【答案】B
【解析】【解答】A.尿素分解产生氨气,氨气的浓度越大,越有利于NO的转化,则尿素与NO的比值为a曲线大于b曲线,A项不符合题意;
B.催化剂可加快反应速率,对于平衡转化率不会改变,B项符合题意;
C.随着温度升高,尿素分解氨气的速率加快,NH3的浓度变大,温度升高催化剂活性增加,导致化学反应速率加快,C项不符合题意;
D.温度过高,NO的转化效率下降,NO的浓度反而升高,发生反应,D项不符合题意;
故答案为:B。
【分析】A.尿素分解产生氨气,氨气的浓度越大,越有利于NO的转化;
B.催化剂不影响平衡转化率;
C.温度对催化剂的活性产生影响;
D.高温下发生反应。
13.【答案】B
【解析】【解答】A. a极通入,元素化合价升高发生氧化反应,所以为负极,极通入,元素化合价降低发生还原反应,所以为正极,故A不符合题意;
B. 未指明气体所处状态,故B符合题意;
C. 极为得电子生成,故C不符合题意;
D. 反应有水生成,一段时间后溶液浓度降低,故D不符合题意。
故答案为:B
【分析】解答新型化学电源的步骤:(1)判断电池类型→确认电池原理→核实电子、离子移动方向。(2)确定电池两极→判断电子、离子移动方向→书写电极反应和电池反应。(3)失去电子的一极为负极。(4)电极反应→根据电荷守恒、原子守恒配平电极方程式
14.【答案】A
【解析】【解答】对于反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),
A.速率之比等于化学计量数之比,故v(NH3):v(O2)=4:5,即v(O2)= v(NH3),故A符合题意;
B.速率之比等于化学计量数之比,故v(O2):v(H2O)=5:6,即v(H2O)= v(O2),故B不符合题意;
C.速率之比等于化学计量数之比,故v(NH3):v(H2O)=4:6,即v(H2O)= v(NH3) ,故C不符合题意;
D.速率之比等于化学计量数之比,故v(O2):v(NO)=5:4,即v(NO)= v(O2) ,故D不符合题意;
故答案为A。
【分析】同一化学反应中,不同物质表示的化学反应速率之比等于其化学计量数之比。
15.【答案】A
【解析】【解答】[Co(NH3)6]3+呈正八面体结构,若其中有两个NH3分子分别被H2O取代, 所形成的[Co(NH3)4(H2O)2]3+的几何异构体种数有正八面体和斜八面体两种不同的类型,因此选项是A。
【分析】根据空间构型可以知道Co处于中心,而氨气分子处于八面体的留个顶点位置,结构高度对称,上下的顶点一样,以及中间四个顶点一样,取代时可以都是上下顶点,还可以是上下各一个顶点,以及中间四个顶点任意一个,形成两种结构
16.【答案】C
【解析】【解答】A. A极通入SO2,SO2在负极失电子生成SO42-,则电极反应为SO2+2H2O-2e-=SO42-+4H+,故A不符合题意;
B.该电池的反应原理为二氧化硫与氧气的反应,反应总式为2SO2+O2+2H2O=2H2SO4,故B不符合题意;
C. A为负极,B为正极,质子的移动方向为从电极A到电极B,故C符合题意;
D.反应物的浓度大,反应速率快,SO2气流速度的大小可能影响电池的电动势,故D不符合题意;
故答案为:C。
【分析】原电池是将化学能转变成电能,负极失电子发生氧化反应,正极得电子发生还原反应。电子从负极流向正极。
17.【答案】B
【解析】【解答】勒夏特列原理是:如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。A、加入硝酸银溶液后,银离子消耗溴水中的溴离子,生成溴化银沉淀,溶液中溴离子浓度减小,平衡向着正向移动,能够用勒夏特列原理解释,不符合题意;
B、因为催化剂不影响化学平衡,不能用勒夏特列原理解释,符合题意;
C、用饱和食盐水除去氯气中氯化氢杂质的反应原理为:Cl2+H2O HCl+HClO,饱和食盐水中氯离子的浓度很高,氯离子的浓度高能使该反应平衡向逆向移动,能够用勒夏特列原理解释,不符合题意;
D、通入氢气后氢气浓度增大,平衡向着氢气浓度减小的方向移动,能够用勒夏特列原理解释,不符合题意;
故答案为:B。
【分析】勒夏特列原理是化学平衡原理,而催化剂能同等程度的加快正逆反应速率,正逆反应速率仍然相等,化学平衡不移动。
18.【答案】C
【解析】【解答】A.NH4+在好氧微生物反应器中转化为NO3-,结合电子守恒、电荷守恒得到反应的离子方程式为NH4++2O2═NO3-+2H++H2O,故A不符合题意;
B.微生物燃料电池中氢离子移向B电极,说明A为原电池的负极,B为原电池的正极,所以电子由A(负)极沿导线流向B(正)极,故B不符合题意;
C.NO3-离子在B(正)极得到电子生成氮气,电极反应式为2NO3-+12H++10e-=N2↑+6H2O,标准状况下,生成3. 36LN2时,即n(N2)= =0.15mol,理论上电路中有1.5mol电子通过;故C符合题意;
D.酸性介质中,CH3COO-在原电池A(负)极失电子,发生氧化反应生成CO2气体,则A极的电极反应式为CH3COO--8e-+2H2O═2CO2↑+7H+,故D不符合题意;
故答案为:C。
【分析】A.铵根离子氮元素-3价,具有还原性,氧气具有氧化性,可发生氧化还原反应
B.A极区,通入的醋酸跟,出来的是二氧化碳,碳元素的化合价升高,失去电子,发生氧化反应,做负极,B极区,硝酸根中氮元素得电子,发生还原反应,变为氮气。
C.根据B极电极反应式进行计算
D.A极区,通入的醋酸跟,出来的是二氧化碳,碳元素的化合价升高,失去电子,发生氧化反应
19.【答案】C
【解析】【解答】A.根据图1可知,在压强均为P2的条件下,温度为T1的曲线首先达到平衡状态,这说明温度为T1时反应速率快,达到平衡的时间少。温度高反应速率快,所以温度是T2<T1,A不符合题意;
B.碳氧根据图1可知,在温度均T1的条件下,压强为P2的首先达到平衡状态,这说明压强为P2时反应速率快,达到平衡的时间少,压强大反应速率快,所以压强是P2>P1,B不符合题意;
C.该反应是体积减小的可逆反应,增大压强反应物的转化率增大。若P3<P4,则压强为P4时的转化率大于压强P3时的转化率,C符合题意;
D.增大压强平衡向正反应方向移动,氨气的体积分数增大,所以若P3>P4,y轴可以表示NH3的体积分数,D不符合题意;
故答案为:C。
【分析】根据“先拐先平数值大”进行分析,根据化学平衡的移动分析转化率和体积分数的变化。
20.【答案】(1)0.1mol L﹣1 min﹣1;20%
(2)A;B;E
(3)A;D
(4)80%
【解析】【解答】解:(1)还剩余0.8 mol氧气可知:反应消耗0.4mol SO2和0.2mol O2,生成0.4mol SO3,
三氧化硫的反应速率为v(SO3)= = =0.1mol L﹣1 min﹣1,
SO2转化率= ×100%= ×100%=20%,
故答案为:0.1mol L﹣1 min﹣1;20%;(2)A.容器内压强不再发生变化,该反应两边气体体积不相等,反应过程中压强是变量,压强不变,该反应达到了平衡状态,故A正确;
B.SO2的体积分数不再发生变化,表明正逆反应速率相等,达到了平衡状态,故B正确;
C.容器内气体原子总数不再发生变化,根据原子守恒,原子总数始终不变,所以原子总数不能作为判断平衡状态的依据,故C错误;
D.相同时间内消耗2nmolSO2的同时消耗nmolO2,都是指的是正反应方向,因此不能作为判断平衡状态的依据,故D错误;
E.相同时间内消耗2nmolSO2的同时生成nmolO2,相同时间内消耗2n mol SO2等效于消耗n mol O2,同时生成n mol O2,正反应速率等于逆反应速率,故E正确;
故答案:ABE;(3)A.向容器中通入少量O2,即增大氧气的浓度,能使平衡正向移动并能提高SO2转化率,故A正确;
B.向容器中通入少量SO2,即增大二氧化硫的浓度,能使平衡正向移动但是能降低了SO2转化率,故B错误;
C.使用催化剂,不会影响化学平衡的移动,也不会改变二氧化硫的转化率,故C错误;
D.降低温度,化学平衡正向移动,并能提高SO2转化率,故D正确;
E.向容器中通入少量氦气,当恒容时,各组分的浓度不变,则平衡不移动,故E错误.
故选:AD;(4)t℃时,若将物质的量之比n(SO2):n(O2)=1:1的混合气体通入一个恒温恒压的密闭容器中,设二氧化硫和氧气物质的量为1mol,反应达到化学平衡时,混合气体体积减少了20%,则反应的氧气体积为2×20%=40%,则反应的二氧化硫为80%,即转化率为80%,
故答案为:80%.
【分析】(1)根据平均反应速率v= 计算出反应速率;根据平衡时SO2转化率= ×100%计算;(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变,据此判断平衡状态;(3)根据化学平衡的影响因素来回答;(4)依据反应前后气体体积减少为反应氧气的量分析计算.
21.【答案】(1)c、e
(2)>;0.04 mol·L-1;0.16 mol·(L·min)-1
【解析】【解答】(1)正反应是放热反应,升高温度平衡左移,CO转化率减小;加入催化剂,平衡不移动,转化率不变;减少CO2的浓度、分离出二甲醚,平衡右移,CO转化率增大;增大CO浓度,平衡右移,但CO转化率降低,故答案为:c、e。
(2)此时的浓度商Qc=1.86<400,反应未达到平衡状态,向正反应方向移动,故v(正)>v(逆);设平衡时生成物的浓度为(0.6 mol·L-1+x),则甲醇的浓度为(0.44 mol·L-1-2x),根据平衡常数表达式可得,解得x=0.2 mol·L-1,故0.44 mol·L-1-2x=0.04 mol·L-1。由表可知,甲醇的起始浓度为(0.44+1.2) mol·L-1=1.64 mol·L-1,其平衡浓度为0.04 mol·L-1,10 min内变化的浓度为1.6 mol·L-1,故v(CH3OH)=0.16 mol·(L·min)-1。
【分析】(1)要提高CO的转化率,则应使平衡正向移动,结合平衡移动的影响因素进行分析;
(2)①由浓度商与平衡常数的大小确定反应进行的方向,从而确定正逆反应速率的大小;
②由平衡时各物质的物质的量浓度,结合平衡常数进行计算;
根据速率公式计算反应速率;
22.【答案】(1)10V/7;40%
(2)5V/7
【解析】【解答】⑴欲保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,这是在恒温恒容条件下的等效平衡
A(g) + B(g)
C(g)
起始(mol) 1 2 0
转化(mol) x x x
平衡(mol) 1-x 2-x x
依题意可知:
解之得:
也就是说平衡后总的物质的量为:
3mol的混合气体占的体积为V,那么
的气体占的体积为:
所以,保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,则平衡时体系容积为
;但是平衡不移动,体积分数不变。
⑵这是等温等容条件下的等效平衡,体积只能是等于原来的
【分析】(1) 保持温度、压强在上述条件下不变,在密闭容器中充入2molA和4molB,相当于等效平衡,按照原平衡计算体积比,然后按照倍数关系进行分析即可;
(2)按照恒温恒容下化学计量数不相等的等效平衡进行分析。
23.【答案】(1)⑥⑨
(2)⑥⑦⑧⑩
【解析】【解答】(1)2HI(g) H2(g)+I2(g)为气体物质的量不变的反应。
①单位时间内生成n mol H2的同时,生成n mol HI,速率之比不等于物质的量之比,正逆反应速率不等,不是平衡状态,故①不符合题意;②一个H-H键断裂等效于两个H-I键形成,同时有一个H-I键断裂,正逆反应速率不等,不是平衡状态,故②不符合题意;③百分组成w(HI)=w(I2),不能说明组成不变,不能说明是平衡状态,故③不符合题意;④反应速率v(H2)=v(I2)=0.5v(HI),不能说明正逆反应速率相等,不能说明是平衡状态,故④不符合题意;⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1,不能说明浓度是否不变,不能说明是平衡状态,故⑤不符合题意;⑥温度和体积一定时,生成物浓度不再变化,说明正逆反应速率相等,达平衡状态,故⑥符合题意;⑦温度和体积一定时,容器压强始终不变,容器内压强不再变化,不能说明是平衡状态,故⑦不符合题意;⑧条件一定,混合气体的质量不变,物质的量不变,平均相对分子质量始终不变,混合气体的平均相对分子质量不再变化,不能说明是平衡状态,故⑧不符合题意;⑨温度和体积一定时,混合气体的颜色不再变化,说明碘蒸气的浓度不变,说明为平衡状态,故⑨符合题意;⑩温度和压强一定时,混合气体的质量不变,气体的体积不变,混合气体的密度一直不变,混合气体的密度不再变化,不能说明是平衡状态,故⑩不符合题意;
已达平衡状态的是⑥⑨;故答案为:⑥⑨;(2)N2 + 3H2 2NH3为气体物质的量减小的反应。①单位时间内生成n mol H2的同时,生成n mol NH3,速率之比不等于物质的量之比,正逆反应速率不等,不是平衡状态,故①不符合题意;②3个H-H键断裂等效于6个H-N键形成,同时有一个H-N键断裂,正逆反应速率不等,不是平衡状态,故②不符合题意;③百分组成w(NH3)=w(H2),不能说明组成不变,不能说明是平衡状态,故③不符合题意;④速率之比等于化学计量数之比,不能说明正逆反应速率相等,不能说明是平衡状态,故④不符合题意;⑤浓度之比等于化学计量数之比,不能说明浓度是否不变,不能说明是平衡状态,故⑤不符合题意;⑥温度和体积一定时,生成物浓度不再变化,说明正逆反应速率相等,达平衡状态,故⑥符合题意;⑦温度和体积一定时,气体的物质的量减小,容器内气体的氧气为变量,容器内压强不再变化,说明是平衡状态,故⑦符合题意;
⑧条件一定,混合气体的质量不变,物质的量减小,平均相对分子质量增大,混合气体的平均相对分子质量不再变化,说明是平衡状态,故⑧符合题意;
⑨温度和体积一定时,混合气体的颜色始终为无色,不能说明为平衡状态,故⑨不符合题意;
⑩温度和压强一定时,混合气体的质量不变,气体的体积减小,混合气体的密度增大,混合气体的密度不再变化,说明是平衡状态,故⑩符合题意;
已达平衡状态的是⑥⑦⑧⑩;故答案为:⑥⑦⑧⑩。
【分析】2HI(g) H2(g)+I2(g)为气体物质的量不变的反应,N2 + 3H2 2NH3为气体物质的量减小的反应。根据化学平衡状态的特征和标志分析判断。
24.【答案】(1)增大
(2)增大
(3)减小
(4)减小
【解析】【解答】(1)恒温恒容下,在平衡体系中再充入一定量SO2,则c(SO2)增大,平衡正向移动,NO2的转化率增大;
(2)恒温恒压下,在平衡体系中再充入一定量的NO2,则c(NO2)增大,平衡正向移动,由于平衡移动是减弱改变,而不能抵消改变,因此达到新的平衡后,体系中c(NO2)增大;
(3)由于该反应为放热反应,因此升高温度后,平衡逆向移动,因此反应的平衡常数K减小;
(4)由于该反应为放热反应,因此降低温度后,平衡正向移动,达到新的平衡后,c(SO2)减小,c(NO)增大,因此达到新的平衡时减小;
【分析】此题是对反应速率和化学平衡的考查,结合浓度、温度、压强对反应速率和平衡移动的影响进行分析。
