第3章 物质在水溶液中的行为 (含解析)课时检测 2023-2024学年高二化学鲁科版(2019)选择性必修1
文档属性
| 名称 | 第3章 物质在水溶液中的行为 (含解析)课时检测 2023-2024学年高二化学鲁科版(2019)选择性必修1 |  | |
| 格式 | docx | ||
| 文件大小 | 562.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 19:37:33 | ||
图片预览




文档简介
第3章 物质在水溶液中的行为 课时检测
一、单选题
1.物质的量浓度相同的NaX、NaY和NaZ溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX,HZ, HY B.HX,HY,HZ C.HZ,HY,HX D.HY,HZ,HX
2.在科学史上每一次重大的发现都极大地推进了科学的发展。下列对化学史的描述正确的是( )
A.侯德榜制的碱是NaOH
B.卢瑟福提出原子有核模型
C.道尔顿发现电子
D.凯库勒的贡献在于确定了苯的分子式
3.下列物质在水溶液中,溶质存在电离平衡的是( )
A.NaHSO4 B.CH3COOH C.BaSO4 D.CH3COONa
4.下列各组离子,能在溶液中大量共存的是( )
A.、、、 B.、、、
C.、、、 D.、、、
5.下列实验事实不能证明醋酸是弱电解质的是( )
A.用醋酸溶液做导电实验时,灯泡很暗
B.常温下,测得0.1醋酸溶液的
C.常温下,将的醋酸溶液稀释1000倍测得
D.等氢离子浓度、等体积的盐酸和醋酸溶液中和碱时,醋酸中和碱的量更多
6.常温下,向20 mL 0.1mol·L-1一元酸HA中滴加相同浓度的KOH溶液,溶液中由水电离的氢离子浓度随加入KOH溶液体积的变化如图所示。则下列说法错误的是( )
A.HA的电离常数约为10-5
B.b点溶液中存在:c(A-)=c(K+)
C.c点对应的KOH溶液的体积V=20 mL,c水(H+)约为7×10-6 mol·L-1
D.导电能力:c>a>b
7.现有:①0.1 mol·L-1醋酸溶液,②0.1 mol·L-1盐酸,③pH=1的醋酸溶液。分别加水稀释,使体积变为原来的10倍。对于稀释前后溶液的有关说法错误的是( )
[说明:pH=-lgc(H+)]
A.稀释前,溶液pH:①>②=③
B.稀释后,溶液pH:①>②=③
C.稀释前,溶液中溶质的物质的量浓度:③>①=②
D.稀释后,溶液中溶质的物质的量浓度:③>①=②
8.在医院中,为酸中毒病人输液不应采用( )
A.0.9%氯化钠溶液 B.0.9%氯化铵溶液
C.1.25%碳酸氢钠溶液 D.5%葡萄糖溶液
9.已知相同温度下电离常数K(HF)>K(HCN),在物质的量浓度均为0.1mol/L的NaCN和NaF混合浓度中,下列排序正确的是( )
A.c(OH﹣)>c(HF)>c(HCN)>c(H+)
B.c(OH﹣)>c(CN﹣)>c(F﹣)>c(H+)
C.c(OH﹣)>c(F﹣)>c(CN﹣)>c(H+)
D.c(F﹣)>c(OH﹣)>c(HCN)>c(HF)
10.关于物质的分类,正确的是( )
A.纯碱---碱 B.盐酸---纯净物
C.氯化银---弱电解质 D.氧化钠---碱性氧化物
11.常温下,H2A是一种易溶于水的二元酸,将NaOH溶液滴入等物质的量浓度的H2A溶液中,溶液中H2A、HA-、A2-的物质的量分数(a)随溶液pH的变化关系如图所示。下列说法错误的是( )
A.常温下,H2A HA-+H+的电离平衡常数Ka1=10-3.30
B.当c(Na+)=2c(A2-)+c(HA-)时,溶液呈中性
C.pH=6.27时,c(A2-)=c(HA-)>c(H+)>c(OH-)
D.V(NaOH溶液):V(HA溶液)=3:2时,2c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+)
12.下列微粒在所给条件下,一定可以大量共存的是( )。
A.与单质铝反应能产生大量氢气的溶液中:、、、
B.常温下的酸性溶液中:、、、
C.澄清透明酸性溶液中:、、、
D.遇酚酞显红色的溶液中:、、、
13.水溶液呈碱性的正盐是( )
A. B. C.KOH D.
14.向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中( )
A.c(Ca2+)、c(OH﹣)均增大
B.c(Ca2+)、c(OH﹣)均保持不变
C.c(Ca2+)、c(OH﹣)均减小
D.c(OH﹣)增大、c(H+)减小
15.下列指定条件下的结果正确的是( )
A.0.1 mol·L-1氨水中,c(OH-)=c(NH )
B.常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=7
C.在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1 mol·L-1某二元弱酸盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
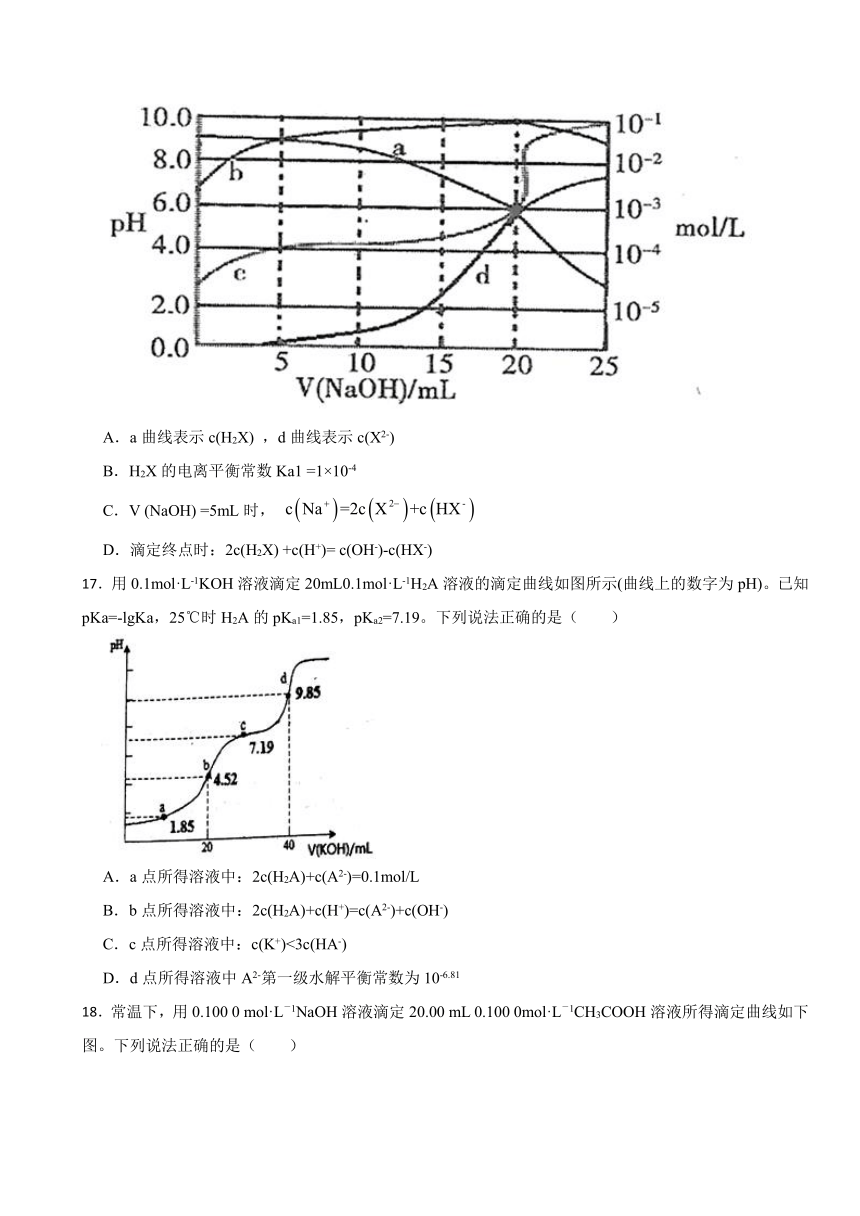
16.25℃时,以甲基橙为指示剂用0.1000 mol·L-1的NaOH溶液滴定二元酸H2X溶液。溶液的pH及溶液中H2X、 HX-及X2-的物质的量液度变化如图所示,下列说法错误的是( )
A.a曲线表示c(H2X) ,d曲线表示c(X2-)
B.H2X的电离平衡常数Ka1 =1×10-4
C.V (NaOH) =5mL时,
D.滴定终点时:2c(H2X) +c(H+)= c(OH-)-c(HX-)
17.用0.1mol·L-1KOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH)。已知pKa=-lgKa,25℃时H2A的pKa1=1.85,pKa2=7.19。下列说法正确的是( )
A.a点所得溶液中:2c(H2A)+c(A2-)=0.1mol/L
B.b点所得溶液中:2c(H2A)+c(H+)=c(A2-)+c(OH-)
C.c点所得溶液中:c(K+)<3c(HA-)
D.d点所得溶液中A2-第一级水解平衡常数为10-6.81
18.常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。下列说法正确的是( )
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.溶液中②、③点水的电离程度:③>②
C.点②所示溶液中:c(Na+)=c(CH3COO-)=c(H+)=c(OH-)
D.该滴定过程应该选择甲基橙作为指示剂
19.室温下,将0.1000mol·L-1盐酸滴入20.00mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示,下列说法正确的是()
A.b点处的溶液中c(Cl-)>c(M+)>c(OH-)>c(H+)
B.室温下,MOH的电离平衡常数Kb为1×10-5
C.c点处的溶液中c(M+)=c(Cl-)=c(H+)=c(OH-)
D.d点处的溶液中c(MOH)+c(H+)=c(OH-)
二、综合题
20.乙硫醇()的综合利用及治理是当前环境领域关注的焦点之一。
(1)家用煤气中可掺入微量具有难闻气味的乙硫醇。
已知: kJ·mol
kJ·mol
kJ·mol
的 。
(2)是一种高效多功能的新型绿色水处理剂,可用于除去废水中的。已知水溶液中的物种分布分数如图所示。
①已知,比较和酸性强弱并从结构的角度说明理由: 。
②写出工业废水时,氧化生成和的离子方程式: 。
③一种采用电化学方法制取的装置原理如图所示。阳极使用的是易被氧化的活性铁电极。电解池阳极室中KOH溶液的浓度为14 mol·L、电解60 min,调节不同的电压,测得反应后溶液中的浓度与电流密度(其他条件一定,电压与电流密度大小成正比)的关系如图所示。
I 写出制取的电极反应式: 。
II 电流密度大于4 mA·cm时,所得反应后溶液中的浓度上升幅度变小的原因是 。
21.请根据物质在生产、生活等方面的应用填空:
(1)苏打水溶液中滴加酚酞溶液后,溶液呈 (填“无”或“红”)色;
(2)检验某补铁剂中的Fe2+是否被氧化成Fe3+,可向该补铁剂溶液中加入KSCN溶液,若溶液 (填“变红色“或“产生红褐色沉淀”),则Fe2+已被氧化成Fe3+;
(3)铝制餐具不宜长时间存放酸性、碱性食物,但常温下铝制容器可以整装浓硫酸,是由于铝在冷的浓硫酸中 (填“不反应“或“钝化”),
22.磷酸二氢钾在工农业和医学领域具有广泛的应用。以下是工业上制备磷酸二氢钾的两种方法。
(1)Ⅰ.根据流程图回答下列问题:
气体X为 (填化学式),“转化”步骤的离子方程式
(2)滤液①中加入甲醇的作用是 。操作I为 。
(3)Ⅱ.电解法。电解法制取KH2PO4的原理如图,一定条件下,还可得到NaClO3。
在 室(填标号)可得到KH2PO4,写出产生ClO 的电极反应式
(4)用碱性CH3OH燃料电池作为该装置的电源,燃料电池的负极反应式
(5)Ⅲ.纯度分析:测定产品纯度的反应原理为 KH2PO4+NaOH=KNaHPO4+H2O
取产品3.00g加入15mL蒸馏水溶解,加入指示剂,用0.5000 mol/L NaOH标准溶液滴定至终点,消耗40.00mL,该产品的纯度为 (结果保留三位有效数字)
23.常温下,向浓度为0.1mol·L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
(1)该温度时NH3·H2O的电离常数K约为 。
(2)比较b、c、d三点时的溶液中,由水电离出的OH- 浓度大小顺序为 。
(3)滴定时,由b点到c点的过程中,忽略溶液温度的变化,下列各选项中数值逐渐减小的是____(填字母)。
A.c(H+)·c(OH-) B.
C.c(NH)·c(OH- ) D.
(4)滴定过程中所用盐酸的pH= ,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH水解的影响,忽略混合时溶液体积变化),则e点对应的横坐标为 。
(5)常温下反应NH3·H2O(aq)+H+(aq) NH (aq)+H2O(l)的平衡常数K= 。
(6)d点溶液中溶质的电子式 。
24.CO2的回收利用对减少温室气体排放、改善人类生存环境具有重要意义。利用CO2和CH4重整可制合成气(主要成分CO、H2),重整过程中部分反应的热化学方程式为: ①CH4(g) = C(s) + 2H2(g) △H = +75.0 kJ·mol-1
②CO2(g) + H2(g) = CO(g) + H2O(g) △H = +41.0 kJ·mol-1
③CO(g) + H2(g) = C(s) + H2O(g) △H = -131.0 kJ·mol-1
(1)反应CO2(g) + CH4(g) = 2CO(g) + 2H2(g)的△H= 。
(2)固定n(CO2)= n(CH4),改变反应温度,CO2和CH4的平衡转化率见下图
①同温度下CO2的平衡转化率 (填“大于”或“小于”)于CH4的平衡转化率,其原因是 。
②高温下进行该反应时常会因反应①生成“积碳”(碳单质),造成催化剂中毒,高温下反应①能自发进行的原因是 。
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,该反应的化学方程式为 ,反应过程中碳元素的化合价为-2价的中间体是 。
(4)卤水可在吸收烟道气中CO2的同时被净化,实现以废治废,其中涉及的一个反应是CaSO4 + Na2CO3 = CaCO3 + Na2SO4,则达到平衡后,溶液中c(CO32-)/c(SO42-) = 。【用Ksp(CaSO4)和Ksp(CaCO3)表示】
答案解析部分
1.【答案】B
【解析】【解答】物质的量浓度相同的NaX、NaY和NaZ溶液,其pH依次为8、9、10,说明NaX、NaY和NaZ均为强碱弱酸盐,根据盐类的水解是越弱越水解,根据其pH逐渐增大,所以盐的水解能力逐渐增强,则HX、HY、HZ的酸性越来越弱,由强到弱的顺序是HX>HY>HZ,B符合题意。
故答案为:B
【分析】盐类的水解是:有弱才水解,无弱不水解;越弱越水解,弱弱都水解;谁强显谁性,等弱显中性。强酸强碱盐显中性,弱酸强碱盐显碱性,强酸弱碱盐显酸性,弱酸弱碱慢确定。
2.【答案】B
【解析】【解答】A.侯氏制碱法为氯化钠和氨气、二氧化碳共同反应生成碳酸氢钠,加热后碳酸氢钠分解为碳酸钠,不是NaOH,A错误;
B.卢瑟福提出原子有核模型,B正确;
C.汤姆生发现电子,C错误;
D.凯库勒的贡献在于确定了苯的结构式,D错误;
正确选项B。
【分析】A、侯氏制碱法制得碱是纯碱即小苏打
C、发现电子的是汤姆生
D、凯库勒是确定凯库勒式即苯的结构式
3.【答案】B
【解析】【解答】强酸、强碱和绝大部分盐属于强电解质,弱酸、弱碱和水是弱电解质,强电解质不存在电离平衡,NaHSO4、BaSO4、CH3COONa是强电解质,不存在电离平衡,醋酸是弱电解质,存在电离平衡,综上所述,
故答案为:B。
【分析】 溶质存在电离平衡 ,说明溶质为弱电解质。
4.【答案】C
【解析】【解答】A.、、之间发生氧化还原反应,,不能大量共存,A不符题意;
B.Mg2+和OH-之间发生反应生成白色沉淀Mg(OH)2,不能大量共存,B不符题意;
C.离子间不会反应,能够大量共存,C符合题意;
D.和OH-之间能反应生成弱电解质NH3 H2O,不能大量共存,D不符题意;
故答案为:C。
【分析】思路分析:判断离子共存方法,1.看溶液中离子之间因发生复分解反应生成沉淀、气体和弱电解质而不能共存;2看离子之间因发生氧化还原反应而不能共存,3.注意题目隐含条件,颜色、pH
5.【答案】A
6.【答案】D
【解析】【解答】A.由a点可知,0.1mol/L一元酸HA中c水(H+)=c水(OH-)=1×10-11mol/L,则c(H+)=1×10-14÷10-11=1×10-3mol/L,则HA的电离常数 ,A选项不符合题意;
B.b点溶液中c水(H+)=1×10-7mol/L,c点c水(H+)最大,则溶质恰好为KA,显碱性,a点显酸性,c点显碱性,则中间c水(H+)=1×10-7mol/L的b点恰好显中性,根据电荷守恒可得c(A-)+c(OH-)=c(K+)+c(H+),又c(OH-)=c(H+),则c(A-)=c(K+),B选项不符合题意;
C.c点时加入的KOH的物质的量n(KOH)=20mL×0.1mol/L÷0.1mol/L=20mL,由HA的Ka=1×10-5,可得A-的 则c(A-)≈0.05mol/L,则c(OH-)≈7×10-6mol/L,在KA中c(OH-)都是由水电离处的,则c水(OH-)=c水(H+)≈7×10-6mol/L,C选项不符合题意;
D.向一元弱酸中加入相同浓度的一元强碱,溶液的导电能力逐渐增强,则导电能力:c>b>a,D选项符合题意;
故答案为:D。
【分析】A.根据起始点水的电离情况,计算出由HA电离出的氢离子浓度
B.根据电荷守恒计算即可
C.根据计算此时恰好完全反应,根据电离方程式即可计算氢离子浓度
D.随着氢氧化钠的加入,生成的盐的量逐渐增多,电离增强,导电性增强
7.【答案】B
【解析】【解答】解:A.醋酸是一元弱酸,在溶液中存在电离平衡,主要以电解质分子存在,盐酸是一元强酸,完全电离,稀释前,一元溶液中c(H+):①<②=③,所以溶液pH:①>②=③,A不符合题意;
B.醋酸是一元弱酸,稀释后,一元溶液中c(H+):①<②<③,所以溶液pH:①>②>③,B符合题意;
C.由于醋酸是弱酸,在溶液中存在电离平衡,盐酸是强酸,完全电离,在稀释前,①0.1 mol·L-1醋酸溶液,②0.1 mol·L-1盐酸,③pH=1的醋酸溶液,所以溶液中溶质的物质的量浓度:③>①=②,C不符合题意;
D.盐酸是一元强酸,醋酸是一元弱酸,所以稀释后,溶液中溶质的物质的量浓度:③>①=②,D不符合题意。
故答案为:B
【分析】本题关键①部分电离,酸0.1,但c(H+)<0.1②完全电离,酸、c(H+)=0.1③部分电离c(H+)=0.1,则酸>0.1
8.【答案】B
【解析】【解答】解:为酸中毒病人输液的目的是降低血液中的酸的浓度,题中氯化铵溶液呈酸性,不能用于酸中毒病人输液,而碳酸氢钠溶液可与酸反应而降低酸的浓度,另外0.9%氯化钠溶液、5%葡萄糖溶液是医院常用输液物质,
故选B.
【分析】为酸中毒病人输液的目的是降低血液中的酸的浓度,应用碱性物质.
9.【答案】D
【解析】【解答】解:盐类水解中,越弱越水解,氢氟酸(HF)的酸性比氢氰酸(HCN)强,则CN﹣水解程度大于F﹣离子的水解程度,则混合液中c(F﹣)>c(CN﹣),
由于CN﹣和F﹣离子的水解,溶液显示碱性,c(OH﹣)>c(H+),则溶液中离子浓度大小为:c(Na+)>c(F﹣)>c(CN﹣)>c(OH﹣)>c(H+),c(HCN)>c(HF)
综上所述得到:c(Na+)>c(F﹣)>c(CN﹣)>c(OH﹣)>c(HCN)>c(HF)>c(H+).
故选D.
【分析】氢氟酸(HF)的酸性比氢氰酸(HCN)强,HF比HCN易电离,由盐类水解越弱越水解可知,0.1mol/L的NaF和NaCN混合溶液中,NaCN水解程度大,溶液中c(F﹣)>c(CN﹣),水解显示碱性,则c(OH﹣)>c(H+),据此判断溶液中各离子浓度大小.
10.【答案】D
【解析】【解答】A.纯碱的化学式为Na2CO3,属于盐,选项错误,A不符合题意;
B.盐酸为HCl溶液,属于混合物,选项错误,B不符合题意;
C.氯化银为盐,属于强电解质,选项错误,C不符合题意;
D.碱性氧化物是指能与酸反应生成盐和水的氧化物,氧化钠能与盐酸反应生成氯化钠和水,故氧化钠属于碱性氧化物,选项正确,D符合题意;
故答案为:D
【分析】A.纯碱为Na2CO3;
B.盐酸为HCl溶液;
C.氯化银属于盐,为强电解质;
D.氧化钠能与酸反应生成盐和水;
11.【答案】D
【解析】【解答】A.H2A H++HA-的电离平衡常数Ka1= ,当c(HA-)=c(H2A)时溶液的pH=3.30即溶液中c(H+)=10-3.30,代入Ka1=10-3.30,A项不符合题意;
B.NaOH滴入H2A溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),当c(Na+)=c(HA-)+2c(A2-)时,c(H+)=c(OH-),溶液呈中性,B项不符合题意;
C.根据图像pH=6.27时,溶液中c(A2-)=c(HA-),溶液呈酸性,c(H+) c(OH-),C项不符合题意;
D.NaOH滴入H2A溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),NaOH溶液和H2A溶液物质的量浓度相等,当V(NaOH溶液):V(H2A溶液)=3:2时,溶液中的物料守恒为2c(Na+)=3[c(H2A)+c(HA-)+c(A2-)],将两式整理得, c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+),D项符合题意;
故答案为:D。
【分析】根据各种离子的百分含量与溶液pH的关系图像进行分析溶液中离子浓度的大小关系及弱酸的电离平衡常数等即可。
12.【答案】B
【解析】【解答】A.与单质铝反应能产生大量氢气的溶液呈酸性或碱性, 与H+不能大量共存, 与H+或OH-均不能大量共存,A不符合题意;
B.酸性溶液中,这几种离子能大量共存,B符合题意;
C.H+与NO3-组合具有强氧化性,能氧化Fe2+,不能大量共存,C不符合题意;
D.遇酚酞显红色的溶液呈碱性,Cl2能与碱反应,不能大量共存,D不符合题意;
故答案为:B
【分析】判断离子之间是否能大量共存,主要看离子之间是否发生反应。若离子之间反应生成气体、沉淀、弱电解质或发生氧化还原反应、络合反应、双水解反应等时,离子之间不可大量共存。在遇到此类试题时,注意题干中是否涉及颜色,要熟悉溶液中常见离子的颜色,以及溶液的酸碱性。另注意“H+与NO3-”组合具有强氧化性,能与S2-、Fe2+、I-等发生氧化还原反应。
13.【答案】B
【解析】【解答】A.是强碱弱酸的酸式盐,水溶液由于碳酸氢根水解大于电离而呈碱性,A不合题意;
B.是强碱弱酸的正盐,水溶液由于醋酸根离子水解而呈碱性,B符合题意;
C.KOH是强碱,水溶液由于KOH=K++OH-呈碱性,C不合题意;
D.是强酸,水溶液由于H2SO4=2H++而呈酸性,D不合题意;
故答案为:B。
【分析】水溶液为碱性的盐,根据水解规律,强碱弱酸盐水解呈碱性
14.【答案】B
【解析】【解答】解:加入CaC2,与水发生CaC2+2H2O=Ca(OH)2+HC≡CH↑,反应消耗水,因原溶液为饱和溶液,则反应后一定有Ca(OH)2析出,则溶液浓度不变,
故选B.
【分析】加入CaC2,与水发生CaC2+2H2O=Ca(OH)2+HC≡CH↑,反应消耗水,结合Ca(OH)2(s) Ca2+(aq)+2OH﹣(aq)的影响因素解答.
15.【答案】C
【解析】【解答】A.溶液中的OH-由NH3·H2O、H2O共同电离产生,根据电荷守恒可得c(OH-)=c(NH )+c(H+),A不符合题意;
B.二者等体积混合后,溶液中有未反应的OH-大量存在,溶液显碱性,所以常温下溶液的pH>7,B不符合题意;
C.CH3COONa是强碱弱酸盐,在溶液中CH3COO-水解消耗水电离产生的H+,促进水的电离,最终达到平衡时,溶液中c(OH-)>c(H+),溶液显碱性。根据质子守恒可得c(OH-)=c(CH3COOH)+c(H+),C符合题意;
D.根据物料守恒可得:c(Na+)=c(A2-)+c(HA-)+c(H2A),D不符合题意;
故答案为:C。
【分析】A.根据电荷守恒分析;
B.Ba(OH)2是二元碱,碱过量;
C.根据质子守恒分析;
D.根据物料守恒分析;
16.【答案】C
【解析】【解答】A.当 ,溶液呈酸性,且c(X2-)最小,则曲线d表示c(X2-);a随 的滴入,而 且初始读最高,则a表示c(H2X);观察曲线发现b先上升后下降,则b代表HX-浓度;c表示溶液的pH值,故A不符合题意;
B.由H2X的电离平衡常数 ,当 时,a与b相交,则a=b即 ,则 ,故B不符合题意;
C.当 时根据电荷守恒 ,又因pH<7,所以 ,则 , C符合题意;
D.滴定终点时根据电荷守恒有 ,物料守恒有 ,则2c(H2X) +c(H+)= c(OH-)-c(HX-),故D不符合题意;
故答案为:C。
【分析】A.根据反应过程中离子浓度变化分析;
B.根据V(NaOH)=5mL时,溶液中c(H2X)=c(HX-),结合H2X电离平衡常数的表达式进行计算;
C.结合电荷守恒和溶液的酸碱性分析;
D.结合电荷守恒、物料守恒进行分析;
17.【答案】D
【解析】【解答】A.Ka1= ,a点溶液中c(H+)=10-1.85,则该溶液中c(HA-)= = =c(H2A),再结合物料守恒知,溶液中存在n(H2A)+n(HA-)+n(A2-)=2n(H2A)+n(A2-)=0.1mol/L×0.02L=0.002mol,选项A不符合题意;
B.20mL时,二者恰好完全反应生成KHA,溶液中存在电荷守恒和物料守恒,根据电荷守恒电荷守恒c(K+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),物料守恒c(K+)=c(HA-)+c(A2-)+c(H2A),得到:c(H2A)+c(H+)=c(A2-)+c(OH-),选项B不符合题意;
C.c点溶液中溶质为KHA、K2A,溶液呈碱性,c(OH-)>c(H+),c(H+)=10-7.19mol/L,Ka2= =10-7.19,所以c(HA-)=c(A2-),溶液中电荷守恒为:c(K+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),已知(HA-)=c(A2-),则c(K+)+c(H+)=3c(HA-)+c(OH-),由于c(OH-)>c(H+),所以c(K+)>3c(HA-),选项C不符合题意;
故答案为:D。
【分析】由于 H2A 是二元弱酸,将 KOH溶液滴定20mL0.1mol·L-1H2A溶液发生的反应方程式为,。
18.【答案】B
【解析】【解答】A、在滴定过程中,溶液中离子电荷始终守恒,点①所示溶液中为醋酸和醋酸钠的混合溶液,溶液中离子电荷守恒的关系式为c(CH3COO-)+c(OH-)=c(Na+)+c(H+),A不符合题意;
B、 点②pH=7时,水电离的氢离子为1×10-7mol/L,点③所示溶液中恰好完全反应时,溶质为CH3COONa,CH3COO-水解促进了水的电离,B符合题意;
C.、pH=7时,溶液呈中性,c(H+)=c(OH-),根据电荷守恒,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),c(Na+)=c(CH3COO-),就可得知c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),C不符合题意;
D、滴定终点时,溶质为CH3COONa溶液,醋酸钠溶液中醋酸根离子水解显碱性,溶液由酸性变为碱性,若CH3COOH溶液装在锥形瓶中,应选用酚酞试液作指示剂,D不符合题意。
故答案为:B
【分析】溶液中离子浓度大小的问题需要充分利用守恒关系:电荷守恒(阳离子所带的正电荷数等于阴离子所带的负电荷数)、物料守恒(除H、O外找准体系中的特征元素,例如NH4Cl中的N元素,Na2CO3中的C元素),再结合混合体系的酸碱性做出判断。
19.【答案】B
【解析】【解答】20mL时达到滴定终点,则c(MOH)=(0.1000mol/L×20.00mL)/20.00 mL=0.1000 mol/L;A.b点时,溶液pH=9,溶液呈碱性,则c(H+)c(Cl-),故A不符合题意;
B.a点时,MOH溶液中pH=11,则c(OHˉ)=0.001mol/L,MOH是弱碱,电离平衡常数为:Kb= =1×10-5,故B符合题意;
C.c点处的溶液呈中性,此时溶质为MCl和少量MOH,根据电荷守恒得:c(M+)+c(H+)=c(OH-)+c(Cl-),因为c(H+)=c(OH-),所以得c(M+)=c(Cl-),所以c(M+)=c(Cl-)>c(H+)=c(OH-),故C不符合题意;
D.d点处的溶液中pH值小于7,c(H+)>c(OH-),溶质为MCl,根据物料守恒可得:c(Cl-)=c(M+) +c(MOH),根据电荷守恒得:c(M+)+c(H+)=c(OH-)+c(Cl-),两式结合得:c(H+)=c(OH-)+c(MOH),故D不符合题意;
故答案为:B。
【分析】A、b点为反应一半的点,溶液中由4种离子,且溶液显碱性,c(M+)>c(Cl-)。
B、没有加入酸时,碱的pH为9,可计算Kb。
C、c为中性点,c(H+)=c(OH-),根据电荷守恒:c(M+)+c(H+)=c(OH-)+c(Cl-),所以得c(M+)=c(Cl-),但c(M+)=c(Cl-)>c(H+)=c(OH-)。
D、质子守恒得c(H+)=c(OH-)+c(MOH)。
20.【答案】(1)-3526 kJ·mol
(2)酸性:,是推电子基团,使中的极性降低,电离出的能力减弱;;;铁电极表面出现更多的与Fe之间竞争放电生成;放电生成的将Fe氧化形成氧化物覆盖在电极表面(铁放电时生成氧化物覆盖在电极表面),阻碍的生成
【解析】【解答】(1)已知:① kJ·mol;② kJ·mol;③ kJ·mol;由盖斯定律可知,③+2×②-2×①得 =-3526 kJ·mol;
(2)①由图可知,当和浓度相等时,10②时,氧化生成和,Fe元素由+6价下降到+3价,S元素由-2价上升到+4价,根据得失电子守恒和电荷守恒配平离子方程式为:;
③阳极使用的是易被氧化的活性铁电极,Fe失去电子生成,根据得失电子守恒和电荷守恒配平电极方程式为:;电流密度大于4 mA·cm时,所得反应后溶液中的浓度上升幅度变小的原因是:铁电极表面出现更多的与Fe之间竞争放电生成;放电生成的将Fe氧化形成氧化物覆盖在电极表面(铁放电时生成氧化物覆盖在电极表面),阻碍的生成。
【分析】(1)根据盖斯定律计算;
(2)①依据图中曲线和ksp计算分析;
②根据反应物和生成物的化学式,利用原子守恒、得失电子守恒、电荷守恒分析;
③电解时,阳极与直流电源的正极相连的电极,发生氧化反应;阴极与直流电源的负极相连的电极,发生还原反应。
21.【答案】(1)红
(2)变红色
(3)钝化
【解析】【解答】(1)Na2CO3溶液中CO32-水解,使得溶液显碱性,滴加酚酞后,溶液显红色;
(2)若溶液中的Fe2+被氧化成Fe3+,则滴加KSCN溶液后,溶液显红色;
(3)常温下,浓硫酸能使铝钝化,故常温下,可用铝制容器盛装浓硫酸;
【分析】(1)Na2CO3溶液显碱性;
(2)根据Fe3+的检验分析;
(3)常温下,浓硫酸能是铝钝化;
22.【答案】(1)HCl;Ca3(PO4)2+4H++3SO 2H2PO +3CaSO4
(2)促进KH2PO4析出;蒸馏
(3)C;
(4)CH3OH-6e-+8OH-=CO +6H2O
(5)90.7%
【解析】【解答】(1)根据分析可知:KCl和浓硫酸加热反应生成HCl气体;“转化”步骤的离子方程式为:Ca3(PO4)2+4H++3SO42-=2H2PO4-+3CaSO4,故答案为HCl;Ca3(PO4)2+4H++3SO42-=2H2PO4-+3CaSO4;(2)滤液①是KH2PO4和K2SO4溶液,加入甲醇的作用是促进KH2PO4析出;滤液②是甲醇和K2SO4的混合液,分离它们采用蒸馏操作,故答案:促进KH2PO4析出;蒸馏;(3)由图可知A为阳极室,发生氧化反应,即Cl-+6OH--6e-=ClO3-+3H2O;C为阴极室,发生还原反应,K离子通过阳离子交换膜,进入C室,所以在C室可得到KH2PO4,故答案为C;Cl-+6OH--6e-=ClO3-+3H2O;(4)用碱性CH3OH燃料电池作为该装置的电源,燃料作负极,发生了氧化反,其反应的电极反应式为:CH3OH-6e-+8OH-=CO +6H2O,故答案:CH3OH-6e-+8OH-=CO +6H2O;(5)用0.5000 mol/LNaOH标准溶液滴定至终点,消耗40.00mL,消耗NaOH的物质的量为0.02mol,根据KH2PO4+NaOH=KNaHPO4+H2O,所以反应的KH2PO4为0.02mol,质量为0.02mol×136g/mol=2.72g,产品的纯度= ×100%≈90.7%,故答案为90.7%。
【分析】(1)根据框图可知KCl+H2SO4 KHSO4+HCl ,生成的KHSO4和Ca3(PO4)2反应的离子方程式为Ca3(PO4)2+4H++3SO42-=2H2PO4-+3CaSO4,过滤的滤渣为CaSO4,滤液为KH2PO4和K2SO4溶液;(2)由图可知A为阳极室,发生氧化反应,C为阴极室,发生还原反应,K+通过阳离子交换膜,进入C室,所以在C室可得到KH2PO4;(3)用碱性CH3OH燃料电池作为该装置的电源,燃料作负极,发生了氧化反;(4)根据反应KH2PO4+NaOH=KNaHPO4+H2O计算产品的纯度;
23.【答案】(1)1.0×10-5
(2)d>c>b
(3)C
(4)1;
(5)1.0×109
(6)
【解析】【解答】(1)根据图示,没有滴加盐酸时,0.1mol·L-1的氨水的pH=11,在溶液中NH3·H2O电离,电离方程式为NH3·H2ON+OH-,溶液的pH=11,则c(OH-)==mol/L=10-3mol/L,忽略溶液中水电离出来的H+,则c(N)= c(OH-)=10-3mol/L,NH3·H2O的电离程度较弱,发生电离的NH3·H2O约占所有NH3·H2O的1%,可以忽略不计,则溶液中c(NH3·H2O)= 0.1mol/L,则NH3·H2O的电离常数K===1.0×10-5;
(2)根据题意,d点两种溶液恰好完全反应,生成NH4Cl,N在溶液中能够水解,促进水的电离,b、c两点表示的溶液中c点NH3·H2O被中和的较多,剩余的NH3·H2O较少,对水的电离抑制较少,因此b、c、d三点时的溶液中,由水电离出的OH- 浓度大小顺序为d>c>b;
(3)b点到c点的过程中,NH3·H2O被中和的越来越多,但是还有剩余;
A.在水溶液中,溶液中的c(H+)·c(OH-)=Kw,温度不变,Kw不变,A不正确;
B.b点到c点的过程中,NH3·H2O被中和的越来越多,pH越来越小,c(H+)越来越大,c(OH-)越来越小,则越来越大,B不正确;
C.c(NH)·c(OH- )=c(NH3·H2O),其中为NH3·H2O的电离平衡常数表达式,温度不变,电离平衡常数不变,而b点到c点的过程中,NH3·H2O被中和的越来越多,所以c(NH)·c(OH- ) 逐渐减小,C正确;
D.为N水解的平衡常数表达式,温度不变,水解平衡常数不变,D不正确;
故答案为:C;
(4)根据题意,d点两种溶液恰好完全反应,加入盐酸的体积为VmL,而氨水溶液的体积恰好也是VmL,说明两溶液的溶质的浓度相同,盐酸的浓度也是0.1mol/L,c(H+)=0.1mol/L,pH=1;
如果忽略NH的水解,设e点加入盐酸的体积为xmL,e点溶液的pH=2,c(H+)=0.01mol/L,则有c(H+)===0.01mol/L,则可得x=;
(5)根据反应式NH3·H2O(aq)+H+(aq) NH (aq)+H2O(l),平衡常数K=====1.0×109。
(6)根据题意,d点两种溶液恰好完全反应,生成NH4Cl,即溶质为NH4Cl,是由N和Cl-构成的离子化合物,其电子式为。
【分析】(1)电力平衡常数可以结合初始值判断;
(2)水电离的氢氧根浓度即看水的电离是否收到抑制或者促进进行判断;
(3)电离平衡常数进行判断;
(4)结合完全反应的特殊点进行判断;
(5)平衡常数K可以结合一水合氨和水的离子积进行判断;
(6)氯化铵中铵根离子和氯离子形成离子键,铵根离子的内部是共价键结合。
24.【答案】(1)+247kJ/mol
(2)大于;CO2发生了其他副反应(与H2反应生成C和H2O);该反应△H>0,△S>0,高温时△G = △H - T△S<0
(3)CO2 + 4H2 = CH4 + 2H2O;MgOCH2
(4)
【解析】【解答】(1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol,②CO2(g)+H2(g)═CO(g)+H2O(g) △H=+41.0kJ/mol,③CO(g)+H2(g) ═C(s)+H2O(g)△H=-131.0kJ/mol,反应CO2(g)+CH4(g) ═2CO(g)+2H2(g)可以是①+②-③得到,根据盖斯定律计算反应的焓变△H=+247kJ/mol,故答案为:+247kJ/mol;
(2)①根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率大于;故答案为:大于;CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0,反应①△S>0,△H>0,代入判据,得到反应在高温下能自发进行,故答案为:△H>0,△S>0,高温时△G = △H - T△S<0;
(3)据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”,可以写出方程式为:CO2+4H2=CH4+2H2O;反应过程中碳元素的化合价为-2价的中间体是MgOCH2,故答案为:CO2+4H2=CH4+2H2O;MgOCH2;
(4)达到平衡后,Ksp(CaCO3)=c(Ca2+) c(CO32-),Ksp(CaSO4)=c(Ca2+) c(SO42-),溶液中 = ,故答案为: 。
【分析】(1)根据盖斯定律进行计算反应热即可;
(2)根据转化过程中的利用率判断转化率;根据自由能判据进行分析;
(3)根据元素化合价判断化学式;
(4)根据溶度积常数进行计算。
一、单选题
1.物质的量浓度相同的NaX、NaY和NaZ溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX,HZ, HY B.HX,HY,HZ C.HZ,HY,HX D.HY,HZ,HX
2.在科学史上每一次重大的发现都极大地推进了科学的发展。下列对化学史的描述正确的是( )
A.侯德榜制的碱是NaOH
B.卢瑟福提出原子有核模型
C.道尔顿发现电子
D.凯库勒的贡献在于确定了苯的分子式
3.下列物质在水溶液中,溶质存在电离平衡的是( )
A.NaHSO4 B.CH3COOH C.BaSO4 D.CH3COONa
4.下列各组离子,能在溶液中大量共存的是( )
A.、、、 B.、、、
C.、、、 D.、、、
5.下列实验事实不能证明醋酸是弱电解质的是( )
A.用醋酸溶液做导电实验时,灯泡很暗
B.常温下,测得0.1醋酸溶液的
C.常温下,将的醋酸溶液稀释1000倍测得
D.等氢离子浓度、等体积的盐酸和醋酸溶液中和碱时,醋酸中和碱的量更多
6.常温下,向20 mL 0.1mol·L-1一元酸HA中滴加相同浓度的KOH溶液,溶液中由水电离的氢离子浓度随加入KOH溶液体积的变化如图所示。则下列说法错误的是( )
A.HA的电离常数约为10-5
B.b点溶液中存在:c(A-)=c(K+)
C.c点对应的KOH溶液的体积V=20 mL,c水(H+)约为7×10-6 mol·L-1
D.导电能力:c>a>b
7.现有:①0.1 mol·L-1醋酸溶液,②0.1 mol·L-1盐酸,③pH=1的醋酸溶液。分别加水稀释,使体积变为原来的10倍。对于稀释前后溶液的有关说法错误的是( )
[说明:pH=-lgc(H+)]
A.稀释前,溶液pH:①>②=③
B.稀释后,溶液pH:①>②=③
C.稀释前,溶液中溶质的物质的量浓度:③>①=②
D.稀释后,溶液中溶质的物质的量浓度:③>①=②
8.在医院中,为酸中毒病人输液不应采用( )
A.0.9%氯化钠溶液 B.0.9%氯化铵溶液
C.1.25%碳酸氢钠溶液 D.5%葡萄糖溶液
9.已知相同温度下电离常数K(HF)>K(HCN),在物质的量浓度均为0.1mol/L的NaCN和NaF混合浓度中,下列排序正确的是( )
A.c(OH﹣)>c(HF)>c(HCN)>c(H+)
B.c(OH﹣)>c(CN﹣)>c(F﹣)>c(H+)
C.c(OH﹣)>c(F﹣)>c(CN﹣)>c(H+)
D.c(F﹣)>c(OH﹣)>c(HCN)>c(HF)
10.关于物质的分类,正确的是( )
A.纯碱---碱 B.盐酸---纯净物
C.氯化银---弱电解质 D.氧化钠---碱性氧化物
11.常温下,H2A是一种易溶于水的二元酸,将NaOH溶液滴入等物质的量浓度的H2A溶液中,溶液中H2A、HA-、A2-的物质的量分数(a)随溶液pH的变化关系如图所示。下列说法错误的是( )
A.常温下,H2A HA-+H+的电离平衡常数Ka1=10-3.30
B.当c(Na+)=2c(A2-)+c(HA-)时,溶液呈中性
C.pH=6.27时,c(A2-)=c(HA-)>c(H+)>c(OH-)
D.V(NaOH溶液):V(HA溶液)=3:2时,2c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+)
12.下列微粒在所给条件下,一定可以大量共存的是( )。
A.与单质铝反应能产生大量氢气的溶液中:、、、
B.常温下的酸性溶液中:、、、
C.澄清透明酸性溶液中:、、、
D.遇酚酞显红色的溶液中:、、、
13.水溶液呈碱性的正盐是( )
A. B. C.KOH D.
14.向饱和澄清石灰水中加入少量CaC2,充分反应后恢复到原来的温度,所得溶液中( )
A.c(Ca2+)、c(OH﹣)均增大
B.c(Ca2+)、c(OH﹣)均保持不变
C.c(Ca2+)、c(OH﹣)均减小
D.c(OH﹣)增大、c(H+)减小
15.下列指定条件下的结果正确的是( )
A.0.1 mol·L-1氨水中,c(OH-)=c(NH )
B.常温下,10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=7
C.在0.1 mol·L-1CH3COONa溶液中,c(OH-)=c(CH3COOH)+c(H+)
D.0.1 mol·L-1某二元弱酸盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
16.25℃时,以甲基橙为指示剂用0.1000 mol·L-1的NaOH溶液滴定二元酸H2X溶液。溶液的pH及溶液中H2X、 HX-及X2-的物质的量液度变化如图所示,下列说法错误的是( )
A.a曲线表示c(H2X) ,d曲线表示c(X2-)
B.H2X的电离平衡常数Ka1 =1×10-4
C.V (NaOH) =5mL时,
D.滴定终点时:2c(H2X) +c(H+)= c(OH-)-c(HX-)
17.用0.1mol·L-1KOH溶液滴定20mL0.1mol·L-1H2A溶液的滴定曲线如图所示(曲线上的数字为pH)。已知pKa=-lgKa,25℃时H2A的pKa1=1.85,pKa2=7.19。下列说法正确的是( )
A.a点所得溶液中:2c(H2A)+c(A2-)=0.1mol/L
B.b点所得溶液中:2c(H2A)+c(H+)=c(A2-)+c(OH-)
C.c点所得溶液中:c(K+)<3c(HA-)
D.d点所得溶液中A2-第一级水解平衡常数为10-6.81
18.常温下,用0.100 0 mol·L-1NaOH溶液滴定20.00 mL 0.100 0mol·L-1CH3COOH溶液所得滴定曲线如下图。下列说法正确的是( )
A.点①所示溶液中:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
B.溶液中②、③点水的电离程度:③>②
C.点②所示溶液中:c(Na+)=c(CH3COO-)=c(H+)=c(OH-)
D.该滴定过程应该选择甲基橙作为指示剂
19.室温下,将0.1000mol·L-1盐酸滴入20.00mL未知浓度的某一元碱MOH溶液中,溶液pH随加入盐酸体积变化曲线如图所示,下列说法正确的是()
A.b点处的溶液中c(Cl-)>c(M+)>c(OH-)>c(H+)
B.室温下,MOH的电离平衡常数Kb为1×10-5
C.c点处的溶液中c(M+)=c(Cl-)=c(H+)=c(OH-)
D.d点处的溶液中c(MOH)+c(H+)=c(OH-)
二、综合题
20.乙硫醇()的综合利用及治理是当前环境领域关注的焦点之一。
(1)家用煤气中可掺入微量具有难闻气味的乙硫醇。
已知: kJ·mol
kJ·mol
kJ·mol
的 。
(2)是一种高效多功能的新型绿色水处理剂,可用于除去废水中的。已知水溶液中的物种分布分数如图所示。
①已知,比较和酸性强弱并从结构的角度说明理由: 。
②写出工业废水时,氧化生成和的离子方程式: 。
③一种采用电化学方法制取的装置原理如图所示。阳极使用的是易被氧化的活性铁电极。电解池阳极室中KOH溶液的浓度为14 mol·L、电解60 min,调节不同的电压,测得反应后溶液中的浓度与电流密度(其他条件一定,电压与电流密度大小成正比)的关系如图所示。
I 写出制取的电极反应式: 。
II 电流密度大于4 mA·cm时,所得反应后溶液中的浓度上升幅度变小的原因是 。
21.请根据物质在生产、生活等方面的应用填空:
(1)苏打水溶液中滴加酚酞溶液后,溶液呈 (填“无”或“红”)色;
(2)检验某补铁剂中的Fe2+是否被氧化成Fe3+,可向该补铁剂溶液中加入KSCN溶液,若溶液 (填“变红色“或“产生红褐色沉淀”),则Fe2+已被氧化成Fe3+;
(3)铝制餐具不宜长时间存放酸性、碱性食物,但常温下铝制容器可以整装浓硫酸,是由于铝在冷的浓硫酸中 (填“不反应“或“钝化”),
22.磷酸二氢钾在工农业和医学领域具有广泛的应用。以下是工业上制备磷酸二氢钾的两种方法。
(1)Ⅰ.根据流程图回答下列问题:
气体X为 (填化学式),“转化”步骤的离子方程式
(2)滤液①中加入甲醇的作用是 。操作I为 。
(3)Ⅱ.电解法。电解法制取KH2PO4的原理如图,一定条件下,还可得到NaClO3。
在 室(填标号)可得到KH2PO4,写出产生ClO 的电极反应式
(4)用碱性CH3OH燃料电池作为该装置的电源,燃料电池的负极反应式
(5)Ⅲ.纯度分析:测定产品纯度的反应原理为 KH2PO4+NaOH=KNaHPO4+H2O
取产品3.00g加入15mL蒸馏水溶解,加入指示剂,用0.5000 mol/L NaOH标准溶液滴定至终点,消耗40.00mL,该产品的纯度为 (结果保留三位有效数字)
23.常温下,向浓度为0.1mol·L-1、体积为VL的氨水中逐滴加入一定浓度的盐酸,用pH计测溶液的pH随盐酸的加入量而降低的滴定曲线,d点两种溶液恰好完全反应。根据图中信息回答下列问题:
(1)该温度时NH3·H2O的电离常数K约为 。
(2)比较b、c、d三点时的溶液中,由水电离出的OH- 浓度大小顺序为 。
(3)滴定时,由b点到c点的过程中,忽略溶液温度的变化,下列各选项中数值逐渐减小的是____(填字母)。
A.c(H+)·c(OH-) B.
C.c(NH)·c(OH- ) D.
(4)滴定过程中所用盐酸的pH= ,d点之后若继续加入盐酸至图像中的e点(此时不考虑NH水解的影响,忽略混合时溶液体积变化),则e点对应的横坐标为 。
(5)常温下反应NH3·H2O(aq)+H+(aq) NH (aq)+H2O(l)的平衡常数K= 。
(6)d点溶液中溶质的电子式 。
24.CO2的回收利用对减少温室气体排放、改善人类生存环境具有重要意义。利用CO2和CH4重整可制合成气(主要成分CO、H2),重整过程中部分反应的热化学方程式为: ①CH4(g) = C(s) + 2H2(g) △H = +75.0 kJ·mol-1
②CO2(g) + H2(g) = CO(g) + H2O(g) △H = +41.0 kJ·mol-1
③CO(g) + H2(g) = C(s) + H2O(g) △H = -131.0 kJ·mol-1
(1)反应CO2(g) + CH4(g) = 2CO(g) + 2H2(g)的△H= 。
(2)固定n(CO2)= n(CH4),改变反应温度,CO2和CH4的平衡转化率见下图
①同温度下CO2的平衡转化率 (填“大于”或“小于”)于CH4的平衡转化率,其原因是 。
②高温下进行该反应时常会因反应①生成“积碳”(碳单质),造成催化剂中毒,高温下反应①能自发进行的原因是 。
(3)一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”从而变废为宝,其反应机理如图所示,该反应的化学方程式为 ,反应过程中碳元素的化合价为-2价的中间体是 。
(4)卤水可在吸收烟道气中CO2的同时被净化,实现以废治废,其中涉及的一个反应是CaSO4 + Na2CO3 = CaCO3 + Na2SO4,则达到平衡后,溶液中c(CO32-)/c(SO42-) = 。【用Ksp(CaSO4)和Ksp(CaCO3)表示】
答案解析部分
1.【答案】B
【解析】【解答】物质的量浓度相同的NaX、NaY和NaZ溶液,其pH依次为8、9、10,说明NaX、NaY和NaZ均为强碱弱酸盐,根据盐类的水解是越弱越水解,根据其pH逐渐增大,所以盐的水解能力逐渐增强,则HX、HY、HZ的酸性越来越弱,由强到弱的顺序是HX>HY>HZ,B符合题意。
故答案为:B
【分析】盐类的水解是:有弱才水解,无弱不水解;越弱越水解,弱弱都水解;谁强显谁性,等弱显中性。强酸强碱盐显中性,弱酸强碱盐显碱性,强酸弱碱盐显酸性,弱酸弱碱慢确定。
2.【答案】B
【解析】【解答】A.侯氏制碱法为氯化钠和氨气、二氧化碳共同反应生成碳酸氢钠,加热后碳酸氢钠分解为碳酸钠,不是NaOH,A错误;
B.卢瑟福提出原子有核模型,B正确;
C.汤姆生发现电子,C错误;
D.凯库勒的贡献在于确定了苯的结构式,D错误;
正确选项B。
【分析】A、侯氏制碱法制得碱是纯碱即小苏打
C、发现电子的是汤姆生
D、凯库勒是确定凯库勒式即苯的结构式
3.【答案】B
【解析】【解答】强酸、强碱和绝大部分盐属于强电解质,弱酸、弱碱和水是弱电解质,强电解质不存在电离平衡,NaHSO4、BaSO4、CH3COONa是强电解质,不存在电离平衡,醋酸是弱电解质,存在电离平衡,综上所述,
故答案为:B。
【分析】 溶质存在电离平衡 ,说明溶质为弱电解质。
4.【答案】C
【解析】【解答】A.、、之间发生氧化还原反应,,不能大量共存,A不符题意;
B.Mg2+和OH-之间发生反应生成白色沉淀Mg(OH)2,不能大量共存,B不符题意;
C.离子间不会反应,能够大量共存,C符合题意;
D.和OH-之间能反应生成弱电解质NH3 H2O,不能大量共存,D不符题意;
故答案为:C。
【分析】思路分析:判断离子共存方法,1.看溶液中离子之间因发生复分解反应生成沉淀、气体和弱电解质而不能共存;2看离子之间因发生氧化还原反应而不能共存,3.注意题目隐含条件,颜色、pH
5.【答案】A
6.【答案】D
【解析】【解答】A.由a点可知,0.1mol/L一元酸HA中c水(H+)=c水(OH-)=1×10-11mol/L,则c(H+)=1×10-14÷10-11=1×10-3mol/L,则HA的电离常数 ,A选项不符合题意;
B.b点溶液中c水(H+)=1×10-7mol/L,c点c水(H+)最大,则溶质恰好为KA,显碱性,a点显酸性,c点显碱性,则中间c水(H+)=1×10-7mol/L的b点恰好显中性,根据电荷守恒可得c(A-)+c(OH-)=c(K+)+c(H+),又c(OH-)=c(H+),则c(A-)=c(K+),B选项不符合题意;
C.c点时加入的KOH的物质的量n(KOH)=20mL×0.1mol/L÷0.1mol/L=20mL,由HA的Ka=1×10-5,可得A-的 则c(A-)≈0.05mol/L,则c(OH-)≈7×10-6mol/L,在KA中c(OH-)都是由水电离处的,则c水(OH-)=c水(H+)≈7×10-6mol/L,C选项不符合题意;
D.向一元弱酸中加入相同浓度的一元强碱,溶液的导电能力逐渐增强,则导电能力:c>b>a,D选项符合题意;
故答案为:D。
【分析】A.根据起始点水的电离情况,计算出由HA电离出的氢离子浓度
B.根据电荷守恒计算即可
C.根据计算此时恰好完全反应,根据电离方程式即可计算氢离子浓度
D.随着氢氧化钠的加入,生成的盐的量逐渐增多,电离增强,导电性增强
7.【答案】B
【解析】【解答】解:A.醋酸是一元弱酸,在溶液中存在电离平衡,主要以电解质分子存在,盐酸是一元强酸,完全电离,稀释前,一元溶液中c(H+):①<②=③,所以溶液pH:①>②=③,A不符合题意;
B.醋酸是一元弱酸,稀释后,一元溶液中c(H+):①<②<③,所以溶液pH:①>②>③,B符合题意;
C.由于醋酸是弱酸,在溶液中存在电离平衡,盐酸是强酸,完全电离,在稀释前,①0.1 mol·L-1醋酸溶液,②0.1 mol·L-1盐酸,③pH=1的醋酸溶液,所以溶液中溶质的物质的量浓度:③>①=②,C不符合题意;
D.盐酸是一元强酸,醋酸是一元弱酸,所以稀释后,溶液中溶质的物质的量浓度:③>①=②,D不符合题意。
故答案为:B
【分析】本题关键①部分电离,酸0.1,但c(H+)<0.1②完全电离,酸、c(H+)=0.1③部分电离c(H+)=0.1,则酸>0.1
8.【答案】B
【解析】【解答】解:为酸中毒病人输液的目的是降低血液中的酸的浓度,题中氯化铵溶液呈酸性,不能用于酸中毒病人输液,而碳酸氢钠溶液可与酸反应而降低酸的浓度,另外0.9%氯化钠溶液、5%葡萄糖溶液是医院常用输液物质,
故选B.
【分析】为酸中毒病人输液的目的是降低血液中的酸的浓度,应用碱性物质.
9.【答案】D
【解析】【解答】解:盐类水解中,越弱越水解,氢氟酸(HF)的酸性比氢氰酸(HCN)强,则CN﹣水解程度大于F﹣离子的水解程度,则混合液中c(F﹣)>c(CN﹣),
由于CN﹣和F﹣离子的水解,溶液显示碱性,c(OH﹣)>c(H+),则溶液中离子浓度大小为:c(Na+)>c(F﹣)>c(CN﹣)>c(OH﹣)>c(H+),c(HCN)>c(HF)
综上所述得到:c(Na+)>c(F﹣)>c(CN﹣)>c(OH﹣)>c(HCN)>c(HF)>c(H+).
故选D.
【分析】氢氟酸(HF)的酸性比氢氰酸(HCN)强,HF比HCN易电离,由盐类水解越弱越水解可知,0.1mol/L的NaF和NaCN混合溶液中,NaCN水解程度大,溶液中c(F﹣)>c(CN﹣),水解显示碱性,则c(OH﹣)>c(H+),据此判断溶液中各离子浓度大小.
10.【答案】D
【解析】【解答】A.纯碱的化学式为Na2CO3,属于盐,选项错误,A不符合题意;
B.盐酸为HCl溶液,属于混合物,选项错误,B不符合题意;
C.氯化银为盐,属于强电解质,选项错误,C不符合题意;
D.碱性氧化物是指能与酸反应生成盐和水的氧化物,氧化钠能与盐酸反应生成氯化钠和水,故氧化钠属于碱性氧化物,选项正确,D符合题意;
故答案为:D
【分析】A.纯碱为Na2CO3;
B.盐酸为HCl溶液;
C.氯化银属于盐,为强电解质;
D.氧化钠能与酸反应生成盐和水;
11.【答案】D
【解析】【解答】A.H2A H++HA-的电离平衡常数Ka1= ,当c(HA-)=c(H2A)时溶液的pH=3.30即溶液中c(H+)=10-3.30,代入Ka1=10-3.30,A项不符合题意;
B.NaOH滴入H2A溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),当c(Na+)=c(HA-)+2c(A2-)时,c(H+)=c(OH-),溶液呈中性,B项不符合题意;
C.根据图像pH=6.27时,溶液中c(A2-)=c(HA-),溶液呈酸性,c(H+) c(OH-),C项不符合题意;
D.NaOH滴入H2A溶液中,溶液中的电荷守恒为c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),NaOH溶液和H2A溶液物质的量浓度相等,当V(NaOH溶液):V(H2A溶液)=3:2时,溶液中的物料守恒为2c(Na+)=3[c(H2A)+c(HA-)+c(A2-)],将两式整理得, c(Na+)+c(OH-)=2c(H2A)+c(HA-)+c(H+),D项符合题意;
故答案为:D。
【分析】根据各种离子的百分含量与溶液pH的关系图像进行分析溶液中离子浓度的大小关系及弱酸的电离平衡常数等即可。
12.【答案】B
【解析】【解答】A.与单质铝反应能产生大量氢气的溶液呈酸性或碱性, 与H+不能大量共存, 与H+或OH-均不能大量共存,A不符合题意;
B.酸性溶液中,这几种离子能大量共存,B符合题意;
C.H+与NO3-组合具有强氧化性,能氧化Fe2+,不能大量共存,C不符合题意;
D.遇酚酞显红色的溶液呈碱性,Cl2能与碱反应,不能大量共存,D不符合题意;
故答案为:B
【分析】判断离子之间是否能大量共存,主要看离子之间是否发生反应。若离子之间反应生成气体、沉淀、弱电解质或发生氧化还原反应、络合反应、双水解反应等时,离子之间不可大量共存。在遇到此类试题时,注意题干中是否涉及颜色,要熟悉溶液中常见离子的颜色,以及溶液的酸碱性。另注意“H+与NO3-”组合具有强氧化性,能与S2-、Fe2+、I-等发生氧化还原反应。
13.【答案】B
【解析】【解答】A.是强碱弱酸的酸式盐,水溶液由于碳酸氢根水解大于电离而呈碱性,A不合题意;
B.是强碱弱酸的正盐,水溶液由于醋酸根离子水解而呈碱性,B符合题意;
C.KOH是强碱,水溶液由于KOH=K++OH-呈碱性,C不合题意;
D.是强酸,水溶液由于H2SO4=2H++而呈酸性,D不合题意;
故答案为:B。
【分析】水溶液为碱性的盐,根据水解规律,强碱弱酸盐水解呈碱性
14.【答案】B
【解析】【解答】解:加入CaC2,与水发生CaC2+2H2O=Ca(OH)2+HC≡CH↑,反应消耗水,因原溶液为饱和溶液,则反应后一定有Ca(OH)2析出,则溶液浓度不变,
故选B.
【分析】加入CaC2,与水发生CaC2+2H2O=Ca(OH)2+HC≡CH↑,反应消耗水,结合Ca(OH)2(s) Ca2+(aq)+2OH﹣(aq)的影响因素解答.
15.【答案】C
【解析】【解答】A.溶液中的OH-由NH3·H2O、H2O共同电离产生,根据电荷守恒可得c(OH-)=c(NH )+c(H+),A不符合题意;
B.二者等体积混合后,溶液中有未反应的OH-大量存在,溶液显碱性,所以常温下溶液的pH>7,B不符合题意;
C.CH3COONa是强碱弱酸盐,在溶液中CH3COO-水解消耗水电离产生的H+,促进水的电离,最终达到平衡时,溶液中c(OH-)>c(H+),溶液显碱性。根据质子守恒可得c(OH-)=c(CH3COOH)+c(H+),C符合题意;
D.根据物料守恒可得:c(Na+)=c(A2-)+c(HA-)+c(H2A),D不符合题意;
故答案为:C。
【分析】A.根据电荷守恒分析;
B.Ba(OH)2是二元碱,碱过量;
C.根据质子守恒分析;
D.根据物料守恒分析;
16.【答案】C
【解析】【解答】A.当 ,溶液呈酸性,且c(X2-)最小,则曲线d表示c(X2-);a随 的滴入,而 且初始读最高,则a表示c(H2X);观察曲线发现b先上升后下降,则b代表HX-浓度;c表示溶液的pH值,故A不符合题意;
B.由H2X的电离平衡常数 ,当 时,a与b相交,则a=b即 ,则 ,故B不符合题意;
C.当 时根据电荷守恒 ,又因pH<7,所以 ,则 , C符合题意;
D.滴定终点时根据电荷守恒有 ,物料守恒有 ,则2c(H2X) +c(H+)= c(OH-)-c(HX-),故D不符合题意;
故答案为:C。
【分析】A.根据反应过程中离子浓度变化分析;
B.根据V(NaOH)=5mL时,溶液中c(H2X)=c(HX-),结合H2X电离平衡常数的表达式进行计算;
C.结合电荷守恒和溶液的酸碱性分析;
D.结合电荷守恒、物料守恒进行分析;
17.【答案】D
【解析】【解答】A.Ka1= ,a点溶液中c(H+)=10-1.85,则该溶液中c(HA-)= = =c(H2A),再结合物料守恒知,溶液中存在n(H2A)+n(HA-)+n(A2-)=2n(H2A)+n(A2-)=0.1mol/L×0.02L=0.002mol,选项A不符合题意;
B.20mL时,二者恰好完全反应生成KHA,溶液中存在电荷守恒和物料守恒,根据电荷守恒电荷守恒c(K+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),物料守恒c(K+)=c(HA-)+c(A2-)+c(H2A),得到:c(H2A)+c(H+)=c(A2-)+c(OH-),选项B不符合题意;
C.c点溶液中溶质为KHA、K2A,溶液呈碱性,c(OH-)>c(H+),c(H+)=10-7.19mol/L,Ka2= =10-7.19,所以c(HA-)=c(A2-),溶液中电荷守恒为:c(K+)+c(H+)=c(HA-)+c(OH-)+2c(A2-),已知(HA-)=c(A2-),则c(K+)+c(H+)=3c(HA-)+c(OH-),由于c(OH-)>c(H+),所以c(K+)>3c(HA-),选项C不符合题意;
故答案为:D。
【分析】由于 H2A 是二元弱酸,将 KOH溶液滴定20mL0.1mol·L-1H2A溶液发生的反应方程式为,。
18.【答案】B
【解析】【解答】A、在滴定过程中,溶液中离子电荷始终守恒,点①所示溶液中为醋酸和醋酸钠的混合溶液,溶液中离子电荷守恒的关系式为c(CH3COO-)+c(OH-)=c(Na+)+c(H+),A不符合题意;
B、 点②pH=7时,水电离的氢离子为1×10-7mol/L,点③所示溶液中恰好完全反应时,溶质为CH3COONa,CH3COO-水解促进了水的电离,B符合题意;
C.、pH=7时,溶液呈中性,c(H+)=c(OH-),根据电荷守恒,c(CH3COO-)+c(OH-)=c(Na+)+c(H+),c(Na+)=c(CH3COO-),就可得知c(Na+)=c(CH3COO-)>c(H+)=c(OH-),故:c(Na+)=c(CH3COO-)>c(H+)=c(OH-),C不符合题意;
D、滴定终点时,溶质为CH3COONa溶液,醋酸钠溶液中醋酸根离子水解显碱性,溶液由酸性变为碱性,若CH3COOH溶液装在锥形瓶中,应选用酚酞试液作指示剂,D不符合题意。
故答案为:B
【分析】溶液中离子浓度大小的问题需要充分利用守恒关系:电荷守恒(阳离子所带的正电荷数等于阴离子所带的负电荷数)、物料守恒(除H、O外找准体系中的特征元素,例如NH4Cl中的N元素,Na2CO3中的C元素),再结合混合体系的酸碱性做出判断。
19.【答案】B
【解析】【解答】20mL时达到滴定终点,则c(MOH)=(0.1000mol/L×20.00mL)/20.00 mL=0.1000 mol/L;A.b点时,溶液pH=9,溶液呈碱性,则c(H+)
B.a点时,MOH溶液中pH=11,则c(OHˉ)=0.001mol/L,MOH是弱碱,电离平衡常数为:Kb= =1×10-5,故B符合题意;
C.c点处的溶液呈中性,此时溶质为MCl和少量MOH,根据电荷守恒得:c(M+)+c(H+)=c(OH-)+c(Cl-),因为c(H+)=c(OH-),所以得c(M+)=c(Cl-),所以c(M+)=c(Cl-)>c(H+)=c(OH-),故C不符合题意;
D.d点处的溶液中pH值小于7,c(H+)>c(OH-),溶质为MCl,根据物料守恒可得:c(Cl-)=c(M+) +c(MOH),根据电荷守恒得:c(M+)+c(H+)=c(OH-)+c(Cl-),两式结合得:c(H+)=c(OH-)+c(MOH),故D不符合题意;
故答案为:B。
【分析】A、b点为反应一半的点,溶液中由4种离子,且溶液显碱性,c(M+)>c(Cl-)。
B、没有加入酸时,碱的pH为9,可计算Kb。
C、c为中性点,c(H+)=c(OH-),根据电荷守恒:c(M+)+c(H+)=c(OH-)+c(Cl-),所以得c(M+)=c(Cl-),但c(M+)=c(Cl-)>c(H+)=c(OH-)。
D、质子守恒得c(H+)=c(OH-)+c(MOH)。
20.【答案】(1)-3526 kJ·mol
(2)酸性:,是推电子基团,使中的极性降低,电离出的能力减弱;;;铁电极表面出现更多的与Fe之间竞争放电生成;放电生成的将Fe氧化形成氧化物覆盖在电极表面(铁放电时生成氧化物覆盖在电极表面),阻碍的生成
【解析】【解答】(1)已知:① kJ·mol;② kJ·mol;③ kJ·mol;由盖斯定律可知,③+2×②-2×①得 =-3526 kJ·mol;
(2)①由图可知,当和浓度相等时,10
③阳极使用的是易被氧化的活性铁电极,Fe失去电子生成,根据得失电子守恒和电荷守恒配平电极方程式为:;电流密度大于4 mA·cm时,所得反应后溶液中的浓度上升幅度变小的原因是:铁电极表面出现更多的与Fe之间竞争放电生成;放电生成的将Fe氧化形成氧化物覆盖在电极表面(铁放电时生成氧化物覆盖在电极表面),阻碍的生成。
【分析】(1)根据盖斯定律计算;
(2)①依据图中曲线和ksp计算分析;
②根据反应物和生成物的化学式,利用原子守恒、得失电子守恒、电荷守恒分析;
③电解时,阳极与直流电源的正极相连的电极,发生氧化反应;阴极与直流电源的负极相连的电极,发生还原反应。
21.【答案】(1)红
(2)变红色
(3)钝化
【解析】【解答】(1)Na2CO3溶液中CO32-水解,使得溶液显碱性,滴加酚酞后,溶液显红色;
(2)若溶液中的Fe2+被氧化成Fe3+,则滴加KSCN溶液后,溶液显红色;
(3)常温下,浓硫酸能使铝钝化,故常温下,可用铝制容器盛装浓硫酸;
【分析】(1)Na2CO3溶液显碱性;
(2)根据Fe3+的检验分析;
(3)常温下,浓硫酸能是铝钝化;
22.【答案】(1)HCl;Ca3(PO4)2+4H++3SO 2H2PO +3CaSO4
(2)促进KH2PO4析出;蒸馏
(3)C;
(4)CH3OH-6e-+8OH-=CO +6H2O
(5)90.7%
【解析】【解答】(1)根据分析可知:KCl和浓硫酸加热反应生成HCl气体;“转化”步骤的离子方程式为:Ca3(PO4)2+4H++3SO42-=2H2PO4-+3CaSO4,故答案为HCl;Ca3(PO4)2+4H++3SO42-=2H2PO4-+3CaSO4;(2)滤液①是KH2PO4和K2SO4溶液,加入甲醇的作用是促进KH2PO4析出;滤液②是甲醇和K2SO4的混合液,分离它们采用蒸馏操作,故答案:促进KH2PO4析出;蒸馏;(3)由图可知A为阳极室,发生氧化反应,即Cl-+6OH--6e-=ClO3-+3H2O;C为阴极室,发生还原反应,K离子通过阳离子交换膜,进入C室,所以在C室可得到KH2PO4,故答案为C;Cl-+6OH--6e-=ClO3-+3H2O;(4)用碱性CH3OH燃料电池作为该装置的电源,燃料作负极,发生了氧化反,其反应的电极反应式为:CH3OH-6e-+8OH-=CO +6H2O,故答案:CH3OH-6e-+8OH-=CO +6H2O;(5)用0.5000 mol/LNaOH标准溶液滴定至终点,消耗40.00mL,消耗NaOH的物质的量为0.02mol,根据KH2PO4+NaOH=KNaHPO4+H2O,所以反应的KH2PO4为0.02mol,质量为0.02mol×136g/mol=2.72g,产品的纯度= ×100%≈90.7%,故答案为90.7%。
【分析】(1)根据框图可知KCl+H2SO4 KHSO4+HCl ,生成的KHSO4和Ca3(PO4)2反应的离子方程式为Ca3(PO4)2+4H++3SO42-=2H2PO4-+3CaSO4,过滤的滤渣为CaSO4,滤液为KH2PO4和K2SO4溶液;(2)由图可知A为阳极室,发生氧化反应,C为阴极室,发生还原反应,K+通过阳离子交换膜,进入C室,所以在C室可得到KH2PO4;(3)用碱性CH3OH燃料电池作为该装置的电源,燃料作负极,发生了氧化反;(4)根据反应KH2PO4+NaOH=KNaHPO4+H2O计算产品的纯度;
23.【答案】(1)1.0×10-5
(2)d>c>b
(3)C
(4)1;
(5)1.0×109
(6)
【解析】【解答】(1)根据图示,没有滴加盐酸时,0.1mol·L-1的氨水的pH=11,在溶液中NH3·H2O电离,电离方程式为NH3·H2ON+OH-,溶液的pH=11,则c(OH-)==mol/L=10-3mol/L,忽略溶液中水电离出来的H+,则c(N)= c(OH-)=10-3mol/L,NH3·H2O的电离程度较弱,发生电离的NH3·H2O约占所有NH3·H2O的1%,可以忽略不计,则溶液中c(NH3·H2O)= 0.1mol/L,则NH3·H2O的电离常数K===1.0×10-5;
(2)根据题意,d点两种溶液恰好完全反应,生成NH4Cl,N在溶液中能够水解,促进水的电离,b、c两点表示的溶液中c点NH3·H2O被中和的较多,剩余的NH3·H2O较少,对水的电离抑制较少,因此b、c、d三点时的溶液中,由水电离出的OH- 浓度大小顺序为d>c>b;
(3)b点到c点的过程中,NH3·H2O被中和的越来越多,但是还有剩余;
A.在水溶液中,溶液中的c(H+)·c(OH-)=Kw,温度不变,Kw不变,A不正确;
B.b点到c点的过程中,NH3·H2O被中和的越来越多,pH越来越小,c(H+)越来越大,c(OH-)越来越小,则越来越大,B不正确;
C.c(NH)·c(OH- )=c(NH3·H2O),其中为NH3·H2O的电离平衡常数表达式,温度不变,电离平衡常数不变,而b点到c点的过程中,NH3·H2O被中和的越来越多,所以c(NH)·c(OH- ) 逐渐减小,C正确;
D.为N水解的平衡常数表达式,温度不变,水解平衡常数不变,D不正确;
故答案为:C;
(4)根据题意,d点两种溶液恰好完全反应,加入盐酸的体积为VmL,而氨水溶液的体积恰好也是VmL,说明两溶液的溶质的浓度相同,盐酸的浓度也是0.1mol/L,c(H+)=0.1mol/L,pH=1;
如果忽略NH的水解,设e点加入盐酸的体积为xmL,e点溶液的pH=2,c(H+)=0.01mol/L,则有c(H+)===0.01mol/L,则可得x=;
(5)根据反应式NH3·H2O(aq)+H+(aq) NH (aq)+H2O(l),平衡常数K=====1.0×109。
(6)根据题意,d点两种溶液恰好完全反应,生成NH4Cl,即溶质为NH4Cl,是由N和Cl-构成的离子化合物,其电子式为。
【分析】(1)电力平衡常数可以结合初始值判断;
(2)水电离的氢氧根浓度即看水的电离是否收到抑制或者促进进行判断;
(3)电离平衡常数进行判断;
(4)结合完全反应的特殊点进行判断;
(5)平衡常数K可以结合一水合氨和水的离子积进行判断;
(6)氯化铵中铵根离子和氯离子形成离子键,铵根离子的内部是共价键结合。
24.【答案】(1)+247kJ/mol
(2)大于;CO2发生了其他副反应(与H2反应生成C和H2O);该反应△H>0,△S>0,高温时△G = △H - T△S<0
(3)CO2 + 4H2 = CH4 + 2H2O;MgOCH2
(4)
【解析】【解答】(1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol,②CO2(g)+H2(g)═CO(g)+H2O(g) △H=+41.0kJ/mol,③CO(g)+H2(g) ═C(s)+H2O(g)△H=-131.0kJ/mol,反应CO2(g)+CH4(g) ═2CO(g)+2H2(g)可以是①+②-③得到,根据盖斯定律计算反应的焓变△H=+247kJ/mol,故答案为:+247kJ/mol;
(2)①根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率大于;故答案为:大于;CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0,反应①△S>0,△H>0,代入判据,得到反应在高温下能自发进行,故答案为:△H>0,△S>0,高温时△G = △H - T△S<0;
(3)据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”,可以写出方程式为:CO2+4H2=CH4+2H2O;反应过程中碳元素的化合价为-2价的中间体是MgOCH2,故答案为:CO2+4H2=CH4+2H2O;MgOCH2;
(4)达到平衡后,Ksp(CaCO3)=c(Ca2+) c(CO32-),Ksp(CaSO4)=c(Ca2+) c(SO42-),溶液中 = ,故答案为: 。
【分析】(1)根据盖斯定律进行计算反应热即可;
(2)根据转化过程中的利用率判断转化率;根据自由能判据进行分析;
(3)根据元素化合价判断化学式;
(4)根据溶度积常数进行计算。
同课章节目录
- 第1章 化学反应与能量转化
- 第1节 化学反应的热效应
- 第2节 化学能转化为电能——电池
- 第3节 电能转化为化学能——电解
- 第4节 金属的腐蚀与防护
- 微项目 设计载人航天器用化学电池与氧气再生方案——化学反应中能量及物质的转化利用
- 第2章 化学反应的方向、 限度与速率
- 第1节 化学反应的方向
- 第2节 化学反应的限度
- 第3节 化学反应的速率
- 第4节 化学反应条件的优化——工业合成氨
- 微项目 探讨如何利用工业废气中的二氧化碳合成甲醇——化学反应选择与反应条件优化
- 第3章 物质在水溶液中的行为
- 第1节 水与水溶液
- 第2节 弱电解质的电离 盐类的水解
- 第3节 沉淀溶解平衡
- 第4节 离子反应
- 微项目 揭秘索尔维制碱法和侯氏制碱法——化学平衡思想的创造性应用
