1.2.1 基态原子的核外电子排布 课件(共18张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 1.2.1 基态原子的核外电子排布 课件(共18张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 924.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 19:03:50 | ||
图片预览





文档简介
(共18张PPT)
第2节 原子结构与元素周期表 课时1
1.理解能量最低原理、泡利不相容原理、洪特规则。能用以上原理或规则解释1~36号元素基态原子的核外电子排布;
2.根据基态原子的核外电子排布规律,会书写1~36号元素基态原子的核外电子排布式。
联想 · 质疑
联想 · 质疑
电子在原子核外分层排布,为什么第一层最多只能容纳 2个电子,第二层最多只能容纳 8个电子而不能容纳更多的电子?原子核外电子的排布与原子轨道有什么关系?
一、基态原子的核外电子排布
1.基态原子的核外电子排布原则
(1)能量最低原理
原子核外的电子应优先排布在能量最低的能级里,然后有里到外,依次排布在能量逐渐升高的能级里。使整个原子处于能量最低状态。
电子排布式
根据能量最低原理按轨道能级进行排序,进而在ns、np、nd等符号的右上角用数字表示出电子的数目。
H:1s1
He:1s2
↓↑
↓↓
↑↑
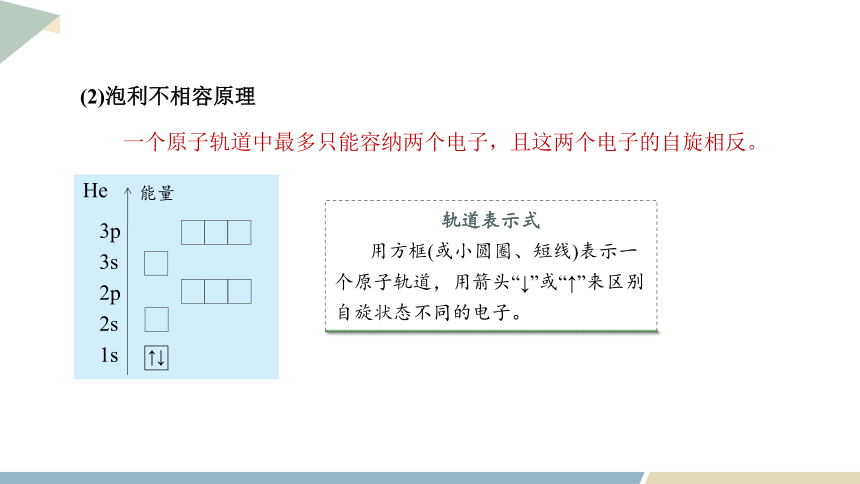
(2)泡利不相容原理
一个原子轨道中最多只能容纳两个电子,且这两个电子的自旋相反。
轨道表示式
用方框(或小圆圈、短线)表示一个原子轨道,用箭头“↓”或“↑”来区别自旋状态不同的电子。
He
3p
3s
2p
2s
1s
↑↓
能量
(3)洪特规则
对于基态原子,电子在能量相同的轨道上排布时,将尽可能分占不同的轨道并且自旋方向相同。
交流 · 研讨
交流 · 研讨
碳原子的核外电子排布式为1s22s22p2。三个p轨道的能量完全一样,那么,p轨道上的两个电子应当采取哪种方式排布呢?
↑
↓
↑
↑↓
↑
2p 2p 2p
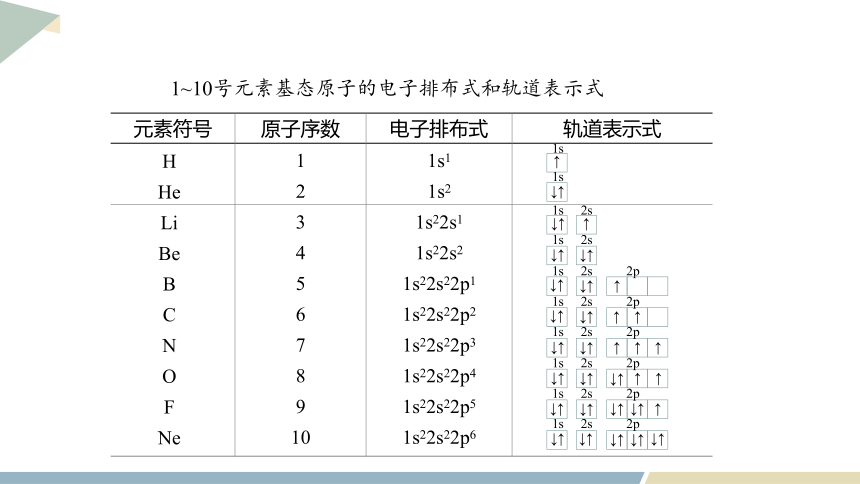
1~10号元素基态原子的电子排布式和轨道表示式
元素符号 原子序数 电子排布式 轨道表示式
H
He
Li
Be
B
C
N
O
F
Ne
1
2
3
4
5
6
7
8
9
10
1s1
1s2
1s22s1
1s22s2
1s22s22p1
1s22s22p2
1s22s22p3
1s22s22p4
1s22s22p5
1s22s22p6
↓↑
1s 2s
1s 2s
1s 2s 2p
1s
1s
1s 2s 2p
1s 2s 2p
1s 2s 2p
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↑
↑
1s 2s 2p
1s 2s 2p
↓↑
↓↑
↓↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
[思考]基态原子核外电子在原子轨道上是先排3d轨道还是先排4s轨道
能量最低原理
实验和理论都证实,为了使整个原子体系的能量最低,基态原子核外电子在原子轨道上的排布顺序按照箭头的方向依次排布在各原子轨道上:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p……
思考与交流
试依据基态原子核外电子在原子轨道上的排布顺序分析:为什么原子核外最外层电子不超过8个?次外层不超过18个电子?
由于E(nd)>E[(n+1)s],当ns和np轨道电子排满时,多余的电子不是填入nd轨道,而是首先填入(n+1)s轨道,因此最外层电子数不可能超过2+6=8。同理次外层由(n-1)s(n-1)p(n-1)d组成,所容纳的电子数不大于2+6+10=18。
2.19~36号元素基态原子的核外电子排布
活动 · 探究
活动 · 探究
按照前面介绍的原则和方法,请你尝试写出19~36号元素K~Kr的原子的核外电子排布式。
基态原子电子排布式的书写方法
第一步:按照构造原理写出电子填入能级的顺序:1s→2s→2p→3s→3p→……
第二步:根据各能级容纳的电子数填充电子。
第三步:去掉空能级,并按照电子层顺序排列即可得到电子排布式。
Cr: 1s22s22p63s23p63d54s1 Cu: 1s22s22p63s23p63d104s1
洪特规则的特例
能量相同的原子轨道处于全充满(如p6、d10、f14)、半充满(如p3、d5、f7)和全空(如p0、d0、f0)状态时,体系的能量较低,原子较稳定。
[试一试]写出47号元素Ag的原子的核外电子排布式
Ag: 1s22s22p63s23p63d104s24p64d105s1
简化电子排布式 意义 为避免电子排布式书写过于烦琐,把内部稳定的相当于稀有气体结构的那一部分用稀有元素符号外加方括号表示
实例 K:[Ar]4s1
价电子 排布式 意义 主族元素的价层电子指最外层电子,价电子排布式即外围电子排布式。
实例 Al:3s23p1
不一定。价电子是指决定元素化学性质的电子,最外层电子一定属于价电子,但有的内层电子也是价电子,如铁原子3d轨道上的6个电子也属于价电子。
思考与交流
价电子就是最外层电子吗
【练一练】
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d。( )
(2)某基态原子部分核外电子的排布式为3d64s2。( )
(3)构造原理中的电子排布能级顺序,实质是各能级能量由低到高的顺序。( )
(4)基态碳原子的电子排布式为1s22s12p3。( )
2.下列轨道表示式能表示氮原子的最低能量状态的是( )
A
3.构造原理揭示的电子排布能级顺序,实质是各能级能量的高低顺序。若以E表示某能级的能量,下列能级能量大小顺序中正确的是( )
A.E(4f)>E(4s)>E(3d) B.E(3s)>E(2s)>E(1s)
C.E(3s)>E(3p)>E(3d) D.E(5s)>E(4s)>E(4f)
B
4.下列说法错误的是( )
A.电子排布式1s22s22p63s23p64s3违反了泡利不相容原理
B.基态原子电子排布式1s22s22p63s23p63d5违反了能量最低原理
C.根据构造原理,原子核外电子填充顺序为1s、2s、2p、3s、3p、3d、4s、4p……
D.钠原子由1s22s22p63s1→1s22s22p63p1时,原子吸收能量,由基态转化成激发态
C
5.下列各原子或离子的电子排布式错误的是( )
A.Mg2+ 1s22s22p6
B.Br 1s22s22p63s23p63d104s24p5
C.O2- 1s22s22p6
D.Cr 1s22s22p63s23p63d44s2
1s22s22p63s23p63d54s1
D
6.回答下列问题:
(1)基态Co原子核外电子排布式为 ;
(2)基态Ge原子的核外电子排布式为 ;
(3)Zn2+的价电子轨道表示式为 ;
(4)Co3+核外未成对电子数为 。
4
1s22s22p63s23p63d74s2
1s22s22p63s23p63d104s24p2
↓↑
↓↑
↓↑
↓↑
↓↑
3d
能量最低原理
泡利不相容原理
洪特规则
基态原子的
核外电子排布
特例
电子排布式
轨道表示式
价电子排布式
第2节 原子结构与元素周期表 课时1
1.理解能量最低原理、泡利不相容原理、洪特规则。能用以上原理或规则解释1~36号元素基态原子的核外电子排布;
2.根据基态原子的核外电子排布规律,会书写1~36号元素基态原子的核外电子排布式。
联想 · 质疑
联想 · 质疑
电子在原子核外分层排布,为什么第一层最多只能容纳 2个电子,第二层最多只能容纳 8个电子而不能容纳更多的电子?原子核外电子的排布与原子轨道有什么关系?
一、基态原子的核外电子排布
1.基态原子的核外电子排布原则
(1)能量最低原理
原子核外的电子应优先排布在能量最低的能级里,然后有里到外,依次排布在能量逐渐升高的能级里。使整个原子处于能量最低状态。
电子排布式
根据能量最低原理按轨道能级进行排序,进而在ns、np、nd等符号的右上角用数字表示出电子的数目。
H:1s1
He:1s2
↓↑
↓↓
↑↑
(2)泡利不相容原理
一个原子轨道中最多只能容纳两个电子,且这两个电子的自旋相反。
轨道表示式
用方框(或小圆圈、短线)表示一个原子轨道,用箭头“↓”或“↑”来区别自旋状态不同的电子。
He
3p
3s
2p
2s
1s
↑↓
能量
(3)洪特规则
对于基态原子,电子在能量相同的轨道上排布时,将尽可能分占不同的轨道并且自旋方向相同。
交流 · 研讨
交流 · 研讨
碳原子的核外电子排布式为1s22s22p2。三个p轨道的能量完全一样,那么,p轨道上的两个电子应当采取哪种方式排布呢?
↑
↓
↑
↑↓
↑
2p 2p 2p
1~10号元素基态原子的电子排布式和轨道表示式
元素符号 原子序数 电子排布式 轨道表示式
H
He
Li
Be
B
C
N
O
F
Ne
1
2
3
4
5
6
7
8
9
10
1s1
1s2
1s22s1
1s22s2
1s22s22p1
1s22s22p2
1s22s22p3
1s22s22p4
1s22s22p5
1s22s22p6
↓↑
1s 2s
1s 2s
1s 2s 2p
1s
1s
1s 2s 2p
1s 2s 2p
1s 2s 2p
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↑
↑
1s 2s 2p
1s 2s 2p
↓↑
↓↑
↓↑
↑
↑
↑
↑
↑
↑
↑
↑
↑
[思考]基态原子核外电子在原子轨道上是先排3d轨道还是先排4s轨道
能量最低原理
实验和理论都证实,为了使整个原子体系的能量最低,基态原子核外电子在原子轨道上的排布顺序按照箭头的方向依次排布在各原子轨道上:1s、2s、2p、3s、3p、4s、3d、4p、5s、4d、5p……
思考与交流
试依据基态原子核外电子在原子轨道上的排布顺序分析:为什么原子核外最外层电子不超过8个?次外层不超过18个电子?
由于E(nd)>E[(n+1)s],当ns和np轨道电子排满时,多余的电子不是填入nd轨道,而是首先填入(n+1)s轨道,因此最外层电子数不可能超过2+6=8。同理次外层由(n-1)s(n-1)p(n-1)d组成,所容纳的电子数不大于2+6+10=18。
2.19~36号元素基态原子的核外电子排布
活动 · 探究
活动 · 探究
按照前面介绍的原则和方法,请你尝试写出19~36号元素K~Kr的原子的核外电子排布式。
基态原子电子排布式的书写方法
第一步:按照构造原理写出电子填入能级的顺序:1s→2s→2p→3s→3p→……
第二步:根据各能级容纳的电子数填充电子。
第三步:去掉空能级,并按照电子层顺序排列即可得到电子排布式。
Cr: 1s22s22p63s23p63d54s1 Cu: 1s22s22p63s23p63d104s1
洪特规则的特例
能量相同的原子轨道处于全充满(如p6、d10、f14)、半充满(如p3、d5、f7)和全空(如p0、d0、f0)状态时,体系的能量较低,原子较稳定。
[试一试]写出47号元素Ag的原子的核外电子排布式
Ag: 1s22s22p63s23p63d104s24p64d105s1
简化电子排布式 意义 为避免电子排布式书写过于烦琐,把内部稳定的相当于稀有气体结构的那一部分用稀有元素符号外加方括号表示
实例 K:[Ar]4s1
价电子 排布式 意义 主族元素的价层电子指最外层电子,价电子排布式即外围电子排布式。
实例 Al:3s23p1
不一定。价电子是指决定元素化学性质的电子,最外层电子一定属于价电子,但有的内层电子也是价电子,如铁原子3d轨道上的6个电子也属于价电子。
思考与交流
价电子就是最外层电子吗
【练一练】
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)原子核外电子填充3p、3d、4s能级的顺序为3p→4s→3d。( )
(2)某基态原子部分核外电子的排布式为3d64s2。( )
(3)构造原理中的电子排布能级顺序,实质是各能级能量由低到高的顺序。( )
(4)基态碳原子的电子排布式为1s22s12p3。( )
2.下列轨道表示式能表示氮原子的最低能量状态的是( )
A
3.构造原理揭示的电子排布能级顺序,实质是各能级能量的高低顺序。若以E表示某能级的能量,下列能级能量大小顺序中正确的是( )
A.E(4f)>E(4s)>E(3d) B.E(3s)>E(2s)>E(1s)
C.E(3s)>E(3p)>E(3d) D.E(5s)>E(4s)>E(4f)
B
4.下列说法错误的是( )
A.电子排布式1s22s22p63s23p64s3违反了泡利不相容原理
B.基态原子电子排布式1s22s22p63s23p63d5违反了能量最低原理
C.根据构造原理,原子核外电子填充顺序为1s、2s、2p、3s、3p、3d、4s、4p……
D.钠原子由1s22s22p63s1→1s22s22p63p1时,原子吸收能量,由基态转化成激发态
C
5.下列各原子或离子的电子排布式错误的是( )
A.Mg2+ 1s22s22p6
B.Br 1s22s22p63s23p63d104s24p5
C.O2- 1s22s22p6
D.Cr 1s22s22p63s23p63d44s2
1s22s22p63s23p63d54s1
D
6.回答下列问题:
(1)基态Co原子核外电子排布式为 ;
(2)基态Ge原子的核外电子排布式为 ;
(3)Zn2+的价电子轨道表示式为 ;
(4)Co3+核外未成对电子数为 。
4
1s22s22p63s23p63d74s2
1s22s22p63s23p63d104s24p2
↓↑
↓↑
↓↑
↓↑
↓↑
3d
能量最低原理
泡利不相容原理
洪特规则
基态原子的
核外电子排布
特例
电子排布式
轨道表示式
价电子排布式
