1.3 课时2 元素的电负性及其变化规律 课件 (共20页)2023-2024学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 1.3 课时2 元素的电负性及其变化规律 课件 (共20页)2023-2024学年高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 19:44:28 | ||
图片预览





文档简介
(共20张PPT)
第3节 原子结构与元素性质 课时2
1.了解元素电负性的含义,能应用元素的电负性说明元素的某些性质;
2.了解电负性的周期性变化规律及应用;
如何描述不同原子在形成化学键的吸引电子能力的强弱呢?
联想 · 质疑
联想 · 质疑
化学键可以看作两个原子为争夺电子而进行的“拔河”。
一、元素的电负性及其变化规律
1.电负性
(1)定义:用来描述两个不同原子在形成化学键时吸引电子能力的相对强弱。
(2)意义:元素的电负性越大,表示其原子在形成化学键时吸引电子的能力越强;反之,电负性越小,相应元素的原子在形成化学键时吸引电子的能力越弱。
“电负性是元素的原子在化合物中吸引电子能力的标度”——鲍林
资 料 在 线
电负性标度的建立
电负性标度的建立是为了量度原子对成键电子吸引能力的相对大小。基于建立模型的不同思路和方法,可以有不同的电负性标度。
鉴于电子亲和能数据的缺乏,鲍林建议用两种元素的原子形成化合物时的生成热的数值来计算电负性,并选定氟的电负性为4.0,进而计算出其它元素的电负性数值。电负性是相对值,没有单位。
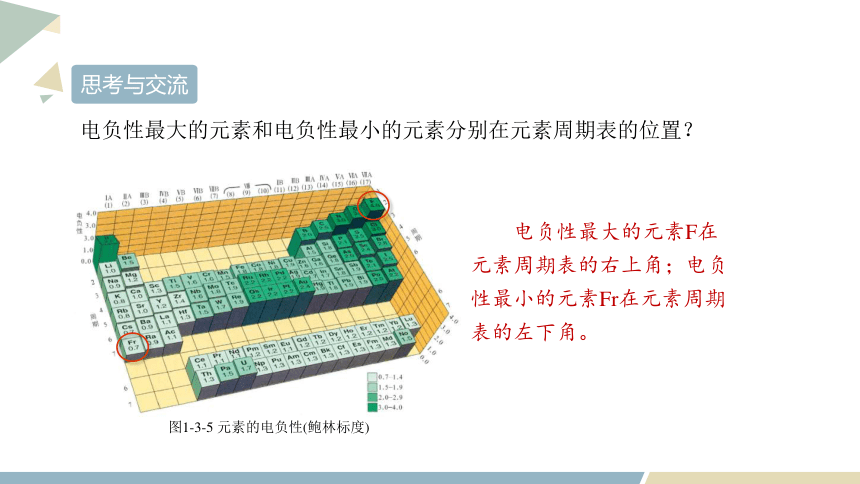
图1-3-5 元素的电负性(鲍林标度)
思考与交流
电负性最大的元素和电负性最小的元素分别在元素周期表的位置?
电负性最大的元素F在元素周期表的右上角;电负性最小的元素Fr在元素周期表的左下角。
思考与交流
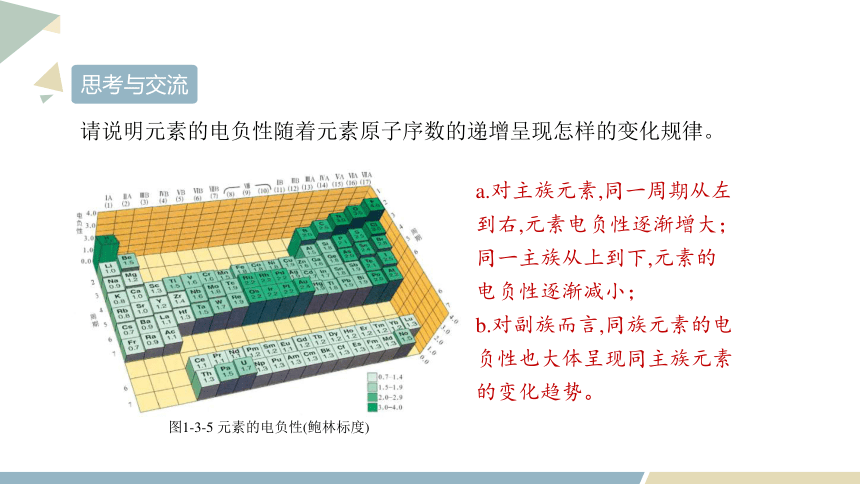
请说明元素的电负性随着元素原子序数的递增呈现怎样的变化规律。
图1-3-5 元素的电负性(鲍林标度)
a.对主族元素,同一周期从左到右,元素电负性逐渐增大;同一主族从上到下,元素的电负性逐渐减小;
b.对副族而言,同族元素的电负性也大体呈现同主族元素的变化趋势。
思考与交流
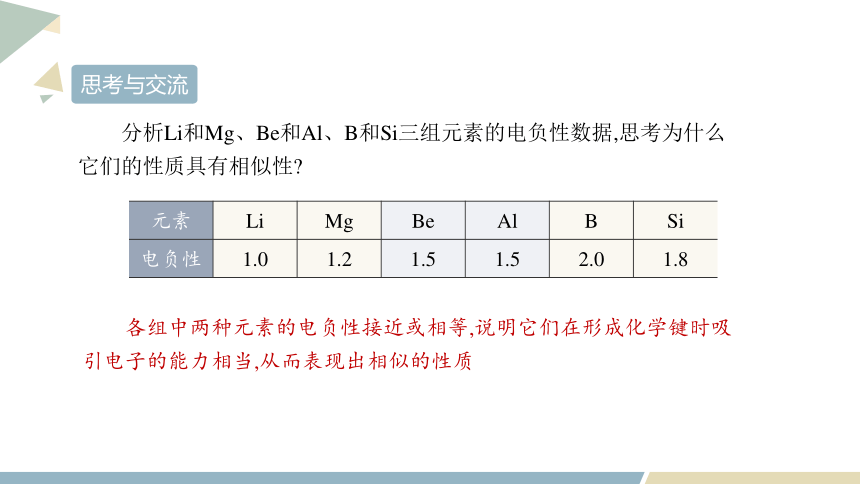
分析Li和Mg、Be和Al、B和Si三组元素的电负性数据,思考为什么它们的性质具有相似性
各组中两种元素的电负性接近或相等,说明它们在形成化学键时吸引电子的能力相当,从而表现出相似的性质
元素 Li Mg Be Al B Si
电负性 1.0 1.2 1.5 1.5 2.0 1.8
2.电负性的应用
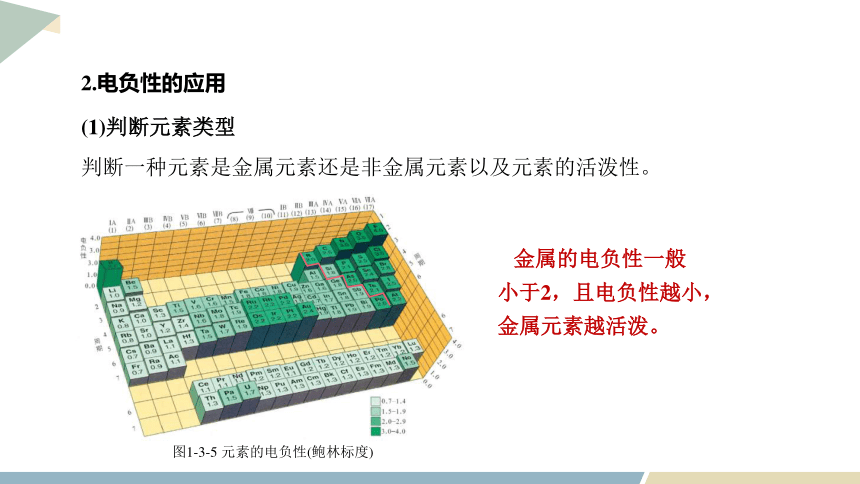
(1)判断元素类型
判断一种元素是金属元素还是非金属元素以及元素的活泼性。
图1-3-5 元素的电负性(鲍林标度)
金属的电负性一般小于2,且电负性越小,金属元素越活泼。
(1)判断元素类型
判断一种元素是金属元素还是非金属元素以及元素的活泼性。
图1-3-5 元素的电负性(鲍林标度)
非金属的电负性一般大于2,且电负性越大,非金属元素越活泼。
注:不能把电负性2作为划分金属元素和非金属元素的绝对标准。
(2)判断元素的化合价
①电负性数值小的元素在化合物中吸引电子的能力弱,元素的化合价为正值。
②电负性数值大的元素在化合物中吸收电子的能力强,元素的化合价为负值。
H2O
2.1 3.5
(3)判断化学键的类型
一般地,如果两种成键元素的电负性差值较大时易形成离子键;如果两种成键元素的电负性差值较小时易形成共价键。
交流 · 研讨
交流 · 研讨
请你利用教材中所给出的短周期元素的原子半径、第一电离能及电负性数据,通过作图寻找它们之间的关系和规律,以及它们与金属活动性顺序之间的关系。基于图象对这些关系和规律进行描述和讨论。
原子半径/10-10m
原子半径与电负性的关系
电负性
0 1 2 3 4
1.8
1.6
1.4
1.2
1.0
0.8
0.6
0.4
0.2
0
寻找数据之间的关系时,可以借鉴数学中研究函数的思路,首先确定自变量,再选取因变量,并运用函数图像表示出自变量与因变量之间的关系。
元素周期表中电负性、第一电离能和金属性、非金属性的关系
电负性、第一电离能呈增大趋势
电负性、第一电离能呈减小趋势
电
负
性
、
电
离
能
逐
渐
增
强
电
负
性
、
电
离
能
逐
渐
减
弱
非
金
属
性
逐
渐
增
强
非金属性逐渐增强
金属性逐渐增强
金
属
性
逐
渐
增
强
二、元素周期律的实质
1.实质:
原子核外电子排布
元素性质的周期性变化取决于元素 的周期性变化。
价电子排布
核外电子层数
2.具体表现:
(1)
同族元素性质
递变性
相似性
取决于
取决于
原子的 的相似性
原子的 的增加
价电子
(2)主族元素是金属还是非金属元素 原子中 的多少
取决于
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)元素的电负性越大,原子在化合物中吸引电子的能力越强。( )
(2)主族元素的电负性越大,元素原子的第一电离能一定越大。( )
(3)在同一周期中,元素电负性从左到右呈递增的趋势(稀有气体元素除外)。( )
(4)形成化合物时,电负性越小的元素越容易显正价。( )
【练一练】
2.下列各组元素按电负性大小排列正确的是( )
A.F>N>O B.O>Cl>F C.As>P>N D.Cl>S>As
D
C
3.下列说法正确的是( )
A.金属与非金属化合时,都可以形成离子键
B.金属元素的电负性一定小于非金属元素的电负性
C.电负性相差越大的元素间越容易形成离子键
D.同周期元素从左到右,第一电离能和电负性均增大
D
4.用电负性数据不能判断的是( )
A.某元素是金属元素还是非金属元素
B.氢化物HY和HX中键的极性强弱
C.化学键是离子键还是共价键
D.化合物的溶解度
5.现有四种元素的基态原子的电子排布式:①1s22s22p63s23p2 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p4。则下列有关比较中正确的是( )
A.原子半径:④>②>①
B.电负性:④>③>②>①
C.第一电离能:④>③>②>①
D.最高正化合价:④>③>②>①
B
电负性的定义
电负性的变化规律
应用
电负性
意义
电负性标度——F 4.0
判断元素类型
判断元素的化合价
判断化学键的类型
第3节 原子结构与元素性质 课时2
1.了解元素电负性的含义,能应用元素的电负性说明元素的某些性质;
2.了解电负性的周期性变化规律及应用;
如何描述不同原子在形成化学键的吸引电子能力的强弱呢?
联想 · 质疑
联想 · 质疑
化学键可以看作两个原子为争夺电子而进行的“拔河”。
一、元素的电负性及其变化规律
1.电负性
(1)定义:用来描述两个不同原子在形成化学键时吸引电子能力的相对强弱。
(2)意义:元素的电负性越大,表示其原子在形成化学键时吸引电子的能力越强;反之,电负性越小,相应元素的原子在形成化学键时吸引电子的能力越弱。
“电负性是元素的原子在化合物中吸引电子能力的标度”——鲍林
资 料 在 线
电负性标度的建立
电负性标度的建立是为了量度原子对成键电子吸引能力的相对大小。基于建立模型的不同思路和方法,可以有不同的电负性标度。
鉴于电子亲和能数据的缺乏,鲍林建议用两种元素的原子形成化合物时的生成热的数值来计算电负性,并选定氟的电负性为4.0,进而计算出其它元素的电负性数值。电负性是相对值,没有单位。
图1-3-5 元素的电负性(鲍林标度)
思考与交流
电负性最大的元素和电负性最小的元素分别在元素周期表的位置?
电负性最大的元素F在元素周期表的右上角;电负性最小的元素Fr在元素周期表的左下角。
思考与交流
请说明元素的电负性随着元素原子序数的递增呈现怎样的变化规律。
图1-3-5 元素的电负性(鲍林标度)
a.对主族元素,同一周期从左到右,元素电负性逐渐增大;同一主族从上到下,元素的电负性逐渐减小;
b.对副族而言,同族元素的电负性也大体呈现同主族元素的变化趋势。
思考与交流
分析Li和Mg、Be和Al、B和Si三组元素的电负性数据,思考为什么它们的性质具有相似性
各组中两种元素的电负性接近或相等,说明它们在形成化学键时吸引电子的能力相当,从而表现出相似的性质
元素 Li Mg Be Al B Si
电负性 1.0 1.2 1.5 1.5 2.0 1.8
2.电负性的应用
(1)判断元素类型
判断一种元素是金属元素还是非金属元素以及元素的活泼性。
图1-3-5 元素的电负性(鲍林标度)
金属的电负性一般小于2,且电负性越小,金属元素越活泼。
(1)判断元素类型
判断一种元素是金属元素还是非金属元素以及元素的活泼性。
图1-3-5 元素的电负性(鲍林标度)
非金属的电负性一般大于2,且电负性越大,非金属元素越活泼。
注:不能把电负性2作为划分金属元素和非金属元素的绝对标准。
(2)判断元素的化合价
①电负性数值小的元素在化合物中吸引电子的能力弱,元素的化合价为正值。
②电负性数值大的元素在化合物中吸收电子的能力强,元素的化合价为负值。
H2O
2.1 3.5
(3)判断化学键的类型
一般地,如果两种成键元素的电负性差值较大时易形成离子键;如果两种成键元素的电负性差值较小时易形成共价键。
交流 · 研讨
交流 · 研讨
请你利用教材中所给出的短周期元素的原子半径、第一电离能及电负性数据,通过作图寻找它们之间的关系和规律,以及它们与金属活动性顺序之间的关系。基于图象对这些关系和规律进行描述和讨论。
原子半径/10-10m
原子半径与电负性的关系
电负性
0 1 2 3 4
1.8
1.6
1.4
1.2
1.0
0.8
0.6
0.4
0.2
0
寻找数据之间的关系时,可以借鉴数学中研究函数的思路,首先确定自变量,再选取因变量,并运用函数图像表示出自变量与因变量之间的关系。
元素周期表中电负性、第一电离能和金属性、非金属性的关系
电负性、第一电离能呈增大趋势
电负性、第一电离能呈减小趋势
电
负
性
、
电
离
能
逐
渐
增
强
电
负
性
、
电
离
能
逐
渐
减
弱
非
金
属
性
逐
渐
增
强
非金属性逐渐增强
金属性逐渐增强
金
属
性
逐
渐
增
强
二、元素周期律的实质
1.实质:
原子核外电子排布
元素性质的周期性变化取决于元素 的周期性变化。
价电子排布
核外电子层数
2.具体表现:
(1)
同族元素性质
递变性
相似性
取决于
取决于
原子的 的相似性
原子的 的增加
价电子
(2)主族元素是金属还是非金属元素 原子中 的多少
取决于
1.判断下列说法是否正确,正确的打“√”,错误的打“×”。
(1)元素的电负性越大,原子在化合物中吸引电子的能力越强。( )
(2)主族元素的电负性越大,元素原子的第一电离能一定越大。( )
(3)在同一周期中,元素电负性从左到右呈递增的趋势(稀有气体元素除外)。( )
(4)形成化合物时,电负性越小的元素越容易显正价。( )
【练一练】
2.下列各组元素按电负性大小排列正确的是( )
A.F>N>O B.O>Cl>F C.As>P>N D.Cl>S>As
D
C
3.下列说法正确的是( )
A.金属与非金属化合时,都可以形成离子键
B.金属元素的电负性一定小于非金属元素的电负性
C.电负性相差越大的元素间越容易形成离子键
D.同周期元素从左到右,第一电离能和电负性均增大
D
4.用电负性数据不能判断的是( )
A.某元素是金属元素还是非金属元素
B.氢化物HY和HX中键的极性强弱
C.化学键是离子键还是共价键
D.化合物的溶解度
5.现有四种元素的基态原子的电子排布式:①1s22s22p63s23p2 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p4。则下列有关比较中正确的是( )
A.原子半径:④>②>①
B.电负性:④>③>②>①
C.第一电离能:④>③>②>①
D.最高正化合价:④>③>②>①
B
电负性的定义
电负性的变化规律
应用
电负性
意义
电负性标度——F 4.0
判断元素类型
判断元素的化合价
判断化学键的类型
