2.1 课时1 共价键的形成、特征及类型 课件 (共20页)2023-2024学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 2.1 课时1 共价键的形成、特征及类型 课件 (共20页)2023-2024学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 19:47:20 | ||
图片预览







文档简介
(共20张PPT)
防晒霜中所含的有效成分的分子中含有π键,这些分子中的π电子可在吸收紫外线后被激发,从而阻挡部分紫外线对皮肤的伤害。
防晒霜为何能防晒呢?
π键是什么样的化学键,
它又是怎么形成的呢?
第1节 共价键模型 课时1
1.认识共价键的形成、本质和特征;
2.了解共价键的主要类型σ键和π键,会判断共价键的极性。
知识回顾
知识回顾
共价键是原子间通过共用电子对所形成的化学键。
请用电子式表示H2、HCl、Cl2分子的形成过程?
H2:
HCl:
H + Cl →H Cl
×
·
·
·
·
·
·
·
·
·
·
·
·
·
·
×
·
·
·
·
H + H → H H
如何用原子轨道的概念理解共价键的形成?
Cl2:
Cl + Cl → Cl Cl
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
一、共价键的形成与特征
1.共价键的形成
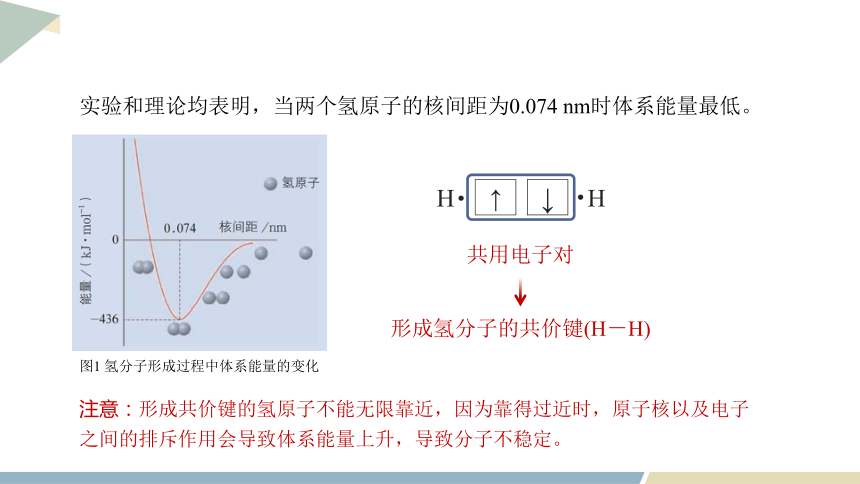
以氢分子的形成为例(用电子云表示形成过程)
H
H
1s1
1s1
体系的能量等于两个氢原子
的能量之和(能量最高)
两个s轨道相互重叠
电子在核间出现概率增大
电子同时受到两个原子核的吸引,体系的能量逐渐下降
图1 氢分子形成过程中体系能量的变化
实验和理论均表明,当两个氢原子的核间距为0.074 nm时体系能量最低。
↑
↓
H
H
形成氢分子的共价键(H-H)
共用电子对
注意:形成共价键的氢原子不能无限靠近,因为靠得过近时,原子核以及电子之间的排斥作用会导致体系能量上升,导致分子不稳定。
(1)共价键的本质
原子之间通过共用电子对形成的相互作用。
不是。有些含离子键的化合物是由非金属元素形成的,如铵盐;少数金属与非金属原子间形成的化学键也可能是共价键,如AlCl3中的化学键是共价键。
[思考]非金属元素只能形成共价键吗 只有非金属原子之间才能形成共价键吗
电负性相同或差值小的非金属元素原子
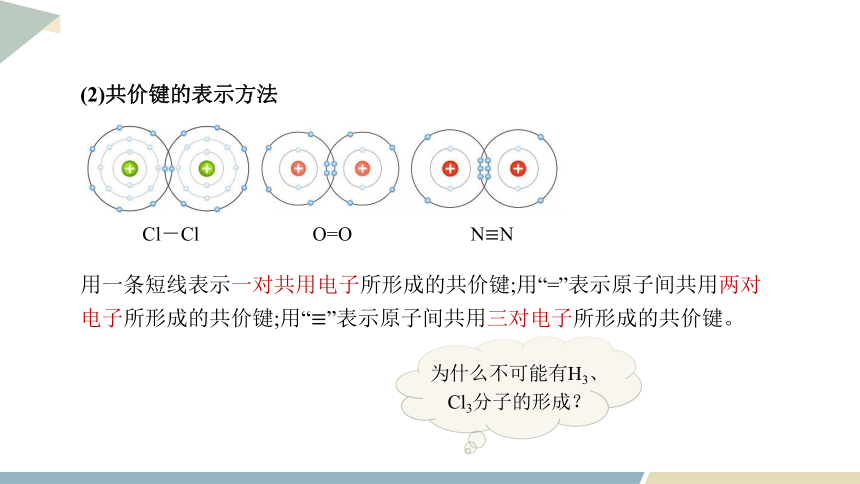
为什么不可能有H3、Cl3分子的形成?
(2)共价键的表示方法
用一条短线表示一对共用电子所形成的共价键;用“=”表示原子间共用两对电子所形成的共价键;用“≡”表示原子间共用三对电子所形成的共价键。
Cl-Cl O=O N≡N
2.共价键的特征
(1)饱和性
每个原子所能形成共价键的总数或以共价键连接的原子数目是一定的。
O=O H-O-H O=C=O
饱和性决定了各种原子形成分子时相互结合的数量关系
(2)方向性
在形成共价键时,原子轨道重叠得越多,电子在核间出现的概率越大,所形成的共价键就越牢固。因此,共价键将尽可能沿着电子出现概率最大的方向形成,这就是共价键的方向性。
分子的空间结构与共价键的方向性密切相关。
交流 · 研讨
交流 · 研讨
通过“人工固氮”将空气中的氮气转化为含氮化合物用于生产化肥或其他化工产品是人类突破的重要课题。解决这个课题的难点在于氮分子中的共价三键使构成氮分子的两个氮原子紧紧地结合在一起,由此氮气的性质非常稳定。请从轨道重叠的角度解释氮分子中的共价三键是如何形成的。
N
↓↑
↓↑
↑
↑
↑
1s 2s 2p
二、共价键的类型
1.σ键与π键(按原子轨道重叠方式分类)
(1)σ键
σ键
s-s σ键
s-p σ键
p-p σ键
成键时,原子轨道以“头碰头”方式重叠形成的共价键。
轴对称
HCl
H2
Cl2
(2)π键
镜面对称
π 键( p - p π 键 )
成键时,原子轨道以“肩并肩”方式重叠形成的共价键
氮分子中
σ键和π键
形成示意图
思考与交流
Ⅰ.哪种成键方式电子云重叠程度大?
头碰头
Ⅱ.σ键和π键哪个更牢固?
σ键
Ⅲ.所有σ键都有方向性吗?
s-s σ键没有方向性
Ⅳ.如何判断共价键是 σ键,还是π 键?
一般规律:共价单键是σ键;共价双键中有一个σ键,另一个是π键;
共价三键由一个σ键和两个π键组成。
2.极性键和非极性键(按共用电子对是否偏移分类)
(1)非极性键
构成分子的是同种元素的两个原子,它们吸引电子的能力相同,所以共用的电子不偏向其中任何一个原子,参与成键的原子都不显电性,这种共价键叫作非极性共价键,简称非极性键。
(2)极性键
原子的电负性差值越大,形成的共价键极性越强
构成分子的两个原子是不同元素的原子时,由于两个原子吸引电子的能力不同,共用的电子必然偏向吸引电子能力大的原子一方,这个原子因附近电子出现的概率较大而带部分负电荷,而另一原子则带部分正电荷,这种共价键叫作极性共价键,简称极性键。
成键原子显电性
【练一练】
1.有下列十种物质:
①CH4 ②C2H5OH ③N2 ④HCl ⑤CO2
⑥CH3CH3 ⑦C2H4 ⑧C2H2 ⑨H2O2 ⑩HCHO
请按要求回答下列问题(填编号):
(1)只有σ键的是 ,既有σ键又有π键的是 。
(2)只含有极性键的化合物是 ,既含有极性键,又含有非极性键的化合物是 。
(3)含有双键的是 ,含有三键的是 。
①②④⑥⑨
③⑤⑦⑧⑩
①④⑤⑩
②⑥⑦⑧⑨
⑤⑦⑩
③⑧
2.下列说法中正确的是( )
A.若把H2S分子写成H3S分子,违背了共价键的饱和性
B.共价键的饱和性与原子轨道的重叠程度有关
C.所有共价键都有方向性
D.两个原子轨道发生重叠后,电子仅存在于两核之间
A
3.共价键①H—H键 ②H—F键 ③H—O键 ④N—H键 ⑤P—H键中,键的极性由弱到强的顺序正确的是( )
A.①②③④⑤ B.⑤④③②①
C.①⑤④③② D.②③④⑤①
C
4.下列有关化学键类型的判断不正确的是( )
A.s-s σ键与s-p σ键的对称性不同
B.分子中含有共价键,则至少含有一个σ键
C.已知乙炔的结构式为H—C≡C—H,则乙炔分子中存在2个σ键(C—H)和3个π键(C≡C)
D.乙烷分子中只存在σ键,即6个C—H键和1个C—C键都为σ键,不存在π键
C
共价键
本质
特征
方向性
饱和性
类型
σ键
π键
共价单键
共价双键
共价三键
极性键
非极性键
电子云轴对称
电子云镜面对称
防晒霜中所含的有效成分的分子中含有π键,这些分子中的π电子可在吸收紫外线后被激发,从而阻挡部分紫外线对皮肤的伤害。
防晒霜为何能防晒呢?
π键是什么样的化学键,
它又是怎么形成的呢?
第1节 共价键模型 课时1
1.认识共价键的形成、本质和特征;
2.了解共价键的主要类型σ键和π键,会判断共价键的极性。
知识回顾
知识回顾
共价键是原子间通过共用电子对所形成的化学键。
请用电子式表示H2、HCl、Cl2分子的形成过程?
H2:
HCl:
H + Cl →H Cl
×
·
·
·
·
·
·
·
·
·
·
·
·
·
·
×
·
·
·
·
H + H → H H
如何用原子轨道的概念理解共价键的形成?
Cl2:
Cl + Cl → Cl Cl
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
·
一、共价键的形成与特征
1.共价键的形成
以氢分子的形成为例(用电子云表示形成过程)
H
H
1s1
1s1
体系的能量等于两个氢原子
的能量之和(能量最高)
两个s轨道相互重叠
电子在核间出现概率增大
电子同时受到两个原子核的吸引,体系的能量逐渐下降
图1 氢分子形成过程中体系能量的变化
实验和理论均表明,当两个氢原子的核间距为0.074 nm时体系能量最低。
↑
↓
H
H
形成氢分子的共价键(H-H)
共用电子对
注意:形成共价键的氢原子不能无限靠近,因为靠得过近时,原子核以及电子之间的排斥作用会导致体系能量上升,导致分子不稳定。
(1)共价键的本质
原子之间通过共用电子对形成的相互作用。
不是。有些含离子键的化合物是由非金属元素形成的,如铵盐;少数金属与非金属原子间形成的化学键也可能是共价键,如AlCl3中的化学键是共价键。
[思考]非金属元素只能形成共价键吗 只有非金属原子之间才能形成共价键吗
电负性相同或差值小的非金属元素原子
为什么不可能有H3、Cl3分子的形成?
(2)共价键的表示方法
用一条短线表示一对共用电子所形成的共价键;用“=”表示原子间共用两对电子所形成的共价键;用“≡”表示原子间共用三对电子所形成的共价键。
Cl-Cl O=O N≡N
2.共价键的特征
(1)饱和性
每个原子所能形成共价键的总数或以共价键连接的原子数目是一定的。
O=O H-O-H O=C=O
饱和性决定了各种原子形成分子时相互结合的数量关系
(2)方向性
在形成共价键时,原子轨道重叠得越多,电子在核间出现的概率越大,所形成的共价键就越牢固。因此,共价键将尽可能沿着电子出现概率最大的方向形成,这就是共价键的方向性。
分子的空间结构与共价键的方向性密切相关。
交流 · 研讨
交流 · 研讨
通过“人工固氮”将空气中的氮气转化为含氮化合物用于生产化肥或其他化工产品是人类突破的重要课题。解决这个课题的难点在于氮分子中的共价三键使构成氮分子的两个氮原子紧紧地结合在一起,由此氮气的性质非常稳定。请从轨道重叠的角度解释氮分子中的共价三键是如何形成的。
N
↓↑
↓↑
↑
↑
↑
1s 2s 2p
二、共价键的类型
1.σ键与π键(按原子轨道重叠方式分类)
(1)σ键
σ键
s-s σ键
s-p σ键
p-p σ键
成键时,原子轨道以“头碰头”方式重叠形成的共价键。
轴对称
HCl
H2
Cl2
(2)π键
镜面对称
π 键( p - p π 键 )
成键时,原子轨道以“肩并肩”方式重叠形成的共价键
氮分子中
σ键和π键
形成示意图
思考与交流
Ⅰ.哪种成键方式电子云重叠程度大?
头碰头
Ⅱ.σ键和π键哪个更牢固?
σ键
Ⅲ.所有σ键都有方向性吗?
s-s σ键没有方向性
Ⅳ.如何判断共价键是 σ键,还是π 键?
一般规律:共价单键是σ键;共价双键中有一个σ键,另一个是π键;
共价三键由一个σ键和两个π键组成。
2.极性键和非极性键(按共用电子对是否偏移分类)
(1)非极性键
构成分子的是同种元素的两个原子,它们吸引电子的能力相同,所以共用的电子不偏向其中任何一个原子,参与成键的原子都不显电性,这种共价键叫作非极性共价键,简称非极性键。
(2)极性键
原子的电负性差值越大,形成的共价键极性越强
构成分子的两个原子是不同元素的原子时,由于两个原子吸引电子的能力不同,共用的电子必然偏向吸引电子能力大的原子一方,这个原子因附近电子出现的概率较大而带部分负电荷,而另一原子则带部分正电荷,这种共价键叫作极性共价键,简称极性键。
成键原子显电性
【练一练】
1.有下列十种物质:
①CH4 ②C2H5OH ③N2 ④HCl ⑤CO2
⑥CH3CH3 ⑦C2H4 ⑧C2H2 ⑨H2O2 ⑩HCHO
请按要求回答下列问题(填编号):
(1)只有σ键的是 ,既有σ键又有π键的是 。
(2)只含有极性键的化合物是 ,既含有极性键,又含有非极性键的化合物是 。
(3)含有双键的是 ,含有三键的是 。
①②④⑥⑨
③⑤⑦⑧⑩
①④⑤⑩
②⑥⑦⑧⑨
⑤⑦⑩
③⑧
2.下列说法中正确的是( )
A.若把H2S分子写成H3S分子,违背了共价键的饱和性
B.共价键的饱和性与原子轨道的重叠程度有关
C.所有共价键都有方向性
D.两个原子轨道发生重叠后,电子仅存在于两核之间
A
3.共价键①H—H键 ②H—F键 ③H—O键 ④N—H键 ⑤P—H键中,键的极性由弱到强的顺序正确的是( )
A.①②③④⑤ B.⑤④③②①
C.①⑤④③② D.②③④⑤①
C
4.下列有关化学键类型的判断不正确的是( )
A.s-s σ键与s-p σ键的对称性不同
B.分子中含有共价键,则至少含有一个σ键
C.已知乙炔的结构式为H—C≡C—H,则乙炔分子中存在2个σ键(C—H)和3个π键(C≡C)
D.乙烷分子中只存在σ键,即6个C—H键和1个C—C键都为σ键,不存在π键
C
共价键
本质
特征
方向性
饱和性
类型
σ键
π键
共价单键
共价双键
共价三键
极性键
非极性键
电子云轴对称
电子云镜面对称
