2.3.2 配位键 课件 (共18张PPT)2023-2024学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 2.3.2 配位键 课件 (共18张PPT)2023-2024学年高二化学鲁科版(2019)选择性必修2 |

|
|
| 格式 | pptx | ||
| 文件大小 | 49.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 20:07:21 | ||
图片预览



文档简介
(共18张PPT)
第3节 离子键、配位键与金属键 课时2
1.知道简单配合物形成的实质;
2.能够通过实验探究配合物的制备,并了解配合物的应用。
交流 · 研讨
交流 · 研讨
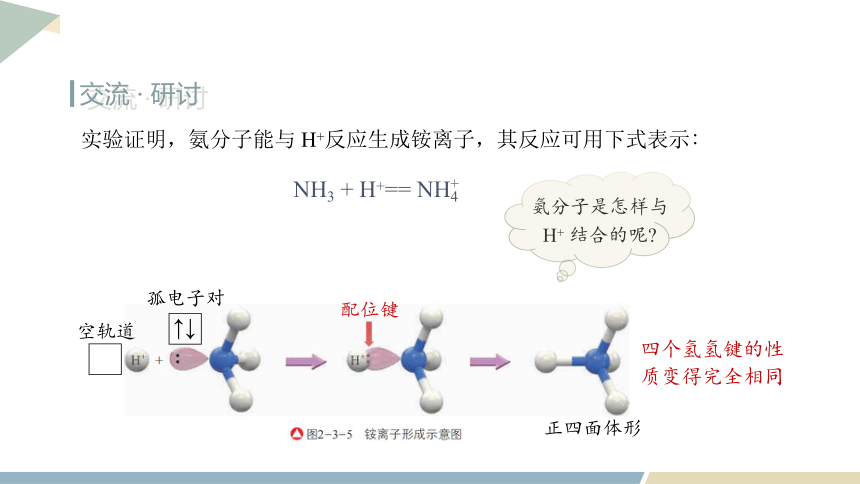
实验证明,氨分子能与 H+反应生成铵离子,其反应可用下式表示∶
NH3 + H+== NH4
+
氨分子是怎样与 H+ 结合的呢
配位键
↑↓
孤电子对
空轨道
四个氢氢键的性质变得完全相同
正四面体形
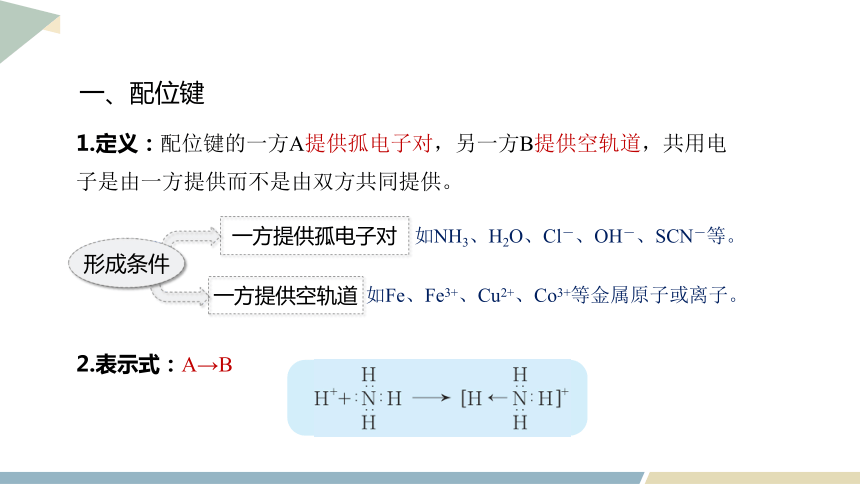
一、配位键
1.定义:配位键的一方A提供孤电子对,另一方B提供空轨道,共用电子是由一方提供而不是由双方共同提供。
形成条件
一方提供孤电子对
一方提供空轨道
如NH3、H2O、Cl-、OH-、SCN-等。
如Fe、Fe3+、Cu2+、Co3+等金属原子或离子。
2.表示式:A→B
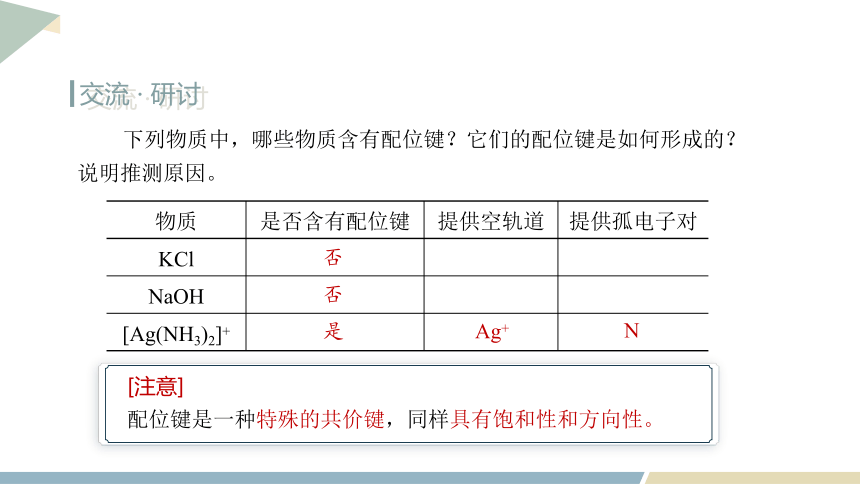
物质 是否含有配位键 提供空轨道 提供孤电子对
KCl
NaOH
[Ag(NH3)2]+
交流 · 研讨
交流 · 研讨
下列物质中,哪些物质含有配位键?它们的配位键是如何形成的?说明推测原因。
[注意]
配位键是一种特殊的共价键,同样具有饱和性和方向性。
否
是
否
Ag+
N
3.配位化合物(配合物)
(1)定义:一般来说,组成中含有配位键的化合物。
(2)组成:
以[Cu(NH3)4]SO4为例:
[Cu(N H 3)4 ] S O 4
内界(配离子)
配合物
外界
配位体
配位数
配位原子
中心原子
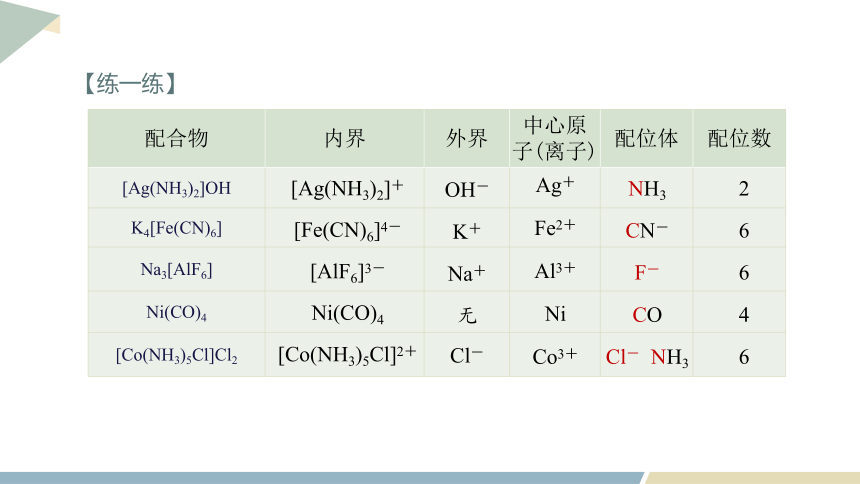
配合物 内界 外界 中心原子(离子) 配位体 配位数
[Ag(NH3)2]OH
K4[Fe(CN)6]
Na3[AlF6]
Ni(CO)4
[Co(NH3)5Cl]Cl2
[Ag(NH3)2]+
[Fe(CN)6]4-
[AlF6]3-
Ni(CO)4
[Co(NH3)5Cl]2+
OH-
K+
Na+
无
Cl-
Ag+
Fe2+
Al3+
Ni
Co3+
NH3
2
CN-
6
6
F-
CO
4
Cl- NH3
6
【练一练】
4.配合物的制备与应用
(1)探究氯化铜固体在溶解并稀释过程中所发生的变化
视频
【实验现象】
棕黄色
→ 蓝色
→ 黄绿色
[CuCl4]2-
CuCl2
[Cu(H2O)4]2+
[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O
外界条件的变化影响配离子的存在形式。Cl-和H2O相互竞争引起平衡移动,从而使溶液颜色发生变化。
(2)分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
视频
【实验现象】
①往氯化铁中加入盐酸,其溶液颜色比往氯化铁中加蒸馏水的颜色较浅;
②往氯化铁中加入硝酸,溶液颜色为无色。
Fe3+在溶液中显黄色是因为Fe3+水解并与OH-配位,生成了[Fe(H2O)6OH]2+。
而在酸化抑制水解的情况下,生成无色的[Fe(H2O)6]3+。氯化铁溶液中形成黄色配离子[FeCl4]-。
(3)制备[Ag(NH3)2]+并用于与葡萄糖反应得到银镜
视频
【实验现象】
产生白色沉淀后继续滴加氨水至白色沉淀消失。
加入适量葡萄糖溶液后水浴加热,有银镜生成。
AgOH+2NH3·H2O= [Ag(NH3)2]++OH-+2H2O
[Ag(NH3)2]+被还原成银单质
Ag++NH3·H2O=AgOH↓+NH4
(无色溶液)
(白色沉淀)
+
(4)对比Cu2+与氨水和OH-反应的差异
视频
【实验现象】
与OH-相比,氨水与Cu2+反应的溶液蓝色更深。
③Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
④Cu(OH)2 + 4NH3·H2O = [Cu(NH3)4]2++2OH-+4H2O
①Cu2++2OH-=Cu(OH)2↓
②Cu(OH)2+2OH-== [Cu(OH)4]2-。
含有离子键、一般共价键、配位键。
配合物的配体不同,配合物的颜色深浅不同。
Cu2+ 和 H2O
[Cu(H2O)4]2+
(四水合铜离子)
Cu2+ 和 NH3
[Cu(NH3)4]2+
(四氨合铜离子)
[Cu(NH3)4]2+
思考与交流
配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些
归纳
配合物的应用
物质检验
利用金属离子和与其配位的物质的性质不同,进行溶解、沉淀或萃取等操作来达到分离提纯、分析检测等目的。
物质制备
参与生命活动
用于尖端技术、医药科学、催化反应和材料化学等领域
生命体中,许多酶与金属离子的配合物有关
用于科学研究和生产实践
Fe3+的检验:
制备银氨溶液用于制镜工业
Fe3++nSCN- = [Fe(SCN)n]3-n
化 学 与 生 命
血红蛋白中的配位键
载氧前,血红蛋白中Fe2+与琳环中的四个氨原子和蛋白质上咪唑环的氨原子均通过配位键相连。
一氧化碳分子的结合能力比氧气分子与Fe2+的结合能力强得多,因而会导致血红蛋白与一氧化碳结合失去载氧能力。当一氧化碳的浓度过高,会导致人体因缺氧而中毒。
【练一练】
1.下列化合物属于配合物的是( )
A.Cu2(OH)2SO4 B.CaCl2
C.[Zn(NH3)4]SO4 D.KAl(SO4)2
2.下列关于配位键的说法中不正确的是( )
A.配位键是一种电性作用
B.配位键实质是一种共价键
C.形成配位键的电子对由成键原子双方提供
D.配位键具有饱和性和方向性
C
C
3.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法正确的是( )
A.题给配合物中中心原子的电荷数和配位数均为6
B.该配合物可能是平面正方形结构
C.Cl-和NH3分子均与Pt4+配位
D.配合物中Cl-与Pt4+配位,而与NH3分子不配位
C
4.回答下列问题:
(1)配合物[Ag(NH3)2]OH的中心离子是 ,配位原子是 (填原子符号),配位数是 ,其电离方程式是
(2)向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,观察到的现象是 。
(3)解释(2)加入氨水后,现象发生变化的原因。
Ag+
N
2
[Ag(NH3)2]OH==[Ag(NH3)2]++OH-
产生白色沉淀,加入氨水后,白色沉淀逐渐溶解
AgCl存在微弱的溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq),向其中滴加氨水,Ag+与NH3能发生如下反应:Ag++2NH3== [Ag(NH3)2]+,会使沉淀溶解平衡向右移动,最终因生成[Ag(NH3)2]Cl而溶解。
配位键
形成
配合物
配备与应用
成键原子一方提供孤电子对,
另一方具有接受孤电子对的空轨道
组成中含有配位键的物质
第3节 离子键、配位键与金属键 课时2
1.知道简单配合物形成的实质;
2.能够通过实验探究配合物的制备,并了解配合物的应用。
交流 · 研讨
交流 · 研讨
实验证明,氨分子能与 H+反应生成铵离子,其反应可用下式表示∶
NH3 + H+== NH4
+
氨分子是怎样与 H+ 结合的呢
配位键
↑↓
孤电子对
空轨道
四个氢氢键的性质变得完全相同
正四面体形
一、配位键
1.定义:配位键的一方A提供孤电子对,另一方B提供空轨道,共用电子是由一方提供而不是由双方共同提供。
形成条件
一方提供孤电子对
一方提供空轨道
如NH3、H2O、Cl-、OH-、SCN-等。
如Fe、Fe3+、Cu2+、Co3+等金属原子或离子。
2.表示式:A→B
物质 是否含有配位键 提供空轨道 提供孤电子对
KCl
NaOH
[Ag(NH3)2]+
交流 · 研讨
交流 · 研讨
下列物质中,哪些物质含有配位键?它们的配位键是如何形成的?说明推测原因。
[注意]
配位键是一种特殊的共价键,同样具有饱和性和方向性。
否
是
否
Ag+
N
3.配位化合物(配合物)
(1)定义:一般来说,组成中含有配位键的化合物。
(2)组成:
以[Cu(NH3)4]SO4为例:
[Cu(N H 3)4 ] S O 4
内界(配离子)
配合物
外界
配位体
配位数
配位原子
中心原子
配合物 内界 外界 中心原子(离子) 配位体 配位数
[Ag(NH3)2]OH
K4[Fe(CN)6]
Na3[AlF6]
Ni(CO)4
[Co(NH3)5Cl]Cl2
[Ag(NH3)2]+
[Fe(CN)6]4-
[AlF6]3-
Ni(CO)4
[Co(NH3)5Cl]2+
OH-
K+
Na+
无
Cl-
Ag+
Fe2+
Al3+
Ni
Co3+
NH3
2
CN-
6
6
F-
CO
4
Cl- NH3
6
【练一练】
4.配合物的制备与应用
(1)探究氯化铜固体在溶解并稀释过程中所发生的变化
视频
【实验现象】
棕黄色
→ 蓝色
→ 黄绿色
[CuCl4]2-
CuCl2
[Cu(H2O)4]2+
[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O
外界条件的变化影响配离子的存在形式。Cl-和H2O相互竞争引起平衡移动,从而使溶液颜色发生变化。
(2)分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
视频
【实验现象】
①往氯化铁中加入盐酸,其溶液颜色比往氯化铁中加蒸馏水的颜色较浅;
②往氯化铁中加入硝酸,溶液颜色为无色。
Fe3+在溶液中显黄色是因为Fe3+水解并与OH-配位,生成了[Fe(H2O)6OH]2+。
而在酸化抑制水解的情况下,生成无色的[Fe(H2O)6]3+。氯化铁溶液中形成黄色配离子[FeCl4]-。
(3)制备[Ag(NH3)2]+并用于与葡萄糖反应得到银镜
视频
【实验现象】
产生白色沉淀后继续滴加氨水至白色沉淀消失。
加入适量葡萄糖溶液后水浴加热,有银镜生成。
AgOH+2NH3·H2O= [Ag(NH3)2]++OH-+2H2O
[Ag(NH3)2]+被还原成银单质
Ag++NH3·H2O=AgOH↓+NH4
(无色溶液)
(白色沉淀)
+
(4)对比Cu2+与氨水和OH-反应的差异
视频
【实验现象】
与OH-相比,氨水与Cu2+反应的溶液蓝色更深。
③Cu2+ + 2NH3·H2O = Cu(OH)2↓+2NH4+
④Cu(OH)2 + 4NH3·H2O = [Cu(NH3)4]2++2OH-+4H2O
①Cu2++2OH-=Cu(OH)2↓
②Cu(OH)2+2OH-== [Cu(OH)4]2-。
含有离子键、一般共价键、配位键。
配合物的配体不同,配合物的颜色深浅不同。
Cu2+ 和 H2O
[Cu(H2O)4]2+
(四水合铜离子)
Cu2+ 和 NH3
[Cu(NH3)4]2+
(四氨合铜离子)
[Cu(NH3)4]2+
思考与交流
配合物[Cu(NH3)4]SO4中含有的化学键类型有哪些
归纳
配合物的应用
物质检验
利用金属离子和与其配位的物质的性质不同,进行溶解、沉淀或萃取等操作来达到分离提纯、分析检测等目的。
物质制备
参与生命活动
用于尖端技术、医药科学、催化反应和材料化学等领域
生命体中,许多酶与金属离子的配合物有关
用于科学研究和生产实践
Fe3+的检验:
制备银氨溶液用于制镜工业
Fe3++nSCN- = [Fe(SCN)n]3-n
化 学 与 生 命
血红蛋白中的配位键
载氧前,血红蛋白中Fe2+与琳环中的四个氨原子和蛋白质上咪唑环的氨原子均通过配位键相连。
一氧化碳分子的结合能力比氧气分子与Fe2+的结合能力强得多,因而会导致血红蛋白与一氧化碳结合失去载氧能力。当一氧化碳的浓度过高,会导致人体因缺氧而中毒。
【练一练】
1.下列化合物属于配合物的是( )
A.Cu2(OH)2SO4 B.CaCl2
C.[Zn(NH3)4]SO4 D.KAl(SO4)2
2.下列关于配位键的说法中不正确的是( )
A.配位键是一种电性作用
B.配位键实质是一种共价键
C.形成配位键的电子对由成键原子双方提供
D.配位键具有饱和性和方向性
C
C
3.某物质的实验式为PtCl4·2NH3,其水溶液不导电,加入AgNO3溶液反应也不产生沉淀,以强碱处理并没有NH3放出,则关于此化合物的说法正确的是( )
A.题给配合物中中心原子的电荷数和配位数均为6
B.该配合物可能是平面正方形结构
C.Cl-和NH3分子均与Pt4+配位
D.配合物中Cl-与Pt4+配位,而与NH3分子不配位
C
4.回答下列问题:
(1)配合物[Ag(NH3)2]OH的中心离子是 ,配位原子是 (填原子符号),配位数是 ,其电离方程式是
(2)向盛有少量NaCl溶液的试管中滴入少量AgNO3溶液,再加入氨水,观察到的现象是 。
(3)解释(2)加入氨水后,现象发生变化的原因。
Ag+
N
2
[Ag(NH3)2]OH==[Ag(NH3)2]++OH-
产生白色沉淀,加入氨水后,白色沉淀逐渐溶解
AgCl存在微弱的溶解平衡:AgCl(s) Ag+(aq)+Cl-(aq),向其中滴加氨水,Ag+与NH3能发生如下反应:Ag++2NH3== [Ag(NH3)2]+,会使沉淀溶解平衡向右移动,最终因生成[Ag(NH3)2]Cl而溶解。
配位键
形成
配合物
配备与应用
成键原子一方提供孤电子对,
另一方具有接受孤电子对的空轨道
组成中含有配位键的物质
