第2章 章末复习 课件 (共48页)2023-2024学年高二化学鲁科版(2019)选择性必修2
文档属性
| 名称 | 第2章 章末复习 课件 (共48页)2023-2024学年高二化学鲁科版(2019)选择性必修2 |  | |
| 格式 | pptx | ||
| 文件大小 | 898.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 20:07:10 | ||
图片预览










文档简介
(共48张PPT)
章末复习
1.认识微粒间存在不同类型的相互作用,根据微粒的种类及微粒间的相互作用,认识物质的性质与微观结构的关系;
2.认识原子通过原子轨道重叠形成共价键,了解共价键的特征、类型及键参数;
3.能根据微粒间相互作用、分子空间结构等说明或预测物质的性质;
4.能运用相关理论和模型进行解释和预测分子的空间结构,初步认识分子的手性对其性质的影响;
5.认识离子键、共价键的本质,知道配位键的特点,了解配合物的存在与应用,知道金属键的特点与金属某些性质的关系;
6.知道范德华力和氢键是两种常见的分子间作用力,了解其重要作用。
1.共价键的类型
知识点一:共价键模型
(1)根据共用电子对是否偏移,共价键分为 。
(2)根据共用电子对数,共价键分为 。
(3)根据原子轨道的重叠方式不同,可分为 。
(4)配位键是一种特殊的共价键。它是成键元素原子一方提供 ,另一方具有 。
极性键和非极性键
单键、双键和三键
σ键和π键
孤电子对
可接受孤电子对的空轨道
(1)共价键的饱和性
(2)共价键的方向性
2.共价键的特征
①按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋状态相反的电子配对成键,这就是共价键的“饱和性”。
②共价键的饱和性决定了共价化合物的分子组成。
①共价键形成时,两个参与成键的原子轨道总是尽可能沿着电子出现概率最大的方向重叠,而且原子轨道重叠越多,电子在两核间出现概率越大,形成的共价键越牢固。电子所在的原子轨道都有一定的形状,所以要取得最大重叠,共价键必然有方向性。
②共价键的方向性决定了分子的空间结构。
(1)非金属单质分子(稀有气体除外)。如:O2、F2、H2、C60等。
(2)非金属元素形成的化合物。如:H2SO4、CO2、有机物分子等。
(3)某些金属与非金属形成的化合物。如:BeCl2、AlCl3等。
(4)部分离子化合物。如:Na2O2、NaOH、Na2SO4、NH4Cl等。
3.共价键存在范围
4.共价键强弱的判断
(1)由原子半径和共用电子对数判断:
成键原子的原子半径越小,两原子间共用电子对数越多,一般共价键越牢固。
共价键的键能越大,共价键越牢固。
共价键的键长越小,共价键越牢固。
元素的电负性越大,该元素的原子对共用电子对的吸引力越大,形成的共价键一般越稳定。
(2)由键能判断:
(4)由电负性判断:
(3)由键长判断:
知识点二:分子空间结构的理论分析
1.杂化轨道理论
价层电子
空轨道
杂化轨道
轨道总数不变,角度和形状发生变化,成键时释放能量较多,轨道重叠程度增大,生成的分子更稳定。
激发
轨道重新组合
成对电子中的一个
与激发电子邻近
能量相近、类型不同的原子轨道
2.价电子对互斥理论(VSEPR理论)
能量最低
最稳定
价电子对
互相排斥
尽可能远离
(1)中心原子上的价电子对数的计算:
①成键电子对(bp)——可由化学式确定
②中心原子上的孤电子对数=
中心原子的价电子数-其他原子的未成对电子数之和
2
中心原子的价电子对数=成键电子对数+孤电子对数=杂化轨道数
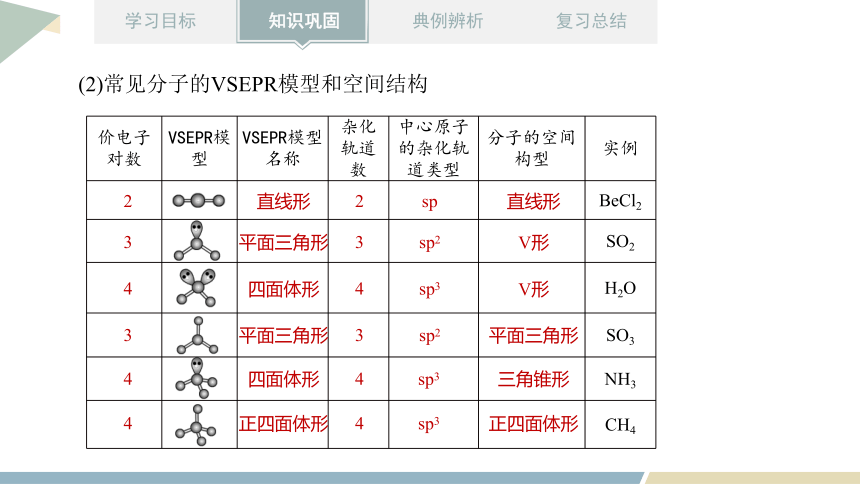
价电子对数 VSEPR模型 VSEPR模型名称 杂化轨道数 中心原子的杂化轨道类型 分子的空间构型 实例
BeCl2
SO2
H2O
SO3
NH3
CH4
直线形
平面三角形
四面体形
平面三角形
四面体形
正四面体形
sp
sp2
sp3
sp2
sp3
sp3
直线形
V形
V形
平面三角形
三角锥形
正四面体形
2
3
4
3
4
4
2
3
4
3
4
4
(2)常见分子的VSEPR模型和空间结构
当价电子对包含孤电子对且成键电子对中也有多重键时,由于它们之间的斥力不同,会对分子的空间结构产生影响。通常,多重键、成键电子对与孤电子对的斥力大小顺序可定性地表示为:
三键—三键>三键—双键>双键—双键>双键—单键>单键—单键
lp—lp lp—bp>bp—bp
(3)电子对之间的排斥与分子空间结构
3.等电子原理
(1)内容:
化学通式相同且价电子总数相等的分子或离子具有相同的空间结构和化学键类型等结构特征。
可以判断一些简单分子或原子团的空间结构。
(2)应用
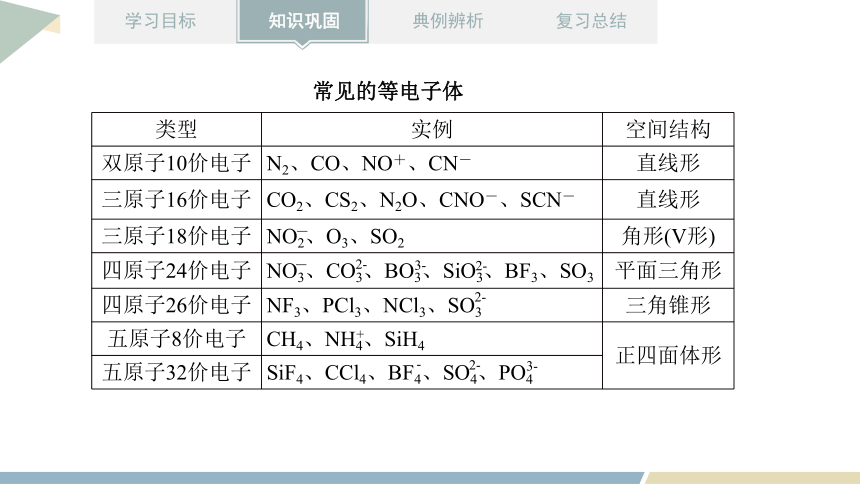
常见的等电子体
类型 实例 空间结构
双原子10价电子 N2、CO、NO+、CN- 直线形
三原子16价电子 CO2、CS2、N2O、CNO-、SCN- 直线形
三原子18价电子 NO2、O3、SO2 角形(V形)
四原子24价电子 NO3、CO3、BO3、SiO3、BF3、SO3 平面三角形
四原子26价电子 NF3、PCl3、NCl3、SO3 三角锥形
五原子8价电子 CH4、NH4、SiH4 正四面体形
五原子32价电子 SiF4、CCl4、BF4、SO4、PO4
-
-
2-
3-
2-
2-
+
-
2-
3-
知识点三:分子中的原子排布与对称性
1.对称分子
(1)定义:像这种依据对称轴的旋转或借助对称面的反映能够复原的分子称为对称分子,分子所具有的这种性质称为对称性。
(2)对称性对分子性质的影响:
极性、旋光性等
2.手性分子
(1)手性:一些分子本身和它们在镜中的像,就如同人的左手和右手,相似但不能重叠,因而称这类分子表现出手性。
(2)手性分子:具有手性的分子。
(3)手性分子性质特点
对称性比较低,不具有对称面。
存在对映异构体,具有相反的旋光性
等物质的量浓度对映异构体溶液,不表现旋光性
3.不对称碳原子(也叫手性碳原子)
对于仅通过单键连接其他原子的碳原子,所连接的四个原子或基团均不相同时(如)CHFClBr,这个碳原子称为不对称碳原子。
知识点四:分子的电荷分布与极性
1.极性分子与非极性分子
(1)定义:分子内存在正、负两极的分子,通常称为极性分子,分子内不存在正、负两极的分子,称为非极性分子。
分子 共价键的极性 分子中正电中 心和负电中心 结论 举例
同种元素的 双原子分子
不同种元素的双原子分子
多原子分子 文字
非极性键
极性键
分子中共价键的极性的向量和等于零
分子中共价键的极性的向量和不等于零
重合
不重合
重合
不重合
非极性分子
极性分子
非极性分子
极性分子
O2
CO
CH4
CH3Cl
(2)共价键极性与分子极性的关系:
(1)熔沸点:
(2)溶解性:
在相对分子质量相同的情况下,极性分子比非极性分子有更高的沸点。
"相似相溶"原理
①极性分子易溶于极性溶剂
②非极性分子易溶于非极性溶剂
2.分子的极性对性质的影响
知识点五:离子键、配位键与金属键
1.离子键
(1)离子键的形成
金属元素
电负性较小
非金属元素
电负性较大
离子键
静电作用
离子
化合物
成键原子所属元素的电负性差值越大,原子之间越容易得失电子而形成离子键。
得电子
阴离子
失电子
阳离子
(2)离子键的特征
无方向性无饱和性
在离子化合物中,每个离子周围最邻近的带异性电荷的离子数目的多少,取决于阴、阳离子的相对大小。离子半径比值的不同,使得离子周围所能容纳的带异性电荷离子的数目不同。
(3)离子极化
在电场的作用下产生的离子中的电子分布发生偏移的现象称为离子极化。
如AgF→AgCl→AgBr→AgI共价性依次增强,且AgI以共价键为主。
2.金属键
(1)定义:
金属阳离子和自由电子之间的强的相互作用。
(2)组成:
金属阳离子和自由电子。
(3)实质:
电性作用——特殊形式的共价键
(4)特征:
①无方向性和饱和性
②电子在整个三维空间运动,属于整块固态金属
价电子数越多,金属键越强。
自由电子运动时与金属离子碰撞把能量从温度高的部分传到温度低的部分,从而使整块金属达到相同的温度。
(5)金属键与金属性质
①具有金属光泽
②导电性
③导热性
在外加电场的条件下自由电子发生定向运动,因而形成电流。
固体金属中有“自由电子”,能吸收所有频率的光并很快放出。
④延展性
各原子层之间发生相对滑动后,仍可保持金属离子与自由电子间的相互作用,发生形变也不易断裂。
3.配位键
(1)形成:
(2)表示方法:常用符号A→B表示。A提供孤电子对,B提供空轨道。
形成条件
一方提供孤电子对
一方提供空轨道
如NH3、H2O、Cl-、OH-、SCN-等。
如Fe、Fe3+、Cu2+、Co3+等金属原子或离子。
(3)特征:
配位键是一种特殊的共价键,同样具有饱和性和方向性。
知识点六:配合物的制备及应用
1.配位化合物(配合物)
(1)定义:一般来说,组成中含有配位键的化合物。
(2)组成:
以[Cu(NH3)4]SO4为例:
[Cu(N H 3)4 ] S O 4
内界(配离子)
配合物
外界
配位体
配位数
配位原子
中心原子
2.配合物的制备与应用
(1)探究氯化铜固体在溶解并稀释过程中所发生的变化
将氯化铜固体溶于水并稀释。溶液中出现颜色由黄绿→蓝的变化过程
棕黄色
→ 蓝色
→ 黄绿色
[CuCl4]2-
CuCl2
[Cu(H2O)4]2+
[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O
外界条件的变化影响配离子的存在形式。Cl-和H2O相互竞争引起平衡移动,从而使溶液颜色发生变化。
(2)分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
Fe3+在溶液中显黄色是因为Fe3+水解并与OH-配位,生成了[Fe(H2O)6OH]2+。
而在酸化抑制水解的情况下,生成无色的[Fe(H2O)6]3+。氯化铁溶液中形成黄色配离子[FeCl4]-。
(3)制备[Ag(NH3)2]+并用于与葡萄糖反应得到银镜
产生白色沉淀后继续滴加氨水至白色沉淀消失。
AgOH+2NH3·H2O= [Ag(NH3)2]++OH-+2H2O
(无色溶液)
加入适量葡萄糖溶液后水浴加热,有银镜生成。
Ag++NH3·H2O=AgOH↓+NH4
(白色沉淀)
+
(4)对比Cu2+与氨水和OH-反应的差异
配合物的配体不同,配合物的颜色深浅不同。
Cu2+ 和 H2O
[Cu(H2O)4]2+
(四水合铜离子)
Cu2+ 和 NH3
[Cu(NH3)4]2+
(四氨合铜离子)
(5)配合物的应用
物质检验
利用金属离子和与其配位的物质的性质不同,进行溶解、沉淀或萃取等操作来达到分离提纯、分析检测等目的。
物质制备
参与生命活动
用于尖端技术、医药科学、催化反应和材料化学等领域
生命体中,许多酶与金属离子的配合物有关
用于科学研究和生产实践
Fe3+的检验:
制备银氨溶液用于制镜工业
Fe3++nSCN- = [Fe(SCN)n]3-n
知识点七:分子间作用力
1.范德华力
(1)定义:分子间普遍存在的一种相互作用力,它使许多物质能以一定的凝聚态(固态和液态)存在。
(2)特点:
①范德华力很弱,比化学键键能小1~2个数量级。
②范德华力的实质也是电性作用,无方向性,无饱和性
③范德华力是一种短程力,作用范围通常为0.3 0.5 nm。
主要影响物质的熔点、沸点等物理性质。
(3)范德华力与物质的性质
组成和结构相似的分子
相对分子质量增大
范德华力增大
熔点和沸点升高
2.氢键
(1)概念:
当氢原子与电负性大的原子X以共价键结合时,氢原子与另一个电负性大的原子Y之间的静电作用。
(2)表示形式:
通常用X—H…Y表示氢键,其中X—H表示氢原子和X原子以共价键相结合。
(3)实质:
静电作用
(4)特征:
具有方向性和饱和性
化学键>氢键>范德华力
(5)氢键作用力的大小:
(6)氢键的类型;
分子间氢键
分子内氢键
(7)氢键对物质性质的影响
①当形成分子间氢键时,物质的熔、沸点将升高。
②影响物质的电离、溶解等过程。
【考点一】化学键的比较
【例1】下列现象与化学键有关的是( )
A.F2、Cl2、Br2、I2的熔点依次升高
B.H2O的沸点远高于H2S的沸点
C.H2O在高温下难分解
D.干冰升华
C
化学键的比较
类型 离子键 共价键 金属键
非极性键 极性键 配位键
本质 阴、阳离子间通过静电作用形成 相邻原子间通过共用电子对与原子核间的静电作用形成 金属阳离子与自由电子间作用
成键条件 成键原子的得、失电子能力差别很大 成键原子得失电子能力相同 成键原子得、失电子能力差别较小 成键原子一方有孤电子对,另一方有可接受孤电子对的空轨道 同种金属或不同金属
化学键的比较
类型 离子键 共价键 金属键
非极性键 极性键 配位键
特征 无方向性、饱和性 有方向性、饱和性 无方向性、饱和性
存在 离子 化合物 单质,共价化合物,离子化合物 共价化合物, 离子化合物 离子 化合物 金属单质、合金
影响强弱的 因素 一般阴、阳离子电荷越多,半径越小,离子键越强 — 成键原子电负性差值越大,键的极性越强;键能越大,键长越短,共价键越牢固 — 金属阳离子半径越小,价电子越多,金属键越强
【练一练】
1.下列有关化学键的叙述,正确的是( )
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.含有极性键的分子一定是极性分子
D.含有共价键的化合物一定是共价化合物
2.光谱证实单质铝与强碱溶液反应有[Al(OH)4]-生成,则[Al(OH)4]-中不存在的是( )
A.共价键 B.非极性键
C.配位键 D.σ键
B
A
【例1】下列各物质中的中心原子不是采用sp3杂化的是( )
A.NH3 B.H2O C.CO2 D.CCl4
【考点二】杂化类型的判断
C
(1)由分子或离子的空间结构判断杂化类型。
①直线形——sp杂化;
②平面形——sp2杂化;
③四面体形——sp3杂化。
杂化类型的判断方法
(2)由电子对数判断杂化类型(包括孤电子对和成键电子对)
①2对——sp杂化;
②3对——sp2杂化;
③4对——sp3杂化。
(3)由碳原子的饱和程度判断。
①饱和碳原子——sp3杂化;
②双键上的碳原子——sp2杂化;
③三键上的碳原子——sp杂化。
杂化类型的判断方法
1.下列分子的空间结构可用sp2杂化轨道来解释的是( )
BF3 ②CH2==CH2 ③Cl2C==CCl2 ④CH≡CH ⑤NH3 ⑥CH4
A.①②③ B.①⑤⑥
C.②③④ D.③⑤⑥
【练一练】
A
2.指出下列原子的杂化轨道类型及分子或离子的空间结构。
(1)BCl3中的B采用 杂化,空间结构为 。
(2)PH3中的P采用 杂化,空间结构为 。
(3) 中的N采用 杂化,空间结构为 。
sp2 三角形
sp3 三角锥形
sp2 角形
【考点三】分子或离子的空间结构及判断方法
【例1】价电子对互斥理论可用于预测简单分子或离子的空间结构。
(1)利用价电子对互斥理论推断下列分子或离子的空间结构:
(2)利用价电子对互斥理论推断键角的大小:
①甲醛中H—C—H的键角 (填“>”“<”或“=”,下同)120°;
②SnBr2分子中Br—Sn—Br的键角 120°;
③PCl3分子中,Cl—P—Cl的键角 109°28'。
三角形 角形 直线形
三角形 三角形 直线形
<
<
<
(1)用价电子对互斥理论判断
①当中心原子无孤电子对时,分子的空间结构与互斥模型一致。
②当中心原子有孤对电子时,分子的空间结构与互斥模型不一致。
(2)用杂化轨道理论判断
(3)根据键角及分子的极性判断
(4)根据等电子原理判断
分子或离子空间结构的判断方法
1.价电子对互斥模型指的是价电子对的空间结构。根据杂化轨道理论和价电子对互斥理论,判断下列分子或者离子的中心原子杂化方式、价电子对互斥模型及空间结构均正确的是( )
选项 分子式 中心原子 杂化方式 价电子对 互斥模型 分子或离子
的空间结构
A SO2 sp 直线形 直线形
B HCHO sp2 三角形 三角锥形
C NF3 sp2 四面体形 三角形
D sp3 正四面体形 正四面体形
【练一练】
D
【考点四】判断分子极性的方法
【例1】下列各组分子中,都是由极性键构成的极性分子的一组是( )
A.CH3Cl和Cl2
B.NH3和H2O
C.H2S与CS2
D.CO2与HI
B
判断分子极性的方法
1.关于CS2、SO2、NH3三种物质的说法正确的是( )
A.CS2在水中的溶解度很小,是由于其属于极性分子
B.SO2和NH3均易溶于水,原因之一是它们都是极性分子
C.CS2为非极性分子,所以在三种物质中熔、沸点最低
D.NH3在水中溶解度很大只是由于NH3分子为极性分子
【练一练】
B
【考点五】等离子体的书写
【例1】根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称等电子体,它们也具有相似的结构特征。
(1)仅由第2周期元素组成的共价分子中,互为等电子体的是________和 ; 和 。
(2)在短周期元素组成的物质中,与 互为等电子体的分子有__________。
SO2、O3
N2 CO CO2 N2O
(1)同主族替换法
同主族元素最外层电子数相等,故可将粒子中一个或几个原子换成同主族元素的其他原子,如O3与SO2、CO2与CS2分别互为等电子体。
(2)左右移位法
①将粒子中的两个原子换成原子序数分别增加n和减少n(n=1,2等)的原子,如N2与CO、 和CNO-互为等电子体。
②将粒子中的m个原子换成原子序数增加(或减少)n的元素的原子,且粒子的总电荷数减小(或增大)m×n。
(3)叠加法
互为等电子体的微粒分别再增加一个相同的原子或同主族元素的原子,如CO和N2互为等电子体,则N2O与CO2也互为等电子体。
利用替换法写等电子体
1.等电子体的结构相似,物理性质相似。下列各组粒子中,空间结构相似的是( )
A.SO2与O3 B.CO2与NO2
C.CS2与NO2 D.PCl3与BF3
2.下列各组微粒属于等电子体的是( )
A.12CO2和14CO B.H2O和NH3
C.NO+和CN- D.NO和CO
【练一练】
A
C
微粒间相互作用
与物质性质
化学键
分子间作用力
离子键
配位键
共价键
金属键
范德华力
氢键
与氢键有关的现象
对物质性质的影响
构成微粒、实质,解释金属性质
特征
分类
键参数
杂化轨道
空间分布
定义
实质
特征
章末复习
1.认识微粒间存在不同类型的相互作用,根据微粒的种类及微粒间的相互作用,认识物质的性质与微观结构的关系;
2.认识原子通过原子轨道重叠形成共价键,了解共价键的特征、类型及键参数;
3.能根据微粒间相互作用、分子空间结构等说明或预测物质的性质;
4.能运用相关理论和模型进行解释和预测分子的空间结构,初步认识分子的手性对其性质的影响;
5.认识离子键、共价键的本质,知道配位键的特点,了解配合物的存在与应用,知道金属键的特点与金属某些性质的关系;
6.知道范德华力和氢键是两种常见的分子间作用力,了解其重要作用。
1.共价键的类型
知识点一:共价键模型
(1)根据共用电子对是否偏移,共价键分为 。
(2)根据共用电子对数,共价键分为 。
(3)根据原子轨道的重叠方式不同,可分为 。
(4)配位键是一种特殊的共价键。它是成键元素原子一方提供 ,另一方具有 。
极性键和非极性键
单键、双键和三键
σ键和π键
孤电子对
可接受孤电子对的空轨道
(1)共价键的饱和性
(2)共价键的方向性
2.共价键的特征
①按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋状态相反的电子配对成键,这就是共价键的“饱和性”。
②共价键的饱和性决定了共价化合物的分子组成。
①共价键形成时,两个参与成键的原子轨道总是尽可能沿着电子出现概率最大的方向重叠,而且原子轨道重叠越多,电子在两核间出现概率越大,形成的共价键越牢固。电子所在的原子轨道都有一定的形状,所以要取得最大重叠,共价键必然有方向性。
②共价键的方向性决定了分子的空间结构。
(1)非金属单质分子(稀有气体除外)。如:O2、F2、H2、C60等。
(2)非金属元素形成的化合物。如:H2SO4、CO2、有机物分子等。
(3)某些金属与非金属形成的化合物。如:BeCl2、AlCl3等。
(4)部分离子化合物。如:Na2O2、NaOH、Na2SO4、NH4Cl等。
3.共价键存在范围
4.共价键强弱的判断
(1)由原子半径和共用电子对数判断:
成键原子的原子半径越小,两原子间共用电子对数越多,一般共价键越牢固。
共价键的键能越大,共价键越牢固。
共价键的键长越小,共价键越牢固。
元素的电负性越大,该元素的原子对共用电子对的吸引力越大,形成的共价键一般越稳定。
(2)由键能判断:
(4)由电负性判断:
(3)由键长判断:
知识点二:分子空间结构的理论分析
1.杂化轨道理论
价层电子
空轨道
杂化轨道
轨道总数不变,角度和形状发生变化,成键时释放能量较多,轨道重叠程度增大,生成的分子更稳定。
激发
轨道重新组合
成对电子中的一个
与激发电子邻近
能量相近、类型不同的原子轨道
2.价电子对互斥理论(VSEPR理论)
能量最低
最稳定
价电子对
互相排斥
尽可能远离
(1)中心原子上的价电子对数的计算:
①成键电子对(bp)——可由化学式确定
②中心原子上的孤电子对数=
中心原子的价电子数-其他原子的未成对电子数之和
2
中心原子的价电子对数=成键电子对数+孤电子对数=杂化轨道数
价电子对数 VSEPR模型 VSEPR模型名称 杂化轨道数 中心原子的杂化轨道类型 分子的空间构型 实例
BeCl2
SO2
H2O
SO3
NH3
CH4
直线形
平面三角形
四面体形
平面三角形
四面体形
正四面体形
sp
sp2
sp3
sp2
sp3
sp3
直线形
V形
V形
平面三角形
三角锥形
正四面体形
2
3
4
3
4
4
2
3
4
3
4
4
(2)常见分子的VSEPR模型和空间结构
当价电子对包含孤电子对且成键电子对中也有多重键时,由于它们之间的斥力不同,会对分子的空间结构产生影响。通常,多重键、成键电子对与孤电子对的斥力大小顺序可定性地表示为:
三键—三键>三键—双键>双键—双键>双键—单键>单键—单键
lp—lp lp—bp>bp—bp
(3)电子对之间的排斥与分子空间结构
3.等电子原理
(1)内容:
化学通式相同且价电子总数相等的分子或离子具有相同的空间结构和化学键类型等结构特征。
可以判断一些简单分子或原子团的空间结构。
(2)应用
常见的等电子体
类型 实例 空间结构
双原子10价电子 N2、CO、NO+、CN- 直线形
三原子16价电子 CO2、CS2、N2O、CNO-、SCN- 直线形
三原子18价电子 NO2、O3、SO2 角形(V形)
四原子24价电子 NO3、CO3、BO3、SiO3、BF3、SO3 平面三角形
四原子26价电子 NF3、PCl3、NCl3、SO3 三角锥形
五原子8价电子 CH4、NH4、SiH4 正四面体形
五原子32价电子 SiF4、CCl4、BF4、SO4、PO4
-
-
2-
3-
2-
2-
+
-
2-
3-
知识点三:分子中的原子排布与对称性
1.对称分子
(1)定义:像这种依据对称轴的旋转或借助对称面的反映能够复原的分子称为对称分子,分子所具有的这种性质称为对称性。
(2)对称性对分子性质的影响:
极性、旋光性等
2.手性分子
(1)手性:一些分子本身和它们在镜中的像,就如同人的左手和右手,相似但不能重叠,因而称这类分子表现出手性。
(2)手性分子:具有手性的分子。
(3)手性分子性质特点
对称性比较低,不具有对称面。
存在对映异构体,具有相反的旋光性
等物质的量浓度对映异构体溶液,不表现旋光性
3.不对称碳原子(也叫手性碳原子)
对于仅通过单键连接其他原子的碳原子,所连接的四个原子或基团均不相同时(如)CHFClBr,这个碳原子称为不对称碳原子。
知识点四:分子的电荷分布与极性
1.极性分子与非极性分子
(1)定义:分子内存在正、负两极的分子,通常称为极性分子,分子内不存在正、负两极的分子,称为非极性分子。
分子 共价键的极性 分子中正电中 心和负电中心 结论 举例
同种元素的 双原子分子
不同种元素的双原子分子
多原子分子 文字
非极性键
极性键
分子中共价键的极性的向量和等于零
分子中共价键的极性的向量和不等于零
重合
不重合
重合
不重合
非极性分子
极性分子
非极性分子
极性分子
O2
CO
CH4
CH3Cl
(2)共价键极性与分子极性的关系:
(1)熔沸点:
(2)溶解性:
在相对分子质量相同的情况下,极性分子比非极性分子有更高的沸点。
"相似相溶"原理
①极性分子易溶于极性溶剂
②非极性分子易溶于非极性溶剂
2.分子的极性对性质的影响
知识点五:离子键、配位键与金属键
1.离子键
(1)离子键的形成
金属元素
电负性较小
非金属元素
电负性较大
离子键
静电作用
离子
化合物
成键原子所属元素的电负性差值越大,原子之间越容易得失电子而形成离子键。
得电子
阴离子
失电子
阳离子
(2)离子键的特征
无方向性无饱和性
在离子化合物中,每个离子周围最邻近的带异性电荷的离子数目的多少,取决于阴、阳离子的相对大小。离子半径比值的不同,使得离子周围所能容纳的带异性电荷离子的数目不同。
(3)离子极化
在电场的作用下产生的离子中的电子分布发生偏移的现象称为离子极化。
如AgF→AgCl→AgBr→AgI共价性依次增强,且AgI以共价键为主。
2.金属键
(1)定义:
金属阳离子和自由电子之间的强的相互作用。
(2)组成:
金属阳离子和自由电子。
(3)实质:
电性作用——特殊形式的共价键
(4)特征:
①无方向性和饱和性
②电子在整个三维空间运动,属于整块固态金属
价电子数越多,金属键越强。
自由电子运动时与金属离子碰撞把能量从温度高的部分传到温度低的部分,从而使整块金属达到相同的温度。
(5)金属键与金属性质
①具有金属光泽
②导电性
③导热性
在外加电场的条件下自由电子发生定向运动,因而形成电流。
固体金属中有“自由电子”,能吸收所有频率的光并很快放出。
④延展性
各原子层之间发生相对滑动后,仍可保持金属离子与自由电子间的相互作用,发生形变也不易断裂。
3.配位键
(1)形成:
(2)表示方法:常用符号A→B表示。A提供孤电子对,B提供空轨道。
形成条件
一方提供孤电子对
一方提供空轨道
如NH3、H2O、Cl-、OH-、SCN-等。
如Fe、Fe3+、Cu2+、Co3+等金属原子或离子。
(3)特征:
配位键是一种特殊的共价键,同样具有饱和性和方向性。
知识点六:配合物的制备及应用
1.配位化合物(配合物)
(1)定义:一般来说,组成中含有配位键的化合物。
(2)组成:
以[Cu(NH3)4]SO4为例:
[Cu(N H 3)4 ] S O 4
内界(配离子)
配合物
外界
配位体
配位数
配位原子
中心原子
2.配合物的制备与应用
(1)探究氯化铜固体在溶解并稀释过程中所发生的变化
将氯化铜固体溶于水并稀释。溶液中出现颜色由黄绿→蓝的变化过程
棕黄色
→ 蓝色
→ 黄绿色
[CuCl4]2-
CuCl2
[Cu(H2O)4]2+
[Cu(H2O)4]2++4Cl- [CuCl4]2-+4H2O
外界条件的变化影响配离子的存在形式。Cl-和H2O相互竞争引起平衡移动,从而使溶液颜色发生变化。
(2)分别以氯化铁和硝酸铁为原料,探究Fe3+溶液显色的原因
Fe3+在溶液中显黄色是因为Fe3+水解并与OH-配位,生成了[Fe(H2O)6OH]2+。
而在酸化抑制水解的情况下,生成无色的[Fe(H2O)6]3+。氯化铁溶液中形成黄色配离子[FeCl4]-。
(3)制备[Ag(NH3)2]+并用于与葡萄糖反应得到银镜
产生白色沉淀后继续滴加氨水至白色沉淀消失。
AgOH+2NH3·H2O= [Ag(NH3)2]++OH-+2H2O
(无色溶液)
加入适量葡萄糖溶液后水浴加热,有银镜生成。
Ag++NH3·H2O=AgOH↓+NH4
(白色沉淀)
+
(4)对比Cu2+与氨水和OH-反应的差异
配合物的配体不同,配合物的颜色深浅不同。
Cu2+ 和 H2O
[Cu(H2O)4]2+
(四水合铜离子)
Cu2+ 和 NH3
[Cu(NH3)4]2+
(四氨合铜离子)
(5)配合物的应用
物质检验
利用金属离子和与其配位的物质的性质不同,进行溶解、沉淀或萃取等操作来达到分离提纯、分析检测等目的。
物质制备
参与生命活动
用于尖端技术、医药科学、催化反应和材料化学等领域
生命体中,许多酶与金属离子的配合物有关
用于科学研究和生产实践
Fe3+的检验:
制备银氨溶液用于制镜工业
Fe3++nSCN- = [Fe(SCN)n]3-n
知识点七:分子间作用力
1.范德华力
(1)定义:分子间普遍存在的一种相互作用力,它使许多物质能以一定的凝聚态(固态和液态)存在。
(2)特点:
①范德华力很弱,比化学键键能小1~2个数量级。
②范德华力的实质也是电性作用,无方向性,无饱和性
③范德华力是一种短程力,作用范围通常为0.3 0.5 nm。
主要影响物质的熔点、沸点等物理性质。
(3)范德华力与物质的性质
组成和结构相似的分子
相对分子质量增大
范德华力增大
熔点和沸点升高
2.氢键
(1)概念:
当氢原子与电负性大的原子X以共价键结合时,氢原子与另一个电负性大的原子Y之间的静电作用。
(2)表示形式:
通常用X—H…Y表示氢键,其中X—H表示氢原子和X原子以共价键相结合。
(3)实质:
静电作用
(4)特征:
具有方向性和饱和性
化学键>氢键>范德华力
(5)氢键作用力的大小:
(6)氢键的类型;
分子间氢键
分子内氢键
(7)氢键对物质性质的影响
①当形成分子间氢键时,物质的熔、沸点将升高。
②影响物质的电离、溶解等过程。
【考点一】化学键的比较
【例1】下列现象与化学键有关的是( )
A.F2、Cl2、Br2、I2的熔点依次升高
B.H2O的沸点远高于H2S的沸点
C.H2O在高温下难分解
D.干冰升华
C
化学键的比较
类型 离子键 共价键 金属键
非极性键 极性键 配位键
本质 阴、阳离子间通过静电作用形成 相邻原子间通过共用电子对与原子核间的静电作用形成 金属阳离子与自由电子间作用
成键条件 成键原子的得、失电子能力差别很大 成键原子得失电子能力相同 成键原子得、失电子能力差别较小 成键原子一方有孤电子对,另一方有可接受孤电子对的空轨道 同种金属或不同金属
化学键的比较
类型 离子键 共价键 金属键
非极性键 极性键 配位键
特征 无方向性、饱和性 有方向性、饱和性 无方向性、饱和性
存在 离子 化合物 单质,共价化合物,离子化合物 共价化合物, 离子化合物 离子 化合物 金属单质、合金
影响强弱的 因素 一般阴、阳离子电荷越多,半径越小,离子键越强 — 成键原子电负性差值越大,键的极性越强;键能越大,键长越短,共价键越牢固 — 金属阳离子半径越小,价电子越多,金属键越强
【练一练】
1.下列有关化学键的叙述,正确的是( )
A.离子化合物中一定含有离子键
B.单质分子中均不存在化学键
C.含有极性键的分子一定是极性分子
D.含有共价键的化合物一定是共价化合物
2.光谱证实单质铝与强碱溶液反应有[Al(OH)4]-生成,则[Al(OH)4]-中不存在的是( )
A.共价键 B.非极性键
C.配位键 D.σ键
B
A
【例1】下列各物质中的中心原子不是采用sp3杂化的是( )
A.NH3 B.H2O C.CO2 D.CCl4
【考点二】杂化类型的判断
C
(1)由分子或离子的空间结构判断杂化类型。
①直线形——sp杂化;
②平面形——sp2杂化;
③四面体形——sp3杂化。
杂化类型的判断方法
(2)由电子对数判断杂化类型(包括孤电子对和成键电子对)
①2对——sp杂化;
②3对——sp2杂化;
③4对——sp3杂化。
(3)由碳原子的饱和程度判断。
①饱和碳原子——sp3杂化;
②双键上的碳原子——sp2杂化;
③三键上的碳原子——sp杂化。
杂化类型的判断方法
1.下列分子的空间结构可用sp2杂化轨道来解释的是( )
BF3 ②CH2==CH2 ③Cl2C==CCl2 ④CH≡CH ⑤NH3 ⑥CH4
A.①②③ B.①⑤⑥
C.②③④ D.③⑤⑥
【练一练】
A
2.指出下列原子的杂化轨道类型及分子或离子的空间结构。
(1)BCl3中的B采用 杂化,空间结构为 。
(2)PH3中的P采用 杂化,空间结构为 。
(3) 中的N采用 杂化,空间结构为 。
sp2 三角形
sp3 三角锥形
sp2 角形
【考点三】分子或离子的空间结构及判断方法
【例1】价电子对互斥理论可用于预测简单分子或离子的空间结构。
(1)利用价电子对互斥理论推断下列分子或离子的空间结构:
(2)利用价电子对互斥理论推断键角的大小:
①甲醛中H—C—H的键角 (填“>”“<”或“=”,下同)120°;
②SnBr2分子中Br—Sn—Br的键角 120°;
③PCl3分子中,Cl—P—Cl的键角 109°28'。
三角形 角形 直线形
三角形 三角形 直线形
<
<
<
(1)用价电子对互斥理论判断
①当中心原子无孤电子对时,分子的空间结构与互斥模型一致。
②当中心原子有孤对电子时,分子的空间结构与互斥模型不一致。
(2)用杂化轨道理论判断
(3)根据键角及分子的极性判断
(4)根据等电子原理判断
分子或离子空间结构的判断方法
1.价电子对互斥模型指的是价电子对的空间结构。根据杂化轨道理论和价电子对互斥理论,判断下列分子或者离子的中心原子杂化方式、价电子对互斥模型及空间结构均正确的是( )
选项 分子式 中心原子 杂化方式 价电子对 互斥模型 分子或离子
的空间结构
A SO2 sp 直线形 直线形
B HCHO sp2 三角形 三角锥形
C NF3 sp2 四面体形 三角形
D sp3 正四面体形 正四面体形
【练一练】
D
【考点四】判断分子极性的方法
【例1】下列各组分子中,都是由极性键构成的极性分子的一组是( )
A.CH3Cl和Cl2
B.NH3和H2O
C.H2S与CS2
D.CO2与HI
B
判断分子极性的方法
1.关于CS2、SO2、NH3三种物质的说法正确的是( )
A.CS2在水中的溶解度很小,是由于其属于极性分子
B.SO2和NH3均易溶于水,原因之一是它们都是极性分子
C.CS2为非极性分子,所以在三种物质中熔、沸点最低
D.NH3在水中溶解度很大只是由于NH3分子为极性分子
【练一练】
B
【考点五】等离子体的书写
【例1】根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子最外层电子数之和相同,也可互称等电子体,它们也具有相似的结构特征。
(1)仅由第2周期元素组成的共价分子中,互为等电子体的是________和 ; 和 。
(2)在短周期元素组成的物质中,与 互为等电子体的分子有__________。
SO2、O3
N2 CO CO2 N2O
(1)同主族替换法
同主族元素最外层电子数相等,故可将粒子中一个或几个原子换成同主族元素的其他原子,如O3与SO2、CO2与CS2分别互为等电子体。
(2)左右移位法
①将粒子中的两个原子换成原子序数分别增加n和减少n(n=1,2等)的原子,如N2与CO、 和CNO-互为等电子体。
②将粒子中的m个原子换成原子序数增加(或减少)n的元素的原子,且粒子的总电荷数减小(或增大)m×n。
(3)叠加法
互为等电子体的微粒分别再增加一个相同的原子或同主族元素的原子,如CO和N2互为等电子体,则N2O与CO2也互为等电子体。
利用替换法写等电子体
1.等电子体的结构相似,物理性质相似。下列各组粒子中,空间结构相似的是( )
A.SO2与O3 B.CO2与NO2
C.CS2与NO2 D.PCl3与BF3
2.下列各组微粒属于等电子体的是( )
A.12CO2和14CO B.H2O和NH3
C.NO+和CN- D.NO和CO
【练一练】
A
C
微粒间相互作用
与物质性质
化学键
分子间作用力
离子键
配位键
共价键
金属键
范德华力
氢键
与氢键有关的现象
对物质性质的影响
构成微粒、实质,解释金属性质
特征
分类
键参数
杂化轨道
空间分布
定义
实质
特征
