1.2.1 碳原子的成键方式 课件(共22张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修3
文档属性
| 名称 | 1.2.1 碳原子的成键方式 课件(共22张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 20:08:57 | ||
图片预览




文档简介
(共22张PPT)
第2节 有机化合物的结构与性质 课时1
1.了解碳原子的成键特点和成键方式的多样性,认识有机化合物种类繁多的原因;
2.了解单键、双键和三键的特点,知道碳原子的饱和程度对有机化合物的性质有重要影响;
3.理解极性键和非极性键的概念,知道共价键的极性对有机化合物性质有重要影响。
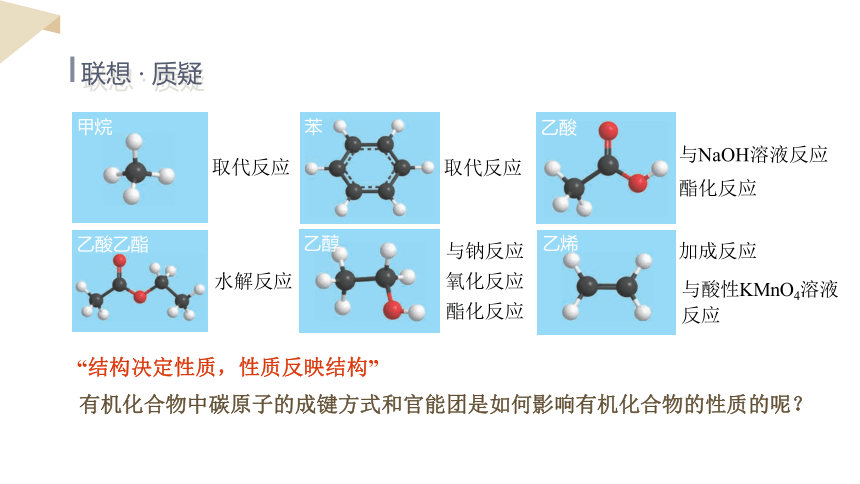
乙酸乙酯
水解反应
联想 · 质疑
联想 · 质疑
甲烷
取代反应
苯
取代反应
乙醇
乙酸
与NaOH溶液反应
酯化反应
氧化反应
酯化反应
乙烯
加成反应
与酸性KMnO4溶液反应
与钠反应
“结构决定性质,性质反映结构”
有机化合物中碳原子的成键方式和官能团是如何影响有机化合物的性质的呢?
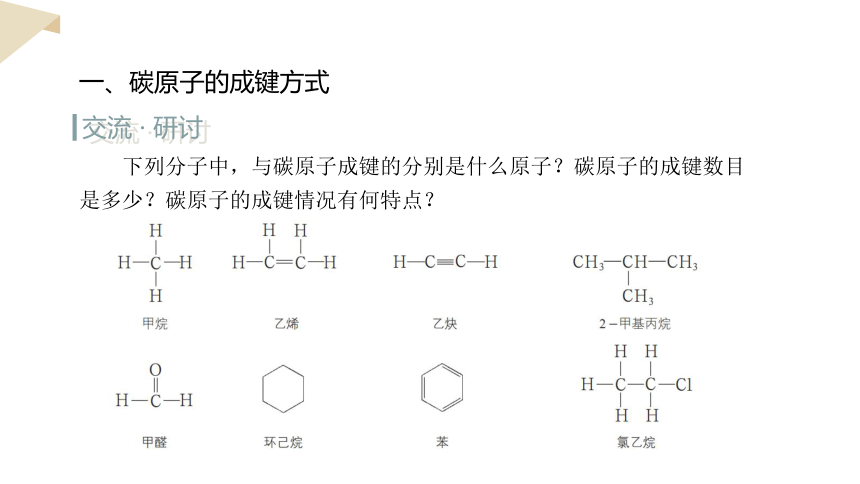
一、碳原子的成键方式
交流 · 研讨
交流 · 研讨
下列分子中,与碳原子成键的分别是什么原子?碳原子的成键数目是多少?碳原子的成键情况有何特点?
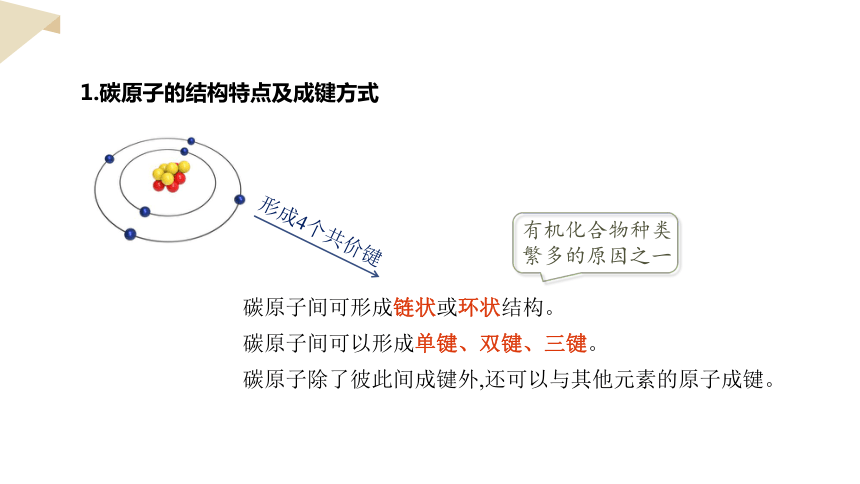
1.碳原子的结构特点及成键方式
形成4个共价键
碳原子间可形成链状或环状结构。
碳原子间可以形成单键、双键、三键。
碳原子除了彼此间成键外,还可以与其他元素的原子成键。
有机化合物种类繁多的原因之一
2.单键、双键和三键
四个单键
一个双键和两个单键
一个三键和一个单键
烷烃分子中的每个碳原子都与四个原子形成共价键(单键),在化学反应中碳原子原有的单键断裂后才能结合其他的原子或原子团,生成新的化合物。
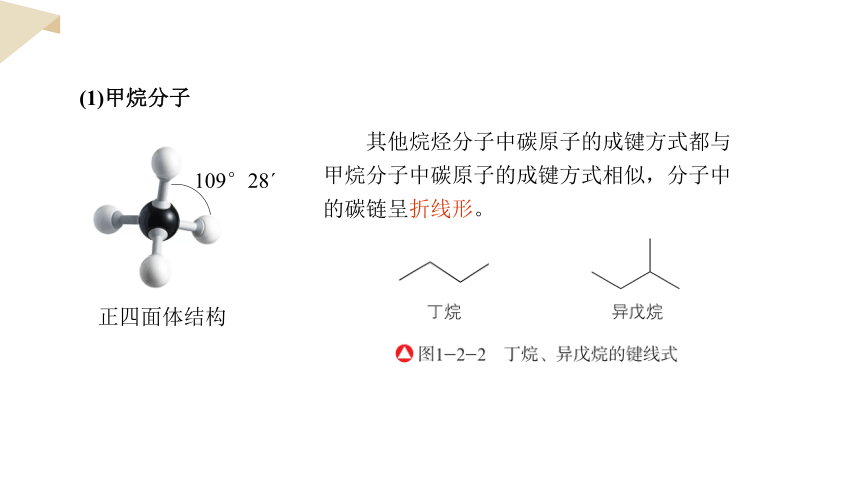
(1)甲烷分子
正四面体结构
109°28ˊ
其他烷烃分子中碳原子的成键方式都与甲烷分子中碳原子的成键方式相似,分子中的碳链呈折线形。
已知甲烷分子中的两个氢原子被两个氯原子取代后的结构只有一种,能否证明CH4的空间构型是正四面体结构,而不是平面结构
能,因为如果CH2Cl2的空间结构为平面形的话应存在两种结构:
思考与交流
H—C—H
Cl
Cl
H—C—Cl
H
Cl
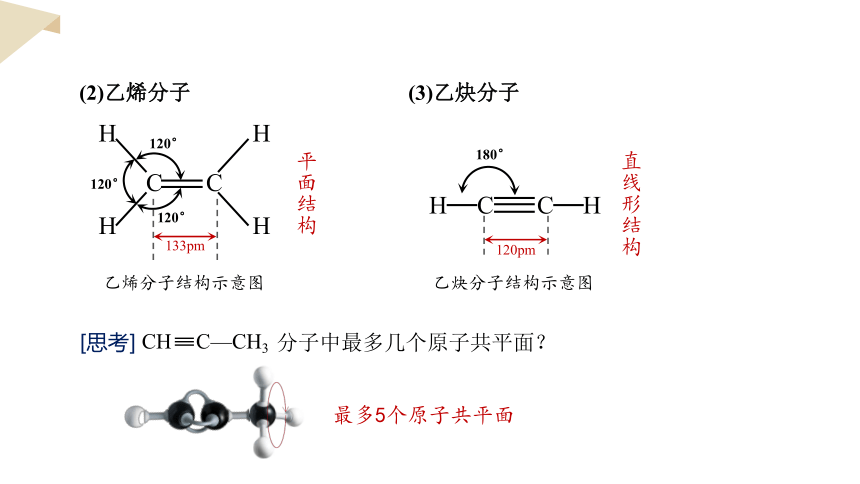
(2)乙烯分子
C
C
H
H
H
H
133pm
120°
120°
120°
乙烯分子结构示意图
平面结构
(3)乙炔分子
180°
乙炔分子结构示意图
直线形结构
C
C
H
H
120pm
[思考] 分子中最多几个原子共平面?
CH C—CH3
最多5个原子共平面
(2)乙烯分子
(3)乙炔分子
C
C
H
H
H
H
133pm
120°
120°
120°
乙烯分子结构示意图
平面结构
180°
乙炔分子结构示意图
直线形结构
C
C
H
H
120pm
[思考] 分子中最多几个原子共平面?
CH2 CH—CH CH2
最多10个原子共平面
乙烯(C2H4)和乙炔(C2H2)分子分别含有碳碳双键和碳碳三键,和乙烷(C2H6)相比它们的含氢数目都减少了,因此碳碳双键和碳碳三键称为不饱和键。
1, 2—二溴乙烷
1, 1, 2, 2—四溴乙烷
CH CH
+Br—Br CH2 CH2
Br
Br
CH2 CH2
+2Br—Br
H—C C—H
Br
Br
Br
Br
加成反应
通常,若有机化合物分子中有不饱和键,在加成反应中反应活性较强,双键或三键中有部分键容易断裂,双键或三键两端的碳原子还可以再结合其他原子或原子团。
CH3—C—H+H2 CH3—CH2—OH
催化剂
O
加成反应
有机化合物的化学性质除了取决于分子是否含有不饱和键外,还与键的极性密切相关。
3.极性键和非极性键
(1)极性键
不同元素的两个原子成键时,共用电子将偏向吸引电子能力较强的一方所形成的共价键是极性共价键,简称为极性键。
(2)非极性键
同种元素的两个原子成键时,共用电子不偏向任何一方,参与成键的两个原子都不显电性,所形成的键是非极性共价键,简称非极性键。
质子数不同
共价键极性的判断和比较
利用元素的电负性数值可以判断和比较键的极性。电负性是表示元素原子在成键时吸引电子能力强弱的一种标度。电负性数值越大,元素原子在成键时吸引电子的能力就越强;成键两元素电负性数值相差越大,键的极性就越强。
元素 H C N O F S Cl
电负性数值 2.1 2.5 3.0 3.5 4.0 2.5 3.0
【注意】键的极性并不是一成不变的,受分子中邻近基团或外界环境的影响,键的极性及强弱程度可能会发生变化。
在研究有机化合物时,可以根据成键两原子吸引电子能力的差异判断键的极性,进而分析和预测有机化合物分子的反应活性部位(在反应中的断键部位)。
CH3—CH2
H
+Cl2
光照
CH3—CH2 +HCl
Cl
交流 · 研讨
交流 · 研讨
乙醇和氯乙烷分子的结构式分别为 、 。
请利用碳原子成键方式的有关知识,分析和预测乙醇和氯乙烷分子在反应中可能的断键部位。
分析角度
判断分子中是否有不饱和键
寻找分子中有极性的化学键
H
H
H
C
C
H
O
H
H
+2Na
H
H
H
C
C
H
O
H
H
2
H
H
H
C
C
H
O
Na
H
2
+H2↑
2
+O2
催化剂
△
2
H
H
H
C
C
H
H
O
+2H2O
H
H
H
C
C
H
O
H
H
浓硫酸
170℃
+H2O
CH2 CH2
【练一练】
1.下列说法不正确的是( )
A.只有成键两原子为同种元素的原子,才有可能形成非极性键
B.极性键中吸引共用电子能力强的原子带部分正电荷
C.键的极性除受成键原子吸引共用电子能力的强弱影响,还受邻近原子团的影响
D.不同元素原子的核内质子数不同,核对外层电子吸引作用的强弱程度就不同
B
2.下列说法中正确的是( )
A.烷烃中只可能存在碳碳单键和碳氢单键
B.烯烃中的碳碳双键是完全相同的两个键
C.烯烃和炔烃中所有的碳原子都是共面的
D.烯烃和炔烃都能与氯气发生加成反应生成氯代烃和氯化氢
3.下列化合物的分子中,所有原子可能共平面的是( )
A.甲苯 B.乙烷
C.丙炔 D.1,3-丁二烯
A
D
4.下列叙述正确的是( )
A.CO2分子内存在着非极性键
B.C2H4分子中一定存在双键
C.含有双键的有机化合物分子中所有原子共平面
D.烷烃分子中一定存在非极性键
5.下列分子中,既具有极性键又具有非极性键的分子是( )
A.CH2Cl2 B.HCHO
C.H2O D.CH2=CH—CH3
B
D
碳原子的
成键方式
碳原子的结构特点及成键方式
单键、双键和三键
极性键与非极性键
空间结构
饱和键与不饱和键
极性的判断——电负性
分析和预测有机化合物分子的断键部位
第2节 有机化合物的结构与性质 课时1
1.了解碳原子的成键特点和成键方式的多样性,认识有机化合物种类繁多的原因;
2.了解单键、双键和三键的特点,知道碳原子的饱和程度对有机化合物的性质有重要影响;
3.理解极性键和非极性键的概念,知道共价键的极性对有机化合物性质有重要影响。
乙酸乙酯
水解反应
联想 · 质疑
联想 · 质疑
甲烷
取代反应
苯
取代反应
乙醇
乙酸
与NaOH溶液反应
酯化反应
氧化反应
酯化反应
乙烯
加成反应
与酸性KMnO4溶液反应
与钠反应
“结构决定性质,性质反映结构”
有机化合物中碳原子的成键方式和官能团是如何影响有机化合物的性质的呢?
一、碳原子的成键方式
交流 · 研讨
交流 · 研讨
下列分子中,与碳原子成键的分别是什么原子?碳原子的成键数目是多少?碳原子的成键情况有何特点?
1.碳原子的结构特点及成键方式
形成4个共价键
碳原子间可形成链状或环状结构。
碳原子间可以形成单键、双键、三键。
碳原子除了彼此间成键外,还可以与其他元素的原子成键。
有机化合物种类繁多的原因之一
2.单键、双键和三键
四个单键
一个双键和两个单键
一个三键和一个单键
烷烃分子中的每个碳原子都与四个原子形成共价键(单键),在化学反应中碳原子原有的单键断裂后才能结合其他的原子或原子团,生成新的化合物。
(1)甲烷分子
正四面体结构
109°28ˊ
其他烷烃分子中碳原子的成键方式都与甲烷分子中碳原子的成键方式相似,分子中的碳链呈折线形。
已知甲烷分子中的两个氢原子被两个氯原子取代后的结构只有一种,能否证明CH4的空间构型是正四面体结构,而不是平面结构
能,因为如果CH2Cl2的空间结构为平面形的话应存在两种结构:
思考与交流
H—C—H
Cl
Cl
H—C—Cl
H
Cl
(2)乙烯分子
C
C
H
H
H
H
133pm
120°
120°
120°
乙烯分子结构示意图
平面结构
(3)乙炔分子
180°
乙炔分子结构示意图
直线形结构
C
C
H
H
120pm
[思考] 分子中最多几个原子共平面?
CH C—CH3
最多5个原子共平面
(2)乙烯分子
(3)乙炔分子
C
C
H
H
H
H
133pm
120°
120°
120°
乙烯分子结构示意图
平面结构
180°
乙炔分子结构示意图
直线形结构
C
C
H
H
120pm
[思考] 分子中最多几个原子共平面?
CH2 CH—CH CH2
最多10个原子共平面
乙烯(C2H4)和乙炔(C2H2)分子分别含有碳碳双键和碳碳三键,和乙烷(C2H6)相比它们的含氢数目都减少了,因此碳碳双键和碳碳三键称为不饱和键。
1, 2—二溴乙烷
1, 1, 2, 2—四溴乙烷
CH CH
+Br—Br CH2 CH2
Br
Br
CH2 CH2
+2Br—Br
H—C C—H
Br
Br
Br
Br
加成反应
通常,若有机化合物分子中有不饱和键,在加成反应中反应活性较强,双键或三键中有部分键容易断裂,双键或三键两端的碳原子还可以再结合其他原子或原子团。
CH3—C—H+H2 CH3—CH2—OH
催化剂
O
加成反应
有机化合物的化学性质除了取决于分子是否含有不饱和键外,还与键的极性密切相关。
3.极性键和非极性键
(1)极性键
不同元素的两个原子成键时,共用电子将偏向吸引电子能力较强的一方所形成的共价键是极性共价键,简称为极性键。
(2)非极性键
同种元素的两个原子成键时,共用电子不偏向任何一方,参与成键的两个原子都不显电性,所形成的键是非极性共价键,简称非极性键。
质子数不同
共价键极性的判断和比较
利用元素的电负性数值可以判断和比较键的极性。电负性是表示元素原子在成键时吸引电子能力强弱的一种标度。电负性数值越大,元素原子在成键时吸引电子的能力就越强;成键两元素电负性数值相差越大,键的极性就越强。
元素 H C N O F S Cl
电负性数值 2.1 2.5 3.0 3.5 4.0 2.5 3.0
【注意】键的极性并不是一成不变的,受分子中邻近基团或外界环境的影响,键的极性及强弱程度可能会发生变化。
在研究有机化合物时,可以根据成键两原子吸引电子能力的差异判断键的极性,进而分析和预测有机化合物分子的反应活性部位(在反应中的断键部位)。
CH3—CH2
H
+Cl2
光照
CH3—CH2 +HCl
Cl
交流 · 研讨
交流 · 研讨
乙醇和氯乙烷分子的结构式分别为 、 。
请利用碳原子成键方式的有关知识,分析和预测乙醇和氯乙烷分子在反应中可能的断键部位。
分析角度
判断分子中是否有不饱和键
寻找分子中有极性的化学键
H
H
H
C
C
H
O
H
H
+2Na
H
H
H
C
C
H
O
H
H
2
H
H
H
C
C
H
O
Na
H
2
+H2↑
2
+O2
催化剂
△
2
H
H
H
C
C
H
H
O
+2H2O
H
H
H
C
C
H
O
H
H
浓硫酸
170℃
+H2O
CH2 CH2
【练一练】
1.下列说法不正确的是( )
A.只有成键两原子为同种元素的原子,才有可能形成非极性键
B.极性键中吸引共用电子能力强的原子带部分正电荷
C.键的极性除受成键原子吸引共用电子能力的强弱影响,还受邻近原子团的影响
D.不同元素原子的核内质子数不同,核对外层电子吸引作用的强弱程度就不同
B
2.下列说法中正确的是( )
A.烷烃中只可能存在碳碳单键和碳氢单键
B.烯烃中的碳碳双键是完全相同的两个键
C.烯烃和炔烃中所有的碳原子都是共面的
D.烯烃和炔烃都能与氯气发生加成反应生成氯代烃和氯化氢
3.下列化合物的分子中,所有原子可能共平面的是( )
A.甲苯 B.乙烷
C.丙炔 D.1,3-丁二烯
A
D
4.下列叙述正确的是( )
A.CO2分子内存在着非极性键
B.C2H4分子中一定存在双键
C.含有双键的有机化合物分子中所有原子共平面
D.烷烃分子中一定存在非极性键
5.下列分子中,既具有极性键又具有非极性键的分子是( )
A.CH2Cl2 B.HCHO
C.H2O D.CH2=CH—CH3
B
D
碳原子的
成键方式
碳原子的结构特点及成键方式
单键、双键和三键
极性键与非极性键
空间结构
饱和键与不饱和键
极性的判断——电负性
分析和预测有机化合物分子的断键部位
