1.3.1 烷烃及其性质 课件(共21张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修3
文档属性
| 名称 | 1.3.1 烷烃及其性质 课件(共21张PPT) 2023-2024学年高二化学鲁科版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 20:09:35 | ||
图片预览








文档简介
(共21张PPT)
第3节 烃 课时1
1.了解烃类在日常生活中的重要作用;
2.认识烷烃的组成和结构特点,能列举烷烃的主要物理性质;
3.能根据甲烷的性质理解烷烃的化学性质,如烷烃与氧气反应、卤素单质的反应,并能书写相应的反应式。
生活中常见的烃
汽车轮胎
天然气
汽油、柴油
塑料水杯
烃
定义:仅含碳和氢两种元素的有机化合物
分类(结构不同)
烷烃
烯烃
芳香烃
炔烃
甲烷
乙烯
乙炔
苯
其结构和性质
各类烃的结构和性质
一、烷烃及其性质
1.烷烃的类别和存在:
(1)类别:烷烃是一种饱和链烃,属于脂肪烃,通式为CnH2n+2(n≥1)。
(2)存在:
二十七烷
二十九烷
十一烷
20个以上碳原子的烷烃
2.物理性质:
烷烃名称 分子式 结构简式 常温下状态 熔点/℃ 沸点/℃ 密度/(g·cm-3)
甲烷 CH4 CH4 气体 -182 -164 0.423
乙烷 C2H6 CH3CH3 气体 -172 -89 0.545
丙烷 C3H8 CH3CH2CH3 气体 -187 -42 0.501
正丁烷 C4H10 CH3CH2CH2CH3 气体 -138 -0.5 0.579
正戊烷 C5H12 CH3(CH2)3CH3 液体 -129 36 0.626
正壬烷 C9H20 CH3(CH2)7CH3 液体 -54 151 0.718
十一烷 C11H24 CH3(CH2)9CH3 液体 -26 196 0.740
十六烷 C16H34 CH3(CH2)14CH3 液体 18 280 0.775
十八烷 C18H38 CH3(CH2)16CH3 固体 28 308 0.777
2.物理性质:
碳原子数 熔点、沸点 通常状态 密度 溶解性
【注意】 一般来说,碳原子数相同的烷烃,支链越多,沸点越低,如沸点:正戊烷>异戊烷>新戊烷。
小
大
低高
气液固
小
大
<1
不溶于水,易溶于有机溶剂
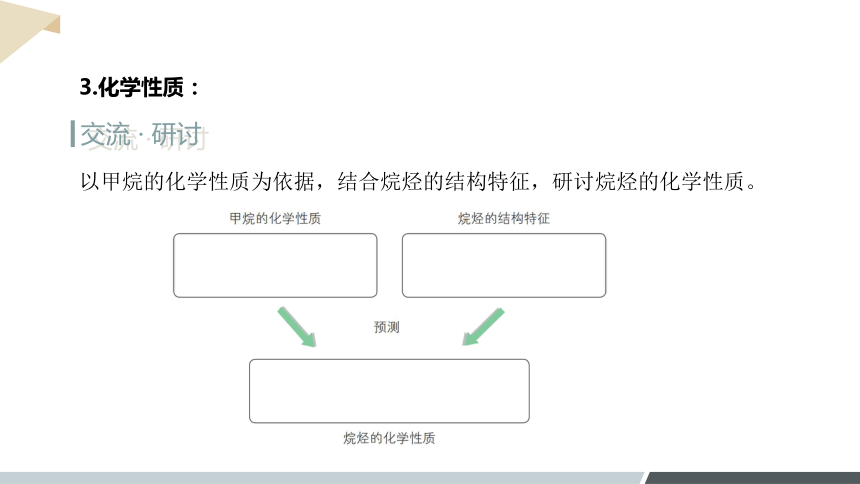
交流 · 研讨
交流 · 研讨
以甲烷的化学性质为依据,结合烷烃的结构特征,研讨烷烃的化学性质。
3.化学性质:
甲烷的性质
通常条件下,甲烷的化学性质比较稳定,主要表现为:
①在空气中燃烧(可燃性)发生氧化反应
②能在光照下与氯气发生取代反应
纯净的甲烷是无色、无臭的气体,难溶于水,密度比空气的小
烷烃的结构特征
碳原子之间都以单键结合成碳链;
碳原子的剩余价键均与氢原子结合。
戊烷
结构
性质
预测
碳原子饱和
极性较强的碳氢键是反应的活性部位
化学键
键的饱和性
键的极性
同系物的分子结构相似,故化学性质相似。烷烃的结构决定了其性质与甲烷的相似。
通常条件下稳定
在光照下与氯气发生取代反应
在空气中能燃烧
碳氢键、碳碳单键
常温下烷烃很不活泼,与强酸,强碱,强氧化剂和还原剂等都不发生反应,只有在特殊条件下(如光照或高温)下才能发生某些化学反应。
1.烷烃的取代反应——与卤素单质的反应
[思考]甲烷在光照条件下与氯气反应一段时间后,会出现哪些实验现象呢?
H
H-C-H
H
H
H-C-
-Cl
Cl -Cl
hv
+
+
Cl
H
H
H
H-C-Cl
H-C-
H
Cl
-Cl
Cl -Cl
hv
+
+
Cl
H
H
气体
有机溶剂
H
H-C-Cl
Cl-C-
H
Cl
-Cl
Cl -Cl
hv
+
+
Cl
H
Cl
H
H-C-Cl
Cl-C-
Cl
Cl
-Cl
Cl -Cl
hv
+
+
Cl
H
Cl
有机溶剂
有机溶剂
【实验现象】黄绿色气体逐渐变淡,有白雾生成,试管内壁上有油状液滴生成,试管中液面上升,食盐水中白色晶体析出。
[思考]根据甲烷与氯气的反应,分别写出乙烷、丙烷与氯气反应生成一氯代物的化学方程式。
CH3CH3+Cl2 CH3CH2Cl+HCl
hv
CH3CH2CH3+Cl2 CH2CH2CH3
hv
1-氯丙烷
Cl
CH3CH2CH3+Cl2 CH3CHCH3
hv
2-氯丙烷
Cl
在光照条件下,烷烃只能与卤素单质发生取代反应,不能与卤素单质的水溶液反应。
烷烃与氯气的反应
在光照条件下,一个氯分子分解为两个氯自由基(含有未成对电子的原子或基团称为自由基)。
生成的氯自由基再与甲烷反应重复上述过程,因此该反应可连续进行。当生成的氯甲烷与氯自由基反应时,可进一步生成二氯甲烷、三氯甲烷和四氯化碳。
(自由基反应)
烷烃的燃烧通式:
2.烷烃的氧化反应
CnH2n+2 + O2 nCO2 + (n+1)H2O
点燃
烃的燃烧通式:
CxHy +(x+ ) O2 xCO2 + H2O
点燃
y
4
y
2
性质
用途
决定
烷烃的种类很多,人们倾向于选择哪种烷烃作为燃料呢?
思考与交流
烷烃 甲烷 丙烷 戊烷 庚烷
碳、氢原子个数比 1:4 3:8 5:12 7:16
碳元素的 质量分数 75% 81.8% 83.3% 84%
倾向于选用烷烃中相对分子质量小的烷烃作为燃料。
100g烃 乙烷 乙烯 乙炔
碳元素的 质量分数 0.80 0.86 0.92
完全燃烧 放出热量 5200kJ 5040kJ 5000kJ
质量相同的烃,碳元素的质量分数越低,完全燃烧时放出的热量越多。
1.判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)甲烷与氯气发生取代反应生成的产物中CH3Cl最多。( )
(2)1 mol CH3CH3与氯气发生反应生成CCl3CCl3最多消耗3 mol Cl2。( )
(3)含有多个碳原子的直链烷烃中碳链是直线形的。( )
(4)甲烷跟氯气反应生成的CH3Cl、CH2Cl2、CHCl3和CCl4的空间结构均为正四面体形。( )
(5)丙烷(C3H8)发生取代反应生成的C3H7Cl的结构只有一种。( )
(6)分子式为CH4的烃与分子式为C10H22的烃一定互为同系物。( )
【练一练】
2.下列叙述错误的是 ( )
A.甲烷与氯气反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4,都属于取代反应B.烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
C.分子通式为CnH2n+2的烃一定是链状烷烃
D.甲烷能够燃烧,在一定条件下会发生爆炸
B
3.下列有机物:①正丁烷,②丙烷,③2 甲基丁烷,④异丁烷,⑤己烷。
沸点由高到低的顺序为( )
A.②①④③⑤ B.⑤③④①② C.⑤③①④② D.②①③④⑤
C
4.现有CH4、C2H4、C2H6三种有机化合物:
(1)等质量的以上三种物质完全燃烧时消耗O2的量最多的是 。
(2)相同状况、相同体积的以上三种物质完全燃烧时消耗O2的量最多的是 。
(4)在120 ℃、101kPa时,上述两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是 。
CH4
C2H6
CH4和C2H4
5.已知烷烃A的密度是相同条件下H2密度的36倍。
(1)该烷烃A的分子式为 。
(2)若A的某种同分异构体B的一氯代物只有一种。
①B的系统名称为 。
②B与Cl2发生反应生成一氯代物的化学方程式为
。
③B燃烧的化学方程式为 。
C5H12
2,2-二甲基丙烷
CH3C(CH3)2CH3+Cl2 CH3C(CH3)2CH2Cl+HCl
光照
C5H12+8O2 5CO2+6H2O
点燃
烷烃
结构特征
物理性质
化学性质
不溶于水,易溶于有机溶剂
随着烷烃碳原子数的增加,烷烃的熔点和沸点逐渐升高
密度比水小,随相对分子质量增大而增大
(紫外线)与卤素单质反应
与强氧化剂、强还原剂不反应
与强酸、强碱溶液不反应
与氧气反应
化学键
通式
碳氢键、碳碳单键
折线形
第3节 烃 课时1
1.了解烃类在日常生活中的重要作用;
2.认识烷烃的组成和结构特点,能列举烷烃的主要物理性质;
3.能根据甲烷的性质理解烷烃的化学性质,如烷烃与氧气反应、卤素单质的反应,并能书写相应的反应式。
生活中常见的烃
汽车轮胎
天然气
汽油、柴油
塑料水杯
烃
定义:仅含碳和氢两种元素的有机化合物
分类(结构不同)
烷烃
烯烃
芳香烃
炔烃
甲烷
乙烯
乙炔
苯
其结构和性质
各类烃的结构和性质
一、烷烃及其性质
1.烷烃的类别和存在:
(1)类别:烷烃是一种饱和链烃,属于脂肪烃,通式为CnH2n+2(n≥1)。
(2)存在:
二十七烷
二十九烷
十一烷
20个以上碳原子的烷烃
2.物理性质:
烷烃名称 分子式 结构简式 常温下状态 熔点/℃ 沸点/℃ 密度/(g·cm-3)
甲烷 CH4 CH4 气体 -182 -164 0.423
乙烷 C2H6 CH3CH3 气体 -172 -89 0.545
丙烷 C3H8 CH3CH2CH3 气体 -187 -42 0.501
正丁烷 C4H10 CH3CH2CH2CH3 气体 -138 -0.5 0.579
正戊烷 C5H12 CH3(CH2)3CH3 液体 -129 36 0.626
正壬烷 C9H20 CH3(CH2)7CH3 液体 -54 151 0.718
十一烷 C11H24 CH3(CH2)9CH3 液体 -26 196 0.740
十六烷 C16H34 CH3(CH2)14CH3 液体 18 280 0.775
十八烷 C18H38 CH3(CH2)16CH3 固体 28 308 0.777
2.物理性质:
碳原子数 熔点、沸点 通常状态 密度 溶解性
【注意】 一般来说,碳原子数相同的烷烃,支链越多,沸点越低,如沸点:正戊烷>异戊烷>新戊烷。
小
大
低高
气液固
小
大
<1
不溶于水,易溶于有机溶剂
交流 · 研讨
交流 · 研讨
以甲烷的化学性质为依据,结合烷烃的结构特征,研讨烷烃的化学性质。
3.化学性质:
甲烷的性质
通常条件下,甲烷的化学性质比较稳定,主要表现为:
①在空气中燃烧(可燃性)发生氧化反应
②能在光照下与氯气发生取代反应
纯净的甲烷是无色、无臭的气体,难溶于水,密度比空气的小
烷烃的结构特征
碳原子之间都以单键结合成碳链;
碳原子的剩余价键均与氢原子结合。
戊烷
结构
性质
预测
碳原子饱和
极性较强的碳氢键是反应的活性部位
化学键
键的饱和性
键的极性
同系物的分子结构相似,故化学性质相似。烷烃的结构决定了其性质与甲烷的相似。
通常条件下稳定
在光照下与氯气发生取代反应
在空气中能燃烧
碳氢键、碳碳单键
常温下烷烃很不活泼,与强酸,强碱,强氧化剂和还原剂等都不发生反应,只有在特殊条件下(如光照或高温)下才能发生某些化学反应。
1.烷烃的取代反应——与卤素单质的反应
[思考]甲烷在光照条件下与氯气反应一段时间后,会出现哪些实验现象呢?
H
H-C-H
H
H
H-C-
-Cl
Cl -Cl
hv
+
+
Cl
H
H
H
H-C-Cl
H-C-
H
Cl
-Cl
Cl -Cl
hv
+
+
Cl
H
H
气体
有机溶剂
H
H-C-Cl
Cl-C-
H
Cl
-Cl
Cl -Cl
hv
+
+
Cl
H
Cl
H
H-C-Cl
Cl-C-
Cl
Cl
-Cl
Cl -Cl
hv
+
+
Cl
H
Cl
有机溶剂
有机溶剂
【实验现象】黄绿色气体逐渐变淡,有白雾生成,试管内壁上有油状液滴生成,试管中液面上升,食盐水中白色晶体析出。
[思考]根据甲烷与氯气的反应,分别写出乙烷、丙烷与氯气反应生成一氯代物的化学方程式。
CH3CH3+Cl2 CH3CH2Cl+HCl
hv
CH3CH2CH3+Cl2 CH2CH2CH3
hv
1-氯丙烷
Cl
CH3CH2CH3+Cl2 CH3CHCH3
hv
2-氯丙烷
Cl
在光照条件下,烷烃只能与卤素单质发生取代反应,不能与卤素单质的水溶液反应。
烷烃与氯气的反应
在光照条件下,一个氯分子分解为两个氯自由基(含有未成对电子的原子或基团称为自由基)。
生成的氯自由基再与甲烷反应重复上述过程,因此该反应可连续进行。当生成的氯甲烷与氯自由基反应时,可进一步生成二氯甲烷、三氯甲烷和四氯化碳。
(自由基反应)
烷烃的燃烧通式:
2.烷烃的氧化反应
CnH2n+2 + O2 nCO2 + (n+1)H2O
点燃
烃的燃烧通式:
CxHy +(x+ ) O2 xCO2 + H2O
点燃
y
4
y
2
性质
用途
决定
烷烃的种类很多,人们倾向于选择哪种烷烃作为燃料呢?
思考与交流
烷烃 甲烷 丙烷 戊烷 庚烷
碳、氢原子个数比 1:4 3:8 5:12 7:16
碳元素的 质量分数 75% 81.8% 83.3% 84%
倾向于选用烷烃中相对分子质量小的烷烃作为燃料。
100g烃 乙烷 乙烯 乙炔
碳元素的 质量分数 0.80 0.86 0.92
完全燃烧 放出热量 5200kJ 5040kJ 5000kJ
质量相同的烃,碳元素的质量分数越低,完全燃烧时放出的热量越多。
1.判断下列说法是否正确,正确的画“√”,错误的画“×”。
(1)甲烷与氯气发生取代反应生成的产物中CH3Cl最多。( )
(2)1 mol CH3CH3与氯气发生反应生成CCl3CCl3最多消耗3 mol Cl2。( )
(3)含有多个碳原子的直链烷烃中碳链是直线形的。( )
(4)甲烷跟氯气反应生成的CH3Cl、CH2Cl2、CHCl3和CCl4的空间结构均为正四面体形。( )
(5)丙烷(C3H8)发生取代反应生成的C3H7Cl的结构只有一种。( )
(6)分子式为CH4的烃与分子式为C10H22的烃一定互为同系物。( )
【练一练】
2.下列叙述错误的是 ( )
A.甲烷与氯气反应无论生成CH3Cl、CH2Cl2、CHCl3还是CCl4,都属于取代反应B.烷烃中除甲烷外,很多都能使酸性KMnO4溶液的紫色褪去
C.分子通式为CnH2n+2的烃一定是链状烷烃
D.甲烷能够燃烧,在一定条件下会发生爆炸
B
3.下列有机物:①正丁烷,②丙烷,③2 甲基丁烷,④异丁烷,⑤己烷。
沸点由高到低的顺序为( )
A.②①④③⑤ B.⑤③④①② C.⑤③①④② D.②①③④⑤
C
4.现有CH4、C2H4、C2H6三种有机化合物:
(1)等质量的以上三种物质完全燃烧时消耗O2的量最多的是 。
(2)相同状况、相同体积的以上三种物质完全燃烧时消耗O2的量最多的是 。
(4)在120 ℃、101kPa时,上述两种气态烃和足量的氧气混合点燃,相同条件下测得反应前后气体体积没有发生变化,这两种气体是 。
CH4
C2H6
CH4和C2H4
5.已知烷烃A的密度是相同条件下H2密度的36倍。
(1)该烷烃A的分子式为 。
(2)若A的某种同分异构体B的一氯代物只有一种。
①B的系统名称为 。
②B与Cl2发生反应生成一氯代物的化学方程式为
。
③B燃烧的化学方程式为 。
C5H12
2,2-二甲基丙烷
CH3C(CH3)2CH3+Cl2 CH3C(CH3)2CH2Cl+HCl
光照
C5H12+8O2 5CO2+6H2O
点燃
烷烃
结构特征
物理性质
化学性质
不溶于水,易溶于有机溶剂
随着烷烃碳原子数的增加,烷烃的熔点和沸点逐渐升高
密度比水小,随相对分子质量增大而增大
(紫外线)与卤素单质反应
与强氧化剂、强还原剂不反应
与强酸、强碱溶液不反应
与氧气反应
化学键
通式
碳氢键、碳碳单键
折线形
