2.2 课时1 醇 课件(共28页) 2023-2024学年高二化学鲁科版(2019)选择性必修3
文档属性
| 名称 | 2.2 课时1 醇 课件(共28页) 2023-2024学年高二化学鲁科版(2019)选择性必修3 |

|
|
| 格式 | pptx | ||
| 文件大小 | 8.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2024-01-18 20:12:33 | ||
图片预览







文档简介
(共28张PPT)
第2节 醇和酚 课时1
1.了解醇的分类、物理性质、用途和一些常见的醇,能够用系统命名法对简单的饱和一元醇进行命名;
2.知道饱和一元醇的结构特征和化学性质,能举例说明醇的反应机理(断键和成键规律)。掌握醇的转化在有机合成中的应用,会设计醇到烯烃、卤代烃、醛、酮、酯的转化路线。
联想 · 质疑
联想 · 质疑
含乙二醇的防冻液
醇和酚都是重要的有机化合物。如常用作燃料和饮料的酒精(乙醇)、汽车发动机防冻液中的乙二醇、化妆品中的丙三醇含有醇羟基,茶叶中的茶多酚、用于制药皂的苯酚、漆器上涂的漆酚含有酚羟基。
一位著名的有机化学家曾说过,假如让一个有机化学家带上10 种有机化合物到荒岛上独自工作,他的选择里一定会有醇。有了醇,他就能合成出各种各样的有机化合物。那么,在有机化合物的合成中醇为什么会有如此重要的作用?
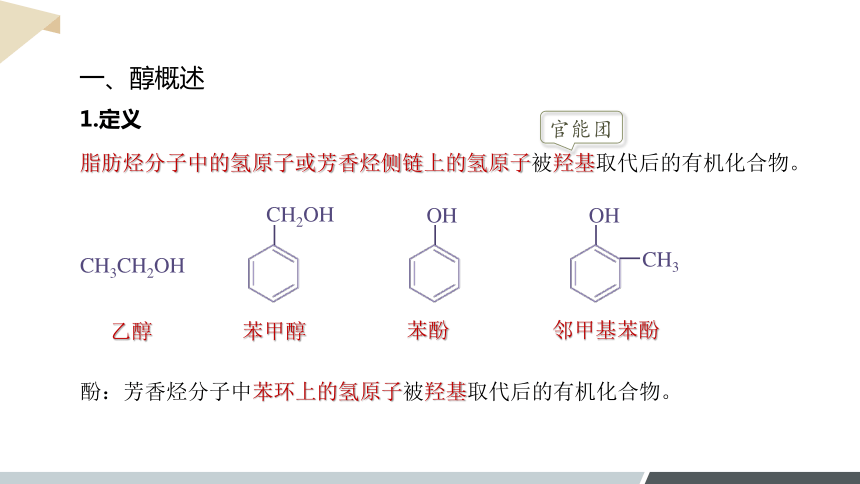
一、醇概述
1.定义
脂肪烃分子中的氢原子或芳香烃侧链上的氢原子被羟基取代后的有机化合物。
酚:芳香烃分子中苯环上的氢原子被羟基取代后的有机化合物。
乙醇
苯酚
苯甲醇
CH3CH2OH
邻甲基苯酚
CH2OH
OH
OH
CH3
官能团
醇的命名
1. 选择分子中连有羟基的碳原子在内的最长碳链做主链,按主链所含碳原子数称为某醇。
2. 对主链碳原子的编号由接近羟基的一端开始。
3. 命名时,羟基的位次号写在“某醇”的前面,其他取代基的名称和位次号写在母体名称的前面。
例如:
饱和一元醇的通式为:
CnH2n+1OH
醇
根据醇分子中所含羟基的数目
一元醇
二元醇
多元醇
按羟基所连烃基种类分类
脂肪醇
脂环醇
饱和醇
不饱和醇
芳香醇
(可简写为R—OH)
2.分类
3.常见的醇
醇
根据醇分子中所含羟基的数目
一元醇
二元醇
多元醇
CH3OH 甲醇(一元醇)
俗名:木醇
无色、具有挥发性的液体
有毒
用作燃料、化工原料
沸点:65℃
与水互溶
CH2—OH
CH2—OH
乙二醇
CH2—OH
CH—OH
丙三醇
CH2—OH
俗名:甘醇
无色、无臭、具有甜味的黏稠液体
无毒
作防冻液、合成涤纶
俗名:甘油
无色、无臭、具有甜味的黏稠液体
无毒
制造日用化妆品、硝化甘油
沸点:197℃
沸点:290℃
与水互溶
与水互溶
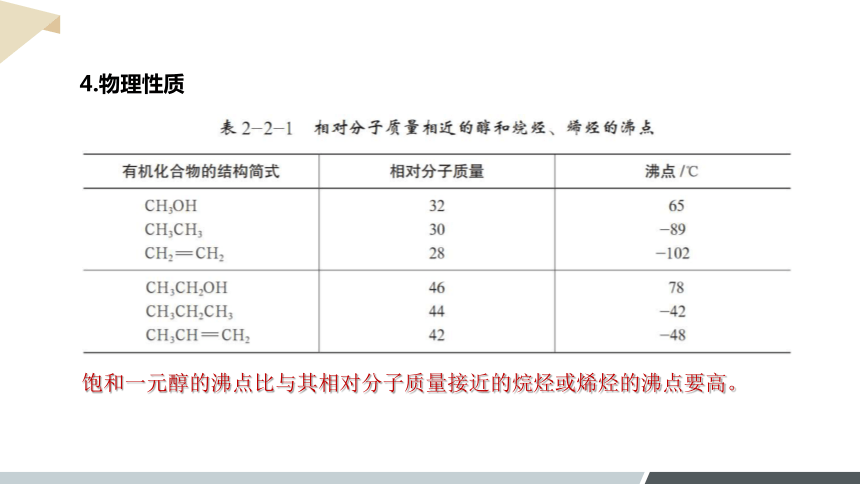
4.物理性质
饱和一元醇的沸点比与其相对分子质量接近的烷烃或烯烃的沸点要高。
氢键
氢键是一种特殊的分子间作用力。氢键的键能比化学键弱很多,但比普通的分子间作用力(范德华力)强。醇分子之间可以形成氢键,醇的水溶液中水分子和醇分子之间也可以形成氢键。
沸点
溶解度
(1)沸点
①饱和一元醇的沸点比与其相对分子质量接近的烷烃或烯烃的沸点要高。
③碳原子数相同时,羟基个数越多,沸点越高。
②饱和一元醇,随分子中碳原子数的增加沸点逐渐升高。
(2)溶解度:
含羟基较多的醇极易溶于水。
常温常压,饱和一元醇在水中的溶解性
醇分子中 碳原子数 1~3 4~11 > 11
溶解性 能与水以任意比例互溶 油状液体,仅可部分溶于水 固体,
难溶于水
随着分子中烷基所含碳原子数的增多,醇的物理性质逐渐接近烷烃。
5.化学性质
预测有机化合物可能发生的化学反应的程序:
分析结构
预测反应类型
选择反应试剂
δ+ δ- δ+
β α
①官能团:
-OH 羟基
②键的极性:
C-C 非极性键; C-H O-H 极性键
③基团之间的相互影响:
羟基使α-H 和 β-H 都较为活泼
交流 · 研讨
交流 · 研讨
以1-丙醇为例,预测反应中醇分子的断键部位及相应的反应类型。
分析结构 预测性质
断键部位 反应类型 反应试剂 条件 反应产物
交流 · 研讨
交流 · 研讨
以1-丙醇为例,预测反应中醇分子的断键部位及相应的反应类型。
碳氧键:脱掉羟基
取代反应、消去反应
氢氧键:脱掉氢原子
取代反应、氧化反应
(1)羟基的反应
①取代反应
反应试剂:
浓的氢卤酸(HCl、HBr、HI)
C2H5OH+HBr C2H5Br+H2O
C2H5Br+NaOH C2H5OH+NaBr
水
碱性条件、—X被—OH取代
酸性条件、—OH被—X取代
醇
卤代烷
乙醇 溴乙烷
溴乙烷 乙醇
(1)羟基的反应
①取代反应(分子间)
反应条件:
酸做催化剂及加热
C2H5—OH+H—O—C2H5 C2H5—O—C2H5+H2O
乙醚
醚的结构可用 R—O—R′ 表示,R、R′都是烃基(烷基、烯基、苯基等)。醚常用作有机溶剂。
浓硫酸
140℃
②消去反应
反应条件:
浓硫酸、加热
CH3—CH2—CH2OH
CH3—CH CH2
↑ + H2O
浓硫酸
170℃
[思考]是否所有的醇都可以发生消去反应,醇消去反应的有什么规律?
有 β-H 的醇在一定温度下才能发生消去反应。
(2)羟基中氢的反应
①与活泼金属的反应
2C2H5OH+2Na→2C2H5ONa+H2↑
视频
钠沉到乙醇底部,反应较缓和。
[思考]为什么金属钠与乙醇反应不如钠与水反应剧烈?
烷基具有推电子作用,使乙醇分子中氢氧键的极性小于水分子中氢氧键的极性。因此醇分子中的羟基氢原子不如水分子中氢原子的活泼。
②与羧酸的反应
浓硫酸
CH3
C
OH + HO—C2H5
O
CH3
C
O—C2H5 + H2O
O
浓硫酸
CH3
C
OH + H18O—C2H5
O
CH3
C
18O—C2H5 + H2O
O
“酸脱羟基醇脱氢”
同位素示踪法
②与羧酸的反应
2C2H5OH+O2 2CH3CHO+2H2O
催化剂
C2H5OH+3O2 2CO2+3H2O
点燃
(2)醇的氧化
乙醇能够被氧化剂氧化。
2CH3CH2OH + O2
Cu
△
2CH3—C—H + 2H2O
O
丙酮
-OH所在的碳原子上要
有氢原子才可以被氧化
醇的催化氧化规律
氢
原
子
数
生成醛(或羧酸)
生成酮
不能被催化氧化
2~3个H
1个H
没有H
如:
R2
R1
R3
C
OH
O
R1
R2
C
H
H
Cu,O2
△
O
R1
R2
C
如:
如:
KMnO4(H+)或
K2Cr2O7(H+)
R
COOH
O
R
H
C
H
H
O
R
H
C
H
H
Cu,O2
△
CHO或
R
总结:醇发生化学反应时的断键位置规律
反应 断键位置
与金属钠反应
催化氧化
浓硫酸加热到170 ℃
浓硫酸加热到140 ℃
浓硫酸条件下 与乙酸加热
与HX加热反应
①
①③
②⑤
①②
②
①
醇钠
醛、酮
卤代烃
烯烃
醚
酯
【练一练】
1.判断正误
(1)乙醇比丁烷、丁烯的沸点高。 ( )
(2)从碘水中提取单质碘时,能用无水乙醇代替CCl4。( )
(3)沸点由高到低的顺序为 >CH3CH2OH>CH3CH2CH3。( )
(4)乙醇与乙醚互为同分异构体。( )
(5)1-丙醇和2-丙醇发生消去反应的产物相同,但发生催化氧化的产物不同。( )
(6)烃分子中的氢原子被羟基取代而生成的羟基化合物一定为醇。( )
CH2OH
CH2OH
2.可以证明乙醇分子中有一个氢原子与另外的氢原子不同的方法是( )
A.1 mol乙醇燃烧生成3 mol H2O
B.1 mol乙醇燃烧生成2 mol CO2
C.1 mol乙醇与足量的Na作用得0.5 mol H2
D.1 mol乙醇可以催化氧化生成1 mol乙醛
C
3.下列由实验得出的结论正确的是( )
选项 实验 结论
A. 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2-二溴乙烷无色、可溶于四氯化碳
B. 乙醇和水都可与金属钠反应产生可燃性气体 乙醇分子中的氢原子与水分子中的氢原子具有相同的活性
C. 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性小于碳酸的酸性
D. 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 生成的氯甲烷具有酸性
A
4.分子式为C7H16O的饱和一元醇的同分异构体有多种,在该醇的下列同分异构体中:
(1)可以发生消去反应生成两种单烯烃的是 ;
(2)可以发生催化氧化生成醛的是 ;
(3)不能发生催化氧化的是 ;
(4)能被催化氧化为酮的有 种;
(5)能使酸性KMnO4溶液褪色的有 种。
3
2
B
D
C
A.
CH3—CH—CH—CH—CH3
CH3
CH3
OH
CH3
OH
CH3
CH3
CH3
C
C
CH3
B.
CH3—C—CH2—CH—CH3
CH3
CH3
OH
C.
CH3(CH2)5CH2OH
D.
醇
定义
分类
物理性质
化学性质
羟基的反应
羟基中氢的反应
醇的氧化
沸点
溶解度
一元醇、二元醇、多元醇
脂肪烃分子中的氢原子/芳香烃侧链上的
氢原子被羟基取代后的有机化合物。
饱和一元醇:CnH2n+1OH
取代反应
消去反应
与活泼金属反应
与羧酸反应
燃烧
催化氧化
第2节 醇和酚 课时1
1.了解醇的分类、物理性质、用途和一些常见的醇,能够用系统命名法对简单的饱和一元醇进行命名;
2.知道饱和一元醇的结构特征和化学性质,能举例说明醇的反应机理(断键和成键规律)。掌握醇的转化在有机合成中的应用,会设计醇到烯烃、卤代烃、醛、酮、酯的转化路线。
联想 · 质疑
联想 · 质疑
含乙二醇的防冻液
醇和酚都是重要的有机化合物。如常用作燃料和饮料的酒精(乙醇)、汽车发动机防冻液中的乙二醇、化妆品中的丙三醇含有醇羟基,茶叶中的茶多酚、用于制药皂的苯酚、漆器上涂的漆酚含有酚羟基。
一位著名的有机化学家曾说过,假如让一个有机化学家带上10 种有机化合物到荒岛上独自工作,他的选择里一定会有醇。有了醇,他就能合成出各种各样的有机化合物。那么,在有机化合物的合成中醇为什么会有如此重要的作用?
一、醇概述
1.定义
脂肪烃分子中的氢原子或芳香烃侧链上的氢原子被羟基取代后的有机化合物。
酚:芳香烃分子中苯环上的氢原子被羟基取代后的有机化合物。
乙醇
苯酚
苯甲醇
CH3CH2OH
邻甲基苯酚
CH2OH
OH
OH
CH3
官能团
醇的命名
1. 选择分子中连有羟基的碳原子在内的最长碳链做主链,按主链所含碳原子数称为某醇。
2. 对主链碳原子的编号由接近羟基的一端开始。
3. 命名时,羟基的位次号写在“某醇”的前面,其他取代基的名称和位次号写在母体名称的前面。
例如:
饱和一元醇的通式为:
CnH2n+1OH
醇
根据醇分子中所含羟基的数目
一元醇
二元醇
多元醇
按羟基所连烃基种类分类
脂肪醇
脂环醇
饱和醇
不饱和醇
芳香醇
(可简写为R—OH)
2.分类
3.常见的醇
醇
根据醇分子中所含羟基的数目
一元醇
二元醇
多元醇
CH3OH 甲醇(一元醇)
俗名:木醇
无色、具有挥发性的液体
有毒
用作燃料、化工原料
沸点:65℃
与水互溶
CH2—OH
CH2—OH
乙二醇
CH2—OH
CH—OH
丙三醇
CH2—OH
俗名:甘醇
无色、无臭、具有甜味的黏稠液体
无毒
作防冻液、合成涤纶
俗名:甘油
无色、无臭、具有甜味的黏稠液体
无毒
制造日用化妆品、硝化甘油
沸点:197℃
沸点:290℃
与水互溶
与水互溶
4.物理性质
饱和一元醇的沸点比与其相对分子质量接近的烷烃或烯烃的沸点要高。
氢键
氢键是一种特殊的分子间作用力。氢键的键能比化学键弱很多,但比普通的分子间作用力(范德华力)强。醇分子之间可以形成氢键,醇的水溶液中水分子和醇分子之间也可以形成氢键。
沸点
溶解度
(1)沸点
①饱和一元醇的沸点比与其相对分子质量接近的烷烃或烯烃的沸点要高。
③碳原子数相同时,羟基个数越多,沸点越高。
②饱和一元醇,随分子中碳原子数的增加沸点逐渐升高。
(2)溶解度:
含羟基较多的醇极易溶于水。
常温常压,饱和一元醇在水中的溶解性
醇分子中 碳原子数 1~3 4~11 > 11
溶解性 能与水以任意比例互溶 油状液体,仅可部分溶于水 固体,
难溶于水
随着分子中烷基所含碳原子数的增多,醇的物理性质逐渐接近烷烃。
5.化学性质
预测有机化合物可能发生的化学反应的程序:
分析结构
预测反应类型
选择反应试剂
δ+ δ- δ+
β α
①官能团:
-OH 羟基
②键的极性:
C-C 非极性键; C-H O-H 极性键
③基团之间的相互影响:
羟基使α-H 和 β-H 都较为活泼
交流 · 研讨
交流 · 研讨
以1-丙醇为例,预测反应中醇分子的断键部位及相应的反应类型。
分析结构 预测性质
断键部位 反应类型 反应试剂 条件 反应产物
交流 · 研讨
交流 · 研讨
以1-丙醇为例,预测反应中醇分子的断键部位及相应的反应类型。
碳氧键:脱掉羟基
取代反应、消去反应
氢氧键:脱掉氢原子
取代反应、氧化反应
(1)羟基的反应
①取代反应
反应试剂:
浓的氢卤酸(HCl、HBr、HI)
C2H5OH+HBr C2H5Br+H2O
C2H5Br+NaOH C2H5OH+NaBr
水
碱性条件、—X被—OH取代
酸性条件、—OH被—X取代
醇
卤代烷
乙醇 溴乙烷
溴乙烷 乙醇
(1)羟基的反应
①取代反应(分子间)
反应条件:
酸做催化剂及加热
C2H5—OH+H—O—C2H5 C2H5—O—C2H5+H2O
乙醚
醚的结构可用 R—O—R′ 表示,R、R′都是烃基(烷基、烯基、苯基等)。醚常用作有机溶剂。
浓硫酸
140℃
②消去反应
反应条件:
浓硫酸、加热
CH3—CH2—CH2OH
CH3—CH CH2
↑ + H2O
浓硫酸
170℃
[思考]是否所有的醇都可以发生消去反应,醇消去反应的有什么规律?
有 β-H 的醇在一定温度下才能发生消去反应。
(2)羟基中氢的反应
①与活泼金属的反应
2C2H5OH+2Na→2C2H5ONa+H2↑
视频
钠沉到乙醇底部,反应较缓和。
[思考]为什么金属钠与乙醇反应不如钠与水反应剧烈?
烷基具有推电子作用,使乙醇分子中氢氧键的极性小于水分子中氢氧键的极性。因此醇分子中的羟基氢原子不如水分子中氢原子的活泼。
②与羧酸的反应
浓硫酸
CH3
C
OH + HO—C2H5
O
CH3
C
O—C2H5 + H2O
O
浓硫酸
CH3
C
OH + H18O—C2H5
O
CH3
C
18O—C2H5 + H2O
O
“酸脱羟基醇脱氢”
同位素示踪法
②与羧酸的反应
2C2H5OH+O2 2CH3CHO+2H2O
催化剂
C2H5OH+3O2 2CO2+3H2O
点燃
(2)醇的氧化
乙醇能够被氧化剂氧化。
2CH3CH2OH + O2
Cu
△
2CH3—C—H + 2H2O
O
丙酮
-OH所在的碳原子上要
有氢原子才可以被氧化
醇的催化氧化规律
氢
原
子
数
生成醛(或羧酸)
生成酮
不能被催化氧化
2~3个H
1个H
没有H
如:
R2
R1
R3
C
OH
O
R1
R2
C
H
H
Cu,O2
△
O
R1
R2
C
如:
如:
KMnO4(H+)或
K2Cr2O7(H+)
R
COOH
O
R
H
C
H
H
O
R
H
C
H
H
Cu,O2
△
CHO或
R
总结:醇发生化学反应时的断键位置规律
反应 断键位置
与金属钠反应
催化氧化
浓硫酸加热到170 ℃
浓硫酸加热到140 ℃
浓硫酸条件下 与乙酸加热
与HX加热反应
①
①③
②⑤
①②
②
①
醇钠
醛、酮
卤代烃
烯烃
醚
酯
【练一练】
1.判断正误
(1)乙醇比丁烷、丁烯的沸点高。 ( )
(2)从碘水中提取单质碘时,能用无水乙醇代替CCl4。( )
(3)沸点由高到低的顺序为 >CH3CH2OH>CH3CH2CH3。( )
(4)乙醇与乙醚互为同分异构体。( )
(5)1-丙醇和2-丙醇发生消去反应的产物相同,但发生催化氧化的产物不同。( )
(6)烃分子中的氢原子被羟基取代而生成的羟基化合物一定为醇。( )
CH2OH
CH2OH
2.可以证明乙醇分子中有一个氢原子与另外的氢原子不同的方法是( )
A.1 mol乙醇燃烧生成3 mol H2O
B.1 mol乙醇燃烧生成2 mol CO2
C.1 mol乙醇与足量的Na作用得0.5 mol H2
D.1 mol乙醇可以催化氧化生成1 mol乙醛
C
3.下列由实验得出的结论正确的是( )
选项 实验 结论
A. 将乙烯通入溴的四氯化碳溶液,溶液最终变为无色透明 生成的1,2-二溴乙烷无色、可溶于四氯化碳
B. 乙醇和水都可与金属钠反应产生可燃性气体 乙醇分子中的氢原子与水分子中的氢原子具有相同的活性
C. 用乙酸浸泡水壶中的水垢,可将其清除 乙酸的酸性小于碳酸的酸性
D. 甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红 生成的氯甲烷具有酸性
A
4.分子式为C7H16O的饱和一元醇的同分异构体有多种,在该醇的下列同分异构体中:
(1)可以发生消去反应生成两种单烯烃的是 ;
(2)可以发生催化氧化生成醛的是 ;
(3)不能发生催化氧化的是 ;
(4)能被催化氧化为酮的有 种;
(5)能使酸性KMnO4溶液褪色的有 种。
3
2
B
D
C
A.
CH3—CH—CH—CH—CH3
CH3
CH3
OH
CH3
OH
CH3
CH3
CH3
C
C
CH3
B.
CH3—C—CH2—CH—CH3
CH3
CH3
OH
C.
CH3(CH2)5CH2OH
D.
醇
定义
分类
物理性质
化学性质
羟基的反应
羟基中氢的反应
醇的氧化
沸点
溶解度
一元醇、二元醇、多元醇
脂肪烃分子中的氢原子/芳香烃侧链上的
氢原子被羟基取代后的有机化合物。
饱和一元醇:CnH2n+1OH
取代反应
消去反应
与活泼金属反应
与羧酸反应
燃烧
催化氧化
